慢病毒载体介导过表达和敲低miR-155的AB 8/13细胞株的建立
唐志明 林栩 梁钊 王晨 韦美理 王蓉 吴昱升 黄慕源
【摘要】目的利用慢病毒載体构建稳定过表达miR-155的AB 8/13细胞株(AB 8/13-LV-has-miR-155)和稳定敲低miR-155的AB 8/13细胞株(AB 8/13-LV-has-miR-155p inhibiton),为研究miR-155在足细胞焦亡和肾脏疾病中的作用奠定基础。方法体外培养AB 8/13细胞,使用不同浓度嘌呤霉素刺激AB 8/13细胞48 h,在光学显微镜下观察AB 8/13细胞的死亡情况;使用LV-has-miR-155阴性对照病毒、LV-has-miR-155-5p inhibiton阴性对照病毒分别感染AB 8/13细胞,在荧光显微镜下观察AB 8/13细胞的状态和感染效率;在嘌呤霉素筛选出稳定细胞株后,通过实时荧光定量PCR法检测稳定细胞株的miR-155表达量。结果在3.5 μg/mL及以上浓度的嘌呤霉素作用于AB 8/13细胞48 h后,所有细胞全部死亡。LV-has-miR-155慢病毒感染AB 8/13细胞的感染效率达到80%的最佳条件为在含HiTransG P的完全培养基中进行感染,MOI为10;LV-has-miR-155-5p inhibiton慢病毒感染AB 8/13细胞的感染效率达到80%的最佳条件为在含HiTransG A的完全培养基中进行感染,MOI为100。qRT-PCR结果显示AB 8/13-LV-has-miR-155细胞株的miR-155表达量明显升高,AB 8/13-LV-has-miR-155p inhibiton细胞株的miR-155表达量降低。结论成功构建AB 8/13-LV-has-miR-155稳定细胞株和AB 8/13-LV-has-miR-155p inhibiton稳定细胞株,为进一步探究miR-155在人足细胞焦亡中的作用机制奠定基础。
【关键词】AB 8/13细胞;慢病毒载体;miR-155
中图分类号:R692文献标志码:ADOI:10.3969/j.issn.1003-1383.2022.05.001
Establishment of overexpression and knockdown of miR-155
genes of AB 8/13 cell lines by lentivirus vector
TANG Zhiming LIN Xu LIANG Zhao WANG Chen WEI Meili WANG Rong WU Yusheng HUANG Muyuan
(1.Department of Nephrology, Affiliated Hospital of Youjiang Medical University for Nationalities; 2. Guangxi Key
Laboratory of Basic Guarantee for Medical Research of Immune-related Diseases, Baise 533000, Guangxi, China)
【Abstract】ObjectiveTo construct the stable overexpression of miR-155 of AB 8/13 cell line (AB 8/13-LV-has-miR-155) and stable knockdown of miR-155 of AB 8/13 cell line (AB 8/13-LV-has-miR-155p inhibiton) by lentivirus vector, so as to lay a foundation for the study of the role of miR-155 in podocyte pyroptosis and kidney diseases. MethodsAB 8/13 cells were cultured in vitro and stimulated with puromycin at different concentrations for 48 hours, and then the death of AB 8/13 cells was observed under optical microscope. After AB 8/13 cells were respectively infected with LV-has-miR-155 negative control virus and LV-has-miR-155p inhibiton negative control virus, the state and infection efficiency of AB 8/13 cells were observed under fluorescence microscope. After the stable cell lines were screened by puromycin, the expression of miR-155 in the stable cell line was detected by real-time fluorescence quantitative PCR. ResultsAfter being treated with puromycin at the concentration of 3.5 μg/mL or above for 48 hours, all AB 8/13 cells died. The optimal conditions for AB 8/13 cells infected with LV-has-miR-155 lentivirus to achieve 80% infectious efficiency were as follows: infection was performed in complete medium containing HiTransG P, and MOI was 10. The optimal conditions for AB 8/13 cells infected with LV-has-miR-155p inhibiton lentivirus to achieve 80% infectious efficiency were as follows: infection was performed in complete medium containing HiTransG A, and MOI was 100. QRT-PCR results showed that the expression of miR-155 in AB 8/13-LV-has-miR-155 cell line increased significantly, and the expression of miR-155 in AB 8/13-LV-has-miR-155 inhibiton cell line decreased. ConclusionTo successfully construct AB 8/13-LV-has-miR-155 stable cell lines and AB 8/13-LV-has-miR-155p inhibiton stable cell lines can lay a foundation for further exploring the mechanism of miR-155 in human podocyte pyroptosis.9F60236C-D85B-47C2-8353-F753D7AE81E8
【Key words】AB 8/13 cell; lentivirus vector; miR-155
Micro RNA (miRNA)是一类内源性、长度为20~24个核苷酸的非编码RNA,其通过对转录后靶基因的调节,进而对正常生理、病理生理、疾病发展等过程起着关键性的调控作用。miR-155是一种重要的miRNA,其影响着IgA肾病、急性肾损伤、糖尿病肾病等疾病的发生发展[1~3]。足细胞作为一种重要的脏层上皮细胞,与基底膜、血管内皮细胞一起参与了肾小球的过滤功能。目前的研究表明,足细胞在微小病变肾病、糖尿病肾病、膜性肾病、狼疮性肾炎、局灶节段性肾小球硬化(FGSG)等肾脏疾病中受到损伤,并且足细胞损伤可以加重肾脏疾病的发展[4]。本课题组前期研究显示在TGF-β1诱导的小鼠足细胞损伤模型中miR-155高表达,降低miR-155表达量减轻足细胞损伤[5]。我们近期研究发现在LPS+ATP诱导的人足细胞焦亡中miR-155表达升高。综上,miR-155可能参与了肾脏疾病中足细胞焦亡的损伤机制。但是,目前尚无文献报道miR-155在足细胞焦亡中的具体作用机制。本研究通过过表达和敲低miR-155的慢病毒载体感染人足细胞AB 8/13,建立AB 8/13-LV-has-miR-155细胞株和AB 8/13-LV-has-miR-155p inhibiton细胞株,为下一步研究miR-155在足细胞焦亡中的作用机制奠定前期基础。
1材料与方法1.1材料人肾小球足细胞株(AB 8/13)获赠于英国Bristol大学Moin A. Saleem教授。RPMI1640培养基(美国 Gibco),胎牛血清(乌拉圭 Lonsera),ITS(美国 Sigma-Aldrich),胰酶(中国 Solarbio),青链霉素混合液(中国 Solarbio),Trizol试剂(美国 Invitrogen),miRNA第一条链cDNA合成试剂盒(中国 Sangon Biotech,#B532451),TB Green? Premix Ex TaqTMⅡ (日本 TaKaRa,RR820A),由武汉金开瑞生物工程有限公司合成U6 Forward primer、U6 Reverse primer、miRNA-155 Forward primer,引物序列见表1,miRNA-155 Reverse primer由试剂盒自带。携带过表达miR-155基因的慢病毒(LV-has-miR-155)、过表达miR-155的阴性对照慢病毒(LV-has-miR-155 nc)、携带敲低miR-155基因的慢病毒(LV-has-miR-155-5p inhibiton)、敲低miR-155的阴性对照慢病毒(LV-has-miR-155-5p inhibiton nc)、HitransG A、HitransG P均购买于上海吉凯基因医学科技股份有限公司。
1.2AB 8/13细胞培养细胞复苏后,在33℃、5% CO2条件下,使用完全培养基(10%胎牛血清+1%青链霉素混合液+ITS 〔Insulin-Transferrin-Selenium〕+RPMI-1640)培养未分化的AB 8/13细胞,每2~3天更换一次培养基,细胞汇合度达80%左右进行传代。
1.3AB 8/13细胞嘌呤霉素工作浓度的筛选将4×104~5×104个对数生长期AB 8/13细胞铺于24孔板,将细胞培养至细胞汇合达80%左右;然后于每孔加入不同浓度的嘌呤霉素,浓度从0 μg/mL开始,以后每孔依次增加0.5 μg/mL,直到嘌呤霉素浓度达到10 μg/mL;继续培养AB 8/13细胞48 h,于显微镜下观察;将所有细胞杀光的最低嘌呤霉素浓度选为AB 8/13细胞的工作浓度。
1.4慢病毒感染AB 8/13细胞的最佳感染条件和MOI的筛选①实验分组:为了筛选出AB 8/13细胞的最佳感染条件和MOI值,将实验分为以下几组:含慢病毒的完全培养基组(M组)、含慢病毒和感染增强剂HiTransG A的完全培养基组(A组)、含慢病毒和感染增强剂HiTransG P的完全培养基组(P组)、不含慢病毒和感染增强剂的完全培养基组(Control组)。②AB 8/13细胞感染:使用完全培养制备2 mL浓度为5×104个/mL的AB 8/13细胞悬液,将细胞悬液以100 μL铺板于96孔板的12个孔,在33℃、5% CO2培养箱中将细胞培养到汇合度达20%~30%。从冰箱中取出慢病毒,并使用不含抗生素的完全培养基将慢病毒滴度稀释为1×106TU/mL、1×107TU/mL、1×108TU/mL,各50 μL。丢掉各孔培养基,按照表2向各孔加入不同滴度慢病毒、感染增强试剂、完全培养基。在慢病毒感染AB 8/13细胞12 h后更换新的完全培养基继续培养,期间可以根据细胞状态更换培养基。③感染效果确定:在慢病毒感染AB 8/13细胞72 h后,在荧光显微镜下观察细胞的感染效率和细胞状态。将感染效率在80%左右、使用慢病毒最少、AB 8/13细胞状态良好的感染条件和MOI选做正式感染的条件。
1.5慢病毒正式感染实验及细胞稳定株的筛选①实验分组:实验分为5组,即加入LV-has-miR-155慢病毒和感染增强剂的完全培养基组(LV-has-miR-155组)、加入LV-has-miR-155 nc慢病毒和感染增强剂的完全培养基组(LV-has-miR-155 nc组)、加入LV-has-miR-155-5p inhibiton慢病毒和感染增强剂的完全培养基组(LV-has-miR-155-5p inhibiton组)、加入LV-has-miR-155-5p inhibiton nc慢病毒和感染增强剂的完全培养基组(LV-has-miR-155-5p inhibiton nc组)、不含慢病毒和感染增强剂的完全培养基组(Control组)。②正式感染实验:使用完全培养基制备5×104个/mL的细胞悬液,将1 mL细胞悬液铺板于12孔板,共10个孔,每组2孔,在33℃、5% CO2培养箱中培养细胞24 h。然后根据分组、最佳感染条件、MOI向每孔加入总体积为500 μL的完全培养基,培养基里包含20 μL 25×HitransG感染试剂和慢病毒液。计算公式:病毒體积=(MOI×细胞数目)/病毒滴度。接着继续在培养箱中培养12 h,中途可以根据AB 8/13细胞的生长状态更换培养基。在慢病毒感染72 h后,于荧光显微镜下观察细胞的感染效率。③稳定株筛选:在慢病毒感染AB 8/13细胞72 h后,将培养基更换为含工作浓度嘌呤霉素的培养基,每3天更换一次。在显微镜下观察到Control组细胞被嘌呤霉素杀光而实验组无细胞出现死亡(荧光效率达到100%)时,将含工作浓度嘌呤霉素的完全培养基的浓度降为1/4,继续对感染的AB 8/13细胞进行增殖和筛选。然后收集细胞进行qPCR鉴定,确实是否为过表达和敲低的AB 8/13细胞株。9F60236C-D85B-47C2-8353-F753D7AE81E8
1.6实时荧光定量PCR(qPCR)检测AB 8/13细胞的miR-155表达量通过Trizol法提取各组AB 8/13细胞的RNA,然后使用超微量分光光度计检测RNA的浓度和纯度,并通过琼脂糖凝胶电泳测定所用RNA是否降解。按说明书取2 μg总RNA进行逆转录。通过LightCycler96测定miR-155、U6的表达。采用2-△△CT法计算miR-155的相对表达量。
1.7统计学方法使用SPSS 20.0统计学软件进行分析,数据以均数±标准差(±s)表示,多个样本间使用单因素方差分析,其中两两相比采用LSD法。检验水准:α=0.05,双侧检验。
2结果2.1嘌呤霉素处理AB 8/13细胞后的死亡情况将AB 8/13细胞铺板于24孔板,待细胞汇合度达80%左右,各培养孔更换为含不同嘌呤霉素浓度的培养基;继续培养48 h后,在显微镜下观察细胞。可见随着嘌呤霉素浓度增加,AB 8/13细胞死亡越来越明显,在浓度达到3.5 μg/mL及以上时可见所有细胞都被杀死(图1)。
2.2LV-has-miR-155和LV-has-miR-155-5p inhibiton慢病毒最佳感染条件及MOI将AB 8/13细胞铺板于96孔板,按不同条件加入相应的转染试剂和阴性对照慢病毒,在感染72 h后,于荧光显微镜下观察结果。在过表达miR-155阴性对照慢病毒感染人足细胞中,当M组、A组、P组的MOI为1时,少许细胞被感染,带有荧光;当M组、A组、P组的MOI为10时,各组被感染足细胞增多,P组被感染足细胞较其他两组多,足细胞效率在80%左右,细胞生长状态良好,其他两组感染效率未达到80%;当M组、A组、P组的MOI为100时,各组被感染足细胞最多,感染效率接近100%(图2)。在敲低miR-155阴性对照慢病毒感染人足细胞中,当M组、A组、P组的MOI为1时,极少数足细胞被感染;当M组、A组、P组的MOI为10时,被感染足细胞稍微增多,感染效率远不及80%;当M组、A组、P组的MOI为100时,被感染足细胞明显增多,感染效率在80%以上,在P组足细胞状态变差,有少许细胞死亡(图3)。最佳感染条件和MOI的选择原则:①在细胞状态不受影响的条件下尽量使用最少量的慢病毒;②细胞感染效率在80%左右。根据上述原则,LV-has-miR-155慢病毒感染AB 8/13细胞的最佳感染条件是在含HiTransG P的完全培养基中进行感染,MOI为10;LV-has-miR-155-5p inhibiton慢病毒感染AB 8/13细胞的最佳条件为在含HiTransG A的完全培养基中进行感染,MOI为100。
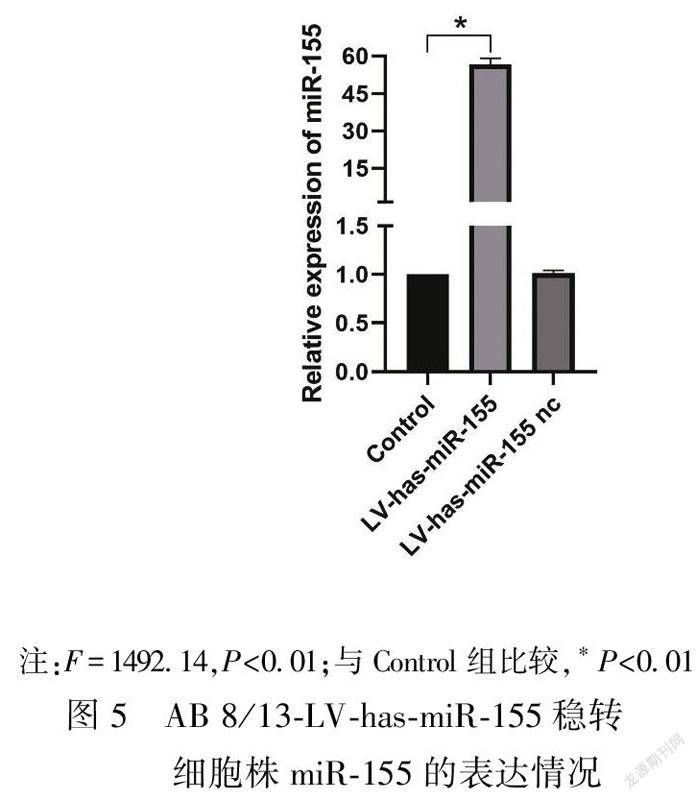
2.3LV-has-miR-155慢病毒感染的AB 8/13细胞株miR-155的表达量在含HiTransG P的完全培养基中加入MOI为10的LV-has-miR-155慢病毒,感染AB 8/13细胞72 h后,使用工作浓度嘌呤霉素筛选出稳定株。荧光显微镜结果显示AB 8/13-LV-has-miR-155细胞株生长状态良好,感染效率为100%(图4)。使用稳定株提取总RNA进行qPCR,结果显示与Control组(1.00±0.00)比较,LV-has-miR-155组的miR-155表达量(56.66±2.50)显著升高,差异有统计学意义(P<0.01),LV-has-miR-155 nc组的miR-155表达量(1.01±0.03)无明显变化(图5)。
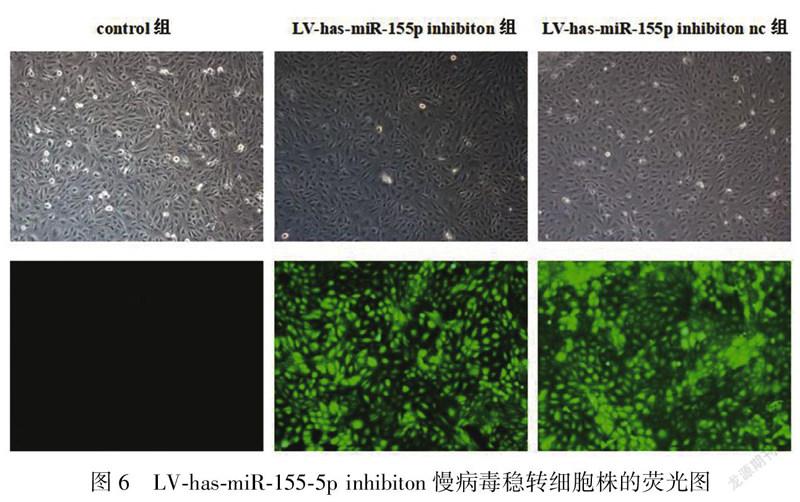
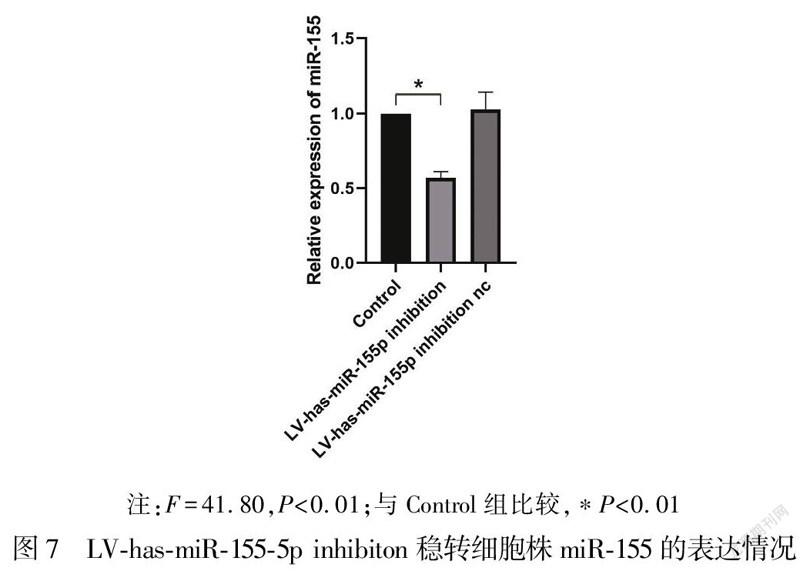
2.4LV-has-miR-155-5p inhibiton慢病毒感染的AB 8/13細胞株miR-155的表达量在含HiTransG A的完全培养基中加入MOI为100的LV-has-miR-155-5p inhibiton慢病毒,在感染细胞72 h后,使用工作浓度嘌呤霉素筛选出稳定株。荧光显微镜结果显示AB 8/13-LV-has-miR-155p inhibiton细胞株生长状态良好,感染效率为100%(图6)。使用稳定株提取总RNA进行qPCR,结果显示与Control组(1.00±0.00)比较,LV-has-miR-155-5p inhibiton组的miR-155表达量(0.57±0.04)降低,差异有统计学意义(P<0.01),LV-has-miR-155-5p inhibiton nc组的miR-155表达量无明显变化(1.0±0.11)(图7)。
3讨论
足细胞是肾脏的一种固有细胞,其黏附于肾小球基底膜,与基底膜、血管内皮细胞一起构成一道滤过屏障,参与肾小球过滤功能。当足细胞受到多种损伤刺激伤害后,如高血糖、阿霉素、血管紧张素Ⅱ等,可经历一系列变化,这些变化有肥大、自噬、去分化、间质细胞转化、脱落、死亡[6]。以上变化引起了足细胞结构和功能受损,从而可以引起和加重多种肾脏疾病,如狼疮性肾炎、微小病变肾病、FGSG、膜性肾病、糖尿病肾病等[4]。
miRNA是一类可以调控基因表达的非编码RNA,在病理生理过程和疾病的发生发展中都起着重要的调节作用。miRNA-155是一种重要的miRNA,与多种肾脏疾病的致病过程密切相关。有研究显示,miRNA-155可能通过抑制CXCR5-ERK信号通路来抑制系膜细胞增殖和TGF-β1的产生,从而参与狼疮性肾炎的致病过程[7]。ZHOU等[1]研究表明,在糖尿病大鼠的肾脏和高糖处理的肾小球系膜细胞中miRNA-155高表达,并且其可以通过TNC/TLR4/NF-κB/miR-155-5p炎症环调控糖尿病肾病的炎症反应和纤维化。ZHANG等[8]研究发现,在I/R诱导的AKI大鼠模型中miRNA-155被上调,miR-155可能通过调节TCF4 /Wnt/β-Catenin途径改善急性肾损伤。本课题组前期研究表明miR-155参与了TGF-β1诱导的足细胞损伤[5,9]。我们近期的研究发现,在LPS+ATP诱导的人足细胞焦亡中miR-155被上调。WANG等[10]研究显示,在高糖处理的足细胞中miRNA-155高表达,其可以通过抑制SIRT1导致足细胞损伤,增强足细胞释放炎症因子。多个研究显示miRNA-155可以调控巨噬细胞、心肌细胞和肾小管细胞的焦亡过程[11~13]。综上,我们推测miR-155可能通过调节足细胞焦亡参与肾脏疾病的病理生理过程。为了进一步探究miR-155在足细胞焦亡中的具体作用机制,需要过表达和敲低足细胞miR-155的表达量。9F60236C-D85B-47C2-8353-F753D7AE81E8
慢病毒是毒性基因被剔除并被外源性基因替代的重组慢病毒载体HIV-1,其具有良好的感染特性,既可以感染分裂细胞也可以感染非分裂细胞。慢病毒常被用于基因过表达与敲低的一种工具,通过把自身携带的外源基因或干扰基因整合到目的细胞染色体上,从而实现对目的基因持续稳定地过表达或敲低[14]。本实验通过LV-has-miR-155和LV-has-miR-155-5p inhibiton慢病毒的阴性对照病毒分别感染AB 8/13细胞,确定了过表达和敲低miR-155慢病毒的最适感染条件;通过不同浓度嘌呤霉素对AB 8/13细胞损伤的情况,确定AB 8/13细胞嘌呤霉素工作浓度。根据LV-has-miR-155和LV-has-miR-155-5p inhibiton慢病毒最适感染条件对足细胞进行感染,用嘌呤霉素进行筛选,获得过表达和敲低miR-155的AB 8/13细胞株。经实时荧光定量PCR验证,与正常AB 8/13细胞相比,miR-155过表达的AB 8/13稳定株miR-155表达量显著升高,miR-155低表达的AB 8/13稳定株miR-155表达量显著降低。因此,我们成功获得了miR-155过表达的AB 8/13稳定株和miR-155低表达的AB 8/13稳定株。
我们前期研究显示miR-155在LPS+ATP诱导的足细胞焦亡中高表达,表明miR-155参与足细胞焦亡。在接下来的研究中,我们将寻找miR-155的下游靶标蛋白,探讨miR-155表达变化对细胞焦亡和下游靶标蛋白的影响,双荧光素酶报告实验验证miR-155与下游蛋白的靶向关系,了解miR-155通过何种通路调控足细胞焦亡,进而为慢性肾脏疾病的防治提供新的理论依据和治疗靶点。参考文献[1] ZHOU Y,MA X Y,HAN J Y,et al.Metformin regulates inflammation and fibrosis in diabetic kidney disease through TNC/TLR4/NF-κB/miR-155-5p inflammatory loop[J].World J Diabetes,2021,12(1):19-46.
[2] WANG M,WEI J L,SHANG F T,et al.Long non-coding RNA CASC2 ameliorates Sepsis-induced acute kidney injury by regulating the miR-155 and NF-κB pathway[J].Int J Mol Med,2020: 2020,45(5):1554-1562.
[3] KANEKO S,YANAI K,ISHII H,et al.Detection of microRNA expression in the kidneys of immunoglobulin a nephropathic mice[J].J Vis Exp,2020(161):2020(161):32716396.
[4] ASANUMA K.The role of podocyte injury in chronic kidney disease[J].Nihon Rinsho Meneki Gakkai Kaishi,2015,38(1):26-36.
[5] 凌霄雁,林栩,郑心彤,等.miR-155表达变化对TGF-β1损伤足细胞蛋白podocin、CD2AP、synaptopodin的影响[J].中国免疫学杂志,2021,37(9):1029-1034,1040.
[6] ZHOU L L,LIU Y H.Wnt/β-catenin signalling and podocyte dysfunction in proteinuric kidney disease[J].Nat Rev Nephrol,2015,11(9):535-545.
[7] KONG J,LI L X,LU Z M,et al.microRNA-155 suppresses mesangial cell proliferation and TGF-β1 production via inhibiting CXCR5-ERK signaling pathway in lupus nephritis[J].Inflammation,2019,42(1):255-263.
[8] ZHANG X B,CHEN X,LI D J,et al.Inhibition of miR-155 ameliorates acute kidney injury by apoptosis involving the regulation on TCF4/wnt/β-catenin pathway[J].Nephron,2019,143(2):135-147.
[9] ZHENG X T,ZHONG Q H,LIN X,et al.Transforming growth factor-β1-induced podocyte injury is associated with increased microRNA-155 expression,enhanced inflammatory responses and MAPK pathway activation[J].Exp Ther Med,2021,21(6):620.
[10] WANG X L,GAO Y B,YI W M,et al.Inhibition of miRNA-155 alleviates high glucose-induced podocyte inflammation by targeting SIRT1 in diabetic mice[J].J Diabetes Res,2021,2021:5597394.
[11] LI C,YIN W T,YU N,et al.miR-155 promotes macrophage pyroptosis induced by Porphyromonas gingivalis through regulating the NLRP3 inflammasome[J].Oral Dis,2019,25(8):2030-2039.
[12] WANG B,WANG Z M,JI J L,et al.Macrophage-derived exosomal miR-155 regulating cardiomyocyte pyroptosis and hypertrophy in uremic cardiomyopathy[J].JACC Basic Transl Sci,2020,5(2):148-166.
[13]WU H Y,HUANG T,YING L,et al.miR-155 is involved in renal ischemia-reperfusion injury via direct targeting of FoxO3a and regulating renal tubular cell pyroptosis[J].Cell Physiol Biochem,2016,40(6):1692-1705.
[14] 解笑宸,于斐,姚粵峰,等.慢病毒介导PTEN基因表达降低的RSC96施万细胞系模型建立[J].中华骨与关节外科杂志,2021,14(1):54-60.
(收稿日期:2021-11-07修回日期:2022-04-18)
(编辑:潘明志)9F60236C-D85B-47C2-8353-F753D7AE81E8

