真核细胞延伸因子2激酶(eEF2K)在胶质母细胞瘤发病机制中的作用
岑丽兰 周欣鸿 顾倩 陆海善 田喆 杨茜
【摘要】目的膠质母细胞瘤(glioblastoma,GBM)具有高度的异质性和侵略性。真核细胞延伸因子2激酶(eEF2K)在多种肿瘤中均过表达,但其在GBM中的作用尚不清楚。本研究基于肿瘤基因组图谱(TCGA)数据库中的数据,旨在阐明eEF2K与GBM的关系。方法通过TCGA数据库用Wilcoxon检验和配对检验了解eEF2K在GBM和正常组织中eEF2K的表达水平。制作受试者工作特征(ROC)曲线,利用曲线下面积(AUC值)评价eEF2K作为二元分类法的价值。Cox回归分析和Kaplan-Meier曲线用于评估eEF2K mRNA表达与预后的相关性。基因集富集分析(GSEA)被用于阐明eEF2K在GBM中的生物学功能。结果与正常组织相比,eEF2K在GBM组织中的表达显著升高(P<0.001)。ROC曲线显示eEF2K对GBM的诊断能力较低(AUC=0.697)。Kaplan-Meier生存分析显示eEF2K高表达与GBM患者预后无关。GSEA发现eEF2K的表达与G-alpha(s)信号通路、亨廷顿病(Huntington disease)、阿尔兹海默病(Alzheimer's disease, AD)、TP53调节代谢基因、线粒体中的电子传输链、反应性生物氧化有关,而ssGSEA显示eEF2K的表达与多种免疫细胞浸润水平有关。结论eEF2K在GBM中上调并不能作为预后不良的生物标志,但是参与GBM中多种免疫细胞浸润。此外,eEF2K在GBM中的生物学功能可能与G-alpha(s)、TP53调节代谢基因、线粒体中的电子传输链、反应性生物氧化有关。这些发现有助于阐明eEF2K在肿瘤发生中的作用,为进一步研究奠定基础。
【关键词】真核细胞延伸因子2激酶;胶质母细胞瘤;免疫细胞浸润;预后;泛癌分析
中图分类号:R739.41文献标志码:ADOI:10.3969/j.issn.1003-1383.2022.05.002
Role of eukaryotic elongation factor 2 kinase (eEF2K)
in the pathogenesis of glioblastoma
CEN Lilan ZHOU Xinhong GU Qian LU Haishan TIAN Zhe YANG Qian
(1. Center for Clinical Pathology Diagnosis and Research, Youjiang Medical University for Nationalities,
2. Department of Clinical Pathology, Affiliated Hospital of Youjiang Medical University for Nationalities,
3. College of Basic Medicine, Youjiang Medical University for Nationalities, 4. Neuroscience Research
Laboratory, Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】ObjectiveGlioblastoma (GBM) is highly heterogeneous and aggressive, and eukaryotic elongation factor 2 kinase (eEF2K) is overexpressed in a variety of tumors, but its role in GBM is unknown. This study aimed to elucidate relationship between eEF2K and GBM based on data from The Cancer Genome Atlas (TCGA) database. MethodsThe expression levels of eEF2K in GBM and normal tissues were studied by Wilcoxon test and pairing test through TCGA database. Receiver operating characteristic (ROC) curve was used to evaluate the value of eEF2K as a binary classification method. Cox regression analysis and Kaplan Meier curve were used to evaluate correlation between eEF2K mRNA expression and prognosis. In addition, gene set enrichment analysis (GSEA) was used to clarify the biological function of eEF2K in GBM. ResultsCompared with normal tissues, the expression of eEF2K in GBM tissues was significantly higher (P<0.001). ROC curve showed that eEF2K had low diagnostic ability for GBM (AUC=0.697). Kaplan Meier survival analysis showed that the high expression of eEF2K was not related to the prognosis of GBM patients. Meanwhile, GSEA found that the expression of eEF2K was related to G-alpha (s) signal pathway, Huntington disease, Alzheimer's disease(AD), TP53 regulates metabolic genes, electron transport chain in mitochondria, and reactive biological oxidation, while ssGSEA showed that the expression of eEF2K was related to various levels of immune cell infiltration. ConclusionThe up-regulation of eEF2K in GBM can not be used as a biomarker of poor prognosis, but it involves in a variety of immune cell infiltration in GBM. In addition, the biological function of eEF2K in GBM may be related to G-alpha (s), Tp53 regulates metabolic genes, electron transport chain in mitochondria, and reactive biological oxidations. These findings help to clarify the role of eEF2K in tumorigenesis and lay a foundation for further research.9860FF2B-6653-4F43-81A5-22CFDB094EDF
【Key words】eEF2K; glioblastoma; immune cell infiltration; prognosis; pan-cancer analysis
胶质母细胞瘤(glioblastoma,GBM)是成人原发性脑肿瘤中最常见的恶性肿瘤之一。尽管目前有可用的治疗方法,但预后不佳,1年生存率为35.7%,5年生存率为4.7%,总生存期为14.6个月,平均生存期低于20个月[1~2]。目前治疗GBM患者的传统方法是手术切除肿瘤(在可能的情况下),同时进行放疗和替莫唑胺(TMZ)化疗,然后辅以替莫唑胺[3]。新出现的免疫疗法在治疗方案上取得一定进展,但由于缺乏共同表达的分子靶点和有效的靶向治疗,患者的生存并未得到实质性改善。因此,为了开发高效的分子靶向治疗方法,迫切需要更好地了解GBM的生物学机制,寻找新的治疗靶点。
钙/钙调蛋白依赖性蛋白激酶Ⅲ(Ca2+/calmodulin-dependent protein kinases Ⅲ),也被称之为真核细胞延长因子2激酶(eukaryotic elongation factor-2 kinase,eEF2K),是一种控制蛋白质的关键酶,在胶质瘤和其他几种类型的人类癌症中表达上调[3~4]。通过不同的途径和机制,发现eEF2K的活性与肿瘤细胞的增殖有关,在几种类型的恶性肿瘤中检测到eEF2K的高表达水平[5~6]。此外发现TMZ联合eEF2K抑制剂可以使GBM患者获得更好的治疗效果[3],所以我们认为eEF2K可能是GBM新的治疗靶点。
本研究使用来自基于肿瘤基因组图谱(TCGA)数据库的数据,我们试图证明 eEF2K与GBM之间的相关性,确定eEF2K在GBM肿瘤组织中表达情况。此外,我们进行预后和临床相关性研究,以探索eEF2K的潜在诊断和预后价值;并通过富集分析和免疫浸润相关分析确定eEF2K的生物学意义。
1 材料与方法
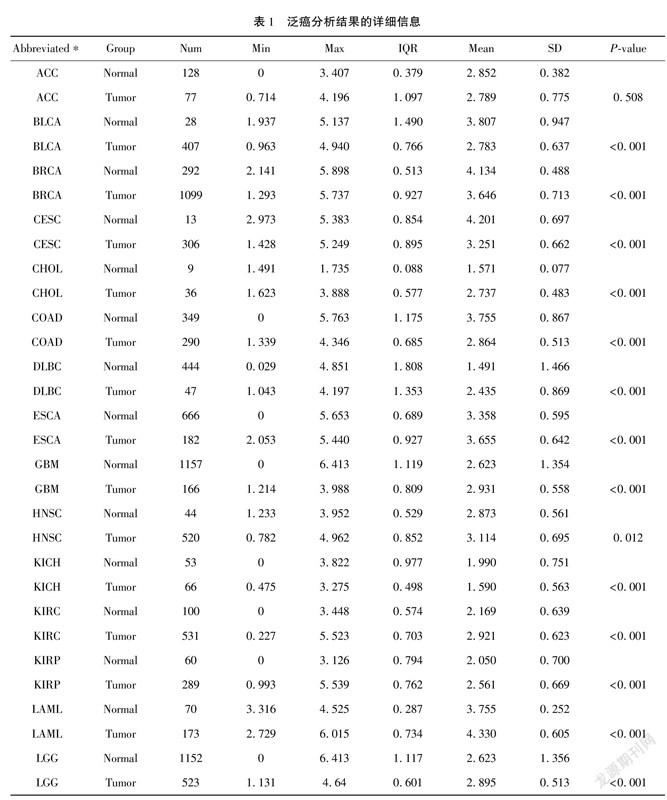
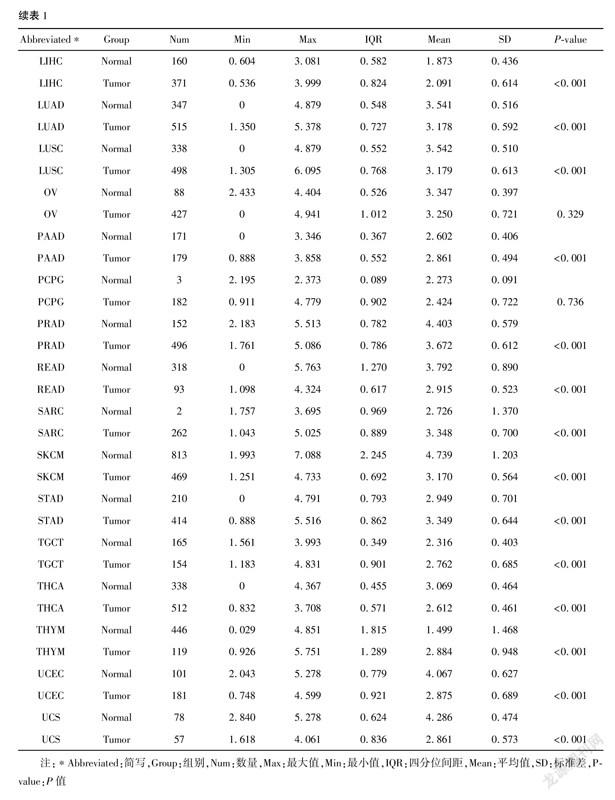
1.1 eEF2K单基因表达差异分析所有癌症类型包括肾上腺皮质癌(ACC)、膀胱尿路上皮癌(BLCA)、乳腺浸潤癌(BRCA)、宫颈鳞癌和腺癌(CESC)、胆管癌(CHOL)、结肠癌(COAD)、弥漫性大B细胞淋巴瘤(DLBC)、食管癌(ESCA)、多形性成胶质细胞瘤(GBM)、头颈鳞状细胞癌(HNSC)、肾嫌色细胞癌(KICH)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、急性髓细胞样白血病(LAML)、脑低级别胶质瘤(LGG)、肝细胞癌(LIHC)、肺腺癌(LUAD)、肺鳞癌(LUSC)、间皮瘤(MESO)、卵巢浆液性囊腺癌(OV)、胰腺癌(PAAD)、嗜铬细胞瘤和副神经节瘤(PCPG)、前列腺癌(PRAD)、直肠腺癌(READ)、肉瘤(SARC)、皮肤黑色素瘤(SKCM)、胃癌(STAD)、睾丸癌(TGCT)、甲状腺癌(THCA)、胸腺癌(THYM)、子宫内膜癌(UCEC)、子宫肉瘤(UCS)和葡萄膜黑色素瘤(UVM)。为了分析eEF2K在以上癌症和邻近组织中表达差异,我们使用UCSC XENA (https://xenabrowser.net/datapages/)网站下载TCGA和基因型-组织表达(genotype-tissue expression, GTEx)的TPM (transcripts per million reads)格式的RNAseq(RNA sequencing)数据,样本数共15 776个。将TPM格式的RNAseq数据进行log2转化后通过Mann-Whitney U 检验比较分析。从中提取TCGA的GBM和GTEx中对应的正常组织数据并绘制受试者工作特征(ROC)曲线。运行R 语言(3.6.3版本) 加载ggplot2包(3.3.3版本)[7]和pROC包(1.17.0.1版本)用于可视化分析。
1.2 eEF2K在GBM患者中的预后分析GBM样品的RNA测序结果以及临床数据来自TCGA数据库(https://portal.gdc.cancer.gov/)和来自于Cell的文章的数据作为补充数据[8]。将数据进行筛选:剔除对照组以及不含有临床信息的数据。采用Cox回归分析eEF2K与GBM患者中总体生存率(overall survival,OS)、疾病特异性生存率(disease specific survival,DDS)和无进展间期(progress free interval,PFI)的关系,通过Kaplan-Meier曲线表示GBM患者eEF2K高低表达之间的生存情况。运行R语言软件(3.6.3版本)加载survminer包(0.4.9版本)用于可视化;加载survival包(3.2-10版本)用于生存资料的统计分析。
1.3 GBM患者中与eEF2K相关的差异表达基因(differentially expressed genes, DEGs)在R语言软件(3.6.3版本)加载DESeq2包(1.26.0版本)处理TCGA GBM项目中 level 3 HTSeq-Counts格式的RNAseq数据,去除对照/正常组。根据eEF2K基因的表达中位值,将样本分为eEF2K高表达组和eEF2K低表达组。对数倍变化的绝对值|log2(FC)|>1.5和调整后的P值(p.adj)<0.05被认为是DEGs的阈值。设置差异倍数、生成差异分析结果后利用ggplot2(3.3.3版本)绘制火山图。
1.4 基因本体注释(GO)分析Enrichr (https://maayanlab.cloud/Enrichr/)是基于网页端的综合性的基因集富集工具[9]。本研究利用Enrichr软件对eEF2K相关DEGs进行GO分析。基于Enrichr在线工具,将涉及的生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)类别的GO术语按P值排序。9860FF2B-6653-4F43-81A5-22CFDB094EDF
1.5 基因集富集分析(gene set enrichment analysis, GSEA)GSEA用来评估一个预先定义的一组基因在两种生物状态之间是否表现出统计学上显著的一致性差异[10]。在这项研究中,使用R语言包Cluster Profiler[11]进行GSEA可视化,以阐明eEF2K高表达组和低表达组之间的显著功能和途径差异。每个分析程序重复1000次。参考基因集合:c2.cp.v7.2.symbols.gmt(Curated),基因集数据库来自MSigDB Collections。P<0.05且伪发现率(false discovery rate, FDR)<0.25的功能或途径被认为具有统计学意义的富集。
1.6 免疫浸润细胞与eEF2K表达的相关性分析通过R语言软件 (3.6.3版本)加载GSVA包(1.34.0版本)利用ssGSEA(single-sample gene set enrichment analysis)免疫浸润算法得出数据。采用Wilcoxon秩和检验和Pearson相关分析,评价免疫细胞浸润与不同eEF2K mRNA表达组之间的关系。用TIMER软件验证不同eEF2K mRNA表达水平与TCGA数据库中GBM免疫细胞浸润的相关性。
1.7 统计学方法所有统计分析和绘图均使用R语言软件(3.6.3版)进行。Mann-Whitney U检验(Wilcoxon rank sum test)用于eEF2K在泛癌中的表达情况。Wilcoxon秩和检验和Wilcoxon符号秩检验分别用于分析eEF2K在非配对样本中的表达。使用 pROC 包生成 ROC 曲线以评估 eEF2K 表达的诊断性能。使用Kaplan-Meier法绘制生存曲线,并通过对数秩检验评估组间差异。使用Spearman检验分析eEF2K与免疫细胞的关系。检验水准:α=0.05,双侧检验。
2 结果
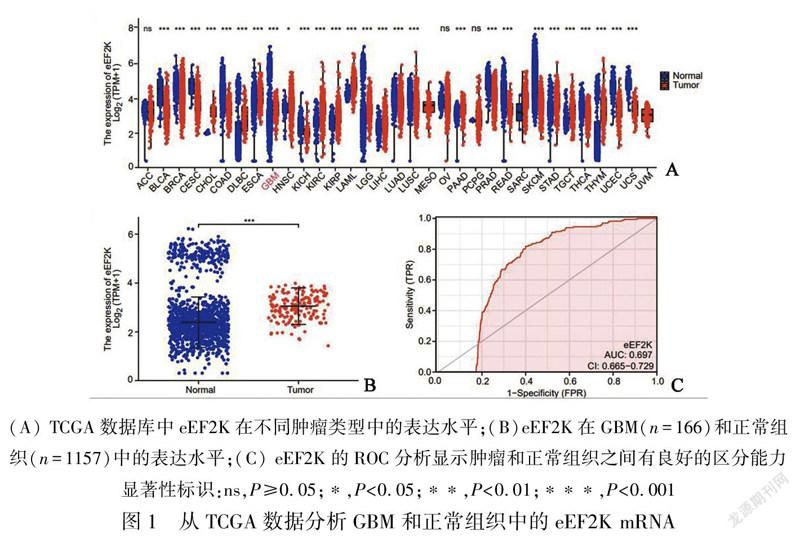
2.1 eEF2K在GBM中表达上调为了评估人类癌症中的eEF2K mRNA表达,我们使用来自TCGA的泛癌RNAseq数据检查eEF2K mRNA表达(表1)。得出了33種肿瘤(包括GBM在内)与邻近正常组织之间eEF2K mRNA的差异表达情况(图1A)。TCGA数据库中除了ACC、OV、PCPG表达无差异外,SARC的正常组织例数仅为2例,无法进行客观的比较,其他肿瘤类型的 eEF2K mRNA 表达均存在差异。CHOL、DLBC、ESCA、GBM、HNSC、KIRC、KIRP、LAML、LGG、LIHC、 PAAD、STAD、TGCT、THYM表达均显著高于正常组织; BLCA、BRCA、CESC、COAD、KICH、LUAD、LUSC、PRAD、READ、SKCM、THCA、UCEC、UCS表达均显著低于正常组织。通过泛癌分析提示GBM患者中eEF2K mRNA显著高于邻近正常组织。我们进一步通过非配对标本分析,GBM组eEF2K mRNA的表达高于邻近正常组织(图1B)。ROC曲线显示GBM中eEF2K mRNA的表达为0.697(95% CI:0.665~0.729)(图1C),eEF2K的最佳截断值为2.455(TPM)。
2.2 eEF2K表达与GBM预后无关为了探讨eEF2K是否影响GBM患者的预后,我们通过Kaplan-Meier 曲线进行生存分析,如图2A~C所示,eEF2K高表达(n=84,红色)和低表达(n=84,蓝色)与GBM患者的OS,eEF2K高表达(n=77)和低表达(n=78)的DSS、eEF2K高表达(n=84)和低表达(n=84)的PFI预后无相关性。
2.3 DEGs鉴定与eEF2K相关的37 832个基因我们对胶质瘤中与eEF2K相关的基因的进行DEGs。共鉴定了37 832个与eEF2K表达相关的基因,鉴定出满足|log2(FC)|>1.5 & p.adj<0.05阈值的ID有357个,在这阈值下,上调基因(logFC为正)的数目有5个,下调基因(logFC为负)的数目有352个, 在热图和火山图中显示了DEGs的表达(图3A、B)。
2.4 预测与eEF2K高、低表达的相关信号通路利用GO分析对GBM患者共表达的功能进行预测。在生物过程(BP)、细胞成分(CC)和分子功能(MF)组中, BP中GO术语前10的条目是CD4+αβT细胞增殖的负调节、维A酸受体信号通路、αβT细胞增殖的负调控、CD4+αβT细胞增殖的调节、CD4+αβT细胞活化的负性调节、钠离子稳态、单价无机阳离子稳态、干扰素-γ产生的负调控、金属离子的稳态、对维A酸的反应(图4A)。CC中GO术语中P值排序靠前的条目是钠通道复合物、阳离子通道复合物(图4B)。MF中GO术语中P值排序靠前的条目是配体门控钠通道活性、MAP激酶活性、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、WW结构域绑定、钠通道活性、配体门控阳离子通道活性(图4C)。我们还进行了GSEA分析,以确定与eEF2K相关的关键通路和疾病。由于文章篇幅有限,按照降序选取前19个满足FDR<0.25,P<0.05标准的数据集,并结合相关文章报道利用GSEA分析,从中挑选六条最丰富的通路和相关疾病,包括G-α(s)信号通路(图4D),Huntington病(图4E),阿尔茨海默病(图4F), TP53调节代谢基因(图4G),线粒体中的电子传输链(图4H),反应组生物氧化(图4I)。
2.5 eEF2K表达与免疫浸润有关GO和GSEA富集分析提示eEF2K可能参与肿瘤免疫反应。我们进一步应用ssGSEA分析了eEF2K mRNA表达与免疫细胞浸润水平的关系,详细的分析结果见表2。免疫细胞浸润与eEF2K mRNA表达的相关性如图5A所示。结果表明,eEF2K mRNA表达与Tem cells、NK cells、Tgd cells、Tcm cells、辅助性T cells和Th2 cells浸润呈正相关(图5B~G)。eEF2K mRNA表达与细胞毒性T细胞、T cells和B cells浸润呈负相关(图5H~J)。9860FF2B-6653-4F43-81A5-22CFDB094EDF
3 讨论
我们通过TCGA数据库发现eEF2K在多种肿瘤组织中表达存在差异,eEF2K在胃癌、胰腺癌、食管癌、肝癌和脑肿瘤(多形性胶质母细胞瘤)等多种实体癌中表达上调[4,6,12~14],在结直肠癌中,eEF2K的mRNA和蛋白质水平均显著下调[15]。文章还揭示了eEF2K参与肿瘤的增殖、侵袭、浸润和生长[5]。不仅如此,其还参与多种疾病状态的调节,包括心血管、神经系统疾病及其他癌症[16]。eEF2K似乎在肿瘤中充当了双重作用,既可以有助于体内肿瘤的生长,又可以抑制肿瘤的发生。我们的分析证实了这一点,我们发现eEF2K在TCGA各肿瘤类型中既有高表达,也存在低表达。这些结果表明,eEF2K可能参与了多种癌症的发生、发展。
结合TCGA数据库中结果显示,eEF2K在GBM组织中的表达高于正常组织,与非配对样本分析中基因表达水平一致。eEF2K在胶质瘤细胞诱导自噬中起着关键作用,通过沉默BECN1来抑制eEF2K介导的自噬,可以显著提高抗癌药物对胶质瘤细胞的疗效[17]。抑制自噬显著降低了在营养耗竭条件下GBM瘤细胞的生长活力[4]。LIU等人[3]通过在胶质瘤模型中加用eEF2K抑制剂NH125,发现抑制eEF2K可增强TMZ对胶质瘤细胞生长、增殖、迁移和侵袭的抑制作用。此外我们还发现,eEF2K的表达可以作为GBM的诊断标志,其AUC(area under curve)为0.697。但基于目前关于eEF2K在GBM肿瘤中的研究甚少,其作用机制暂不清楚。
研究表明eEF2K与多种肿瘤生存预后有关,目前人们把eEF2K看成多种肿瘤预后不良的生物标志物和靶向治疗的潜在新的分子靶点[18]。其高表达与肺癌患者总体生存期较短有关[5]。而在结直肠癌中,eEF2K阴性组的患者总体存活率明显低于eEF2K阳性组[15]。因此,我们猜想eEF2K在GBM肿瘤中表达上调,是否可以作为GBM患者生存不良的潜在预后指标。但是令人失望的是,从TCGA数据库中得出结论,eEF2K表达与GBM患者预后无关。eEF2K mRNA的表达与GBM患者的OS、DSS、PFI预后无关。这种无差异性可能基于TCGA中GBM患者的种群、地域性差异以及病例数过少引起,也许需要更大的样本量来验证上述结论。虽然我们的结论没有支持eEF2K表达与GBM患者预后有关,但不排除其可能参与GBM的细胞生长、增殖、迁移和侵袭的抑制作用。
GSEA分析发现,eEF2K的表达与Galpha(s)信号、亨廷顿病、阿尔兹海默病、TP53调节代谢基因、线粒体中的电子传输链、生物氧化反应等有关。因此,我们的研究为理解eEF2K在肿瘤发病机制中的潜在作用提供了见解,并证明了它作为潜在的神经退行性疾病生物标志物的用途。这也与以往的研究一致,以往的研究发现,eEF2K不仅可能参与多种生物学功能,如细胞增殖、迁移和侵袭[5],还可以调节一些神经系统疾病的记忆缺陷,例如AD[19~20]。我们的研究也提示eEF2K与AD、亨廷顿病有关,可能因为两者都存在共同症状记忆障碍现象,但目前具体作用机制还需要我们进一步探讨。GBM中最常见的基因突变是EGFR(epidermal growth factor receptor)、PTEN(gene of phosphate and tension homology deleted on chromosome ten)、TP53、TERT(telomerase reverse transcriptase)或RB1(Rb gene1)基因等,TP53也被确定为低级别星形细胞瘤和继发性胶质母细胞瘤的标志物[21]。抑制TP53 GOF(gain of function)突变可以抑制GBM的炎症[22],而且TP53和PTEN的联合缺失导致eEF2K的乳腺癌(breast cancer,BC)加速发展[22]。有趣的是,在GBM中,TP53突变也与免疫浸润增加有关[21]。
在肿瘤微环境中,免疫系统不仅保护宿主不受肿瘤发展的影响,而且还可以通过塑造和选择免疫原性降低肿瘤逃逸变体来促进肿瘤的生长[23]。GBM进展过程中受损的血脑屏障允许免疫细胞从血液进入,诱导星形胶质细胞激活,从而促进神经炎症[24]。而在生理条件下,免疫细胞透过血脑屏障是有限的[25]。我们试图研究eEF2K与GBM免疫及24种免疫细胞的浸润水平关系,eEF2K的表达增加与GBM中Tem、NK cells、Tgd、Tcm、T helper cells、Th2 cell浸润呈正相关,与Cytotoxic cells、T cells和B cells浸润呈负相关。近年来,免疫治疗成为包括GBM肿瘤在内的颅内肿瘤疾病很有前景的治疗方法[26]。目前肿瘤免疫治疗的方法包括NK细胞的免疫疗法[25]和T细胞疗法[27]。研究表明,T细胞活化和浸润是抗肿瘤免疫的关键步骤[28]。GBM通过触发T细胞功能障碍来破坏肿瘤免疫反应,导致T细胞老化、耐受、无力和衰竭[29]。先前的研究发现,Th2细胞的浸润与多种肿瘤的免疫抑制和生存不良有关[30]。Th2介导的免疫抑制降低了保护性细胞免疫,并与肿瘤进展有关,在本研究中,eEF2K表达增加会导致Th2细胞浸润增强,提示eEF2K可能有助于介导GBM的免疫逃逸。在GBM患者的肿瘤组织和外周血中增加的Tgd细胞调节GBM的发展[31]。因此,我们推测eEF2K可能通过调节GBM中的免疫浸润来影响患者的预后。
虽然这项研究可以为我们对eEF2K与GBM之间的相关性提供新的见解,但也存在一些局限性。首先,只评估了一个数据集,这可能会导致样本偏差。其次,为了增加研究结果的可信度,应进一步扩大样本量。第三,为了提高临床应用水平,还应考虑更多的临床因素。第四,缺乏体外实验和活体实验,我们的结果还需要进一步的实验验证。为了进一步研究eEF2K在GBM中的作用机制,我们应在不久的將来进行体内外研究实验。9860FF2B-6653-4F43-81A5-22CFDB094EDF
綜上所述,eEF2K mRNA在GBM中高表达,本研究虽然没有揭示eEF2K在GBM中的预后价值。但我们的研究结果表明,eEF2K可能通过促进多种免疫细胞的浸润,调节肿瘤细胞的肿瘤微环境,抑制获得性免疫,从而发挥致癌作用。本研究表明eEF2K可作为GBM诊断的潜在生物标志物,并强调它是一个潜在的免疫治疗靶点。参考文献[1] BRANDAO M,SIMON T,CRITCHLEY G,et al.Astrocytes,the rising stars of the glioblastoma microenvironment[J].Glia,2019,67(5):779-790.
[2] PERRY J R,LAPERRIERE N,O'CALLAGHAN C J,et al.Short-course radiation plus temozolomide in elderly patients with glioblastoma[J].N Engl J Med,2017,376(11):1027-1037.
[3] LIU X Y,ZHANG L,WU J P,et al.Inhibition of elongation factor-2 kinase augments the antitumor activity of Temozolomide against glioma[J].PLoS One,2013,8(11):e81345.
[4] WU H,YANG J M,JIN S K,et al.Elongation factor-2 kinase regulates autophagy in human glioblastoma cells[J].Cancer Res,2006,66(6):3015-3023.
[5] BIRCAN H A,GURBUZ N,PATAER A,et al.Elongation factor-2 kinase (eEF-2K) expression is associated with poor patient survival and promotes proliferation,invasion and tumor growth of lung cancer[J].Lung Cancer,2018,124:31-39.
[6] ZHOU Y,LI Y T,XU S H,et al.Eukaryotic elongation factor 2 kinase promotes angiogenesis in hepatocellular carcinoma via PI3K/Akt and STAT3[J].Int J Cancer,2020,146(5):1383-1395.
[7] MAAG J L V.Gganatogram:an R package for modular visualisation of anatograms and tissues based on ggplot2[J].F1000Research,2018,7:1576.
[8] LIU J F,LICHTENBERG T,HOADLEY K A,et al.An integrated TCGA pan-cancer clinical data resource to drive high-quality survival outcome analytics[J].Cell,2018,173(2):400-416.e11.
[9] KULESHOV M V,JONES M R,ROUILLARD A D,et al.Enrichr:a comprehensive gene set enrichment analysis web server 2016 update[J].Nucleic Acids Res,2016,44(W1):W90-W97.
[10] SUBRAMANIAN A,TAMAYO P,MOOTHA V K,et al.Gene set enrichment analysis:a knowledge-based approach for interpreting genome-wide expression profiles[J].Proc Natl Acad Sci USA,2005,102(43):15545-15550.
[11] YU G C,WANG L G,HAN Y Y,et al.clusterProfiler:an R package for comparing biological themes among gene clusters[J].OMICS A J Integr Biol,2012,16(5):284-287.
[12] JIANG M X,QI L,JIN K X,et al.eEF2K as a novel metastatic and prognostic biomarker in gastric cancer patients[J].Pathol Res Pract,2021,225:153568.
[13] ASHOUR A A,ABDEL-AZIZ A A H,MANSOUR A M,et al.Targeting elongation factor-2 kinase (eEF-2K) induces apoptosis in human pancreatic cancer cells[J].Apoptosis,2014,19(1):241-258.
[14] ZHU H C,SONG H M,CHEN G Z,et al.eEF2K promotes progression and radioresistance of esophageal squamous cell carcinoma[J].Radiother Oncol,2017,124(3):439-447.9860FF2B-6653-4F43-81A5-22CFDB094EDF
[15] NG T H,SHAM K W Y,XIE C M,et al.Eukaryotic elongation factor-2 kinase expression is an independent prognostic factor in colorectal cancer[J].BMC Cancer,2019,19(1):649.
[16] LIU R,PROUD C G.Eukaryotic elongation factor 2 kinase as a drug target in cancer,and in cardiovascular and neurodegenerative diseases[J].Acta Pharmacol Sin,2016,37(3):285-294.
[17] CHENG Y,REN X C,ZHANG Y,et al.Integrated regulation of autophagy and apoptosis by EEF2K controls cellular fate and modulates the efficacy of curcumin and velcade against tumor cells[J].Autophagy,2013,9(2):208-219.
[18] KARAKAS D,OZPOLAT B.Eukaryotic elongation factor-2 kinase (eEF2K) signaling in tumor and microenvironment as a novel molecular target[J].J Mol Med (Berl),2020,98(6):775-787.
[19] MA T.Roles of eukaryotic elongation factor 2 kinase (eEF2K) in neuronal plasticity,cognition,and Alzheimer disease[J].J Neurochem,2021:2021Nov19.
[20] BECKELMAN B C,YANG W Z,KASICA N P,et al.Genetic reduction of eEF2 kinase alleviates pathophysiology in Alzheimer's disease model mice[J].J Clin Invest,2019,129(2):820-833.
[21] WESTPHAL M,LAMSZUS K.The neurobiology of gliomas:from cell biology to the development of therapeutic approaches[J].Nat Rev Neurosci,2011,12(9):495-508.
[22] LIU J C,VOISIN V,WANG S,et al.Combined deletion of Pten and p53 in mammary epithelium accelerates triple-negative breast cancer with dependency on eEF2K[J].EMBO Mol Med,2014,6(12):1542-1560.
[23] CROCI D O,SALATINO M.Tumor immune escape mechanisms that operate during metastasis[J].Curr Pharm Biotechnol,2011,12(11):1923-1936.
[24] ZHANG H,ZHOU Y L,CUI B Q,et al.Novel insights into astrocyte-mediated signaling of proliferation,invasion and tumor immune microenvironment in glioblastoma[J].Biomed Pharmacother,2020,126:110086.
[25] GOLN I,DE LA FUENTE L R,COSTOYA J A.NK cell-based glioblastoma immunotherapy[J].Cancers,2018,10(12):522.
[26] SONG J,KADABA P,KRAVITZ A,et al.Multiparametric MRI for early identification of therapeutic response in recurrent glioblastoma treated with immune checkpoint inhibitors[J].Neuro-oncology,2020,22(11):1658-1666.
[27] WALKER D G,SHAKYA R,MORRISON B,et al.Impact of pre-therapy glioblastoma multiforme microenvironment on clinical response to autologous CMV-specific T-cell therapy[J].Clin Transl Immunology,2019,8(11):e01088.
[28] ROSATO P C,WIJEYESINGHE S,STOLLEY J M,et al.Virus-specific memory T cells populate tumors and can be repurposed for tumor immunotherapy[J].Nat Commun,2019,10(1):567.
[29] WORONIECKA K I,RHODIN K E,CHONGSATHIDKIET P,et al.T-cell dysfunction in glioblastoma:applying a new framework[J].Clin Cancer Res,2018,24(16):3792-3802.
[30] LULLO G D,MARCATTI M,HELTAI S,et al.Th22 cells increase in poor prognosis multiple myeloma and promote tumor cell growth and survival[J].Oncoimmunology,2015,4(5):e1005460.
[31] LEE M,PARK C,WOO J,et al.Preferential infiltration of unique Vγ9Jγ2-Vδ2 T cells into glioblastoma multiforme[J].Front Immunol,2019,10:555.
(收稿日期:2021-11-03修回日期:2022-03-17)
(編辑:梁明佩)9860FF2B-6653-4F43-81A5-22CFDB094EDF

