CO2 加氢制乙醇反应机理及催化剂研究进展
张力婕,韩爱国
(1. 中国石化大连石油化工研究院,辽宁 大连 116045;2. 天津大学分子 + 研究院,天津 300072)
CO2利用对碳循环经济的发展正产生着巨大影响,并在全世界引起广泛关注[1-2]。实施CO2捕集、耦合“绿氢”催化加氢转化制取高价值化学产品,对减少CO2排放和改善生态环境具有重要意义[3-4]。在CO2转化反应中,以生成甲醇为主要产品的途径近年来得到了深入研究[5-8];此外,也有研究者对CO2加氢直接转化为烯烃、芳烃及N,N-二甲基甲酰胺(DMF)等高附加值产品进行了探索[9-13],但有关CO2加氢合成乙醇或高级醇的报道较少。乙醇用途广泛,可以用作清洁燃料添加剂、溶剂和消毒剂等;同时,燃料乙醇作为一种重要的可再生清洁能源,运输安全且与汽油的相容性更好[14],可作为液体化石燃料的替代品。使用含醇汽油不仅能够减少石油的消耗量,而且污染物(包括SOx、NOx、CO、CHx及可吸入颗粒物)的排放量也远低于普通汽油[15]。
与甲醇生产相比,C2+产品的合成面临更大的挑战[16-17],这是因为CO2是一种热力学稳定的化学惰性分子,其转化率较低,需要较高的反应温度(> 200 °C)。其中CO2加氢制乙醇在热力学上较困难,易生成CH4或CO,降低了乙醇的选择性。为实现高选择性CO2加氢制乙醇,研究者们从活性组分、前驱体、助剂及载体等方面开展研究,如通过助剂Na、K等影响CO和H2的活化来调控催化剂表面*CHx、*CO和*H的相对覆盖度,进而调控*CHx—*CO偶联和加氢反应[18]。本文重点分析CO2加氢制乙醇的反应机理;归纳总结活性组分、载体、金属掺杂/负载和工艺参数等因素对催化剂性能的影响;并对未来的研究方向进行展望。
1 CO2 加氢制乙醇反应机理
1.1 反应热力学与动力学分析
CO2是高度对称的直线型分子,化学性质稳定,将CO2活化并转化为乙醇十分困难,C=O键的有效断裂和所需中间物种的选择性生成具有挑战性。如何提高现有催化剂体系的催化活性、稳定性和目标产物乙醇的选择性,是实现大规模CO2加氢制乙醇工业化的关键。CO2催化加氢生成乙醇的反应式如式(1),在温度为298 K时,其焓变熵变以及平衡常数Kp= 2.946 × 1011[19]。

从热力学角度看,CO2催化加氢生成乙醇反应的焓变为负值,即为放热反应,且反应平衡常数Kp较大,产物较易生成,增大压力和降低温度有利于反应向生成乙醇的方向进行;从动力学角度看,反应温度过低,难以有效活化CO2分子,导致反应速率较低,因此为兼顾反应速率和CO2的活化,选择适宜的温度有助于得到较好的乙醇收率[20]。除了研发合适的催化剂外,工艺参数对CO2加氢产物分布和转化率也有很大影响。研究表明[21],产物分布和转化率可以通过改变原料气组成和压力等工艺参数来调节。不同类型的反应器以及工艺参数(反应温度、反应压力、原料气H2与CO2的比例以及空速等)对产物分布的影响如图1 所示。

图1 不同类型反应器中工艺参数对产物分布的影响[21]Fig. 1 Influence of process parameters in different types ofreactor on the product distribution[21]
1.2 反应机理
反应机理是确定反应过程中可能形成的中间体的关键。由于原位测试技术手段有限,且CO2加氢生成的产物具有多样性,反应机理十分复杂[22-24],不同类型的催化剂催化CO2加氢合成乙醇的反应机理和反应路径迄今仍没有统一和明确的解释。有研究者通过在不同条件下的实验研究或采用原位漫反射傅里叶变换红外光谱(DRIFTS)、傅里叶变换红外光谱(FTIR)和离散傅里叶变换(DFT)等表征技术,提出了合理的反应机理。目前被广泛接受的反应机理主要有两种:一是CO2经逆水气变换反应(RWGS)生成CO,部分CO氢化生成*CH3,CO嵌入*CH3中完成碳链增长,进一步加氢生成乙醇[25]。该过程中催化剂的作用是至关重要的,CO和催化剂上的活性物种之间的结合力需要足够强,以避免CO进一步解离成*C和*O。二是通过CO2分子的吸附和活化形成羧酸中间体,进一步还原产生甲酸中间物种*HCOO,*CHx与*HCOO键合形成的表面中间体(*CH3COO)进一步氢化形成乙醇[26]。
AN等[27]基于表征和实验结果,提出了CO2加氢制乙醇的可能机理,如图2 所示。首先,CO2在La4Ga2O9表面被吸附和活化,然后经过RWGS反应转化为CO中间体,CO随后迁移到Co0—Co2+活性位点上,部分CO解离生成*CHx基团,*CO嵌入*CHx完成碳链增长,最后加氢生成乙醇。

图2 Co/La4Ga2O9 催化剂上CO2 加氢反应机理[27]Fig. 2 Reaction mechanism of CO2 hydrogenation over Co/La4Ga2O9 catalyst[27]
BAI等[28]的机理研究表明,CO2加氢反应生成乙醇过程经历了CO2吸附/活化、甲酸盐中间体的形成、中间体(甲酸盐、*CO、*CH3和*CO插入形成*CH3CO)的转化或加氢,最后加氢生成乙醇;并推测*CO加氢生成*HCO是CO2加氢生成乙醇的速率控制步骤。DING等[29]通过同位素标记法、密度泛函计算和平板模型计算探究了高性能催化剂Cu@Na-Beta催化CO2加氢合成乙醇的反应机理。其认为CO2首先在铜纳米粒子表面氢化成*CH3,随后吸附的*CO2与*CH3反应形成重要的表面中间体*CH3COO,然后*CH3COO氢化形成乙醇。此外,WANG等[30]发现在钴催化剂中加入镍物种可以促进CO2加氢形成相对稳定的*CHx中间体,从而避免了甲烷化的发生,*CHx随后插入到*HCOO中形成乙醇,如图3 所示。LOU等[31]的机理研究也表明,该转化经历了CO2吸附和活化、甲酸盐中间体的形成、乙酸盐的插入以及加氢生成乙醇的过程。
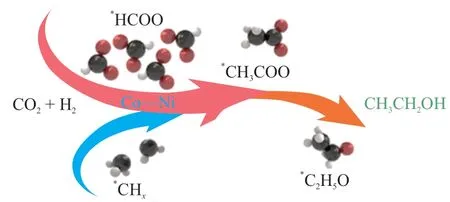
图3 *CHx插入*HCOO形成乙醇的机理[30]Fig. 3 Mechanism of ethanol formation by *CHx insertion to*HCOO[30]
2 CO2 加氢制乙醇催化剂研究进展
与均相催化剂相比,多相催化剂在反应后易于分离和回收且具有较好的可再生性,因此被广泛应用于CO2加氢制乙醇中。近年来,文献中报道的关于CO2加氢制乙醇的研究大多在实验室规模的反应器上进行。反应器主要包括间歇反应器和连续反应器;而催化剂种类较多,其性能与活性组分、载体等密切相关。
2.1 活性组分对催化剂性能的影响
2.1.1 Rh基催化剂
负载型贵金属催化剂因其在C—C偶联方面的卓越能力于CO2加氢反应中备受关注。在连续反应器中,YANG等[32]探究了负载在TiO2纳米棒上的Rh基催化剂中羟基的关键作用。结果表明,RhFeLi/TiO2纳米棒催化剂在催化CO2加氢反应中乙醇选择性为32%,促进作用归因于TiO2纳米棒上高分散性的Rh和高密度的羟基之间的协同作用。羟基可以稳定甲酸根并质子化甲醇,使甲醇很容易分解为*CHx,然后CO(RWGS反应生成)插入*CHx中形成*CH3CO,*CH3CO再加氢生成乙醇,如图4 所示。

图4 负载于TiO2 纳米棒上的Rh基催化剂CO2 加氢机理[32]Fig. 4 CO2 hydrogenation mechanism of Rh-based catalyst supported on TiO2 nanorods[32]
此外,QIAN等[33]发现Ru3(CO)12/Rh2(CO)4Cl2-LiI催化剂可以在温和条件下有效地催化1,3-二甲基-2-咪唑烷酮(DMI)中的CO2加氢反应生成甲醇、乙醇和丙醇等。LiI作为助剂,由于锂离子更强的路易斯酸性,在催化反应过程中提供了合适的配位位点,因而促进了C2+醇的合成,在最优条件下,C2+醇的选择性可高达96.4%,并且该催化剂较易回收。
2.1.2 Au基催化剂
负载型Au纳米粒子(Au NPs)或金纳米团簇(Au NCs)作为一种多功能催化剂具有较高的活性和选择性,可用于CO2加氢反应。在间歇反应器中,WANG等[34]合成了一种高效TiO2负载的Au NCs催化剂,温和条件下,在DMF溶剂中将CO2和H2直接合成乙醇。Au NCs与TiO2载体之间独特的协同效应,特别是具有丰富氧空位的锐钛矿晶相TiO2,促进了所设计催化剂的成功应用。结果表明,Au/a-TiO2(a表示锐钛矿)催化剂表现出较高的活性和对乙醇的高选择性,乙醇产率为942.8 mmol/(g·h)(单位时间单位质量催化剂(以Au计)上生成乙醇的物质的量),乙醇的选择性> 99%;并表现出优异的稳定性。
2.1.3 Pt基催化剂
Pt合金能够活化CO2,因此Pt基催化剂可用于CO2加氢合成乙醇。在连续反应器中,OUYANG等[35]将Pt纳米颗粒负载在两种不同形态的Co3O4(纳米棒和纳米片)上制备Pt/Co3O4催化剂。该催化剂在50 h反应时间内具有稳定且相对较高的CO2转化率和醇选择性,在t= 200 °C和p= 2 MPa条件下C2+醇产率为0.56 mmol/(g·h)。HE等[36]研究了水对CO2加氢生成高级(C2~C4)醇的影响,水和催化剂Pt/Co3O4具有极好的促进反应的协同作用。C2~C4醇的高选择性可以在t= 140 °C下实现(尤其是使用DMI作共溶剂时),液相产物中C2~C4醇的选择性可达35.2%。
2.1.4 Pd基催化剂
由于Pt及其合金催化剂具有很强的CO2活化能力,因此有关CO2加氢制乙醇催化剂的研究主要集中在Pt及其合金催化剂上,但是Pt高昂的价格及其稀缺性严重阻碍了此类催化剂的进一步发展。因此人们开始专注于开发无Pt催化剂用于CO2加氢转化制乙醇,其中Pd基催化剂由于有利于C—C偶联反应(控制乙醇产率的关键步骤)而引起了广泛关注。
在间歇反应器中,BAI等[28]合成了高度有序的Pd-Cu NPs催化剂,实现了高活性、高选择性、高稳定性地将CO2加氢转化为乙醇。通过调整Pd-Cu NPs和催化剂载体的组成发现,Pd2Cu NPs/P25 对乙醇的选择性高达92.0%,转换频率(TOF)可达359.0 h-1。DRIFTS表征结果表明,Pd与Cu间的电子相互作用可促进*CO氢化为*HCO(CO2加氢生成乙醇的速率控制步骤)。在连续反应器中,LOU等[31]制备了一种特殊的CeO2负载的Pd二聚体(Pd2/CeO2)催化剂,该催化剂可有效地将CO2转化为乙醇,乙醇选择性高达99.2%,乙醇产率达45.6 g/(g·h)(单位时间单位质量催化剂(以Pd计)上生成乙醇的质量)。这是由于Pd二聚体具有独特的Pd2O4构型,能够直接将CO2解离为CO,触发C—C偶联,Pd2/CeO2表面与CO结合能力强,从而防止CO解吸,并促进CO和*CH3中间体之间的偶联形成乙醇前驱体,从而实现高活性、高选择性生成乙醇。
2.1.5 In基催化剂
In2O3是CO2加氢制甲醇的有效催化剂,而Ir基单核配合物能够催化甲醇羰基化进而生成C2+醇。在间歇反应器中,YE等[37]设计了一种双功能Ir1-In2O3单原子催化剂,通过将单原子Ir锚定在In2O3载体上整合两种催化活性中心。结果表明,该催化剂可有效催化CO2加氢并高选择性地生成乙醇(选择性> 99%),初始TOF可达481 h-1。该催化剂的机理研究表明,Ir原子与相邻的氧空位结合形成路易斯酸碱对,激活CO2并形成吸附在Ir原子上的羰基(*CO)中间体。然后*CO与吸附在In2O3上的甲醇结合形成C—C键,进而生成乙醇。
2.1.6 Cu基催化剂
在间歇反应器中,AN等[38]于t= 100 °C、p= 2 MPa、n(H2):n(CO2) = 3:1 的条件下使用MOF(金属有机骨架)负载的Cu基催化剂Zr12-bqdc-CuCs催化CO2加氢反应,产物乙醇的选择性> 99%。该催化剂不仅具有较好的稳定性和较高的选择性,其特殊的催化剂结构还避免了活性位点的团聚。作者通过同位素追踪实验和理论计算的结果,提出了CO2加氢生成甲醇和乙醇的反应机理,如图5 所示。该研究结果展现出MOF材料作为催化剂载体的独特优势,为CO2加氢制乙醇开拓了新的思路。

图5 Zr12-bpdc-Cu催化剂上CO2 加氢生成甲醇和乙醇的反应机理[38]Fig. 5 Reaction mechanism of methanol and ethanol synthesis from CO2 hydrogenation over Zr12-bpdc-Cu catalyst[38]
在连续反应器中,DING等[29]在Na-Beta沸石的晶粒中嵌入2~5 nm的Cu纳米颗粒,成功合成了一种高性能催化剂Cu@Na-Beta,在其作用下,CO2加氢获得乙醇为唯一有机产物。t= 300 °C、GHSV=12000 mL/(g·h)及p= 2.1 MPa条件下,乙醇单程产率可达14%,时空产率(单位时间单位质量催化剂上生成乙醇的质量)为398 mg/(g·h)。结合实验和理论计算结果,认为不规则Cu纳米粒子与周围沸石骨架之间的协同作用是催化剂Cu@Na-Beta高性能的原因。
2.1.7 Co基催化剂
Co基催化剂催化CO2加氢反应生成烃类和含氧化合物的关键在于降低金属Co的加氢性能,使得CO2可以转化形成CO中间体,随后继续加氢形成烃类或含氧物质(如醇类)[39]。Co2C催化剂由于具有优秀的CO插入能力,可以在CO加氢反应中实现超过60%的醇选择性。但是Co2C是一种结构敏感的催化剂,在H2气氛下很容易被分解为金属Co。金属Co有利于CO解离活化形成大量*CHx,不利于CO插入反应的进行,在CO2加氢反应中会增加CH4的选择性,降低乙醇的选择性。
为了实现Co2C的稳定性及CO吸附与活化的调节,在连续反应器中,ZHANG等[40]通过引入不同的碱金属并改变其含量来调节Co2C与碱金属之间的相互作用。其以SiO2为载体,通过浸渍法制备了不同碱金属修饰的X-Co/SiO2(X= Li、Na、K)催化剂。CO2加氢反应结果表明,2%Na-Co/SiO2(Na质量分数2%)催化剂获得了最高的醇选择性(12.5%)和乙醇产率(0.47 mmol/(g·h)),该催化剂在100 h稳定性测试中基本保持稳定。此外,ZHANG等[41]制备了负载在不同载体(Al2O3、ZnO、AC、TiO2、SiO2和Si3N4)上的Na-Co基催化剂,用于将CO2直接加氢生成乙醇,并探究载体的影响。结果表明,SiO2和Si3N4负载的催化剂在反应温度为250 °C时表现出较高的乙醇选择性,CO2转化率为18.82%,乙醇选择性为62.81%,而CH4主要在其他负载型催化剂上产生。负载型Co2C催化剂的CO2加氢制乙醇反应机理如图6 所示。

图6 负载型Co2C催化剂的CO2 加氢制乙醇机理[41]Fig. 6 Mechanism of supported Co2C catalyst in CO2 hydrogenation to ethanol[41]
在间歇反应器中,ZHANG等[42]以离子液体为前驱体制备了一系列CoMoCx催化剂,并通过改变渗碳温度来调节CoMoCx催化剂的比例和电子性质,优化CO2催化加氢生成乙醇的效率。在最佳反应条件(t= 180 °C和p= 2 MPa )下,乙醇的选择性达97.4%、产率达0.528 mmol/(g·h)。此外,WANG等[43]以Co-Al层状双金属氢氧化物(LDH)为前驱体,通过煅烧和还原制备了氧化铝负载的Co催化剂(CoAlOx);通过在不同的预还原温度下调节催化剂的Co-CoOx组成,提高了CO2加氢制乙醇的选择性。结果表明, 600 °C下还原后的催化剂在140 °C下反应时乙醇选择性为92.1%,产率为0.444 mmol/(g·h)。
2.1.8 Fe基催化剂
由于贵金属价格昂贵及资源稀有,将其作为催化剂的主要成分大量用于转化大规模CO2是不现实的。在连续反应器中,INUI等[44]选择FT型成分(Fe、Cu、Zn、Al和K)作为催化剂主要组分,以较小质量分数的贵金属(例如Pd和Rh)和少量的Ga作为提高催化性能的关键组分(根据需要组合的元素的催化剂性质,选择适宜的比例),合成了催化CO2加氢生成乙醇的Fe基FT型复合催化剂,并探究了其催化CO2加氢合成乙醇的催化性能。结果表明,在CO2转化率分别为31.1%和54.5%时,在不同的催化剂组合和反应条件下,乙醇的最高产率分别为874 g/(L·h)和476 g/(L·h)。
表 1 总结了不同催化剂在不同反应条件下的CO2加氢制乙醇性能研究结果。

表1 不同催化剂CO2 加氢制乙醇性能比较Table 1 Performance comparison of different catalysts for CO2 hydrogenation to ethanol
2.2 载体对催化剂性能的影响
在CO2加氢制乙醇中使用的载体类型也影响着催化剂性能。载体为催化剂纳米颗粒提供热稳定性和机械稳定性的同时,还有助于改善颗粒的流动性,从而有利于化学稳定性的提高。
在 间 歇 反 应 器 中,BAI等[28]在t= 200 °C、n(H2):n(CO2) = 3:1 和反应时间为5 h的条件下,研究了载体SiO2、CeO2、Al2O3和P25 上负载Pd2Cu NPs后催化剂的CO2加氢制乙醇催化性能。结果表明,这4 种载体负载Pd2Cu NPs后,其乙醇产率分别为14.8 mmol/(g·h)、16.2 mmol/(g·h)、19.7 mmol/(g·h)
和41.5 mmol/(g·h)。由于P25 上存在氧物种且Pd和Cu之间发生电荷转移使得Pd2Cu NPs/P25 催化剂表现出最佳的催化性能和最大的乙醇产率。
在连续反应器中,YANG等[32]以质量分数1%的RhFeLi作为掺杂剂,在t= 250 °C、n(H2):n(CO2) = 3:1、p= 3 MPa和GHSV= 6000 h-1的条件下考察了不同载体对乙醇收率的影响,其使用的载体是ZSM-5、SiO2、TS-1、锐钛矿TiO2、TiO2NRs、TiO2Com(商用TiO2)、ZrZnOx、ZnO和ZrO2。结果表明,TiO2NRs作为载体时获得了最高的乙醇产率(1.3%),这是由于TiO2NRs中羟基含量较高,有利于生成乙醇。ZHANG等[41]在t= 250 °C、p= 5 MPa、GHSV= 4000 h-1、n(H2):n(CO2) = 3:1 及反应时间40 h的条件下,通过改变载体研究了Co2C催化剂的CO2加氢制乙醇性能。结果表明,与载体SiO2(18.82%,转化率,下同)和Si3N4(17.75%)相比,以Al2O3(48.47%)、ZnO(33.69%)、AC(67.19%)和TiO2(63.66%)为载体的催化剂CO2转化率更高;在Na-Co/AC催化剂上实现了最大的CO2转化率(67.19%)和乙醇选择性(71.36%),但低CO选择性有利于甲烷的形成。因此,综合考虑,SiO2被认为是该反应条件下的最佳载体,此时CO2转化率为18.82%,乙醇选择性为62.81%。
2.3 金属掺杂/负载对催化剂性能的影响
对于CO2加氢制乙醇反应,通过在催化剂载体上掺杂/负载不同含量的金属,可以调节CO2的转化率和目标产物乙醇的选择性。因此,研究者们常通过金属掺杂/负载来优化催化剂性能以确保生成更多的目标产物乙醇。
在间歇反应器中,CUI等[50]基于n(Ru):n(Co)分别为20:40、30:30、40:20、45:15、20:10 和60:30 进行负载制备了Ru3(CO)12-Co4(CO)12催化剂,并在t= 200 °C、n(H2):n(CO2) = 2:1 和反应时间为12 h下进行CO2加氢制乙醇反应。结果表明,n(Ru):n(Co)为40:20 时,乙醇选择性最高,为87.5%(29.5 mmol/(L·h)),这是因为高负载量影响了乙醇的生成速率并增加了甲醇的合成。YE等[37]在反应t= 200 °C、n(H2):n(CO2) =5:1 及反应时间为 5 h条件下,考察了Ir-In2O3催化剂中Ir的负载量(质量分数,下同)从0.2%增加到1.0%时催化剂的性能。结果表明,随着Ir负载量的增加,乙醇选择性从85.3%(0.92 mmol/(g·h))持续下降到5.7%(0.13 mmol/(g·h))。因此增加Ir的负载量会抑制乙醇合成并生成更多的甲醇。SEM-EDX和TEM分析结果表明,随着Ir负载量从0.5%增加到1.0%,单原子Ir从小尺寸生长为1~2 nm大小的聚集纳米颗粒,比表面积减小且关键活性位点减少,导致产物中乙醇产量降低。
在连续反应器中,WANG等[47]在t= 250 °C、WHSV= 6000 h-1和n(H2):n(CO2) = 3:1 的条件下,对催化剂Rh-VOx/MCM-41 进行了质量分数为0.1%至1.0%的VOx金属负载。结果表明,当负载量为0.3%时,乙醇选择性(在醇中)最高,为24.1%;较高的负载量降低了CO2的转化率和乙醇的选择性,这是由于大量的VOx覆盖在Rh表面,阻碍了Rh活性位点发挥作用。ZHANG等[49]在t= 250 °C、p= 5 MPa和GHSV= 6000 mL/(g·h)条件下,研究了Na-Rh/S-1 催化剂中金属Na负载量(质量分数)在0.13%~0.26%之间变化时催化剂的性能。结果表明,在没有Na负载的情况下,产物中不会形成乙醇,表明在选择性生成乙醇的过程中需要Na和Rh的相互作用。随着Na的负载量的增加,乙醇的选择性呈现出先增大后降低的趋势,当金属Na负载量为0.19%时,此时乙醇的选择性最大,为24%(72 mmol/(g·h)),这是由于当Na的负载量继续增大时,较多的Na覆盖了大部分Rh+活性位点,导致乙醇的选择性降低。
2.4 工艺参数对催化剂性能的影响
2.4.1 反应温度的影响
适宜的反应温度不仅能促进CO2的活化,还能促进中间体*CO进一步生成乙醇的前驱体*CHxO。由于CO2化学性质稳定且受动力学控制,因此通常要求反应温度在200~300 °C范围内,以使产物中乙醇的选择性更高。
在间歇反应器中,QIAN等[33]制备了Ru3(CO)12/Rh2(CO)4Cl2-LiI催化剂,在n(H2):n(CO2) = 4:4和反应时间为12 h条件下将温度从180 °C升高到200 °C时,乙醇产率从3.6 mmol/(L·h)增加到6.0 mmol/(L·h);进一步升高到220 °C,乙醇产率略有增加,达到6.2 mmol/(L·h),而C3~C4醇产率在高温下不断增加。Ye等[37]制备了Ir1-In2O3催化剂,在n(H2):n(CO2) =5:1、反应时间为 5 h的条件下考察了反应温度从180 °C升高到240 °C时催化剂的性能。结果表明,当温度从180 °C升高到200 °C时,乙醇选择性保持在99.7%, 至240 °C时,乙醇选择性则降至92.2%(1.44 mmol/(g·h)),表明反应在较高温度下受动力学控制,温度进一步升高提高了甲醇收率降低了乙醇选择性。
在连续反应器中,WANG等[47]在WHSV= 6000 h-1、n(H2):n(CO2) = 3:1 和 反 应 时 间 为12 h 的 条 件下,研究了反应温度在200~300 °C范围内催化剂Rh-0.3VOx/MCM-41 的CO2转化率和乙醇选择性变化。结果表明,CO2转化率从200 °C时的3.10%增加到250 °C时的12.10%,至300 °C时增加到18.48%;而乙醇选择性从200 °C时的7.74%增加到250 °C 时的24.10%,至300 °C时则下降到10.00%。表明温度较高时,大部分CO2转化为CO,且高温限制了CO进一步加氢生成乙醇的反应。ZHENG等[46]在GHSV=3000 mL/(g·h)、n(H2):n(CO2) = 3:1 和反应时间为18 h的条件下,研究了反应温度从230 °C升高到 290 °C时催化剂LaCo0.7Ga0.3O3的CO2转化率和产物选择性变化。结果表明,反应温度从230 °C升高到290 °C时,CO2转化率从5.60%增加到28.29%,乙醇选择性从83.38%降低到40.50%,表明在较高的反应温度下易生成甲醇和CO等副产物,而最佳反应温度为240 °C,此时CO2的转化率为10.10%,乙醇的选择性为80.00%。
2.4.2n(H2):n(CO2)的影响
n(H2):n(CO2)对CO2加氢生成乙醇有一定的影响。较低的n(H2):n(CO2)有利于CO2加氢生成甲醇,而较高的n(H2):n(CO2)则可能会使生成的乙醇进一步氢化成C3~C4醇,由于这两种情况都不利于合成乙醇,因此需要优化n(H2):n(CO2)。
在间歇反应器中,QIAN等[33]在t= 200 °C、反应时间为12 h的条件下研究了n(H2):n(CO2)对催化剂Ru3(CO)12/Rh2(CO)4Cl2产物选择性的影响。结果表明,在n(H2):n(CO2) = 4:4 时乙醇选择性最高,为47.3%(6.09 mmol/(L·h))。CUI等[50]在t= 200 °C、反应时间为12 h的条件下,使用双金属催化剂Ru3(CO)12-Co4(CO)12研究了n(H2):n(CO2)分别为1:2、2:4、3:6 和6:3 等时产物的选择性变化。结果表明,当n(H2):n(CO2) = 6:3 时乙醇选择性最高,为87.5%;而当n(H2):n(CO2) 保持在3:6 时,乙醇选择性降低到73.4%(6.1 mmol/(L·h)),表明适当的氢压力可以提高乙醇选择性。
在连续反应器中,AN等[27]在t= 270 °C、GHSV=3000 mL/(g·h)和反应时间为12 h的条件下,研究了n(H2):n(CO2)分别为3:1、4:1 和5:1 时催化剂Co/La4Ga2O9的产物选择性变化。结果表明,随着n(H2):n(CO2)从3:1 增加到5:1,CO2转化率从7%降低到2%,乙醇选择性从64%降低到28%,这是由于CO和H2在Co NPs表面存在竞争吸附,较低的H2与CO2比例有利于CO吸附在Co NPs表面,因此提高了乙醇的选择性;而较高的H2与CO2比例倾向于促进H2吸附在Co NPs表面,从而减少了CO的吸附并降低乙醇选择性,同时提高CO选择性。
2.4.3 反应时间的影响
反应时间也是CO2加氢制乙醇的重要影响因素。通常较短的反应时间对反应有利,但过短的反应时间生成的乙醇量较少;而反应时间较长最终会导致乙醇氢化成C3~C4醇,或由于可逆反应氢化成甲醇。因此,需要优化反应时间以使产物中的乙醇含量更高。
在间歇反应器中,ZHANG等[42]在t= 180 °C、p= 2 MPa条件下,考察了反应时间从2 h增加到10 h时催化剂CoMoCx-800(碳化温度为800 °C)催化CO2加氢生成乙醇的选择性变化。结果表明,随着反应时间从2 h增加到10 h,乙醇选择性从94.0%逐渐增加到98.5%;然而,由于甲醇和高级醇的形成,乙醇产率在反应6 h后开始下降。WANG等[30]在t= 200 °C和n(H2):n(CO2) = 3:1 的条件下,考察了反应时间从4 h增加至20 h时催化剂Co0.52Ni0.48AlOx催化CO2加氢制乙醇的选择性变化。结果表明,在4~12 h的反应时间内,乙醇选择性先从76.6%(2.1 mmol/g)增加到85.8%(15.5 mmol/g),随后又下降到85.0%(26.0 mmol/g),这是由于反应时间较长形成了甲醇所致。
在 连 续 反 应 器 中,YE 等[37]在t= 200 °C、n(H2):n(CO2) = 5:1的条件下,考察了反应时间从0.5 h增加至18 h时催化剂Ir1-In2O3催化CO2加氢生成乙醇选择性的变化。结果表明,反应时间从0.5 h增加到5 h时,乙醇选择性首先从51.6%(0.016 mmol/(g·h))增加到99.7%(0.990 mmol/(g·h)),此后保持恒定,乙醇产率在反应18 h时达到最大值2.100 mmol/(g·h)。ZHANG等[42]在t= 250 °C、GHSV= 4000 h-1和n(H2):n(CO2) = 3:1 的条件下,考察了反应时间从21 h增加到296 h时催化剂Na-Co/SiO2催化CO2加氢转化率和乙醇选择性的变化。结果表明,随着反应时间从21 h增加到42 h,CO2转化率和乙醇选择性分别达到最大值18.8%和62.8%;反应进行到296 h时CO2转化率和乙醇选择性分别降低到14.7%和59.1%,这是由于较长的反应时间使乙醇进一步加氢生成了副产物丙醇和C5OH,从而显著降低乙醇的选择性。ZHANG等[40]在t= 310 °C、WHSV=6000 mL/(g·h)和n(H2):n(CO2) = 3:1 的 条 件 下,考察了反应时间从25 h增加到100 h时催化剂Na-Co/SiO2催化CO2加氢生成乙醇产率的变化。结果表明,随着反应时间从25 h增加到50 h,乙醇产率从0.21 mmol/(g·h)增加到0.54 mmol/(g·h),至100 h时乙醇产率下降到0.41 mmol/(g·h)。与H2相比,CO在Co位点上的吸附较少,导致C—C耦合减少,乙醇的生成量减少,因此,乙醇产率的下降是由于CO选择性增加。
2.4.4 空速的影响
空速是基于反应物分子在催化剂上停留时间的另一个重要参数,空速高停留时间短,空速低则停留时间长。停留时间过短会减少反应物分子与催化剂的接触时间导致转化率较低,而停留时间过长则会使更多的产物乙醇转化为C3~C5醇,因此需进行优化以寻找到最佳的空速条件。
在连续反应器中,WANG等[47]使用Rh-0.3VOx/MCM-41 催化剂在t= 250 °C、n(H2):n(CO2) = 3:1 和反应时间为12.0 h时考察了WHSV从4000 h-1增加到12000 h-1时CO2加氢制乙醇产物的变化。结果表明,随着WHSV从4000 h-1增加到6000 h-1,CO2转化率首先从26.5%增加到28.2%,至12000 h-1时下降到16.5%,表明较高的空速会减少反应物分子与催化剂的接触时间,从而降低CO2转化率;对选择性而言,在WHSV从4000 h-1增加到12000 h-1时,乙醇选择性从29.2%下降到20.0%,这是由于VOx物种的存在占据了Rh位点,较高的空速有利于CO的形成,同时由于CO的解离,还会生成CH4,因此WHSV=4000 h-1时最佳,此时乙醇的选择性更高。AN等[27]使 用Co/La4Ga2O9催 化 剂 研 究 了 在t= 270 °C、n(H2):n(CO2) = 3:1 时GHSV从1500 mL/(g·h)增 加到7500 mL/(g·h)时产物的变化。结果表明,随着GHSV从1500 mL/(g·h)增加到7500 mL/(g·h),CO2转化率从30%降低到11%,乙醇选择性(在醇中)从62%降低到28%,这是由于空速增大减少了反应物种和催化剂活性位点的接触时间,使CO2转化率降低;当GHSV> 3000 mL/(g·h)时,*CO倾向于从催化剂表面脱离形成CO,从而使乙醇的生成量减少。该反应体系中,GHSV= 3000 mL/(g·h)时最佳。
3 结语与展望
在“碳达峰、碳中和”背景下,CO2催化加氢制乙醇是一条具有现实意义的转化途径,但由于CO2的化学惰性、反应机理的复杂性以及反应路径的难以控制性而限制了其工业化的进程。本文综述了CO2加氢制乙醇的研究进展,分析了CO2加氢制乙醇反应机理,归纳总结了活性组分、载体、金属掺杂/负载以及工艺参数对催化剂性能的影响。总结认为:对于CO2催化加氢制乙醇反应机理和路径主要观点有两种:一是CO2经RWGS反应生成CO,部分CO氢化生成*CH3,CO嵌入*CH3中完成碳链增长,再进一步加氢生成乙醇;二是CO2分子经吸附和活化形成羧酸中间体,进一步还原产生甲酸中间物种*HCOO,*CHx与*HCOO键合形成表面中间体(*CH3COO),进一步氢化形成乙醇。
尽管目标产物乙醇的产率和选择性在实验室规模能达到预期,但是在推进其工业化的进程中,仍存在副产物CO选择性过高及催化剂时空产率较低等问题。未来的研究方向应在保证获得更高的CO2转化率和乙醇产率的同时,实现反应器的大规模CO2处理;从工业化的角度来看,所需的催化剂应具有更高的活性、选择性和稳定性,同时应关注工业放大以后催化剂的可回收性以及催化剂循环利用后的损失问题。

