PT2399 通过抑制HIF-2α 对小鼠关节软骨的保护作用
周 永, 冯罡宁, 丁 冬, 胡学宇, 燕江波, 唐志群, 金群华
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院,银川 750004)
骨关节炎(osteoarthritis,OA)是运动系统中较为常见的无菌性炎症,多发生在膝关节[1]。全世界至少有3 亿人患有OA[2]。目前各种治疗手段均无法有效阻止OA 的恶化。OA 涉及多种关节内的组织和细胞,由于其主要病变部位位于软骨,所以软骨一直是OA 研究的重点[3]。关节软骨是一种缺少血管和神经分布的结缔组织[4],关节软骨细胞长期处于氧缺乏的内环境,其环境氧含量自软骨表面由浅及深逐渐降低[5]。而软骨细胞的氧源于关节液和血管丰富的软骨下骨[6]。
HIF 蛋白属于转录因子家族,是细胞响应缺氧的关键因子。HIF 蛋白由α 和β 亚基两部分组成。HIF 蛋白家族共有3 个成员:HIF-1、HIF-2和HIF-3。HIF 蛋白α 亚基在正常含氧情况下可以被脯氨酰羟化酶羟基化,最终导致了HIF-α降解[7]。在氧含量低的情况下,HIF-α 不易被羟基化,易与β 亚基形成异二聚体后在细胞质中蓄积,进入细胞核,进而激活下游靶向基因而发挥作用[8]。研究[9]表明,缺氧在软骨细胞中起着两方面作用:一方面HIF-1α 对维护关节软骨起着保护作用,其具有促进软骨细胞外基质合成,抑制runx2 和Wnt 的作用。另一方面,在前炎性细胞因子的存在下,HIF-2α 则对软骨细胞外基质具有破坏作用,并会增强VEGF、MMP13 和某些异常胶原的表达。β-连环蛋白(β-catenin)在Wnt 信号通路中是一种关键分子,分布于软骨组织细胞内[10]。β-catenin 信号通路的激活在软骨增生与成长中有不可取代的作用,但其在某些病理情况下被过度激活可能导致软骨退变和OA 形成[11]。PT2399是一种高效的、选择性的HIF-2α 的拮抗剂,能直接结合HIF-2α 的PASB 结构域。透明细胞肾癌是以pVHL 失活为特征的细胞恶性增殖[12-13],而PT2399 在人透明细胞肾癌细胞中分离了HIF-2α/HIF-1β 形成的异源性二聚体[14],使得HIF-2α的生物学作用被抑制,因此PT2399 因对HIF-2α产生的拮抗作用而具有高效的体内抗肿瘤活性。然而PT2399 能否通过抑制HIF-2α 来延缓OA的发展尚不清楚。本研究通过对OA 小鼠注射HIF-2α 抑制剂PT2399 来探究HIF-2α 在OA 中的作用,并探究HIF-2α 是否通过β-catenin 对OA 产生作用。
1 材料与方法
1.1 实验动物
选择30 只雄性C57BL/6 小鼠(购自宁夏医科大学实验动物中心,动物许可证号:IACUC-NYLAC-2020-147),8 周龄(体质量:18~20 g),分为3 组:不进行处理(对照组)、行内侧半月板失稳术(destabilization of the medial meniscus,DMM)造模(模型组)、DMM 建模后PT2399 治疗组(治疗组),每组10 只。小鼠处于22 ℃和(60±5)%的湿度,12 h 光/暗周期环境,可以自由活动并获取食物和水。模型手术部位为小鼠的右膝关节,治疗组小鼠在造模后每天进行腹腔注射PT2399(30 mg/100 g)。
1.2 材料
PT2399 购自美国MCE 公司;组织固定液、磷酸盐缓冲液(PBS)、番红O 固绿液体染色剂、伊红染液、苏木素染液、10%EDTA 脱钙液购自武汉Servicebio 公司;PV-9001 二抗试剂盒购自南京中杉金桥公司;兔源HIF-2α 抗体、β-catenin、Ⅱ型胶原抗体、基质金属蛋白酶13(MMP13)抗体和山羊抗兔IgGH&L 均购自美国Abcam 公司;小量组织全RNA 提取试剂盒购自美国爱思进公司;一步法cDNA 反转录试剂盒、qRT-PCR 试剂盒购自北京全式金公司;抗荧光衰减封片剂购自上海碧云天公司。
1.3 方法
1.3.1 组织处理 治疗8 周后处死3 组小鼠。取右膝关节新鲜标本,将标本置于4%多聚甲醛液中固定,使用PBS 多次冲洗,置于10%EDTA 脱钙液中脱钙,每天换液1 次。成功脱钙后,使用蜡块包埋。将蜡块置于冰台上3~5 min 后将其切成厚度为4 μm 冠状位切片,置于37 ℃水浴,使用载玻片捞片后,于烤片机上(60 ℃)烤干,进行下一步实验。
1.3.2 番红O 固绿和HE 染色观察分析小鼠膝关节软骨组织的病理改变 将组织切片置于60 ℃烤片机中30 min,二甲苯2 次脱蜡,然后在梯度乙醇溶液中进行水化,苏木素染色4 min,0.5%盐酸乙醇溶液分化5 s,返蓝15 min。使用0.3%固绿染色4 min,1%醋酸冲洗5 s,0.15%番红染色4 min,最后使用梯度上升的乙醇溶液脱水,二甲苯透明,中性树胶封片。在HE 染色实验中,将组织切片烘干、脱蜡、苏木素染色、分化、返蓝、伊红染色、冲洗、封片。在400 倍光镜下观察软骨组织的病理变化,采用国际骨关节炎研究学会(OARSI)评分进行评估,评分越高,表示骨关节炎程度越重。
1.3.3 免疫组织化学(IHC)检测小鼠软骨组织中HIF-2α 和MMP13 的表达情况 HIF-2α 和MMP13的阳性表达为IHC 染色下呈现棕色。将切片脱蜡、水化,胰蛋白酶修复抗原、山羊血清封闭、滴加一抗(4 ℃)反应12 h。所用一抗为Anti-HIF-2α:(1∶200),Anti-β-catenin:(1∶200),Anti-II 型胶原(1∶300)。采用Image J 1.8.0 软件分析3 组小鼠软骨层中相应蛋白的阳性细胞所占软骨面积的百分比。
1.3.4 免疫荧光(IF)检测小鼠软骨组织中β-catenin和Ⅱ型胶原蛋白的表达情况 β-catenin 和Ⅱ型胶原阳性表达为IF 下呈红色。将切片脱蜡,水化,胰酶抗原修复,山羊血清封闭、滴加一抗(4 ℃)反应12 h。随后与山羊抗兔二抗(1∶300,37 ℃)反应1 h。使用倒置荧光显微镜进行观察并及时拍照。使用Image Pro Plus 6.0 软件选取小鼠软骨区域,分别计量不同组别相应蛋白的阳性细胞平均吸光度(IOD),使用GraphPad Prism 8.3.0统计学软件分析数据。
1.3.5 qRT-PCR 实验检测不同分组小鼠软骨中HIF-2α 和β-catenin 的mRNA 表达变化 使用组织RNA 提取试剂盒提取小鼠关节软骨中总RNA,然后进行实时定量PCR 反应。使用2-△△CT计算目的基因相对表达量。所用qRT-PCR 引物序列见表1。
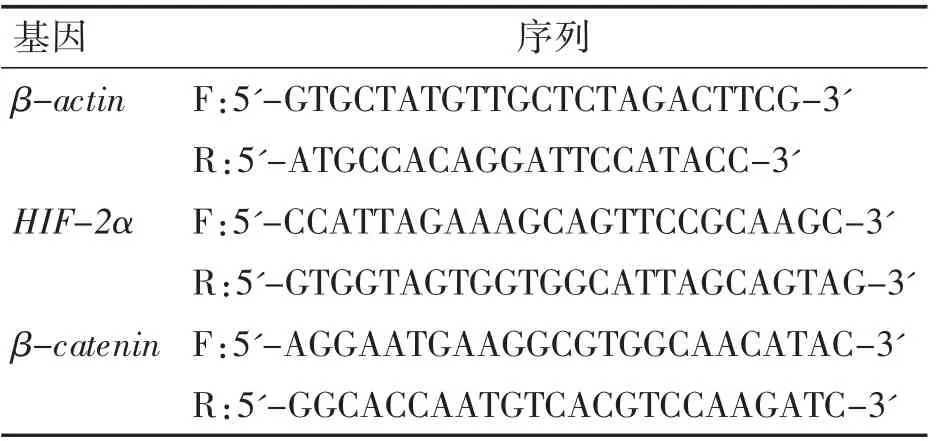
表1 所用qRT-PCR 引物序列
1.4 统计学方法
数据采用GraphPad Prism 8.3.0 统计学软件进行分析,本研究数据满足方差齐性要求,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠软骨退变比较
番红O 固绿和HE 染色结果显示:相对于治疗组,模型组小鼠的软骨组织丢失较多,软骨层变薄磨损较重;治疗组小鼠可见部分软骨丢失,软骨组织较模型组厚,见图1。
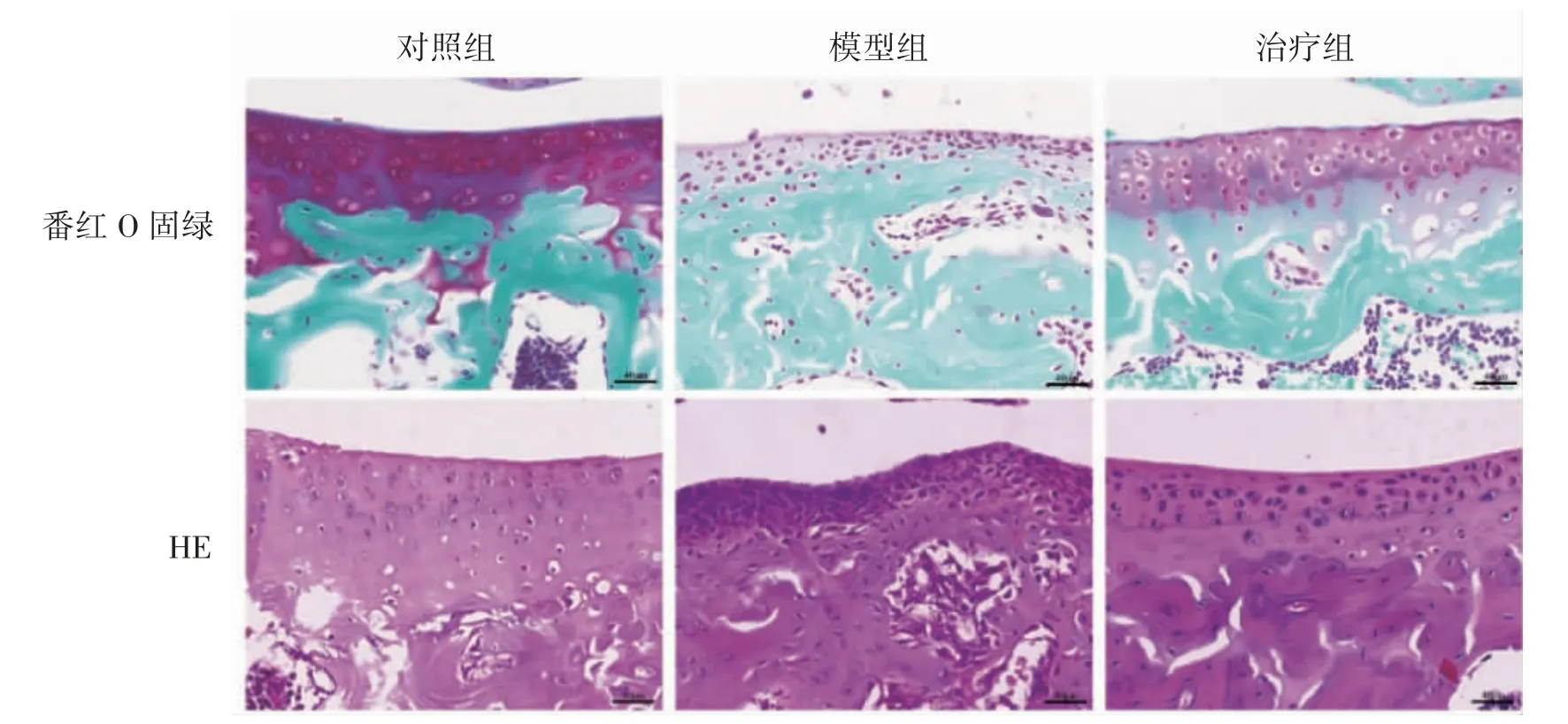
图1 小鼠膝关节软骨组织病理改变(×400)
透明软骨厚度:对照组>治疗组>模型组,钙化软骨厚度和OARSI 评分:对照组<治疗组<模型组(P 均<0.01),见表2。
表2 各组小鼠软骨组织退变比较(±s)
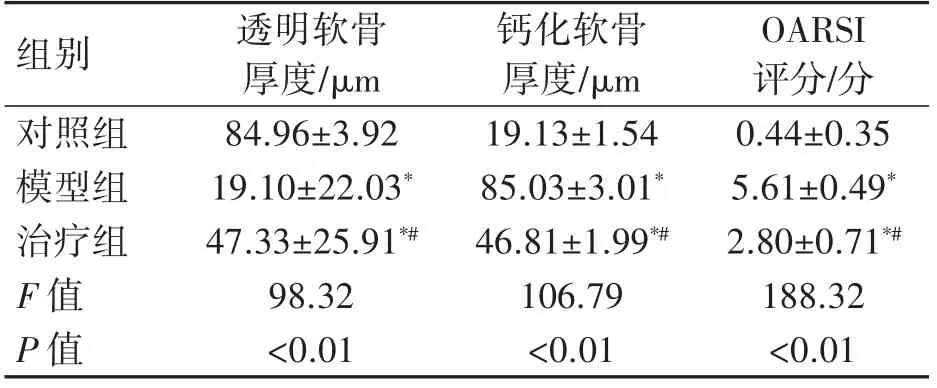
表2 各组小鼠软骨组织退变比较(±s)
OARSI评分/分对照组 84.96±3.92 19.13±1.54 0.44±0.35模型组 19.10±22.03* 85.03±3.01* 5.61±0.49*治疗组 47.33±25.91*# 46.81±1.99*# 2.80±0.71*#F 值 98.32 106.79 188.32 P 值 <0.01 <0.01 <0.01组别 透明软骨厚度/μm钙化软骨厚度/μm
2.2 各组小鼠软骨组织中HIF-2α、MMP13、βcatenin 和Ⅱ型胶原相对表达情况
IHC 结果显示:模型组HIF-2α 和MMP13 表达量高于治疗组和对照组,治疗组高于对照组(P均<0.01),见图2、表3。
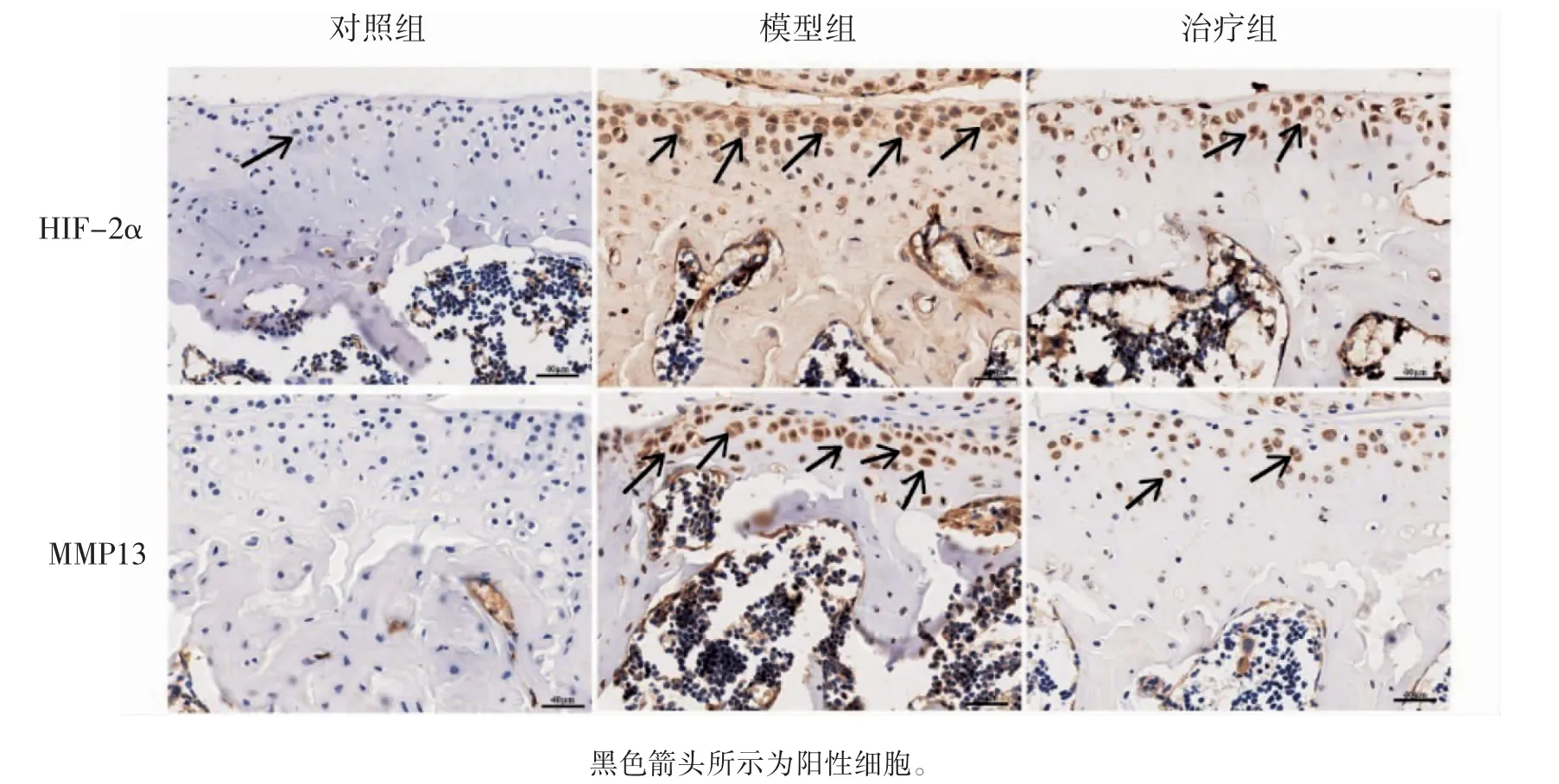
图2 小鼠膝关节软骨HIF-2α、MMP13 的表达情况(IHC×400)

表3 各组小鼠膝关节软骨HIF-2α、MMP13 的阳性表达率比较(%)
IF 结果显示:模型组小鼠β-catenin 蛋白相对表达高于治疗组和对照组,治疗组高于对照组(P 均<0.01);模型组小鼠软骨组织中Ⅱ型胶原相对表达低于治疗组和对照组,治疗组低于对照组(P 均<0.01),见图3、图4。

图3 小鼠膝关节软骨β-catenin 和Ⅱ型胶原的表达情况(IF×400)
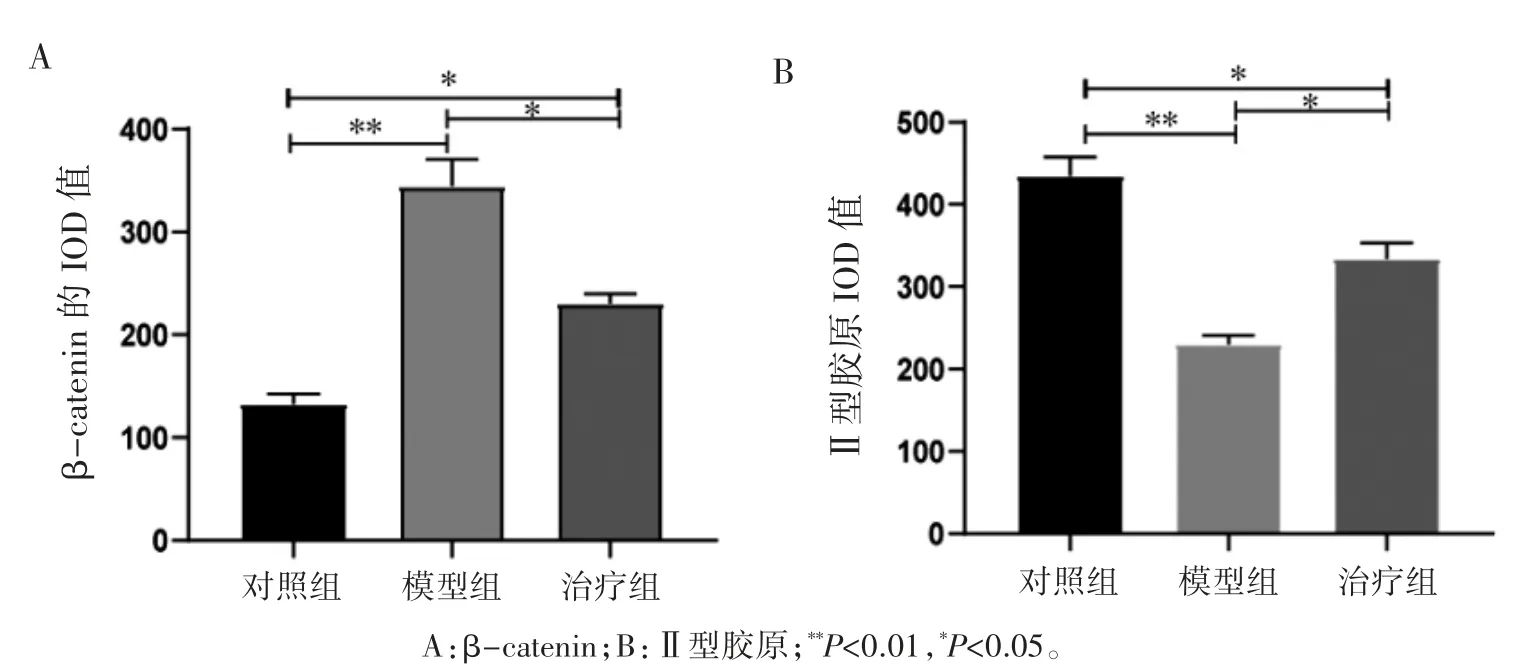
图4 各组小鼠膝关节软骨β-catenin 和Ⅱ型胶原的IOD 值
2.3 各组小鼠HIF-2α 和β-catenin 的mRNA 的表达情况
qRT-PCR 实验结果可见,小鼠软骨组织中HIF-2α 和β-catenin 的mRNA 表达量:对照组<治疗组<模型组(P 均<0.05),见图5。
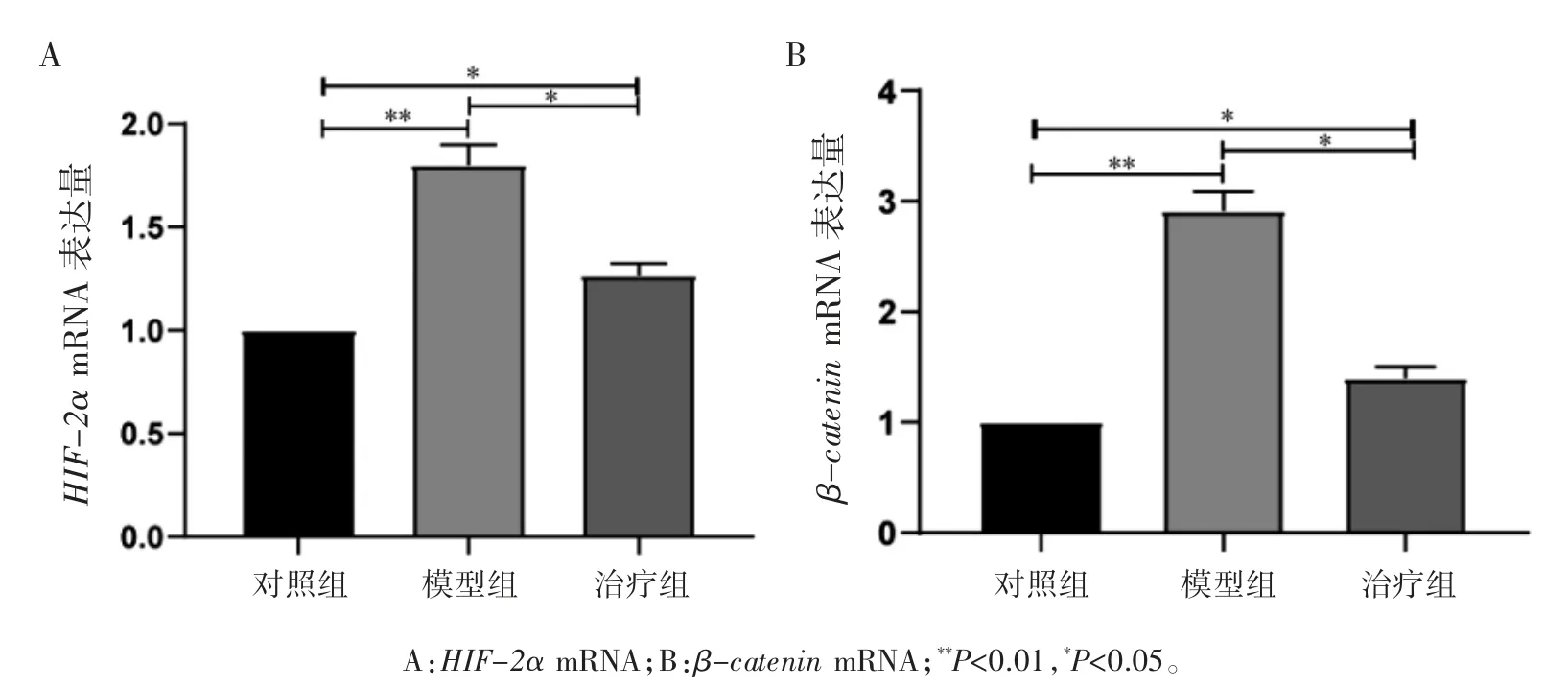
图5 各组小鼠软骨组织中HIF-2α 和β-catenin 的mRNA 相对表达情况
3 讨论
本研究结果可见,在OA 的发展过程中,软骨细胞坏死丢失,表面被破坏,透明软骨因磨损变薄而逐渐消失,模型组标本可见钙化软骨厚度增加,OARSI 评分升高。IHC 结果显示,软骨破坏后,HIF-2α 蛋白的表达增加,提示其表达与OA的发生、发展有关。另外,通过造模和注射PT2399引发HIF-2α 表达变化时,HIF-2α 与β-catenin表达趋势相同,qRT-PCR 实验结果也证实了这一点,表明HIF-2α 可能对Wnt 通路具有调节作用。
Ⅱ型胶原是软骨细胞外基质的重要组成部分,对软骨细胞起物理支持、营养和保护作用[15]。在本实验中,可见Ⅱ型胶原的表达随软骨破坏的增加而逐渐减少。MMP13 是软骨Ⅱ型胶原的主要降解酶,在OA 中发挥重要作用[15]。HIF-2α 和MMP13 的蛋白表达可随软骨破坏程度的增加而增加,提示在发生OA 时,HIF-2α 对MMP13存在诱导和协同作用[16-17]。
HIF-2α 定位于高分化软骨细胞中,是调节低氧环境下软骨分解代谢的重要因子[18]。随着小鼠和人的骨关节炎软骨组织内HIF-2α 表达的含量增高,软骨细胞的凋亡作用也呈增加的趋势[7]。HIF-2α 诱导软骨细胞凋亡是通过其对Fas基因来调控的。Fas 基因通过下游凋亡相关因子而引发软骨细胞凋亡,最终造成关节软骨细胞的丢失与破坏[19]。另外,HIF-2α 能抑制软骨细胞中的自噬,与软骨破坏过程呈正相关[20]。
PT2399 可通过结合HIF-2α 的PASB 结构域,改变其分子结构,进而达到干扰或抑制HIF-2α 的表达作用。在肾透明细胞癌中,pVHL 下调导致肾癌细胞恶性增殖,PT2399 在人肾透明细胞癌中分离了HIF-2α/HIF-1β 形成的异源性二聚体,这使得HIF-2α 的生物学作用被抑制,因此PT2399 对HIF-2α 产生了拮抗作用。
本研究将HIF-2α 抑制剂PT2399 应用于小鼠OA 中,发现PT2399 具有延缓OA 发展的作用,这种用于治疗肾癌的新型药剂也许是治疗OA及其相关研究的新方向。

