大鼠类胚体的制备及实时观察
李家瑞, 徐 彧, 徐海瑾, 李建宁, 李 岩, 宋 辉, 杨 怡
(1.宁夏医科大学基础医学院生物化学与分子生物学系,银川 750004; 2.宁夏医科大学内分泌学研究所,银川 750004;3.宁夏医科大学基础医学院医学遗传学与细胞生物学系,银川 750004)
大鼠是第一种用于科学研究的哺乳动物,因其生理调节能力和药理反应等方面与人类相似[1],常作为动物模型广泛地应用于生理、药理与毒理研究。但大鼠胚胎干细胞(embryonic stem cells,ESCs)的建立直到2008 年才得以成功[2]。ESCs 能够分化为机体所有类型细胞[3],为研究再生医学[4-5]和发育生物学提供了丰富的细胞来源。ESCs 的体外分化通常需要先形成类胚体(embryoid bodies,EBs)[5],EBs 是三维的细胞聚集体,含有3 个胚层的所有细胞类型[6]。体外形成的EBs通过定向诱导分化的方法,可以获得个体发育早期体内的一些前体细胞群[7],如心肌细胞[8-9]、神经细胞[10]、血细胞[11]、胰腺细胞[12]等。课题组前期研究发现,使用小鼠EBs 的诱导方法将大鼠ESCs 诱导分化为EBs 的过程中细胞死亡率极高,获得EBs 的数量也无法满足后续实验的需要。因此,有效地生产大鼠EBs,是使用大鼠ESCs 定向分化成所需细胞类型进行相关科学研究的关键。本研究通过悬滴法和悬浮法[13]将大鼠ESCs 制备为EBs 并连续培养10 d,在第5 天和第10 天对其进行形态学观察、直径测量、数量统计以及特异性基因与蛋白表达的检测,对两种方法得到的EBs 进行比较,了解两种方法的优劣,筛选在不同情况下更适宜的EBs 制备方法,为通过EBs 途径体外分化特定类型细胞用于临床疾病的研究提供参考。
1 材料与方法
1.1 主要仪器
荧光定量PCR 仪、酶标仪、电泳仪(美国Bio-Rad 公司);核酸超微量仪(德国GE 公司);化学发光成像仪(美国Azure 公司);倒置荧光显微镜(德国Leica 公司);高速冷冻离心机(美国Thermo Pisher Scientific 公司);超净工作台(苏州净化设备有限公司)。
1.2 主要试剂
BCA 蛋白检测试剂盒与全蛋白提取试剂盒(江苏凯基公司);10%PAGE 凝胶快速制备试剂盒与蛋白Maker(中国雅酶公司);逆转录试剂盒与RT-qPCR 试剂盒(日本TaKaRa 公司);稳定性ECL 发光液(美国Thermo Fisher Scientific 公司);丝裂霉素C(美国Sigma 公司);DMEM、DMEM/F12、Neurobasal、MEM Non-Essential Amino Acids、N2、B27、L-Glutamine、β-mercaptoethanol、青霉素链霉素双抗生素溶液、胎牛血清(美国Gibco 公司);引物合成(上海生工公司);OCT4 与Naong 抗体(美国Affinity 公司);Nestin 与AFP 抗体(SAB 公司);Brachyury、GAPDH、山羊抗兔IgG 与山羊抗兔IgG/Cy3 抗体(Bioss 公司);CHIR99021与PD0325901(美国APExBIO 公司)。
1.3 饲养层的制备
将小鼠原代胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)培养至第3 代,待MEF 长满瓶底时向培养基中加入丝裂霉素-C(Mitomycin-C),终浓度为10 μg·mL-1,37 ℃、5%CO2培养箱中放置2 h。然后将MEF 消化为单细胞悬液,接种于提前用明胶处理1 h 以上的六孔板中,培养箱中培养备用。
1.4 ESCs 的培养
将ESCs 接种在饲养层细胞上,放入37 ℃、5%CO2细胞培养箱中,每天换液。ESCs 细胞培养基为N2B27 培养基,并添加3 μmol·L-1CHIR99021和1 μmol·L-1PD0325901。N2B27 培养基成分主要由250 mL DMEM/F12 与Neurobasal 培养基,5 mL 非必需氨基酸、N2 与谷氨酰胺,10 mL B27以及3 μL β-mercaptoethanol 组成。
1.5 类胚体的培养
将培养至第3 代的ESCs 用胰酶消化,移入明胶处理过的培养皿中沉降20 min 左右,在光学显微镜下观察MEF 贴壁后,将未贴壁的ESCs移入15 mL 的离心管离心,留下细胞沉淀。悬浮法[13]:用类胚体培养基(N2B27 培养基添加0.75 μmol·L-1CHIR99021 和0.25 μmol·L-1PD 0325901)重悬沉淀的细胞,转入90 mm 低黏附性无菌培养皿中,隔天换一次液;悬滴法[13]:用类胚体培养基重悬沉淀,用移液枪吸取35 μL 细胞悬液,滴加到90 mm 低黏附性无菌培养皿的皿盖上,每滴间隔约0.5 cm,重复此操作直至皿盖滴满,快速将皿盖翻转过来,盖到加有PBS 或蒸馏水的90 mm 低黏附性无菌培养皿上,培养2 d后转为悬浮培养。
1.6 RT-qPCR 检测ESCs 与EBs 的特异性基因
运用TIANGEN 总RNA 提取试剂盒提取悬浮法培养第5 天(xf5)、第10 天(xf10)以及悬滴法培养第10 天(xd10)的类胚体和ESCs 的RNA,用TaKaRa 反转录试剂盒合成cDNA,按照TaKaRa RT-qPCR 试剂盒说明书进行RT-qPCR实验,检测各组样品的基因表达水平,引物序列见表1。

表1 大鼠ESCs 向EBs 分化过程中相关基因引物
1.7 Western blot 检测ESCs 与EBs 的特异性蛋白
采用凯基全蛋白提取试剂盒提取xf5、xf10以及xd10 的类胚体和ESCs 的总蛋白,并使用凯基BCA 蛋白含量检测试剂盒进行定量。用雅酶10%PAGE 凝胶快速制备试剂盒制备凝胶并电泳,然后将其转移至PVDF 膜上。以GAPDH(1∶5 000)为内参,以兔一抗OCT4(1∶1 000)、Naong(1∶1 000)、Nestin(1∶1 000)、AFP(1∶1 000)以及Brachyury(1∶1 000)4 ℃孵育过夜。山羊抗兔IgG二抗(1∶3 000)室温孵育1 h。将ECL 发光液滴加在蛋白条带上,放入蛋白成像系统中检测并记录蛋白条带。
1.8 免疫荧光检测EBs 的表面抗原
4%多聚甲醛固定细胞10 min,PBS 漂洗3次。0.5% Triton 穿孔10 min,PBS(0.05% triton-100/PBS)漂洗5 次,5%山羊血清封闭30 min,以GAPDH(1∶300)为内参,孵育兔一抗OCT4(1 ∶300)、Naong(1∶300)、Nestin(1∶60)、AFP(1∶60)以及Brachyury(1∶300),4 ℃过夜。PBS 漂洗3 次,孵育山羊抗兔二抗IgG/Cy3(1∶400)(避光操作),室温1 h,PBS 漂洗3 次。5 μg·mL-1Hoechst 33342染色10 min,PBS 漂洗3 次,荧光显微镜下观察拍照。
1.9 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用成组t 检验,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用Dunnett-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 ESCs 形态学观察及多能基因mRNA 和蛋白水平的检测
在倒置显微镜下观察发现,大鼠ESCs 贴附在饲养层上,克隆状分布,细胞间界限清晰,呈圆形或椭圆形,边缘较光滑,轮廓清晰,见图1A。RT-qPCR 结果表明,诱导制备的ESCs 和EBs 均能够表达多能基因Naong 和OCT4,但随着培养时间的增长,多能基因表达逐渐降低,与ESCs 相比,EBs(xf5、xf10 和xd10)中OCT4 与Naong 基因的表达量均降低(P 均<0.05),见图1B。Western blot 结果显示,ESCs 中多能蛋白Naong 和OCT4的表达量均高于EBs(xf5、xf10 和xd10)(P 均<0.05),见图1。

图1 ESCs 形态学观察及多能基因OCT4 与Naong mRNA 和蛋白检测
2.2 EBs 形态学观察、数量统计及直径检测
在倒置显微镜下观察,EBs 呈圆形或椭圆形球体,边缘光滑,细胞间联系紧密。随后对形成的EBs 进行计数与直径测量,结果显示,悬滴法制备的EBs 生成率低于悬浮法(P 均<0.01),但同质性更好,而悬浮法制备的EBs 数量更多,操作更为简便,见图2。

图2 EB 形态学观察、数量统计及直径检测
2.3 RT-qPCR 检测EBs 特异基因表达水平
悬浮法制备的EBs 成功表达AFP、Gata-6、cdh1、Gata-1、Mixl1、Brachyury、Nestin、VIM 等 三胚层基因,并且随着EBs 培养天数的增加,内胚层基因AFP 表达升高(P<0.05),Gata-6 和cdh1 的表达无明显变化(P>0.05);中胚层基因Brachyury表达降低(P<0.05),Gata-1 和Mixl1 表达无明显变化(P>0.05);外胚层基因VIM 表达降低(P<0.05),Nestin 表达无明显变化(P>0.05),见图3A。RT-qPCR 结果显示,xf10 的EBs 三胚层基因表达均高于xd10 的EBs(P 均<0.05),见图3B。
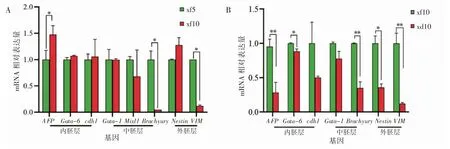
图3 RT-qPCR 检测EBs 特异基因表达
2.4 Western blot 检测EBs 特异蛋白与表面抗原表达水平
悬浮培养的EBs 随着培养天数增加,内胚层蛋白AFP 表达增强,中胚层蛋白Brachyury 表达下降,外胚层蛋白Nestin 表达略有增加;而同时期xf10 的EBs 三胚层蛋白表达均高于xd10 的EBs。通过细胞免疫荧光检测EBs 表面抗原发现,EBs 能够表达特异蛋白Naong、OCT4、AFP、Nestin与Brachury 等,见图4。
3 讨论
ESCs 具有发育的全能性,能够分化为机体所有类型的细胞,尽管存在伦理问题[14]和异体移植的免疫排斥反应[15],但ESCs 仍是细胞疗法最有希望的细胞来源。目前,ESCs 的体外分化方式主要有两种,第一种为单层黏附培养[16],即让ESCs在贴壁的培养环境下,通过向培养液中添加生长因子及其他种类化学诱导剂,或者将ESCs 与其他种类细胞共培养[17],使ESCs 向某种特定类型细胞定向诱导分化。第二种是让ESCs 在高密度的环境中过度生长,形成三维结构即EBs,以启动分化,这种分化方式更加稳定且分化效率更高。
研究表明,EBs 分化的主要影响因素包括培养基组成[18]、细胞数量[19]、EBs 大小[20]和EBs 形态[21]。EBs 大小会直接影响其向下游分化的结果[22],可能是EBs 中单个细胞对微环境的感知和应激造成的。当EBs 超过一定的大小范围时,这种影响更加明显,EBs 外围的细胞倾向于分化为原始内胚层细胞[23],而EBs 中心的细胞则倾向于形成原始的外胚层细胞。不同形态的EBs 也表现出不同的分化倾向[21]。
本研究对两种方法制备的EBs 进行了形态学观察、数量统计与直径检测,发现悬滴法培养的EBs 直径大、同质性好,但生成效率低;而悬浮法培养的EBs 直径小、同质性差,但生成效率高,适宜大量制备。随后对EBs 三胚层特异基因与蛋白的表达进行了检测,发现悬浮法比悬滴法培养的EBs 三胚层特异基因与蛋白表达更高,这可能是悬浮法培养的EBs 分化不同步,包含多种类型导致的。
除此之外,EBs 的培养时间也可能对后期分化产生影响。目前,大多数通过EBs 途径进行体外定向诱导分化的实验,是将EBs 培养至5~10 d 进行贴壁分化培养[19]。本研究通过悬浮法培养将大鼠ESCs 制备为EBs 并培养至第10 天,对培养第5 天和第10 天的EBs 进行比较,通过RTqPCR 检测发现,EBs 均可表达AFP、Gata-6、cdh1、Gata-1、Mixl1、Brachuny、Nestin 与VIM 等三胚层基因,证明EBs 可以分化为机体所有类型细胞。另外,随着EBs 培养时间的增长,不同时期的EBs三胚层基因表达发生了变化。EBs 内胚层基因表达增加,而外胚层与中胚层基因表达逐渐减少,说明EBs 三胚层基因表达具有时间性。
综上所述,悬滴法可以控制EBs 形成时的起始细胞数,从而得到大小均一、发育同步的EBs,更为适合体外分化实验,但一次难以制备大量EBs;悬浮法可以制备大量的EBs,但所获EBs 差异大,发育不同步。研究[24]表明EBs 大小与均匀性将影响ESCs 的体外定向诱导分化。总而言之,本文通过两种方法成功制备了大鼠EBs,并且发现EBs 培养时间的不同也对EBs 体外分化具有很大的作用,对今后通过EBs 途径进行体外分化实验具有一定的研究价值与参考意义。

