FSH 抑制大鼠卵泡颗粒细胞Hippo 信号通路促进雌激素合成
陈泰任, 吴梦静, 董玉婷, 孔 斌, 蔡玉芳, 黑常春,吴 凯, 赵承军,2, 常 青,2,3
(1.宁夏医科大学基础医学院人体解剖学与组织胚胎学系,银川 750004; 2.宁夏生殖与遗传重点实验室,银川 750004;3.生育力保持教育部重点实验室,银川 750004)
卵泡刺激素(follicle stimulating hormone,FSH)是由垂体的促性腺细胞合成的糖蛋白激素。在卵巢中,FSH 对颗粒细胞(granulosa cells GCs)的生长和雌激素的产生起着重要作用[1-3]。FSH 可以调控芳香化酶(CYP19A1)的表达,CYP19A1 是雌激素产生的关键酶,主要存在于卵泡GCs 中,通过催化作用将GCs 中由卵泡膜细胞合成的雄激素转化为雌激素。FSH 通过许多途径调控CYP19A1的表达,比如通过循环单磷酸腺苷(cAMP)途径调控CYP19A1 的活性等,但是仍然有许多调控途径不是很清楚[4-6]。Hippo 信号通路可以调控细胞增殖和凋亡[7-9]。在卵巢中,当Hippo 信号通路失活时,通路中的MST1/2、LATS1/2 因子磷酸化也被抑制,导致关键因子YAP 进入细胞核与转录因子TEAD 相互作用促进转录,促进GCs 增殖并合成雌激素。相反,当Hippo 通路激活时,会导致MST1/2,LATS1/2 磷酸化,从而引起YAP 因子磷酸化并滞留在细胞质中,抑制GCs 生长与雌激素的合成[10]。因此,课题组以大鼠原代卵泡GCs 为研究对象,探索FSH 是否可通过抑制Hippo 信号通路增强GCs 雌激素的合成。
1 材料与方法
1.1 实验动物
36 只3 周龄SD 大鼠(SPF 级),由宁夏医科大学实验动物中心提供[动物合格证号:SCXK(宁)2020-0001]。本实验严格按照中华人民共和国国家质量监督检验检疫总局和中国国家标准化管理委员会发布的《实验动物福利伦理审查指南》进行。
1.2 主要试剂
FSH(Solarbio 公司)、Verteporfin(VP、YAP的特异性抑制剂[11],Solarbio 公司)、孕马血清(pregnant mare serum gonadotropin,PMSG)购自Prospec-Tany 公司;DMEM/F-12 培养基、胎牛血清(fetal bovine serum,FBS)和青链霉素均购自BI 公司。兔抗YAP(AF6328,Affbiotech 公司)、兔抗P-YAP[Phospho-YAP1(Ser127),bs-3475R,Bioss 公司]、兔抗LATS1(17049-1-AP,Proteintech 公司)、兔抗P-LATS1(Phospho-LATS1,bs-3246R,Bioss 公司)、兔抗CYP19A1(Aromatase,ABclonal 公司);二抗(HRP Goat Anti-Rabbit IgG,AS104,ABclonal公司;Dylight 488,Goat Anti-Rabbit IgG,绿光,A23220,Abbkine 公司)、DAPI(fluorescent sealing agent,ZLI-9557,北京中杉金桥公司)、ELISA 雌二醇(estradiol,E2)检测试剂盒(CEA461Ge,Cloud-Clone Corp),乙醇、二甲苯等其他试剂为国产分析纯试剂。
1.3 大鼠原代卵泡GCs 分离与培养
GCs 的提取及培养参考已报道的实验方法[12]并加以改进。大鼠腹腔注射PMSG(10 IU/只)36 h后取材,脱颈处死大鼠后从双侧背部迅速取出卵巢置于PBS 中,剥离卵巢周围多余脂肪以及输卵管等组织,用PBS 清洗后,置于含DMEM/F12 培养液的培养皿中,用1 mL 注射器针头在体式镜下刺破卵泡,收集GCs 至无菌离心管,离心(1 000 r·min-1,5 min),弃上清,沉淀加入培养基混匀,以5×104个/mL 的细胞密度接种到含10%胎牛血清的DMEM/F12 培养液中,部分培养皿中事先放入盖玻片(细胞爬片)。在37 ℃、5%CO2培养箱中培养24 h 后,镜下观察并更换培养液,细胞爬片取出用4%多聚甲醛液固定30 min后进行形态学观察和免疫荧光纯度鉴定。随后将细胞分为对照组(无干预)、FSH 组(0.3 IU·mL-1)、VP 组(10 μg·mL-1)、FSH+VP 组(10 μg·mL-1VP+0.3 IU·mL-1FSH 联合干预),FSH 和VP 的干预剂量参考文献[13-14]继续培养24 h,培养时间参考文献[12,15],保留各组的培养液存放于-80 ℃,后续用ELISA 试剂盒测定培养液中E2 浓度。
培养结束后,各组培养皿上的贴壁GCs 用细胞刮刮下,放入试管中离心后保留沉淀,-80 ℃保存,用于分子生物学研究。
1.4 HE 染色观察大鼠原代卵巢颗粒细胞形态
将培养24 h 的细胞爬片用4%多聚甲醛固定30 min,浸于苏木素溶液中2 min 后流水冲洗15 min,夹取爬片在1%盐酸乙醇中蘸一下,即刻流水冲洗15 min 后伊红染色10 min,各浓度梯度乙醇脱水2 min,二甲苯Ⅰ、二甲苯Ⅱ各透明5 min,中性树胶封片,晾干后显微镜下观察和拍照。
1.5 免疫荧光检测GCs 纯度
细胞培养至24 h,将细胞爬片进行固定,固定之后每孔加入400 μL 0.2%Triton,破膜10 min,PBS 漂洗3 次,5 min/次,每孔加入400 μL 进口山羊血清,封闭30 min。封闭结束后加一抗兔抗FSHR(1∶250)孵育,4 ℃过夜后复温25 min,PBS漂洗3 次,5 min/次,荧光标记二抗(Dylight 488,Goat Anti-Rabbit IgG,绿光,1∶1 000)避光孵育2 h,PBS 清洗后封片剂(含DAPI)封片、拍照。阴性对照组用无菌PBS 代替一抗。实验重复3 次,细胞纯度达到90%以上,则本批样本可以继续进行后续实验。
1.6 Western blot 检测各组GCs 相关蛋白的表达
GCs 从-80 ℃取出后用蛋白提取试剂盒裂解、提取蛋白,用BAC 法测定蛋白样品浓度后加入一定量5×loading buffer,加水配平,100 ℃煮15 min。在10% SDS-PAGE 凝胶上进行电泳,每孔8 μL(40 μg 蛋白量)样本,电泳后将蛋白转移到PVDF膜上,5%脱脂牛奶溶液封闭2 h 后YAP、P-YAP、LATS1、P-LATS1、CYP19A1 一抗孵育(均兔抗鼠1∶1 000)4 ℃过夜,第2 天加入二抗(山羊抗兔1∶5 000)常温孵育1 h 后用ECL 法发光曝光条带,用ImageJ 软件分析各组蛋白灰度值,内参为β-actin。
1.7 ELISA 测定各组GCs 培养液的E2 浓度。
将各组GCs 的培养液从-80 ℃拿出,1 000×g离心20 min,取上清,按照说明书运用ELISA 竞争抑制法测定E2 浓度。
1.8 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。P≤0.05 为差异有统计学意义。
2 结果
2.1 大鼠GCs 形态观察与纯度鉴定
GCs 培养24 h 后,细胞贴壁聚集生长,呈梭形或星形。免疫荧光染色后,镜下可见FSHR 表达在GCs 细胞膜和细胞质,呈现绿色细小颗粒,DAPI 染核后呈深蓝色。GCs 纯度=FSHR 阳性细胞数/总细胞数,本实验得到的细胞纯度鉴定结果为(93.33±3.09)%,纯度达到进行后续实验的要求,见图1。

图1 大鼠GCs 形态观察与纯度鉴定
2.2 Western blot 检测各组大鼠GCs 相关蛋白表达
与对照组相比,FSH 组中LATS1、YAP、CYP19A1表达均升高,P-LATS1、P-YAP 表达均降低(P 均<0.05);VP 组中LATS1、YAP、CYP19A1 表达均降低,P-LATS1、P-YAP 表达均升高(P均<0.05)。与FSH 组相比,VP 组和VP+FSH 组中LATS1、YAP、CYP19A1 表达均降低,P-LATS1、P-YAP 表达均升高(P 均<0.05)。与VP 组相比,VP+FSH组中LATS1、YAP、CYP19A1 表达均升高,P-LATS1、P-YAP 表达均降低(P 均<0.05),见图2。
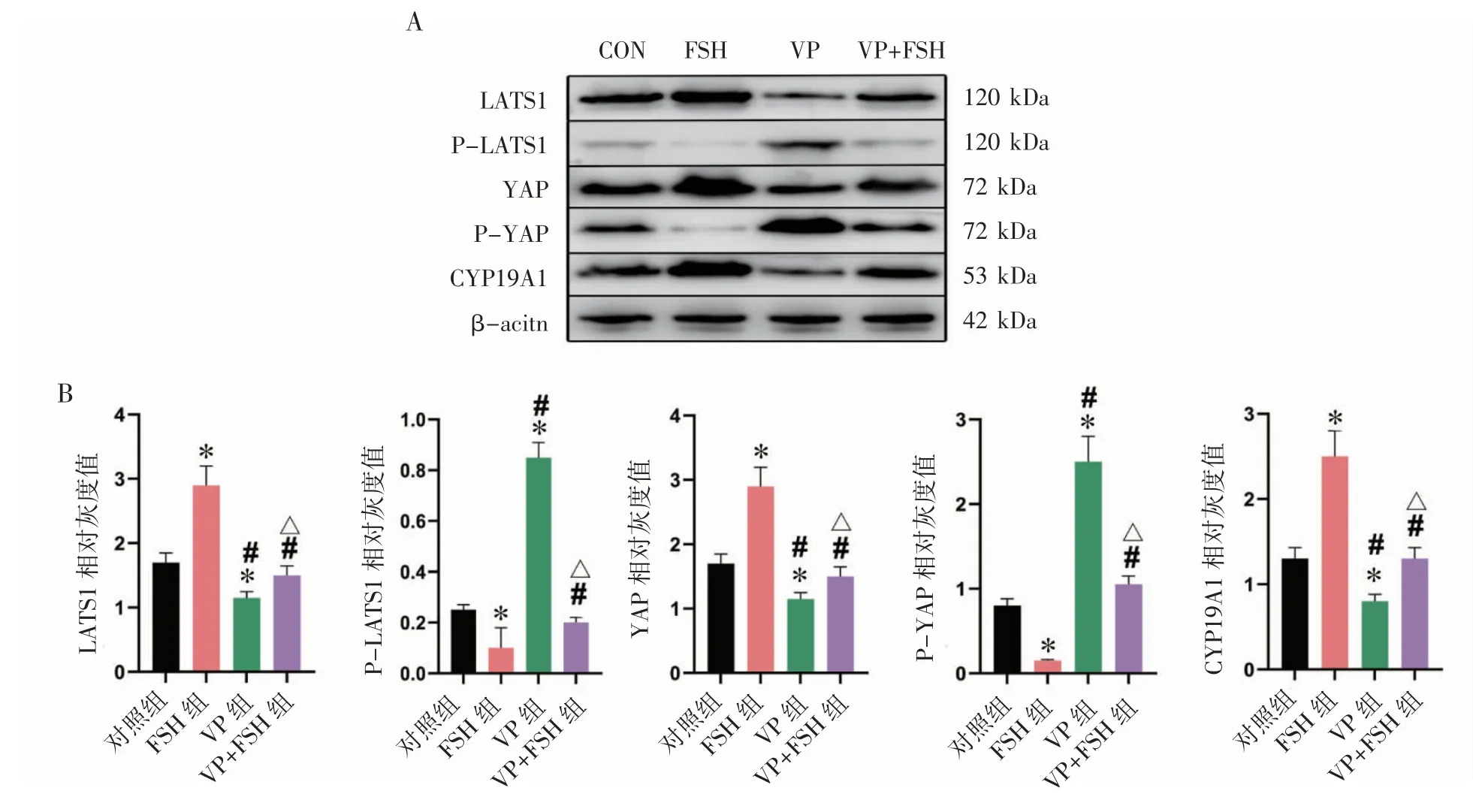
图2 Western blot 检测各组大鼠GCs 相关蛋白表达
2.3 各组大鼠GCs 培养液中E2 浓度比较
与对照组相比,E2 在FSH 组中浓度升高,在VP 组中降低(P 均<0.05)。与FSH 组相比,E2 在VP 组和VP+FSH 组中均降低(P 均<0.05)。与VP组相比,VP+FSH 组的E2 浓度升高(P<0.05),见图3。

图3 ELISA 测定各组大鼠GCs 培养液中E2 浓度
3 讨论
FSH 通过多个途径调控GCs 生长和雌激素的合成[4,16]。本研究中,Western blot 结果显示,LATS1、YAP 在FSH 干预后升高,P-LATS1、PYAP 降低。在VP 干预后,LATS1、YAP 降低,PLATS1、P-YAP 升高。在VP+FSH 组中,FSH 可以逆转VP 干预的影响。LATS1、YAP 都是Hippo 信号通路中的因子,当Hippo 通路处于抑制状态时,通路中LATS1 和YAP 表达升高。而当Hippo 信号通路激活时,非磷酸化的LATS1 和YAP 降低,LATS1 磷酸化(P-LATS1)升高,并且进一步导致YAP 磷酸化(P-YAP)升高[7]。VP 是YAP 的特异性抑制剂[11],但其对YAP 的抑制被FSH 逆转。以上结果表明,FSH 可以抑制Hippo 信号通路,升高GCs 中LATS1 和YAP 的表达。
CYP19A1 是雌激素生成的重要因子[17]。本研究发现,当YAP 被VP 抑制之后CYP19A1 也被抑制,而当YAP 被FSH 升高后CYP19A1 也升高,且FSH 可以逆转VP 对YAP 和CYP19A1 的抑制,表明FSH 可以通过YAP 正调控CYP19A1 的表达。
ELISA 结果显示,FSH 可以促进GCs 中E2的合成,VP 可抑制GCs 中E2 的合成,VP+FSH联合干预后,VP 对GCs 中E2 合成的抑制作用被FSH 逆转。VP 作为YAP 的抑制剂,在抑制YAP的同时,抑制了CYP19A1 和E2 的合成,而FSH可以逆转VP 的作用,表明FSH 可以升高YAP和CYP19A1 的表达,从而进一步促进E2 的生成。
综上所述,本研究发现,FSH 可通过抑制Hippo 信号通路,促进GCs 中CYP19A1 的表达与雌激素的合成。

