枸杞多糖联合人骨骼肌源性血管外膜细胞对人脐血CD34+细胞造血支持的体外研究
张 磊, 张思齐, 杨婷婷, 马 洁, 郑 波
(1.宁夏医科大学,银川 750004; 2.宁夏医科大学总医院人类干细胞研究所,银川 750004; 3.宁夏医科大学总医院血液内科,银川 750004)
枸杞(lycium barbarum)属药食同源植物,其主要成分枸杞多糖(lycium barbarum polysaccharide,LBP)具有多种生物活性功能,在免疫调节、神经保护、辐射防护、抗肿瘤、抗糖尿病、抗心血管疾病等方面发挥着一定作用[1-3]。近年来有研究[4-5]发现,LBP 可有效提高机体对白血病细胞的杀伤能力,促进白血病细胞凋亡,也能够促进小鼠骨髓单个核细胞(bone marrow mononuclear cells,BMNCs)的细胞增殖,减少放射损伤引起的骨髓细胞凋亡;LBP 还能保护骨髓基质细胞及维持骨髓微环境稳定,促进辐射损伤后造血功能恢复[6-8]。
骨髓基质细胞对维持造血干/祖细胞(hematopoietic stem/progenitor cells,HSPCs)正常造血功能起重要作用。目前常用的促进造血的间充质干细胞主要来自成人骨髓,但年龄、侵袭性操作等因素限制了骨髓来源间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的应用[9]。CD146+血管外膜细胞(pericytes/perivascular cells,PCs)是普遍存在的间充质干细胞的前体细胞,一直以来被认为是HSPCs 维持功能的关键支持者,是调节HSPCs 功能的骨髓生态位成分[10-11]。本课题组前期研究证实了CD146+人骨骼肌源性血管外膜细胞(human skeletal muscle-derived pericytes/perivascular cells,hMD-PCs)具有与人BMSCs 一样的对人脐血(umbilical cord blood,UCB)CD34+HSPCs 体外支持的作用并且可以维持其分化潜能[12-13],是支持HSPCs 体外扩增的一个崭新而丰富的细胞来源。那么,LBP 联合CD146+hMD-PCs能否进一步增强HSPCs 的扩增效力尚不明确,且国内外目前相关研究报道较少。本研究通过建立细胞体外培养体系,探讨LBP 联合CD146+hMD-PCs 是否能够增强人UCB CD34+HSPCs 的体外扩增效力。
1 材料与方法
1.1 细胞、试剂与仪器
2020 年12 月至2021 年9 月收集研究标本。人骨骼肌标本来源于宁夏医科大学总医院创伤骨科手术中切除的骨骼肌组织,脐血标本来源于宁夏医科大学总医院产科剖宫产手术足月新生儿,患者及家属均签署知情同意书并获得宁夏医科大学总医院医学伦理委员会批准(编号:2020-099)。
LBP(北京索莱宝科技有限公司);细胞周期与细胞凋亡检测试剂盒(碧云天生物技术有限公司);胎牛血清(Biological Industries 公司);FicollpaqueTMPLUS(GE 公司);TrypLETMExpress、RPMI 1640 培养基、高糖型DMEM 培养基、PBS、青霉素/链霉素(Gibco 公司);丝裂霉素、小鼠血清(Sigma 公司);MethoCult H4535 Enriched without EPO(Stemcell 公司);小鼠抗人抗体:CD45-APCH7、CD34-APC、CD33-FITC、CD10-PE、CD19-BV 421、CD14-Alexa Fluor 700,小鼠抗人同型对照抗体:APC-H7 IgG1、APC IgG1、FITC IgG1、PE IgG1、BV 421、Alexa Fluor 700 IgG2a、7-AADViaProbe(BD 公司);人CD34 磁珠、MACSR BSA Stock Solution、auto MACSRinsing Solution、MACS 分选柱(Miltenyi Biotec 公司);培养皿、培养板(Corning 公司);离心管(Thermo 公司);BD FACSAria Ⅲ流式细胞仪(BD Biosciences 公司);Perkin-Elmer VICTOR Nivo 酶标仪(PerkinElmer公司)。
1.2 实验方法
1.2.1 CD146+hMD-PCs 的分选与UCB CD34+HSPCs 的分离纯化 通过酶解与多参数流式细胞术分选获得CD146+hMD-PCs(CD146+CD56-CD34-CD144-CD45-),具体参照课题组前期研究[12,14]。采集新鲜新生儿脐带血并用Ficoll-paque分离液提取脐血单个核细胞,通过免疫磁珠分选UCB CD34+HSPCs。
1.2.2 CCK-8 法检测LBP 对CD146+hMD-PCs增殖的影响 将处于对数生长期的CD146+hMDPCs 用TrypLETMExpress 消化酶消化后以1.5×104/孔的浓度接种于96 孔细胞培养板中,于37 ℃、5%CO2的细胞培养箱中培养24 h,待细胞贴壁后加入含不同浓度LBP(0、150、300、600、1 200 mg·L-1)的基础培养基处理细胞24 h,每组设5 个复孔,之后除去上清,加入CCK-8 试剂-基础培养基混合液(CCK-8 试剂与基础培养基体积比为1∶9),培养箱孵育2 h 后,用酶标仪检测各孔在450 nm 下的吸光度(A)值,并计算不同浓度LBP 处理后CD146+hMD-PCs 的活力值。
1.2.3 流式细胞术检测LBP 对CD146+hMD-PCs细胞周期的影响 取对数生长期的CD146+hMDPCs 去除原培养基,加入LBP 浓度为150 mg·L-1的培养基,放置培养箱培养24 h。消化并收集细胞,加入1 mL 预冷的PBS 清洗细胞2 次,离心后吸除上清,一边涡旋一边加入预冷的70%乙醇,以避免细胞成团,放置于4 ℃冰箱固定12 h。按试剂盒说明书配制碘化丙啶染色液,每管细胞样品中加入0.5 mL 碘化丙啶染色液,37 ℃避光温浴30 min 后完成流式检测。
1.2.4 建立UCB CD34+HSPCs 体外共培养体系 实验分为4 组,LBP+CD146+hMD-PCs 组:将LBP 加入以CD146+hMD-PCs 为基质细胞的UCB CD34+HSPCs 培养体系中;LBP 组:将LBP加入无基质细胞的UCB CD34+HSPCs 培养体系中;CD146+hMD-PCs 组:作为对照组,不加LBP 只有基质细胞CD146+hMD-PCs 与UCB CD34+HSPCs的共培养体系;空白对照组:无基质细胞及LBP的UCB CD34+HSPCs 单独培养体系。
各组基质细胞以1.5×104/孔细胞密度接种于胶原包被的96 孔板中,每组设4 个复孔,CD146+hMD-PCs 组基质细胞不做任何处理,LBP+CD146+hMD-PCs 组基质细胞加入最佳浓度LBP,置于培养箱24 h,待基质细胞贴壁后,用4 μg·mL-1浓度的丝裂霉素处理2 h,PBS 洗涤3 次,加入各自培养基,置于培养箱24 h。将分离纯化的UCB CD34+HSPCs 以5×104/孔的密度分别加至丝裂霉素处理后的基质细胞层上,CD146+hMDPCs 组与空白对照组加入共培养的培养基(RPMI 1640+5%胎牛血清+1%青霉素/链霉素),LBP+CD146+hMD-PCs 组和LBP 组加入LBP 浓度为150 mg·L-1共培养的培养基,放置培养箱培养。
1.2.5 共培养后UCB CD34+HSPCs 增殖情况分析 在共培养的1、2、4 周,收集各组悬浮UCB CD34+HSPCs,加入TrypLETMExpress 消化剩余细胞并用PBS 洗涤3 次收集,离心后重悬,使用台盼蓝染色后在倒置显微镜下计数活细胞。
1.2.6 共培养后UCB CD34+HSPCs 集落形成能力分析 在共培养第1、2、4 周时,分别收集各组UCB CD34+HSPCs,台盼蓝计数活细胞后,取3×103个细胞加入3 mL 甲基纤维素半固体培养基中并混匀,每1 mL 含UCB CD34+HSPCs 的培养基接种于35 mm×10 mm 的培养皿中,各培养体系设置3 皿,放置于37 ℃、5%CO2的培养箱内培养。培养2 周后倒置显微镜下观察集落形态并进行计数,显微镜下>50 个细胞的细胞团计为1 个集落。
1.2.7 共培养后流式细胞术检测UCB CD34+HSPCs 的表型变化 在共培养的1、2、4 周时,收集各组UCB CD34+HSPCs,离心重悬后每毫升细胞悬液加入50 μL 小鼠血清,冰上封闭30 min。封闭后将各组细胞分为样本管、同型管及空白管,样本管每100 μL 细胞悬液分别加入CD45-APCH7、CD34-APC、CD33-FITC、CD10-PE、CD19-BV 421、CD14-Alexa Fluor 700 抗体各1 μL;同型管每100 μL 细胞悬液分别加入APC-H7、APC、FITC、PE、BV 421、Alexa Fluor 700 抗体各1 μL;空白管不加入任何抗体。样本管及同型管加入抗体后冰上避光孵育30 min。抗体孵育结束后离心清洗残余抗体,并重悬至300 μL,每管加入7-AADViaProbe 5 μL,上机检测。
1.3 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。计量资料以均数±标准差(±s)表示。细胞周期、集落单位形成数量组间比较采用独立样本t 检验,LBP 浓度、细胞数量、造血标记表达等指标的多组比较采用单因素方差分析,两两比较采用LSD-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 LBP 对CD146+ hMD-PCs 增殖的影响
CCK-8 检测结果(图1)显示,与未添加LBP组(0 mg·L-1)相比,LBP 浓度为150 mg·L-1时,CD146+hMD-PCs 活力升高(P<0.01),LBP 浓度为600、1 200 mg·L-1时的CD146+hMD-PCs 活力均低于150 mg·L-1时(P 均<0.05)。故选择LBP浓度150 mg·L-1作为后续实验的浓度。
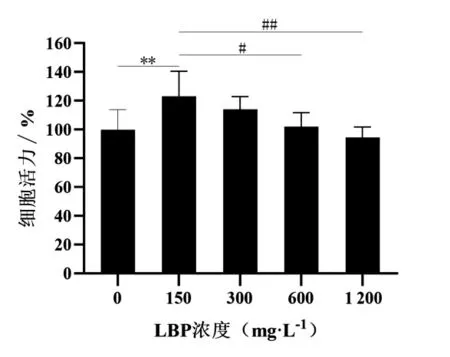
图1 不同浓度LBP 对CD146+hMD-PCs增殖的影响(n=5)
2.2 LBP 对CD146+ hMD-PCs 细胞周期的影响
细胞周期分析结果表明,未用LBP 处理的对照组(0 mg·L-1)G0/G1期、S 期、G2/M 期细胞比例分别为(91.62±0.47)%、(6.04±0.24)%、(2.35±0.24)%,150 mg·L-1LBP 处理24 h 后的实验组G0/G1期、S 期、G2/M 期细胞比例分别为(71.15±0.43)%、(22.13±0.49)%、(6.52±0.30)%。两组G0/G1期、S 期、G2/M 期细胞比例差异均有统计学意义(P 均<0.01),见图2。

图2 LBP 对CD146+ hMD-PCs 细胞周期的影响(n=5)
2.3 共培养4 周后各培养体系的UCBCD34+HSPCs细胞数量变化
各培养体系接种UCB CD34+HSPCs 初始细胞数量约为5×104个。共培养1 周时,CD146+hMDPCs 组及LBP+CD146+hMD-PCs 组细胞数有所增长,而空白对照组及LBP 组细胞数量减少;空白对照组、CD146+hMD-PCs 组、LBP 组、LBP+CD146+hMD-PCs 组细胞数分别为(1.46±0.89)×104个/孔、(6.09±0.20)×104个/孔、(1.88±0.79)×104个/孔、(7.53±0.19)×104个/孔;与CD146+hMD-PCs组相比,LBP+CD146+hMD-PCs 组细胞数量增加,LBP 组细胞数量减少(P 均<0.01)。
共培养至第2 周,CD146+hMD-PCs 组及LBP+CD146+hMD-PCs 组细胞数进一步增长,空白对照组及LBP 组细胞数量持续减少;空白对照组、CD146+hMD-PCs 组、LBP 组、LBP+CD146+hMD-PCs 组细胞数分别为(0.59±0.08)×104个/孔、(6.52±0.15)×104个/孔、(1.41±0.03)×104个/孔、(8.85±0.17)×104个/孔;LBP+CD146+hMD-PCs组细胞数量多于CD146+hMD-PCs 组(P<0.01);LBP 组细胞数量少于CD146+hMD-PCs 组,多于空白对照组(P 均<0.01)。
共培养至第4 周时,CD146+hMD-PCs 组、LBP 组及LBP+CD146+hMD-PCs 组细胞数分别减少至(3.60±0.10)×104个/孔、(0.54±0.07)×104个/孔、(4.70±0.09)×104个/孔,空白对照组已无细胞存活;LBP+CD146+hMD-PCs 组细胞数量高于CD146+hMD-PCs 组,LBP 组细胞数量低于CD146+hMD-PCs 组(P 均<0.01),见图3。

图3 共培养4 周后各培养体系的UCB CD34+ HSPCs 细胞数量变化(n=5)
2.4 共培养后各培养体系UCB CD34+ HSPCs 的集落形成能力
LBP+CD146+hMD-PCs 组共培养1、2、4 周后UCB CD34+HSPCs 的集落形成单位数分别为(130.00±4.26)、(68.75±3.25)、(38.75±4.54)个,CD146+hMD-PCs 组分别为(109.75±6.34)、(49.50±4.09)、(16.75±3.20)个,LBP+CD146+hMD-PCs组各时间点的集落形成单位数量均较CD146+hMDPCs 组升高(P 均<0.05),见图4。空白对照组与LBP 组在共培养1、2、4 周时无集落形成。
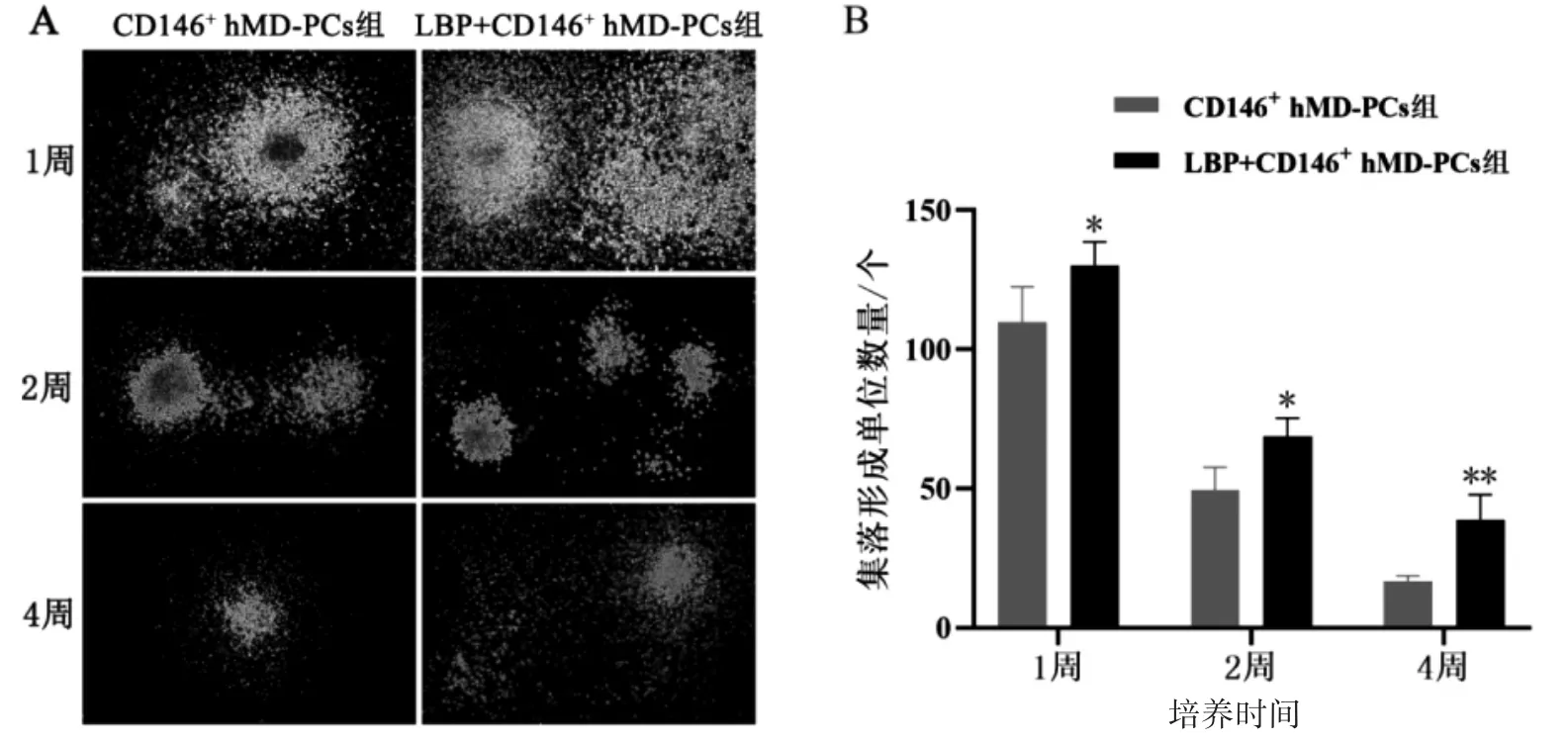
图4 各培养体系不同时间点UCB CD34+ HSPCs 集落形态及集落形成能力分析图(n=5)
2.5 共培养后各培养体系的UCB CD34+HSPCs 的细胞表型变化
各培养体系共培养1、2、4 周后,UCB CD34+HSPCs 及其亚群比例均有不同程度变化。将全血细胞标记为CD45,造血祖细胞标记为CD34+CD33-,淋巴细胞标记为CD10、CD19,髓系细胞标记为CD14(图5 A)。流式细胞术结果显示,与CD146+hMD-PCs 组相比,LBP+CD146+hMD-PCs 组CD45+细胞比例在共培养1、2、4 周后均升高,CD34+CD33-细胞比例在共培养2 周后升高,CD10+CD19+、CD14+细胞比例在共培养2、4 周后升高(P均<0.05);与LBP 组相比,LBP+CD146+hMDPCs 组CD45+、CD34+CD33-、CD10+CD19+、CD14+细胞比例在共培养1、2、4 周后均升高(P 均<0.05);与CD146+hMD-PCs 组 相 比,LBP 组CD45+、CD34+CD33-、CD14+细胞比例在共培养1、2、4 周后均降低,CD10+CD19+细胞比例在共培养2、4 周后均降低(P 均<0.05)。
此外,随着培养时间延长,CD146+hMD-PCs组与LBP+CD146+hMD-PCs 组,两组的CD45+细胞、CD34+CD33-细胞比例下降,而CD10+CD19+细胞、CD14+细胞比例上升,提示两组的UCB CD34+HSPCs 均有向髓系及淋系分化的趋势,而LBP 组CD45+、CD34+CD33-、CD10+CD19+及CD14+细胞比例下降,表明细胞逐渐死亡。由于空白对照组细胞数量少无法进行流式检测,因此未对空白对照组进行细胞表型分析(图5 B)。
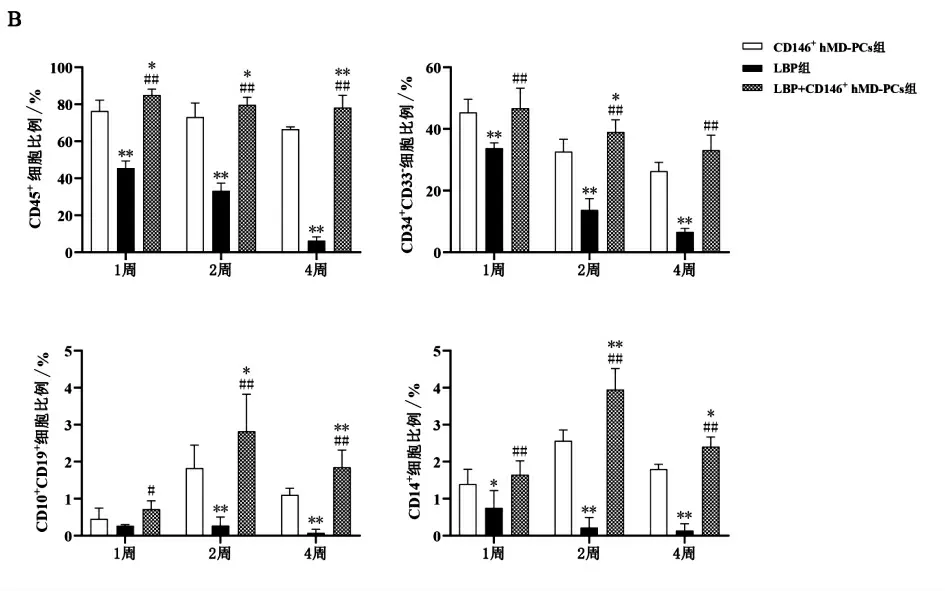
图5 共培养后各培养体系的UCB CD34+ HSPCs 的细胞表型变化分析图(n=5)

3 讨论
LBP 是一种天然植物多糖,来源广泛且无毒副反应,在多种组织和细胞中具有抗氧化、抗肿瘤及调节免疫功能[15-17]。研究[18]表明,LBP 可增强抗氧化酶清除自由基的活性、降低质膜的流动性,减少自由基对细胞的损伤,促进氧化及辐射损伤中骨髓基质细胞的增殖,保护造血系统。此外,LBP 不仅能对抗白血病细胞,抑制其增殖,而且还能缓解化疗、放疗引起的骨髓抑制,提高骨髓淋巴细胞活性,解除放化疗后骨髓抑制引起的免疫力低下,并促进HSPCs 及外周血细胞的恢复[8,19-20]。
HSPCs 具自我更新能力和多系分化潜能,可以在进行骨髓移植后的受体中重建造血系统[21-22],但HSPCs 的增殖和分化依赖于骨髓微环境成分产生的调控因子[23]。CD146+PCs 已被证明是BMSCs 的前体细胞,为调节HSPCs 功能的骨髓微环境成分[24-26],通过细胞间接触或旁分泌效应,由在CD146+PCs 表面表达的跨膜Notch 配体Jagged-1 介导,与HSPCs 表达的受体Notch1 相互作用维持HSPCs 增殖,是HSPCs 维持的关键支持者[27-29]。课题组前期研究[12]证实,CD146+hMDPCs 表达经典的BMSCs 标志CD44、CD73、CD90、CD105。在体外适当的诱导条件下,CD146+hMDPCs 可分化为骨细胞、脂肪细胞及软骨细胞,并进一步证明CD146+hMD-PCs 与BMSCs 一样对UCB CD34+HSPCs 具有体外支持作用。
本研究结果显示,相同条件下,在有基质细胞CD146+hMD-PCs 的培养体系中加入LBP,HSPCs 的细胞数量较CD146+hMD-PCs 组升高,说明在LBP 的促进下,基质细胞CD146+hMD-PCs维持HSPCs 体外扩增的作用增强。无基质细胞的LBP 与UCB CD34+HSPCs 培养体系细胞的数量与CD146+hMD-PCs 组相比减少,与空白对照组相比,细胞数量增多,这可能与LBP 的抗氧化损伤功能有关。集落形成能力反映培养后UCB CD34+HSPCs产生造血祖细胞的功能,LBP+CD146+hMD-PCs培养体系的集落形成单位数量多于以CD146+hMD-PCs 为滋养层的培养体系,而无基质细胞存在的LBP 组其UCB CD34+HSPCs 在甲基纤维素半固体培养基中培养2 周后无集落形成,表明在有CD146+hMD-PCs 基质细胞与UCB CD34+HSPCs共培养体系中加入LBP 可增强HSPCs 保持自我更新的能力。
流式细胞检测结果显示,在LBP 的作用下,CD146+hMD-PCs 促 进UCB CD34+HSPCs 向CD14+细胞、CD10+CD19+细胞分化,且分化能力强于未添加LBP 的CD146+hMD-PCs 组,而LBP 组CD45+细胞、CD34+CD33-细胞、CD14+细胞、CD10+CD19+细胞比例逐渐下降,且无分化趋势,证实了在LBP 与CD146+hMD-PCs 联合作用下,UCB CD34+HSPCs 能够保持更好的多向分化的能力。本研究显示,在无基质细胞情况下LBP 单独作用于UCB CD34+HSPCs 无法促进其细胞增殖、分化,培养后也无集落形成,说明HSPCs 增殖依赖骨髓微环境,仅有LBP 而无基质细胞无法维持HSPCs增殖;但LBP 可以通过促进基质细胞CD146+hMDPCs 增殖从而促进UCB CD34+HSPCs 细胞的体外增殖、分化。
综上所述,LBP 作为一个促进造血功能恢复的天然化合物,具有潜在的临床应用价值。未来应进一步深入研究LBP 在体内的生物学功能,以期为促进造血干细胞的增殖提供更加广泛的药物来源与新的治疗途径。

