大鼠miR-133a-3p 慢病毒载体的构建及稳转株建立
张志蕊, 陈耀平
(1.宁夏医科大学,银川 750004; 2.宁夏医科大学总医院,银川 750004)
迟发性性腺功能减退症(late-onset hypogonadism,LOH)是一种与老龄相关的临床和生化综合征,其特点是一系列特异的临床症状和血清T水平缺乏(低于年轻的健康成年男性参考范围)[1,2]。由于睾酮的作用广泛涉及生殖、皮肤、泌尿肌肉、骨骼、心血管等存在雄激素受体的系统,LOH 的发生会导致患者生活质量的改变,且使多器官系统的功能受到影响[3]。研究发现,循环miRNA 可以非常准确地作为衰老[4]、癌症[5-7]、肌肉疾病[8-9]和神经退行性疾病有前途的生物标记物[10]。课题组前期研究[11]发现,miR-133a-3p 在LOH 患者低表达,并且miR-133a 作为肌肉特异性的miRNA,能促进肌肉的成熟,降低肌肉蛋白质分解的速度而促进肢体骨骼肌的健康[12-13]。本研究通过构建过表达及干扰慢病毒载体并筛选建立miR-133a-3p 稳转细胞株,为进一步研究miR-133a-3p与LOH 的相关机制以及LOH 的诊断和治疗奠定基础。
1 材料与方法
1.1 主要材料
SPF 级2 月龄SD 雄性大鼠3 只,体质量190~220 g,由宁夏医科大学实验动物中心提供;大肠杆菌菌株DH5α,慢病毒载体GV309、GV280及Polybrene 均购自上海吉凯基因科技有限公司;DMEM 细胞培养液、标准胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司;Mir-XTMmiRNA First-Strand Synthesis 和TB GreenqRTPCR、DNase I、TB Green Advantage qPCR Premix均购自日本TaKaRa 公司,Trizol 试剂购自美国Invitrogen 公司,限 制 性 内 切 酶AgeⅠ、NheⅠ及EcoRⅠ均购自美国NEB 公司;质粒抽提试剂盒购自德国Qiagen 公司,miR-133a-3p 引物合成由广州锐博生物科技有限公司完成,质粒测序由上海吉凯基因科技有限公司完成;α-平滑肌肌动蛋白(α-SMA)购自Abcam 公司。
1.2 大鼠阴茎海绵体平滑肌细胞(corpus cavernosum muscle cell,CCSMC)的原代培养及鉴定
采用改良组织块法原代培养大鼠CCSMCs[14],选取2 月龄雄性SD 大鼠,颈椎脱臼或异戊巴比妥钠注射处死大鼠,放入75%乙醇浸泡15 min。在超净台无菌条件下剪开包皮,在阴茎脚处截取阴茎,将其迅速移入含双抗预冷PBS 中洗去血渍并除去尿道、纤维及脂肪等组织。
将海绵体组织剪成0.5~1.0 mm3的组织块(组织块太大影响细胞爬出,太小会对细胞有损伤),按0.5 cm 的间隔放置到涂有20%胎牛血清DMEM/F12 培养基的无菌T25 培养瓶底部,翻转培养瓶后加入3~4 mL 20%完全培养液,放入培养箱5 h 后翻转培养瓶,使组织与培养液充分接触,继续在培养箱内培养。第4 天显微镜下观察可见细胞从组织块中爬出,次日去除组织块继续培养。以后每隔2~3 d 更换1 次培养液,待细胞融合约90%时,用胰酶消化细胞,后加入含10%胎牛血清的DMEM/F12 培养基终止消化,吹打细胞制成单细胞悬液,将悬液置于培养皿中,静置20 min 后,将细胞悬液转移至另一培养皿中,再次静置、贴壁,反复2 次后,将培养皿放入37 ℃、5%CO2培养箱中培养。待细胞生长至对数生长期,细胞融合约90%,按1∶3 传代培养。同时载玻片放置于6 孔板中,传至P2 代,后按1×105个/孔接种,待细胞汇合约70%,行免疫荧光鉴定实验。
1.3 miR-133a-3p 过表达及干扰慢病毒载体的构建
1.3.1 慢病毒载体的构建 根据miRBase(http://www.mirbase.org/)数据库信息设计扩增大鼠miR-133a-3p 前体序列的引物及成熟体反向互补序列,引物信息见表1。构建miR-133a-3p 过表达慢病毒载体为GV309,原件顺序为hU6-MCSUbiquitin-EGFP-IRES-puromycin;构建miR-133a-3p 干扰慢病毒载体为GV280,原件顺序为S-UbiquhU6-MCitin-EGFP-IRES-puromycin,均由上海吉凯基因科技有限公司提供。用限制性内切酶AgeI 和EcoRI 在37 ℃条件下分别酶切载体GV309、GV280。3 h 后获得酶切后的线性载体。1)以大鼠基因组DNA 为模板扩增miR-133a-3p前体序列,扩增体系为(50 μL):ddH2O 32.5 μL;5×PS Buffer 10 μL;dNTP Mix(4 μL);上下游引物(10 μmol·L-1)各1 μL;PrimeSTAR HS DNA Polymerase 0.5 μL;模板(10 ng·μL-1)1 μL。扩增程序:98 ℃预变性5 min,98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸30 s,30 个循环后72 ℃延伸8 min。得到的PCR 产物经琼脂糖凝胶电泳用DNA 纯化试剂盒进行切胶回收,然后将回收的片段和线性化载体进行重组反应,实现线性化载体和目的片段的体外环化。2)根据设计的反向互补序列分别合成两段寡核苷酸序列,见表2,合成后成对的引物干粉溶解于退火缓冲液中,90 ℃水浴15 min,自然冷却至室温,通过T4 DNA ligase 将双酶切线性化载体和退火双链DNA 连接,16 ℃过夜,得到重组产物。两种重组产物分别转化感受态大肠杆菌(escherichia coli)DH5α,涂布LB固体培养板上,37 ℃培养箱培养过夜,挑取平板上的单克隆进行PCR 鉴定,对阳性克隆进行测序及结果分析。将正确克隆菌液扩大培养、抽提,获得高纯度质粒,用于下游病毒包装。

表1 引物信息

表2 DNA 寡核苷酸序列
1.3.2 慢病毒包装 采用三质粒共转染293T 细胞的方法进行慢病毒包装,转染前24 h,消化对数生长期的293T 细胞,以含10%血清的培养基重新接种于10 cm 细胞培养皿,24 h 待细胞密度达70%~80%时,更换为无血清培养基,2 h 后向一灭菌离心管中加入所制备的各DNA 溶液(GV载体质粒20 μg、pHelper1.0 载体质粒15 μg、pHelper 2.0 载体质粒10 μg),相应体积的转染试剂混合均匀,调整总体积为1 mL,在室温下温育15 min,混合液缓慢滴加至293T 细胞培养液中,混匀,培养箱中继续培养6 h,弃去培养基加入10 mL PBS 清洗1 次,加入含10%血清的细胞培养基继续培养48~72 h,收集细胞上清液,4 ℃、4 000×g 离心10 min,去细胞碎片,0.45 μm 过滤后,4 ℃、25 000 r·min-1离心2 h,弃上清,加病毒保存液,轻轻反复吹打重悬,充分溶解后10 000 r·min-1离心5 min 后分装,-80 ℃保存。
1.3.3 慢病毒滴度测定 测定前一天,将293T细胞按4×104个/孔铺96 孔板,准备7~10 个无菌的EP 管,将病毒原液按10 倍梯度稀释:每管中加入90 μL 无血清培养基,将待测定的病毒原液10 μL 加入第1 个管中,混匀后,取10 μL 加入第2 个管中,继续相同的操作直到最后一管;选取所需的细胞孔,弃去90 μL 培养基,加入90 μL稀释好的病毒溶液,培养箱培养24 h,加入完全培养基100 μL,48 h 后荧光显微镜下观察荧光亮度并拍照。根据绿色荧光蛋白的表达量计算病毒滴度,病毒滴度=荧光细胞数/病毒原液量。
1.4 感染复数
CCSMCs 细胞按5×104个/孔接种96 孔板,共21 孔。将miR-133a-3p up 及down 慢病毒稀释液及A/P 增强液分别加入相应的孔中,使其感染复数(multiplicity of infection,MOI)分别为0、1、10 及100,转染12 h 后将病毒液弃掉,添加新鲜培养基,继续培养72 h,荧光显微镜下观察并拍照。对感染效率进行评估,明确CCSMCs 细胞的感染条件及合适MOI。
1.5 稳定转染细胞株筛选
CCSMCs 细胞按1×105个/孔接种6 孔板,培养24 h 待细胞汇合约30%时弃掉培养基,加入MOI 为10 的病毒液培养24 h,更换新鲜培养基继续培养72 h,荧光显微镜下观察到绿色荧光后,加入含2 μg·mL-1嘌呤霉素培养基继续培养,每天更换培养基,当细胞汇合度达90%时提取RNA,检测miR-133a-3p 的表达。
1.6 qRT-PCR 检测mir-133a-3p 的表达
实验设为miR-133a-3p 过表达组、miR-133a-3p 干扰组、阴性对照组和空白对照组,以不感染病毒作为空白对照,感染病毒空载体作为阴性对照。当细胞汇合度达90%时,收集6 孔板中的细胞,用Trizol 法提取细胞总RNA,DNase I 处理 去 除RNA 中 的DNA 污 染,然 后 用Nanodrop 2000 测定RNA 的浓度及纯度,分别用Mir-XTMmiRNA First-Strand Synthesis Kit,TB Green Advantage qPCR Premix 按照使用说明书合成miRNA 的第一链并进行qRT-PCR:95 ℃预变性10 s,95 ℃5 s,60 ℃20 s,共40 个循环。用2-ΔΔCT计算基因相对表达量,实验重复3 次。
1.7 统计学方法
数据采用GraphPad Prism 6 统计软件进行分析。计量资料以均数±标准差(±s)表示,组间比较采用方差分析,两两比较采用LSD-t 法。P≤0.05 为差异有统计学意义。
2 结果
2.1 原代大鼠CCSMCs 的分离培养及鉴定结果
采用改良组织块法原代培养CCSMCs,选取2月龄雄性SD 大鼠。原代培养第4 天,显微镜下可见少许CCSMCs 从组织块中爬出,形态呈梭形(图1A)。当细胞生长至融合后,细胞高低起伏,呈现平滑肌细胞典型的“峰-谷”样生长(图1B),α-SMA 免疫荧光鉴定:荧光显微镜下可见绿色荧光分布在胞核和胞浆中,阳性率达90%(图2)。
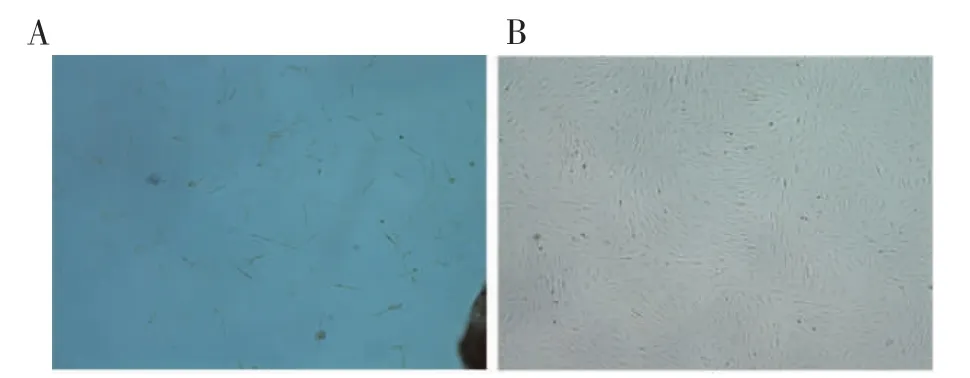
图1 显微镜下原代培养的CCSMCs

图2 CCSMCs 免疫荧光鉴定(×200)
2.2 miR-133a-3p 慢病毒载体的构建及测序结果
miR-133a-3p 过表达及干扰慢病毒载体GV309 和GV280(图3A、B)。将鉴定出的阳性克隆转化子接种于适量含相应抗生素的LB 液体培养基中,37 ℃培养12~16 h,取适量菌液进行测序,并与miR-133a-3p 的反向互补序列进行比对分析。结果表明,测序结果与目标序列完全一致(图3C、D)。

图3 GV309 和GV280 载体结构及测序
2.3 慢病毒滴度测定
构建完成的miR-133a-3p 过表达慢病毒滴度为3×108TU·mL-1,miR-133a-3p 干扰慢病毒滴度为1×109TU·mL-1(图4)。

图4 慢病毒荧光法滴度测定(×100)
2.4 细胞转染和稳转株的筛选
miR-133a-3p 过表达及干扰慢病毒载体感染CCSMCs 细胞72 h 后,Polybrene 浓度为2 μg·mL-1时,转染效率最高,且效率>80%,筛选后得到目的细胞(图5、图6)。
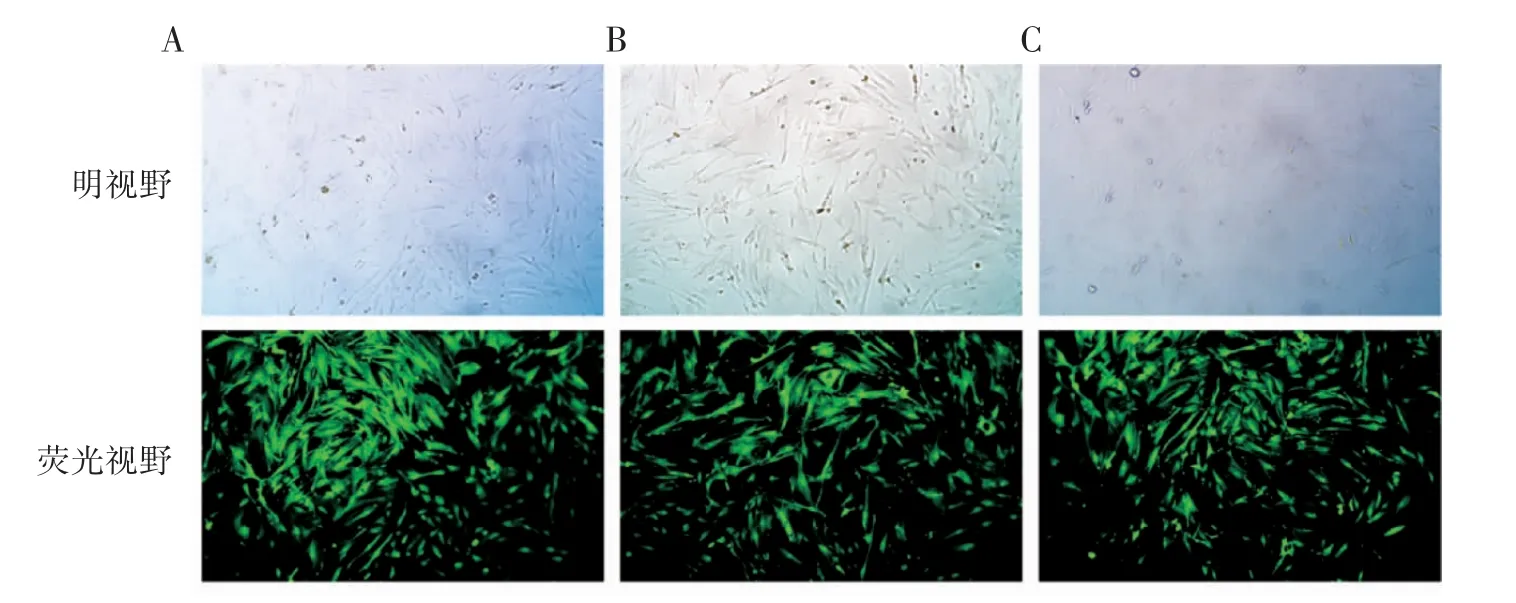
图5 慢病毒转染72 h 后的CCSMCs(×100)

图6 嘌呤霉素筛选10 d 的CCSMCs(×100)
2.5 miR-133a-3p 相对表达量的测定
qRT-PCR 检测各组稳转株中miR-133a-3p的表达情况。如图7 所示,与阴性对照组相比,过表达组的miR-133a-3p 表达量升高,干扰组miR-133a-3p 的表达量降低(P 均<0.01),说明本研究成功构建了过表达及干扰miR-133a-3p 的稳转株。
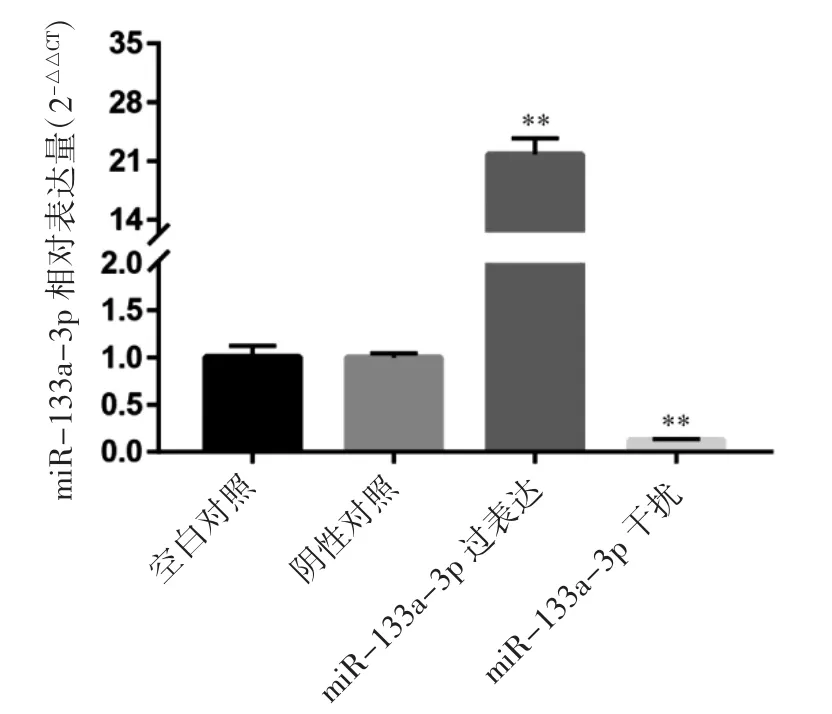
图7 实时荧光定量分析过表达组和干扰组稳转后miR-133a-3p 的表达水平
3 讨论
LOH 的特征是随着年龄的增长,肌肉的容积、大小和力量下降,给予雄激素治疗,肌肉容积和力量会显著增加[2,15-16]。本研究采用改良组织块法培养原代大鼠CCSMCs,在组织块法原代培养第4 天,平滑肌细胞从组织块中爬出,第5 天开始会有成纤维细胞爬出,采用反复差速贴壁法去除成纤维细胞的污染获得高纯度的CCSMCs。本实验α-SMA 阳性细胞率达90%及以上,从而保证了后续实验的准确性与可靠性。
miR-133a-3p 是成熟的miRNA,它来源于两个前体miRNA(miR-133a-1 和miR-133a-2),成熟序列为22nt。miR-133a 具有肌肉特异性表达的特点,它通过肌肉生长的协同转录、选择性剪接调控因子、生长激素通路来调控骨骼肌细胞的增殖和分化过程。Chen 等[17]表明miR-133 可以通过靶向SRF 来增强小鼠成肌细胞的增殖;Huang 等[18]证实miR-133 在成肌细胞分化过程中上调,表明miR-133a-3p 也可作为miR-133家族的一员参与骨骼肌的生肌分化。同时miR-133a 已被证明可调节人主动脉内皮细胞中的eNOS 活性[19],并参与炎症性心肌病[20]和内皮功能障碍[21]。Jiang 等[22]研究结果表明,miR-133a-3p在维持内皮健康的稳态和生理功能中有着重要作用。
源自人类免疫缺陷病毒的慢病毒载体是修饰真核细胞(如造血干细胞和神经细胞)基因的有力工具。慢病毒载体可以将外源基因或外源shRNA 有效地整合到宿主染色体上,从而实现目的序列持久性表达。慢病毒的宿主相对广泛,无论对分裂或非分裂细胞均有感染能力。特别对于一些较难转染的细胞,如干细胞、原代细胞、不分化细胞等,慢病毒也表现出较好的感染效果。本研究构建了miR-133a-3p 过表达慢病毒载体GV309 和miR-133a-3p 干扰慢病毒载体GV280,并对所构建的载体进行滴度测定。将构建成功的慢病毒载体转染大鼠CCSMCs,经嘌呤霉素的筛选,对转染后的CCSMCs 进行qRT-PCR 检测,结果显示过表达组miR-133a-3p 的相对表达量升高,干扰组miR-133a-3p 的相对表达量降低,说明成功建立了稳定表达miR-133a-3p 的细胞株,可为后续开展大鼠miR-133a-3p 的功能研究提供一定的实验基础。

