载脂蛋白E 和巨噬细胞条件性PDHA1 双基因敲除小鼠模型的构建和鉴定
刘耀阳, 孙 岳, 刘太阳, 郝 玮, 王秋实, 刘志宏
(宁夏医科大学公共卫生与管理学院,银川 750004)
动脉粥样硬化(atherosclerosis,AS)是一种以粥样斑块和纤维斑块形成为特征的慢性炎症性疾病[1]。《“健康中国2030”规划纲要》也指出AS是我国一项亟待解决的公共卫生问题。研究[2]表明,炎性反应参与AS 病变形成及进展过程,巨噬细胞作为炎性环境浸润的最主要的免疫细胞之一,在AS 斑块形成起始、进展、结局及斑块破裂等一系列过程中均发挥重要作用[3]。在斑块内微环境的作用下,巨噬细胞一般活化为经典活化型的M1 型以及替代活化型的M2 型,分别发挥致炎与抗炎的作用[4-5]。不同活化形式的巨噬细胞在能量代谢途径存在明显差异,M1 型活化过程中以糖酵解为主要供能途径,M2 型活化过程中以氧化磷酸化为主要供能途径。目前已证实巨噬细胞与代谢的关联[6],它可能通过抑制巨噬细胞糖酵解,促进巨噬细胞氧化磷酸化,调控并维持不同亚群巨噬细胞活化[7],减轻AS 病变。
丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDHC)是定位在线粒体中的多酶复合物[8-9],与细胞能量代谢相关,其中丙酮酸脱氢酶E1-α(pyruvate dehydrogenase E1-α,PDHA1)功能失调是导致PDHC 缺陷的主要原因[10],PDHA1 表达水平的差异能够引起巨噬细胞代谢的变化,进而打破M1/M2 型巨噬细胞活化平衡,在巨噬细胞炎性反应中发挥十分重要的调控作用。载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠广泛应用于AS 动物模型及其并发症的研究[11-12]。因此,为深入研究巨噬细胞中PDHA1 对能量代谢的影响、对巨噬细胞的调控维持作用及在AS 发生、发展过程中发挥的作用和分子机制,本课题组拟利用Cre-Loxp 重组酶系统技术,构建并鉴定PDHA1 巨噬细胞条件性敲除小鼠和ApoE 基因敲除小鼠杂交的双基因敲除小鼠模型,以期为进一步探究巨噬细胞PDHA1 在动脉粥样硬化疾病发病中的作用及机制提供实验依据。
1 材料与方法
1.1 材料
实验动物为PDHA1loxp1/loxp1小鼠、ApoE-/-小鼠及特异性启动子驱动的Lyz2-Cre 工具鼠(均购自北京唯尚立德生物科技有限公司)。所有小鼠均在宁夏医科大学实验动物中心层流动物房,按照无特定病原级动物饲养标准喂养。小鼠喂以充足的啮齿类动物繁殖饲料,自由进食和饮水,室内温度在20~22 ℃,湿度范围40%~60%,12 h 光照/昼夜交替。实验获得宁夏医科大学实验动物中心实验动物福利伦理审查委员会审查批准(编号:IACUC-NYLAC- 2021- 011)。
实验仪器与试剂:DNA 裂解液[triton X、BME、Tris(pH 8.0)、蛋白酶K100 mg·L-1,中国天根公司],DNA Marker(北京宝日医生物科技有限公司),RNA 提取试剂(中国天根公司),蛋白提取试剂盒(南京凯基生物科技发展有限公司),PDHA1引物及Cre 引物(上海生物工程有限公司合成),反转录与荧光定量PCR 试剂盒(美国Thermo Fisher 公司),EB 类似物(GR501-01)及蓝酶(南京诺唯赞生物科技有限公司),PDHA1 抗体、βactin 抗体(美国Abcam 公司)、辣根过氧化氢酶标记二抗(北京博奥森公司),琼脂糖粉末(美国Invitrogen 公司)、PVDF 膜(上海索莱宝生物科技有限公司),荧光定量PCR 仪(上海枫岭生物科技有限公司),手持式匀浆机(上海弗鲁克科技发展有限公司),电泳仪及凝胶成像系统(美国Rio-Rad 公司)。
1.2 引物的设计与选取
引物根据Genbank 公布的小鼠PDHA1 基因序列(CT010294.1)和小鼠ApoE 基因序列(CT010294.1)筛选得出,设计检测小鼠PDHA1基因打靶位点的引物及其定量引物,PDHA1-LOXP2上下游引物检测floxp 插入情况,Lyz2-Cre 上下游引物检测Cre 表达情况,ApoE-PM 上下游引物检测ApoE KO 情况,见表1。
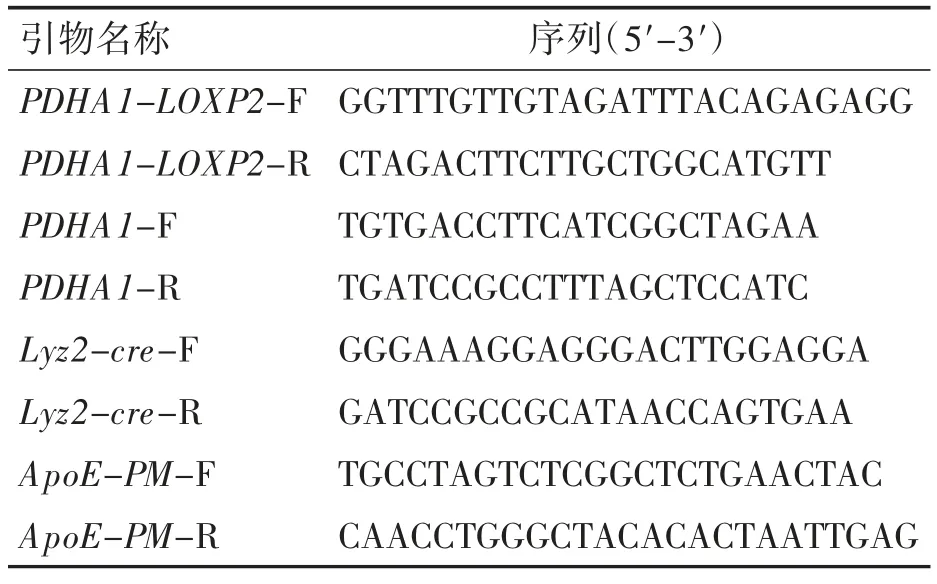
表1 引物名称及序列
1.3 PDHA1f/f-Lyz2-Cre+小鼠品系构建
小鼠雌、雄交配比例为1∶2。先将F1 代雄性小鼠(PDHA1f/w)与雌性表达Cre 酶小鼠(Lyz2-Cre+)互交,分析繁殖能力,后将获得的F2 代杂合子PDHA1f/w-Lyz2-Cre+小鼠进行自然交配,13 周左右,鉴定和筛选后获得F3 代纯合子巨噬细胞PDHA1基因条件性敲除小鼠(PDHA1f/f-Lyz2-Cre+)。
1.4 PDHA1f/f-Lyz2-Cre+-ApoE-/-双基因敲除小鼠品系构建
小鼠雌、雄交配比例为1∶2。首先将F3 代的PDHA1f/f-Lyz2-Cre+小鼠与ApoE 基因敲除小鼠(ApoE-/-)进行交配,获得F4 代PDHA1f/w-Lyz2-Cre+-ApoE+/-杂合子小鼠。随后将F4 代中的PDHA1f/w-Lyz2-Cre+-ApoE+/-杂合子小鼠互相交配,鉴定和筛选后获得F5 代PDHA1 巨噬细胞和ApoE 双基因敲除小鼠(PDHA1f/f-Lyz2-Cre+-ApoE-/-)和对照组小鼠(PDHA1f/f-Lyz2-Cre--ApoE-/-)。
1.5 小鼠基因型鉴定
待鉴定小鼠生长至3 周龄时取小鼠一只脚趾置于1.5 mL 的EP 管中并做好标记,每只脚趾加入120 μL Lysis mix 液(每10 mL Lysis mix 液包含1 mL 10×MGB、50 μL 100% triton X、100 μL β-巯基乙醇,其余用ddH2O 补齐),在55 ℃水浴中过夜裂解,随后95 ℃金属浴中变性10 min。冷却后,11 000 r·min-1离心5 min,上清液即获得基因组DNA,用于后续的PCR 反应。
PCR 反应体系为10.69 μL:蓝酶10 μL,上、下游引物各0.3 μL,含基因组DNA 的裂解产物0.59 μL。鉴定ApoE 和Lyz2-Cre 的PCR 反应条件相同:第一阶段95 ℃预变性5 min;第二阶段95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸42 s,共计进行40 个循环;第三阶段72 ℃延伸5 min,16 ℃保存备用。取PCR 扩增产物进行1%琼脂糖凝胶电泳,上样量为5 μL,DNA Marker 5 μL,凝胶成像系统观察结果。
当PDHA1 基因扩增产物仅在263 bp 出现条带时,小鼠为PDHA1-floxp 纯合子小鼠;仅在297 bp 出现条带时,小鼠为野生型小鼠;在263 bp 和297 bp 同时出现条带时,小鼠为PDHA1-floxp 杂合子小鼠。当Lyz2-Cre 基因扩增产物在790 bp 出现条带时,小鼠的基因型则为Lyz2-Cre+;在这一区间不出现条带时,鉴定为野生型小鼠。当ApoE 基因扩增产物仅在428 bp 出现条带时,鉴定为ApoE-/-小鼠;在428 bp 和346 bp 同时出现条带时,鉴定为ApoE+/-小鼠;仅在346 bp 出现条带时,鉴定为野生型小鼠。
1.6 标本处理
选取小鼠,5%水合氯醛水溶液0.5 mL/只麻醉处死。剪开小鼠腹部皮毛以暴露腹腔,将小鼠肝脏组织、脾脏组织取材备用。1)脾脏组织总RNA:将组织放入1.5 mL 无RNAase 的离心管中并加入约1 mL 裂解液RZ(按每50~100 mg 组织样品加入裂解液RZ 1 mL),使用手持匀浆机将小鼠组织均匀搅碎成悬液,而后在匀浆仪中进行匀浆处理。在4 ℃12 000 r·min-1离心5 min,取上清液至新的无RNAase 离心管;加入200 μL 氯仿后充分振荡以使其混合均匀,于室温条件下静置3 min 后在4 ℃12 000 r·min-1离心5 min,取水相经洗脱后得到RNA 保存备用;2)提取肝脏组织的蛋白:将组织放入EP 管中加入混有蛋白酶抑制剂、磷酸酶抑制剂与PMSF 的裂解液(lysis buffer)1 mL,使用手持匀浆机将小鼠组织均匀搅碎成悬液,而后在匀浆仪中进行匀浆处理。待测量蛋白浓度完毕后加入SDS-PAGE loading buffer 溶液,于99 ℃条件下将蛋白溶液高温变性10 min,而后将冷却后的蛋白溶液置于-80 ℃冰箱保存备用。
1.7 利用q-PCR 技术分析脾脏组织中PDHA1 Loxp2 mRNA 以及PDHA1 mRNA 相对表达
利用紫外分光光度计测定脾脏总RNA 含量以及OD260/OD280的比值,选取OD260/OD280比值为1.8~2.1 的提取RNA,进行逆转录操作。合成cDNA作为模板进行q-PCR 反应,反应体系为20 μL,其中TB Gerrn Premix Ex TaqⅡ(2×)10 μL,上下游引物各0.8 μL,cDNA 模板2 μL,其余用灭菌水补齐。检测PDHA1 Loxp2 mRNA 时反应条件为95 ℃10 s,60 ℃34 s,共计进行45 个循环,反应开始前95 ℃预热30 s ;检测PDHA1 mRNA 时反应条件为95 ℃5 s,57.2 ℃34 s,共计进行45个循环,开始前95 ℃预热30 s。
1.8 利用Western blot 检测两组小鼠肝脏组织PDHA1 蛋白表达
取肝脏蛋白样品20 μL,10%SDS-PAGE 制胶电泳恒压80 V 后转120 V。将载有蛋白的胶于恒流0.3 A 条件下转膜120 min,再将转过的PVDF 膜置于PBST 缓冲液配制的5%脱脂奶粉中封闭3 h。将PDHA1 以及β-actin 这两种抗体按照说明书稀释后,放入封闭后的PVDF 膜,于4 ℃下摇床孵育过夜,使用PBST 缓冲液洗膜3次,每次10 min 以洗去残存在膜上的抗体;二抗室温孵育2 h,洗膜3 次,每次10 min 以洗去残存在膜上的抗体。加入ECL 发光底物显色后通过软件Image Lab 曝光以测定灰度值。
1.9 统计学方法
数据采用SPSS 20.0 软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 小鼠的繁殖情况
为得到PDHA1f/f-Lyz2-Cre+的最佳繁殖方案,本课题组将雄性PDHA1f/w小鼠与雌性表达Cre酶的Lyz2-Cre+小鼠互交,产生F2 代基因型小鼠[PDHA1f/w-Lyz2-Cre-(1/4),PDHA1w/w-Lyz2-Cre+(1/4),PDHA1w/w-Lyz2-Cre-(1/4)];进一步将F2 代基因型小鼠PDHA1f/w-Lyz2-Cre+小鼠互相交配,产生F3 代基因型小鼠[PDHA1f/w-Lyz2-Cre+(3/8),PDHA1f/w-Lyz2-Cre-(1/8),PDHA1f/f-Lyz2 -Cre+(3/16),PDHA1f/f-Lyz2 -Cre-(1/16),PDHA1w/w-Lyz2-Cre+(3/16),PDHA1w/w-Lyz2-Cre-(1/16)],其中PDHA1f/f-Lyz2-Cre+为PDHA1 巨噬细胞特异性基因敲除小鼠。
为了繁育出PDHA1f/f-Lyz2-Cre+-Apoe-/-小鼠,本课题组将前期获得的F3 代基因型PDHA1f/f-Lyz2-Cre+小鼠与Apoe-/-小鼠进行交配,产生了F4 代基因型小鼠[PDHA1f/w-Lyz2-Cre+-Apoe+/-(1/2)、PDHA1f/w-Lyz2-Cre--Apoe+/-(1/2)],随后将选取基因型为PDHA1f/w-Lyz2-Cre+-Apoe+/-雌、雄小鼠进行自然交配,将产生的F5 代基因型小鼠[PDHA1f/f-Lyz2-Cre+-Apoe-/-小鼠、PDHA1f/f-Lyz2-Cre+-Apoe+/-小鼠及PDHA1f/w-Lyz2-Cre+-Apoe-/-]进行交配,约13 周后筛选鉴定出F6 代目标基因型PDHA1f/f-Lyz2-Cre+-Apoe-/-小鼠。以上繁育方案的分离比例均符合基本孟德尔遗传定律,表明巨噬细胞条件性敲除PDHA1 基因后对小鼠繁殖能力无明显影响。
2.2 小鼠基因型鉴定结果
将小鼠脚趾基因组DNA 进行扩增后电泳,共鉴定小鼠22 只,其中雄鼠14 只,雌鼠8 只。小鼠PDHA1-Floxp 基因型鉴定结果见图1,在263 bp处阳性表达为PDHA1-floxp 纯合子小鼠,在263 bp 和297 bp 处均阳性表达为PDHA1-floxp杂合子小鼠,仅在297 bp 处阳性表达为WT 野生型小鼠。将PDHA1-floxp 纯合小鼠进行后续检测。小鼠Lyz2-Cre 基因型鉴定结果见图2。在790 bp 处阳性表达为Lyz2-Cre+小鼠,否则为野生型小鼠。将带有Lyz2-Cre+基因的小鼠再进行后续鉴定,小鼠ApoE 基因型鉴定结果见图3。仅在428 bp 处阳性表达为ApoE-/-纯合子小鼠,在428 bp 和346 bp 处均阳性表达为ApoE+/-小鼠,仅在346 bp 处阳性表达为野生型小鼠。而最终鉴定为ApoE-/-纯合子小鼠即为构建成功的双基因敲除小鼠,其中雄鼠3 只,雌鼠2 只。
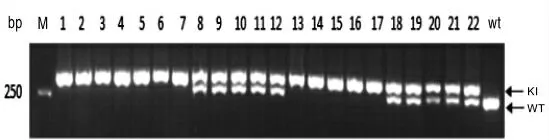
图1 PDHA1-Floxp 基因鉴定结果
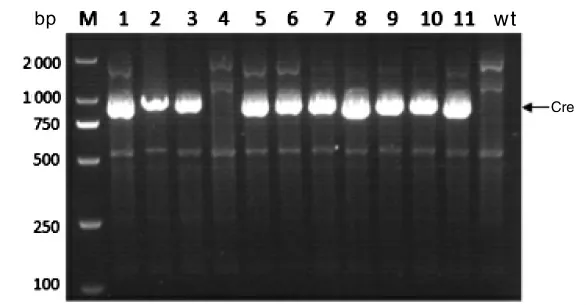
图2 Lyz2-Cre 基因鉴定结果
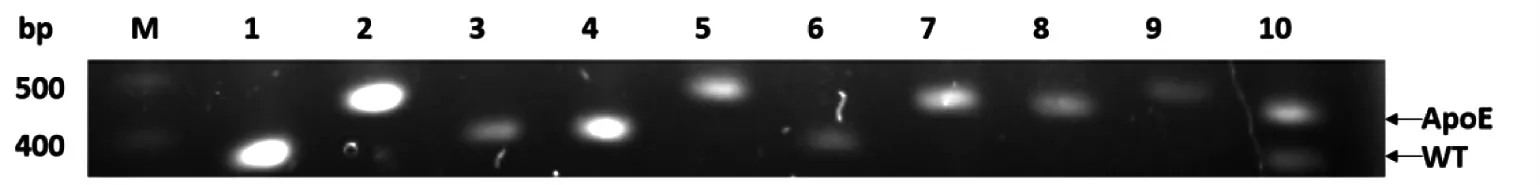
图3 PCR 扩增ApoE 基因鉴定结果
2.3 PDHA1 基因条件性敲除效果鉴定
提取小鼠脾脏组织总RNA,逆转录为cDNA后,使用PDHA1 Loxp2 mRNA 和PDHA1 引物进行PCR 扩增。与WT 小鼠相比,PDHA1 在巨噬细胞中特异性敲除的小鼠的PDHA1 Loxp2 mRNA表达升高,PDHA1 mRNA 的表达降低(P 均<0.05),见图4。
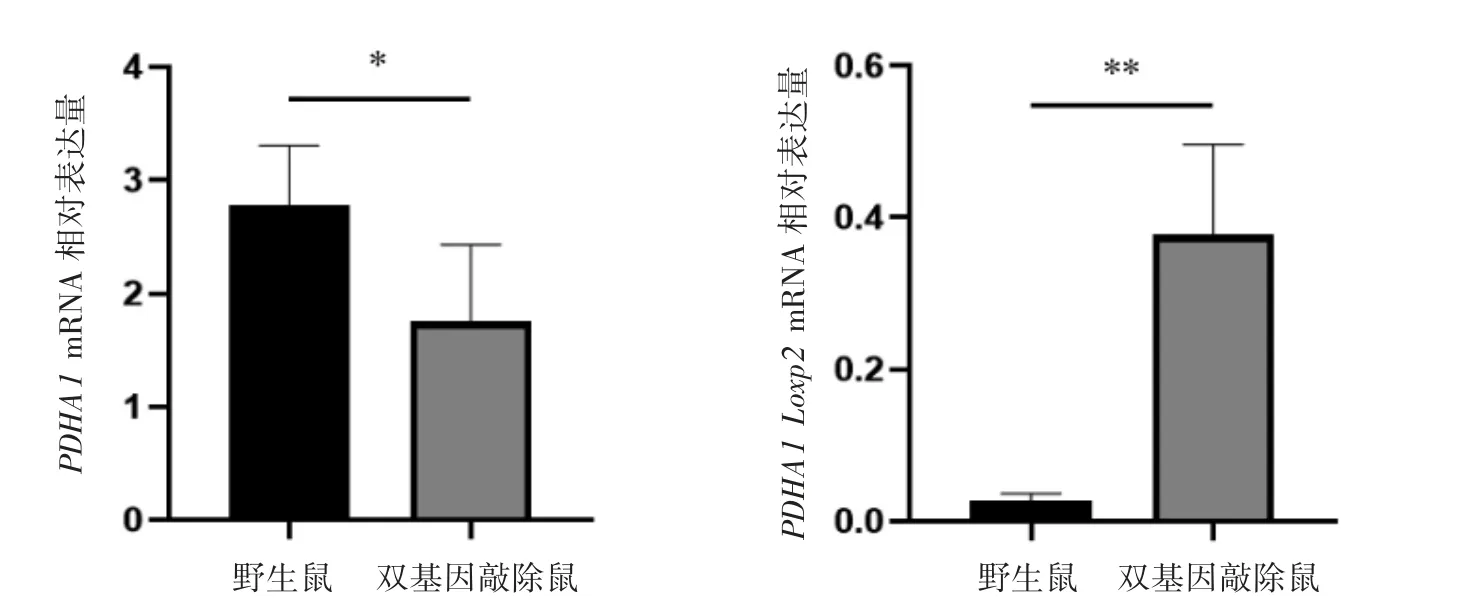
图4 PDHA1 巨噬细胞特异性敲除小鼠脾脏中PDHA1 Loxp2 mRNA 和PDHA1 mRNA 的表达水平(n=6)
提取小鼠肝脏组织总蛋白,进行Western blot检测。结果显示:与对照组相比,PDHA1 在巨噬细胞中特异性敲除小鼠的PDHA1 蛋白含量降低(P<0.05),见图5。

图5 PDHA1 巨噬细胞特异性敲除小鼠肝脏中PDHA1 蛋白表达水平(n=6)
3 讨论
PDHA1 是PDHC 的重要组成部分,可通过改变巨噬细胞能量代谢的方式来影响其极化方式,进而打破促炎作用与抗炎作用的平衡。PDHA1的活跃可促进M2 型活化,表现为AS 病变减轻,提示PDHA1 在细胞组织生长、发育、生理状态维持方面发挥重要作用。本研究采用Cre-LoxP重组酶系统复制Pdha1f/f-Lyz2-Cre+小鼠,并与Apoe-/-进行交配,得到Pdha1f/f-Lyz2-Cre+-Apoe-/-巨噬细胞特异性双基因敲除小鼠,运用q-PCR和Western blot 技术检测巨噬细胞PDHA1 在小鼠脾脏和肝脏中的敲除效率后,发现脾脏和肝脏的PDHA1 mRNA 和蛋白表达水平均降低,同时利用基因型鉴定检测了ApoE 的敲除效率,证明成功复制了Pdha1f/f-Lyz2-Cre+-Apoe-/-巨噬细胞特异性双基因敲除小鼠模型,为后续深入研究PDHA1在AS 斑块中的作用机制奠定基础。
基因敲除技术分为完全基因敲除和条件型基因敲除。前者通过同源重组法消除个体靶基因活性,但因为PDHA1 基因对胚胎发育至关重要,该技术可致死小鼠[13],因此本课题组采用后者中Cre-LoxP 重组酶系统来克服这一缺陷。Cre-LoxP重组系统是一种位点特异的基因重组技术,目前正广泛应用于新型基因打靶中[14-15],该重组酶系统可在特异性的时间或空间介导目的基因的敲除。其基本原理为同源重组技术,被广泛应用于特异位点的基因敲除、基因插入、基因翻转和基因易位,重组后的染色体常常可表达出新的性状,在真核生物和原核生物中均有广泛应用[16]。Cre 重组酶是一种特异性位点重组酶,当目的基因序列位于两个序列方向相同的LoxP 之间时,就可被介导特异性重组[17],使得该基因序列被删除。此次研究利用PDHA1f/w小鼠与Cre+小鼠杂交繁殖数代后q-PCR 技术筛选,得到了基因型为PDHA1f/f-Lyz2-Cre+小鼠[13]。本研究发现,在小鼠生长繁殖的过程当中,敲除后的小鼠在体质量、形态等方面与对照小鼠相比并无明显差异,表明此次基因敲除并不影响其他组织及器官的正常功能与效应。
此外,由于特异性敲除的巨噬细胞在动物体内分布并不均匀,所以本课题组选择了肝脏和脾脏这两个巨噬细胞含量较多的组织进行验证[18]。在构建的PDHA1 基因敲除小鼠其脾脏组织中PDHA1mRNA 表达水平低于对照组,其肝脏组织中PDHA1 蛋白表达水平也较对照组下降,提示诱导性敲除PDHA1 的转基因小鼠造模成功。
综上所述,采用Cre-LoxP 技术可成功构建PDHA1f/f-Lyz2-Cre+-ApoE-/-小鼠模型。该模型小鼠可为深入探讨能量代谢和巨噬细胞的关系、PDHA1 在AS 发生发展中的作用机制提供动物实验基础。

