结直肠癌坏死性凋亡相关lncRNA 预后风险模型构建
刘德明, 郭天康,2
(1.宁夏医科大学临床医学院,银川 750004; 2.甘肃省人民医院,兰州 730000)
结直肠癌(colorectal cancer,CRC)是消化道常见恶性肿瘤之一,其发病率和致死率一直位居前列[1]。近年来手术及放化疗可明显提升患者的生存率[2],但放化疗的耐受性问题仍使CRC 的治疗屡屡受挫[3],迫切需要新型诊疗措施。
坏死性凋亡是一种受高度调控的区别于细胞凋亡和坏死的程序性死亡形式[4],既可促使肿瘤免疫抑制微环境的形成,也可促进CXCL1 蛋白生成,从而促进肿瘤进展[5-6]。因此,探寻更精准的坏死性凋亡相关靶向分子至关重要。长链非编码RNA(lncRNA)是包含200 个以上核苷酸序列的非编码RNA,可在多阶段调控基因的表达并影响其功能,促进或抑制肿瘤的发展[7]。探索坏死性凋亡lncRNA,可更深入理解坏死性凋亡在癌症进展中的作用,并获得具有潜在价值的治疗靶向分子。
本研究结合递归特征消除算法(recursive feature elimination,RFE)及单、多因素Cox 回归分析,构建坏死性凋亡相关lncRNA 的预后风险模型,评价风险模型在患者预后及抗癌药物治疗敏感性中的预测价值,为研究CRC 的诊治和分子机制提供理论依据。
1 材料与方法
1.1 数据下载及处理
从TCGA 数据库(https://portal.gdc.cancer.gov)中下载CRC 患者RNA-seq 数据集及相关临床信息。基于Gencode 数据库(https://www.gencodegenes.org/human/)下载转置文件,进行基因ID 注释转换。
1.2 筛选坏死性凋亡相关lncRNA
采用R 软件Limma 包,设定参数:|logFC|>1,P<0.05,获取CRC 患者癌组织和正常组织的差异lncRNA(DElncRNAs),结果以火山图展示。从GSEA(https://www.gsea-msigdb.org/gsea/index.jsp)、KEGG 数据库(https://www.genome.jp/kegg/)及已发表文献[8]中获取坏死性凋亡相关的编码蛋白基因。基于Spearman 相关分析,设定参数:|r|>0.5,P<0.001,获取相关性lncRNA。通过Venn在线工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html)求取差异lncRNA 与相关lncRNA的交集,将其结果作为坏死性凋亡相关lncRNA,并进行后续分析。
1.3 筛选最优特征lncRNA 并构建预后模型
基于患者临床信息,排除无生存数据及生存时间<30 d 的患者,通过单因素Cox 分析,筛选与CRC 生存相关lncRNA(P<0.05)。使用R 软件Caret 包将整体数据集按50%分割为训练集和验证集。在训练集中,使用RFE 函数算法[9],以最大准确度Accuracy 筛选出最优特征lncRNA 组合。随后通过My.stepwise 包进行多因素Cox 分析,进一步筛选最佳lncRNA 组合,并构建预后风险模型。根据训练集中的中位风险评分,将患者分为高风险组和低风险组。
1.4 模型的验证及分层预后评估
在训练集、验证集和整体集中采用survival ROC 包和survival 包,分别绘制受试者工作特征(receiver operating characteristic,ROC)曲 线[10]和Kaplan-Meier 曲线[11],对模型的预后价值进行评估。随后,采用单因素和多因素Cox 回归分析,评估不同临床特征及风险评分作为CRC 独立预后因子的潜力,结果使用森林图展示。最后,依据不同临床特征将患者进行分层并进行生存分析,评估风险模型在CRC 患者的适用性。
1.5 模型在抗癌药物敏感性分析中的价值评估
使用pRRophetic 包[12],预测CRC 整体集中患者对常见抗癌药物的治疗反应,根据不同风险模型分组中的IC50值,评估模型对CRC 患者抗癌药物选择中的指导价值。
1.6 列线图构建及校正曲线分析
基于多因素Cox 结果,将有意义的因素纳入模型,并构建列线图,预测CRC 患者1、3、5 年总体生存率。基于calibrate 函数,绘制校准曲线,评估预测结果与实际结果相符度,并通过rmda包绘制决策曲线分析(DCA),评估模型与临床特征在预测患者生存方面的优劣性。
2 结果
2.1 数据处理及坏死性凋亡相关lncRNA 的筛选
基于TCGA 数据集RNA-seq 表达值处理,获得568 例CRC 组织,44 例正常结肠组织表达值。差异分析共筛选出2 961 个上调DElncRNAs,2 680 个下调的DElncRNAs,结果以火山图(图1A)展示。从数据库及文献中共获得144 个坏死性凋亡相关的编码蛋白基因,基于Spearman 相关分析,共获得1 973 个相关性lncRNA。韦恩图对两组lncRNA 交集分析,共获得716 个坏死性凋亡相关lncRNA,其中425 个上调,291 个下调(图1B、图1C)。

图1 坏死性凋亡相关lncRNA 的筛选
2.2 最优特征lncRNA 的筛选
基于生存信息,共纳入446 例患者表达值及临床信息进行后续分析。经单变量Cox 分析,获得41 个生存相关lncRNA(图2)。通过RFE 函数算法,对上述lncRNA 分析,以结果最优参数(最大准确度Accuracy=0.8121),见图3A,筛选出28个最优特征lncRNA。
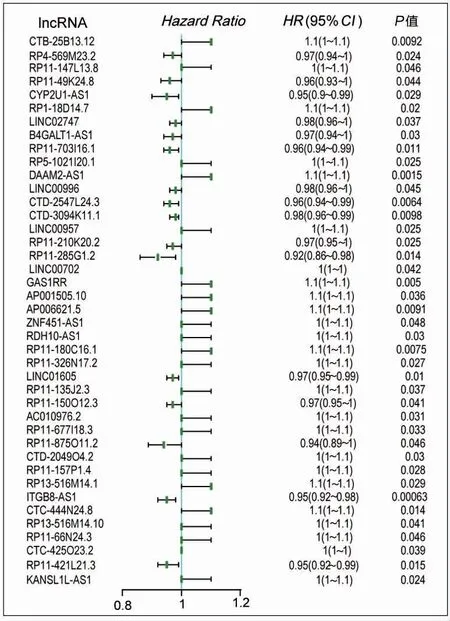
图2 坏死性凋亡相关lncRNA 单因素Cox 分析森林图
2.3 预后风险模型的构建
采用My.stepwise 包进一步筛选最佳lncRNA组合,最终纳入7 个lncRNA,分别是ZNF451-AS1、RP5-1021I20.1、AP001505.10、RP11-421L21.3、KANSL1L-AS1、RP1-18D14.7、RP11-49K24.8,森林图展示结果分析(图3B)。使用7 个最优lncRNA构建风险模型,模型一致性指数(concordance index)为0.79,赤池信息量准则(akaike information criterion,AIC)为366.17。风险评分(riskscore)计算公式如下:
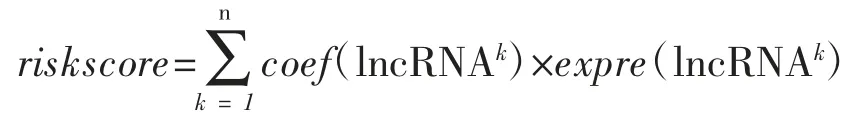
coef(lncRNAk)表示第K 个lncRNA 的多因素Cox 比例风险回归系数,expre(lncRNAk)表示第K 个lncRNA 的表达值。根据计算结果,将训练集的风险评分中位数(0.9574)作为风险模型评分的截断值。
2.4 模型验证及预后评估
ROC 曲线结果显示,该模型在训练集(图4A)的1、3、5 年曲线下面积(AUC)分别为0.842、0.815和0.715,测试集(图4B)分别为0.719、0.732 和0.658,整体集(图4C)中分别为0.758、0.773 和0.698。Kaplan-Meier 曲线结果提示,在训练集,测试集和整体集中,高风险组患者均呈现为较差的预后结果(图3D~F)。不同临床特征分层中的生存曲线分析,高风险组在不同年龄阶段(>65岁vs≤65 岁)、性别(男vs 女)、不同AJCC 分期(Ⅰ/ⅡvsⅢ/Ⅳ)、T 分期(T1/2 vs T3/4)、N 分期(N0 vsN1/2)、M 分期(M0 vs M1)均具有较差的预后。单变量及多变量Cox 独立预后分析结果显示,年龄、AJCC 分期、T 分期及风险评分均可作为CRC患者预后的独立因子。
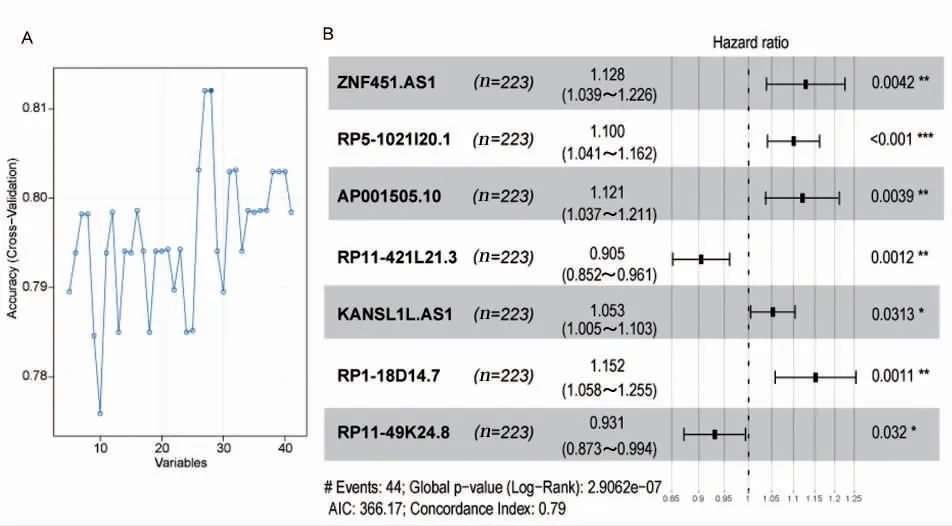
图3 最优特征lncRNA 组合筛选

图4 风险模型的预后评估
2.5 模型在抗癌药物选择中的价值评估
通过pRRophetic 包,预测TCGA 数据库CRC患者对138 种抗癌药物治疗的IC50评分,评估高、低风险组患者对抗癌药物的敏感性。结果显示,高风险组对7 种抗癌药物(BI.2536、BIRB.0796、CMK、IPA.3、Lenalidomide、PD.173074、QS11)敏 感性低,对6 种抗癌药物(AKT.inhibitor.ⅤⅢ、BMS.708163、JNJ.26854165、Lapatinib、MG.132、Temsirolimus)敏感性高。
2.6 列线图构建及评估
基于多因素Cox 分析,将年龄、AJCC 分期、T分期及风险评分纳入模型,构建列线图,预测CRC患者1、3、5 年的预后(图5A)。校正曲线显示列线图预测结果与患者实际生存状态基本相符(图5B)。同时,DCA 曲线显示列线图相较于临床分期等,预测能力具有明显的优势(图5C)。

图5 预测结直肠癌患者1、3、5 年总体生存率的列线图及评估
3 讨论
近年来由于转移及复发率高,且缺乏个体化治疗的有效靶点,CRC 仍然是非常棘手的癌症。探索CRC 进展的分子机制以获得更多潜在治疗靶点,具有重要意义。
坏死性凋亡是细胞死亡的一种裂解形式,是防止细胞凋亡受阻而被激活的细胞自我破坏的过程,在某些退行性或炎性疾病中起到消灭病原体感染的细胞或受损细胞的作用[13]。区别于凋亡过程,该过程的激活不依赖caspase 激酶激活,在caspase 抑制的条件下,死亡受体与配体的结合可触发坏死性凋亡[14-15]。坏死性凋亡在肿瘤发生、进展过程中产生的作用具有双重性,既可增强细胞免疫[16],起抗肿瘤作用,也可刺激肿瘤形成免疫抑制微环境,促进肿瘤进展[5]。既往研究[17]显示,基于胞内RIP-1 以及MLKL 的活性,5-FU 与ZVAD(caspase 抑制剂)联合处理CRC 细胞,可促进细胞发生坏死性凋亡,说明坏死性凋亡在肿瘤耐药研究中的重要价值。RFE 是通过递归的方式移除特定变量,消除变量之间的冗余,保留对预测目标属性贡献大的变量,并重新构建最优组合变量[9]。其主要思想是重复构建模型,遍历所有特征变量,直至筛选出最佳特征变量,该算法是一种寻找最优特征子集的“贪心”算法[18]。在特征变量的筛选及诊断或预后模型构建中起到重要作用。
本研究中,通过Cox 分析及RFE 算法最终纳入7 个lncRNA 构建风险模型,通过对模型ROC 曲线和生存曲线分析,该模型风险评分对CRC患者1、3、5 年的预后具有良好的预测能力,且该模型在不同临床特征分层中均呈现一定预后意义,表明该模型对患者的预后评估不受年龄、性别、肿瘤分期的影响,具有较高的普适性、可靠性及稳定性。此外,风险评分结合患者年龄、AJCC 分期,T分期构建的列线图显示出了高效的生存预测能力,可为临床工作者评估患者预后提供一定的帮助。抗癌药物敏感性分析,可辅助临床医生制定有效的治疗策略,基于R 软件中pRRophetic 包,本研究预测不同风险组中患者对抗癌药物的敏感性,为临床治疗策略的制定提供一定的参考价值。
lncRNA 在基因组中占比较大,可通过影响染色质修饰、RNA 转录以及蛋白质活性等方式在多个层面调控基因的表达[19]。lncRNA 可影响癌症的发生、发展、预后及化疗耐药,靶向lncRNA 的抗癌研究具有重要的意义。本研究的模型中,5 个lncRNA 为保护因子(ZNF451-AS1、RP5-1021I20.1、AP001505.10、KANSL1L-AS1、RP1-18D14.7),2 个为危险因子(RP11-421L21.3、RP11-49K24.8)。ZNF451-AS1 在CRC 中呈现保护性作用,有研究[20]发现,ZNF451-AS1 在头颈部肿瘤中下调,与本研究结果一致,可能在抑制肿瘤进展中发挥的作用一致。而其余6 个lncRNA 目前尚无报道。
本研究用多种方法验证了风险模型的有效性和稳定性,但仍存在不足。该研究的真实性缺乏临床数据及基础实验验证,且结果的可靠性依靠TCGA 数据集的准确性。下一步应通过临床实践及基础实验来验证本研究结果。
综上所述,本研究构建的坏死性凋亡相关lncRNA 的风险模型可以稳定、有效地预测CRC 患者的预后,并可能为临床医生制定治疗策略提供参考依据,也为今后研究CRC 的分子机制、生物标记物及探索新型的治疗靶点提供了新的思路。

