纳武单抗联合伊匹单抗对比纳武单抗单用方案治疗恶性肿瘤有效性和安全性的Meta分析
周晓燕,毛雅珍,王晓贤,刘洁,林雨虹(福建医科大学附属福州市第一医院 检验科,福建 福州 350009)
肿瘤的发生、发展与其微环境的免疫抑制状态息息相关。肿瘤细胞通过诱导免疫抑制细胞在肿瘤周围组织的积聚和诱导免疫抑制分子及其受体表达的增加,抑制抗肿瘤效应T细胞的增殖与活化从而逃避机体免疫系统的监视,最终实现肿瘤免疫逃逸[1]。肿瘤免疫疗法主要通过激活机体的免疫系统,恢复免疫系统识别肿瘤细胞的功能以杀伤恶性细胞,是目前临床抗肿瘤最具潜力的治疗手段[2]。免疫检查点抑制剂(ICI)在晚期实体肿瘤和血液恶性肿瘤的治疗中被广泛应用,并获得了较为持久的临床疗效[3]。其中,针对重要的免疫检查点分子CTLA-4和PD-1/PD-L1通路的单克隆抗体已经进入临床应用,其代表性药物主要包括CTLA-4抑制剂伊匹单抗(ipilimumab,Ipi)、PD-1抑制剂纳武单抗(nivolumab,Nivo)与帕博丽珠单抗(pembrolizumab,Pem)等[4]。
作为肿瘤治疗领域的一大热点,ICI在霍奇金淋巴瘤、黑色素瘤、非小细胞肺癌等恶性肿瘤免疫治疗方面取得了突破性进展。然而,现有的临床研究[5]结果表明,单一的ICI仅可诱导小部分患者的长期免疫应答,大部分患者的缓解率仍不乐观,抗肿瘤反应率低、原发或继发性耐药等问题仍是亟待解决的问题。因此,研究人员正积极探索应用ICI治疗的最适条件及联合其他抗肿瘤手段的方案,如将阻断CTLA-4和PD-1/PD-L1通路的药物联合使用,以互补的方式调节T细胞的增殖和活性,从而提高机体抗肿瘤免疫效应[6-7]。
目前,ICI有关的临床治疗方案多以ICI联合化疗或放疗为主。本研究关注Nivo联合Ipi在多种恶性肿瘤疾病中的应用情况,采用Cochrane系统评价方法,全面检索国内外相关数据,包括治疗相关不良反应,比较Nivo联合Ipi方案与Nivo单用的临床有效性及安全性差异,分析阻断PD-1和CTLA4通路的双免联合疗法能否改善晚期肿瘤患者的预后、延长OS和PFS;同时,探讨联合疗法引起的不良事件(adverse event,AE))的风险,旨在为临床用药提供循证医学证据。
1 资料与方法
1.1 文献资料检索
检索PubMed、知网、万方、维普等国内外数据库,系统搜索关于Nivo联合Ipi与Nivo单独治疗恶性肿瘤的临床试验的文章。
1.2 文献纳入及排除标准
1.2.1 纳入标准 (1)纳入人群:经病理确诊为恶性肿瘤;(2)研究类型:临床随机对照试验(random control trial,RCT)和队列研究(multicohort study,MS);(3)干预措施:Nivo联合Ipi治疗对比Nivo单独治疗恶性肿瘤;(4)结局指标:AE、PFS和(或)OS相关数据或生存曲线图。
1.2.2 排除标准 (1)未设立对照组;(2)重复性研究;(3)非临床试验研究(回顾性研究、病理报道等);(4)未提供PFS和(或)OS的HR且无生存曲线图。
1.3 文献检索策略
英文检索方式:“Ipilimumab”[Title/Abstrac]AND“Nivolumab”[Title/Abstrac]AND(“randomized controlled trial”[Publication Type]OR“controlled clinical trial” [Publication Type]OR “randomized”[Title/Abstract]OR “placebo” [Title/Abstract]OR“clinical trials as topic” [MeSH Terms] OR“randomly”[Title/Abstract]OR“trial”[Title])NOT(“animals”[MeSH Terms])。中文检索方式:[主题:PD-1 抑制剂(精确)]或[主题:Nivolumab(精确)]或[主题:纳武单抗(精确)]或[主题:纳武利尤单抗(精确)]和[主题 :CTLA-4 抑制剂(精确)]或[主题 :Ipilimumab(精确)]或[主题:伊匹单抗(精确)]或[主题:易普利姆玛(精确)]。检索时间为2000年1月至2022年1月,语言限定为英文和中文。
1.4 资料提取
文献数据分别由2位评价员提取并交叉核对,意见不统一时由第3位评价员决定是否纳入。提取的数据包括:(1)基本信息,如研究名称、作者姓名、发表年份等;(2)试验设计细节,包括两组患者的基本情况、免疫抑制剂使用剂量、时间及人数等;(3)干预措施细节、随访时间、死亡及退组情况;(4)结局测量指标:AE、PFS、OS、风险比(hazard ratio,HR)及95%置信区间(confidence interval,CI)等。
1.5 统计学处理
利用周支瑞等[8]报道的数据提取方式,用Windows系统自带截图软件从文献中截取OS和PFS曲线图。通过Adobe Photoshop CS6软件进行去色、增强对比度,导入Engauge Digitizer 11.1软件提取曲线上各点的数值,综合原图合理去掉异常值,采用TIERNEY等[9]文献中提供的计算LnHR和SeLnHR的Excel程序文件,按要求填入相应数据及对应信息即可获得相应数值。该程序文件下载地址:http://www.biomedcentral.com/content/supplementary/1745-6215-8-16-S1.xls。将获得的数值导入RevMan 5.4软件进行合并分析,数据分析类型选用Generic Inverse Variance(OS、PFS)或 Dichotomous(AE)。首先采用χ2检验对各纳入研究进行异质性检验:若异质性较小(P>0.1且I2≤50%),采用固定效应模型进行Meta分析;若异质性较大(P≤0.1且I2>50%),采用随机效应模型进行分析,以P<0.05表示差异有统计学意义。
2 结 果
2.1 文献搜索结果
初检出5 169篇文献,排除重复报道、综述、个案报道、无关内容后剩余52篇文献,根据纳入与排除标准并进行初筛后获得27篇文献,进行全文阅读,最终纳入9篇文献(共包含7项研究),检索流程图见图1。Nivo联合Ipi治疗的疗效差异分析纳入6篇,联合与单独治疗不良反应差异分析纳入8篇,部分文章重叠。
2.2 纳入研究的一般特征和质量评价
文献[10-12]为同一临床研究根据不同的随访时间整理发表的文章。根据需要从不同文章中获取数据,选取文献[11-12]进行分析。文献[13-14]为同一临床试验组,提取两篇文章的基础资料汇总,并从文献[14]中获取不良反应数据进行分析。共纳入符合要求的恶性肿瘤患者1 635例,其中接受Nivo联合Ipi治疗的病例849例、接受单用Nivo治疗的病例786例;黑色素瘤745例、鳞状肺癌243例、转移性尿路上皮癌170例、胸膜间皮瘤125例、卵巢癌100例。所有研究均有资金支持,纳入文献的基本资料见表1。
各项研究均提及随机分配,并描述退出、失访原因,其中除文献[14-15]为MS外,其余均为RCT。对纳入的9篇文献通过RevMan软件进行偏移风险评估,并针对RCT(文献[11-12,16-20])依据改良版Jadad评分量表[21]进行研究质量评价,以总分0~3分为低质量,4~7分为高质量。所有研究均描述了纳入样本的具体标准以及具体的诊疗方案,5项RCT为高质量研究,其中文献[12]和文献[16]的研究对患者和实验人员实行盲法,但未提及具体措施;所有研究均报告了选择性研究结果,不存在选择性报告偏移,见图2和表2。
2.3 Nivo联合Ipi治疗方案显著延长了恶性肿瘤患者的OS
共纳入6个研究[12,15-16,18-20],包含1 336例恶性肿瘤患者,其中Nivo联合Ipi治疗组707例、单独Nivo治疗组629例。各研究间同质性较好(P=0.96,I2=0%),故采用固定效应模型进行Meta分析,结果(图3)显示,联合治疗组患者OS明显高于Nivo单独治疗组(HR=0.86,95%CI:0.75~0.99,P=0.03)。
2.4 Nivo联合Ipi治疗方案显著延长了恶性肿瘤患者的PFS
共纳入6个研究[12,15-16,18-20],包含1 336例恶性肿瘤患者,其中Nivo联合Ipi治疗组707例、单独Nivo治疗组629例。各研究间存在一定的异质性(P<0.000 1,I2=81%),故采用随机效应模型进行Meta分析,结果(图4)显示,联合治疗组患者的PFS明显高于单独Nivo治疗组(HR=0.69,95%CI:0.55~0.85,P=0.000 6)。
2.5 Nivo联合Ipi治疗方案治疗恶性肿瘤患者的AE发生率较高
2.5.1 联合方案增加治疗相关的AE的发生 3个研究[11,14,17]报告了治疗相关AE,包含980例患者,其中Nivo联合Ipi治疗组464例、单独Nivo治疗组516例。各研究间存在一定的异质性(P=0.07,I2=62%),故采用随机效应模型进行Meta分析,结果(图5)显示,联合治疗组患者发生治疗相关AE概率较单药组显著升高(OR=3.18,95%CI:1.55~6.55,P=0.002)。
2.5.2 联合方案增加导致停药相关的AE的发生 4个研究[11,14,16-17]报告了导致停药相关AE,包含1 104例患者,其中Nivo联合Ipi治疗组525例、单独Nivo治疗组579例。各研究间同质性较好(P=0.74,I2=0%),采用固定效应模型进行Meta分析,结果(图6)显示,联合治疗组发生导致停药相关AE概率较单药组显著升高(OR=7.11,95%CI:4.85~10.42,P<0.000 01)。
2.5.3 比较联合方案和Nivo单独治疗方案的相关AE的亚组分析 共纳入6篇文献[11,14,16-17,19-20]报告了治疗相关性AE的亚组信息,主要包括疲乏、发热、皮疹、甲状腺功能异常、大肠炎等。各研究间同质性较好,故均采用固定效应模型进行Meta分析,结果显示,两组患者在高血糖、急性肾损伤以及关节炎或关节痛等AE上的差异无统计学意义(均P>0.05);联合治疗组在其他AE上的发生率高于单药治疗组,差异均有统计学意义(均P<0.05)见表2。
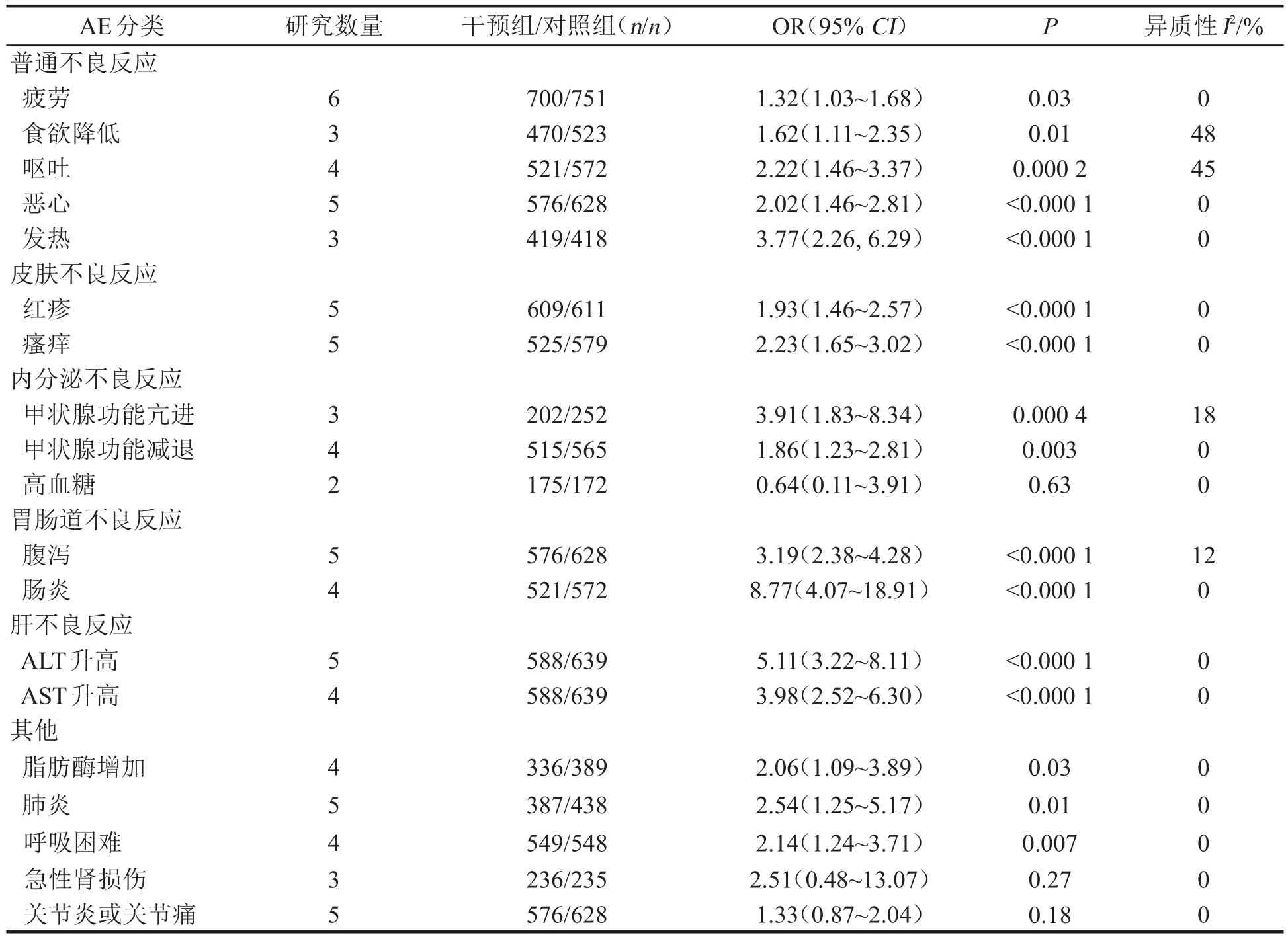
表2 不良反应发生率的亚组Meta分析结果

表2 纳入的RCT研究质量评价结果
3 讨 论
以CTLA-4、PD-1/PD-L1抑制剂为代表的ICI为恶性肿瘤的治疗提供了全新的治疗模式,通过恢复机体免疫细胞的抗肿瘤活性,从而提高治疗反应率[22-23],重塑甚至改写了多种晚期肿瘤治疗的治疗标准。2020年中国临床肿瘤协会发布的ICI临床应用指南[24]中,Nivo成为恶性黑色素瘤晚期一、二线推荐药,同时推荐Nivo联合Ipi为晚期肾癌的一线治疗药。目前,以Nivo作为单药治疗或联合Ipi治疗几种晚期或转移性实体肿瘤的活性和安全性的临床相关研究正在进行。
本文分析比较了Nivo联合Ipi与Nivo单独治疗对多种恶性肿瘤的OS、FPS以及AE发生率的差异。其中文献[10-12]的权重最高(两组共630人),随访时间最长(5年)。合并数据,联合分析了6项临床试验,结果显示,Nivo联合Ipi对比Nivo单用可以显著提高恶性肿瘤患者的OS和PFS;在治疗相关AE和导致停药的AE的发生率上,分别分析了其中3篇和4篇文献,结果表明Nivo联合Ipi发生治疗相关AE和导致停药AE的比值是Nivo单用的3.13和7.11倍,且联合组治疗相关AE的总发生率为90.09%、单药组为74.22%;联合组导致停药AE的总发生率为33.14%、单药组为6.56%。治疗相关的AE包括疲乏、腹泻、瘙痒、皮疹、恶心、急性肾损伤等,亚组分析结果显示,除了高血糖、急性肾损伤以及关节炎或关节痛的发生率在两组间无明显差异外,其余各项目联合治疗组的发生率均显著高于单药治疗组,尤其是在大肠炎(OR=8.77)、腹泻(OR=3.19)、谷丙转氨酶增加(OR=5.11)、谷草转氨酶增加(OR=3.98)、甲状腺功能亢进(OR=3.91)和发热(OR=3.77)等方面,均表现出了较强的发生比。总体分析表明,尽管联合治疗组患者OS和PFS有所延长,但由于双免联合疗法均为针对检查点的封锁治疗,更易出现免疫细胞的非特异性激活或免疫系统过度反应引起的AE,主要累及胃肠道、皮肤、内分泌腺体、肝等重要器官[25]。因而,随访过程中应定期监测患者整体健康状况,早期识别并干预AE,预防严重不良反应的发生。
本研究仍然存在的一定的局限性:第一,由于Nivo联合Ipi对标Nivo单药的临床试验较少,本文选取的研究对象为多种恶性肿瘤,并不是常见的单个疾病对象,无法对不同的肿瘤类型进行亚组分析,可能会对研究结果造成一定影响;第二,本文纳入研究之间存在一定临床异质性,可能会降低文章结论的可信度;第三,Nivo联合Ipi应用或Nivo单用在治疗晚期或转移性肿瘤中并无标准方案,研究者可能根据患者的承受程度设置不同的用药方案和用药剂量,最终合并数据时存在的偏倚一定程度上可能影响整体评估,尤其是AE的判断;第四,由于纳入分析的研究随访期长短不一,两组治疗方案对患者生活质量的影响及远期转归的判断存在一定的影响。在后期的分析中,本课题组将不断更新数据,收集大样本、高质量的临床试验对本文证据进行进一步验证,在用药方案、随访时间及肿瘤亚型上进行更详尽的分析,让结果更有说服力,指导临床实践,为恶性肿瘤患者用药方案的制定及疗程监测提供更可靠的建议。

