工艺条件对甲醇合成催化剂性能的影响
蔡洪城,周菊发,孙 晨,张可羡,黄 晨,杜 勇,张 勇,王治祥,高 平,惠武卫,蒋莉萍,姬存民,王巍然,赵安民
(国家碳一化学工程技术研究中心,工业排放气综合利用国家重点实验室,西南化工研究设计院有限公司,四川 成都 610225)
甲醇是一种非常重要的化工原料,同时也是一种新型清洁燃料。工业上合成甲醇主要使用催化加氢法,采用Cu/Zn/Al2O3为催化剂。Cu/Zn/Al2O3作为经典的甲醇合成催化剂,大量学者分别从催化剂反应机理[1-3]、制备工艺[4-7]和助剂[8-12]等多方面对其进行研究,使甲醇合成催化剂得到了快速发展。蒲晓艳[13]研究了工艺条件对合成甲醇催化反应的影响,研究表明反应条件对甲醇产量的影响程度不同,由大到小依次为温度>氢碳比>新鲜气进气量>压力>循环比;国海光[14]和何海军[15]都研究了CO2含量对甲醇合成催化剂中CO转化率和甲醇产率的影响,结果表明,CO2的存在可保持催化剂的高活性,提高甲醇产率,延长催化剂使用寿命,对甲醇合成有利。本文选用CO和CO2的合成气作为原料气,研究工艺条件对自研样品(记为cat-1)、国外某型号催化剂(记为cat-2)和国内某型号催化剂(记为cat-3)的影响,并对催化剂的热稳定性进行对比分析,考察最佳的反应条件,为工业应用提供参考。
1 实验部分
1.1 催化剂表征
使用德国Bruker公司D8型X射线衍射仪测定样品的物相,Cu Kα射线源,电压40 kV,电流40 mA,扫描速率10o·min-1,扫描范围为10°~80°。
使用美国麦克仪器公司Auto Chem Ⅱ 2920化学吸附仪对样品进行程序升温还原实验。样品用量50 mg,以20 mL·min-1的速率通入Ar,从室温升到200 ℃,恒温1 h,然后冷却到室温,再以20 mL·min-1的速率通入还原气(10%H2-Ar),并以5 ℃·min-1的速率逐渐升温到300 ℃测试,用热导检测器进行检测。
采用梅特勒-托利多TGA/DSC 3+型同步热分析仪分析热重。样品用量50 mg,在空气气氛下以10 ℃·min-1的升温速率从室温升到150 ℃,恒温30 min后,继续升温至800 ℃,测试该过程中样品的失重。
采用美国麦克仪器公司ASAP 2020物理吸附仪测定样品的比表面积、孔容及平均孔径。称取约0.2 g样品,以N2作为吸附质,在300 ℃下抽真空预处理7 h,再于-196℃下进行物理吸附测试。
1.2 催化剂性能评价
实验前,将三种催化剂在120 ℃烘干4 h,然后筛分选取(20~50)目的催化剂样品备用。催化剂测试采用固定床反应器装置。量取2 mL筛分样与同体积同粒度的瓷粒均匀混合,置于反应管恒温区内。反应管采用内径为φ10 cm,长50 cm的不锈钢管,内插φ3 mm×50 cm的热电偶导管便于测试反应温度。反应管经试漏合格后进行程序升温还原,还原压力为0.1 MPa,混合气5%H2-95%N2,空速为3 000 h-1,从室温经4 h升到170 ℃,恒温2 h,然后从170 ℃经2 h升温到220 ℃,恒温2 h。还原结束后,切换为原料气,原料气体积组成为CO=14.0%,CO2=4.0%,N2=10%,H2=72%。根据实验条件,测试不同压力、不同温度和不同空速下催化剂性能。然后在0.1 MPa、400 ℃、3000 h-1的条件下老化10 h,降温到240 ℃测试CO转化率、CO2转化率和甲醇时空收率。气体组成采用Agilent 7890A气相色谱进行在线分析,该色谱配有三个并联的分析单元,配制一根HP-PLOT“S”Al2O3柱子和一个FID检测器分析C1~C6烃类;配制一根5A分子筛柱,两根ProPackQ柱和一个TCD检测器分析CO、CO2、N2;配制一根5A分子筛柱,一根ProPackQ柱和一个TCD检测器分析H2;液相分析釆用Agilent 8890色谱仪,配置HP-INNOWax60 m×320 μm×0.5 μm毛细柱,FID检测器,1 μL自动进样,分流比30∶1,程控升温[16]。
2 结果与讨论
2.1 催化剂表征结果
2.1.1 XRD
图1为三种催化剂的XRD图。
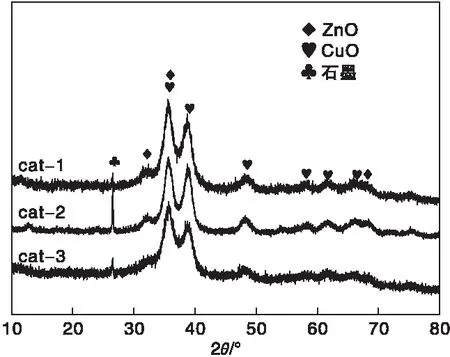
图1 不同催化剂的XRD图Figure 1 XRD patterns of catalysts
从图1可以看出,三种催化剂都含有ZnO、CuO和石墨三种特征峰,且出峰位置基本一致。在2θ=35.7°、38.7°、48.2°、58.0°和61.8°等出现了CuO的特征衍射峰。cat-1在35.7°和38.7°时的主特征峰比cat-2和cat-3稍宽,并且强度更弱,说明cat-1的活性组分CuO晶粒尺寸更小,根据谢乐公式计算得知cat-1的CuO晶粒尺寸为7.3 nm。据报道[17],催化剂中活性组分CuO晶粒越小越有利于分散,催化活性越好,这与后面催化剂性能测试结果一致。从图中可知,三种催化剂均未见明显的ZnO特征峰,说明ZnO高度分散,与CuO产生了很强的协同作用[18]。cat-2催化剂在26.5°的石墨峰更高,说明cat-2中石墨含量更多或者石墨晶型不同。
2.1.2 H2-TPR
图2为三种催化剂的H2-TPR曲线。从图2可知,三种催化剂还原峰主要集中于(125~250) ℃之间,由于ZnO和Al2O3在此条件下不能被还原,因此该还原峰归属于CuO的还原。大量研究表明[19],低温还原峰主要归属于表面CuO的还原,此部分CuO晶粒相对较小,分散更均匀,铜锌之间协同作用更强;高温还原峰归属于体相CuO的还原,此部分CuO分散较差,铜锌之间协同作用弱。从图中可以看出,三种催化剂的还原谱图都出现了低温还原峰,只有cat-3在205 ℃出现了高温还原峰,对比还原温度可知,cat-1的还原峰温最低,cat-2次之,cat-3最高,表明了cat-1样品中CuO与ZnO之间的协同作用更强,且CuO晶粒分散均匀,有利于CuO的还原。
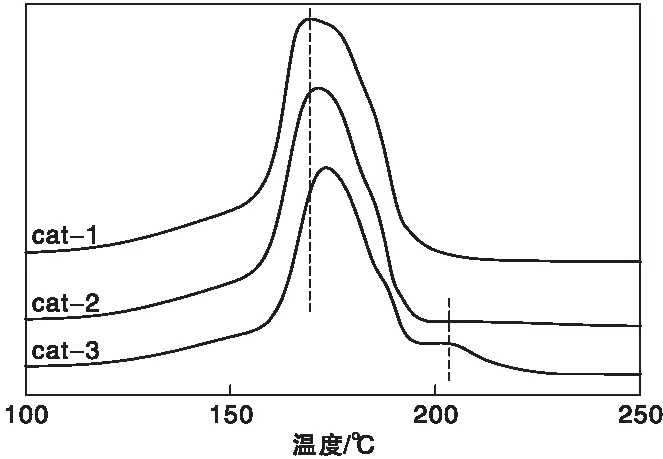
图2 不同催化剂的H2-TPR曲线Figure 2 H2-TPR profiles of catalysts
2.1.3 TG-DTG
图3为三种催化剂的TG和DTG曲线。从TG曲线可以看出,在考察的温度范围内,样品随温度呈现阶段性失重,大致可以分为三个阶段:在150 ℃之前的失重,主要来源于催化剂表面吸附水和杂质的脱除;在(150~450)℃之间的失重,主要是前驱体焙烧残留的碳酸盐分解而引起的,cat-1的失重最大,据此推测,cat-1的焙烧温度可能比cat-2和cat-3低;450 ℃之后的失重主要是高温碳酸盐分解导致的,高温碳酸盐分解温度越高,越有利于催化反应的进行[23],从DTG曲线可以看出,cat-1高温碳酸盐分解温度最高,有利用催化反应的进行,与活性结果相一致。
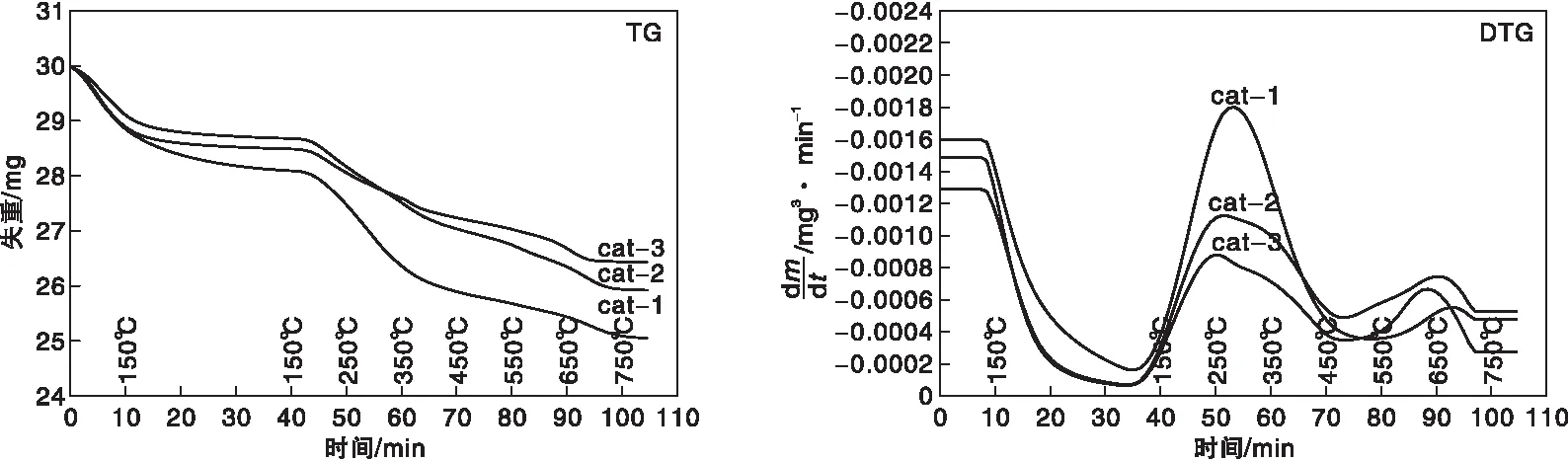
图3 不同催化剂的TG和DTG曲线Figure 3 TG and DTG curves of catalysts
2.1.4 N2低温吸附-脱附
表1为三种催化剂的N2低温吸附-脱附测试结果。催化剂比表面积越大,越有利于活性组分的分散,催化剂活性越好。从表1可以看出,三种催化剂的孔容和平均孔径相差不大,cat-1的比表面积略高,为108 m2·g-1。
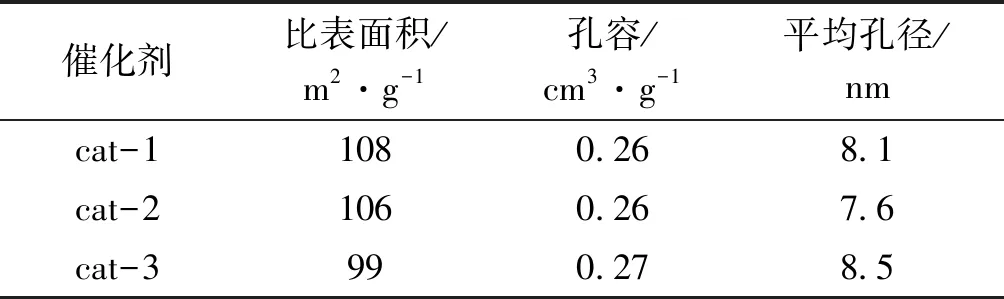
表1 不同催化剂的织构参数
2.2 工艺条件的影响
本实验将从温度、压力、空速和热稳定性对甲醇合成催化剂进行研究。合成气制甲醇主要有CO加氢合成甲醇,CO2加氢合成甲醇和水煤气反应,其反应方程式如下:

(1)

(2)

(3)
上面三个反应都是可逆放热反应,从热力学上来说,提高温度不利于平衡向正反应方向移动,但从动力学上来说,提高反应温度可以增加反应速率,从而使反应向更有利于生产甲醇的方向移动。催化剂自身存在活性温度,若温度低于活性温度,反应不能进行;温度过高,副反应增加,产生更多杂质。主反应(1)和(2)都是体积减少的反应,增加压力有利于生成甲醇,从动力学上来讲,提高压力,各反应物的分压也相应提高,反应物浓度也增大,分子间的碰撞更为容易,因此更多的CO和CO2加入到反应中,增加了反应速率[24]。空速较低时,反应物和催化剂的接触时间长,能够进行充分反应,转化率高;随着空速的升高,原料气在催化剂层停留的时间缩短,尚不能充分反应即离开了催化剂床层,所以高空速下转化率低。甲醇合成反应是放热反应,催化剂活性组分Cu的熔点较低,Hüttig温度(表面原子迁移温度)和Tamman温度(晶格迁移温度)均较低,温度过高,铜晶粒不断长大而发生团聚引起催化剂铜的有效比表面积下降,催化剂活性降低[25]。
2.2.1 反应温度
在反应压力8 MPa和空速10 000 h-1的条件下,不同温度对催化剂性能的影响如图4和图5所示。
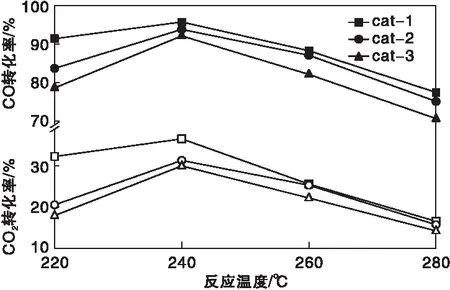
图4 反应温度对CO转化率和CO2转化率的影响Figure 4 Effect of reaction temperature on CO conversion and CO2 conversion
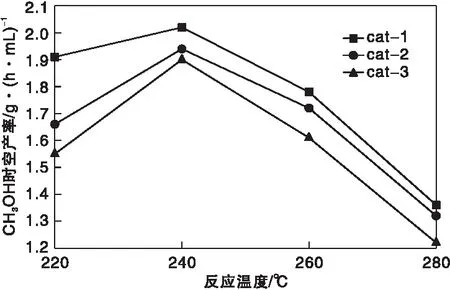
图5 反应温度对CH3OH时空产率的影响Figure 5 Effect of reaction temperature on the spatiotemporal yield of CH3OH
从图4和图5可以看出,随反应温度的升高,CO转化率、CO2转化率和甲醇时空产率都先增加后减少,在240 ℃达到最大。(220~240)℃时反应受动力学控制,升高温度,反应速率增加,转化率增加。温度升高到240 ℃之后,主要受热力学控制,催化剂活性随温度升高而降低。cat-1在220 ℃时CO转化率为91.45%,CO2转化率为32.32%,高于其他两种催化剂,说明cat-1低温活性更好。
2.2.2 反应压力
在反应温度240 ℃和空速10 000 h-1的条件下,不同反应压力对催化剂性能的影响如图6和图7所示。从图6和图7可以看出,在考察的反应压力范围内,随着反应压力的升高,CO转化率、CO2转化率和甲醇时空产率都增加,在8 MPa时达到最大。合成甲醇主反应为体积减少的反应,因此压力越高越有利于生产甲醇,但反应压力太高,对设备的材质和加工工艺要求更高,因此在选择操作压力时应综合考虑设备制造成本和操作成本。从图中还可以看出,cat-1在不同压力下的活性均优于cat-2和cat-3。
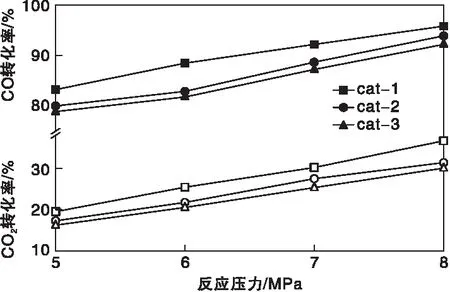
图6 反应压力对CO转化率和CO2转化率的影响Figure 6 Effect of pressure on CO conversion and CO2 conversion
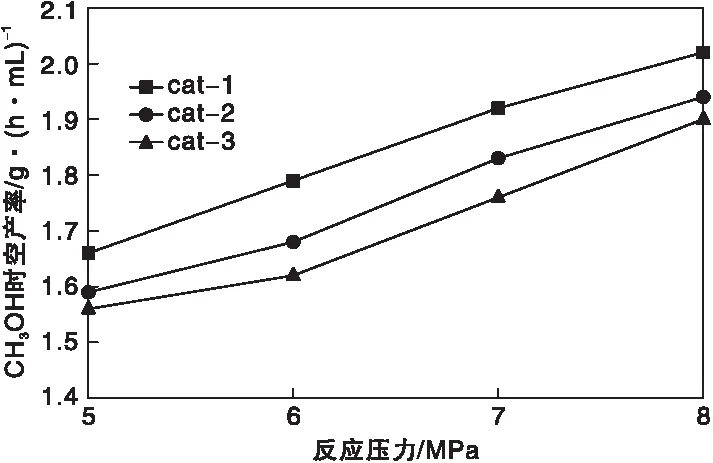
图7 反应压力对CH3OH时空产率的影响Figure 7 Effect of pressure on the spatiotemporal yield of CH3OH
2.2.3 反应空速
在反应温度240 ℃和反应压力8 MPa的条件下,不同空速对催化剂性能的影响如图8和图9所示。

图8 反应空速对CO转化率和CO2转化率的影响 Figure 8 Effect of space velocity on CO conversion and CO2 conversion
从图8和图9可以看出,随着空速的增加,CO转化率和CO2转化率逐渐降低,甲醇时空收率增加。空速较低时,原料气CO转化率和CO2转化率高,但单位时间内生成甲醇的绝对值较低,甲醇产率不高;升高空速,CO转化率和CO2转化率降低,但空速的增加对反应影响更大,因而甲醇的时空产率增加。当空速太高时,会出现催化剂床层压降变大、原料气压缩机功率增加、催化剂粉化和催化剂寿命缩短等问题,因此空速的选择需要综合考虑甲醇产量和装置设备的限制。从图9还可看出,三种催化剂在5 000 h-1时,甲醇时空产率相差不大,当空速逐渐增加,cat-1的甲醇时空产率增加更多,表明cat-1适应的空速范围更宽。
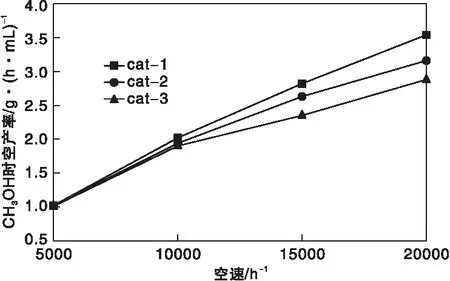
图9 反应空速对CH3OH时空产率的影响Figure 9 Effect of space velocity on the spatiotemporal yield of CH3OH
2.2.4 催化剂热稳定性的考察
将催化剂在400 ℃下老化10 h,然后在反应压力8 MPa、反应温度240 ℃和空速10 000 h-1的条件下考察催化剂的热稳定性,结果见表2。从表2可以看出,经过老化后的催化剂活性都有所下降,其中cat-1老化后CO转化率为83.34%、CO2转化率为31.32%,甲醇时空产率为1.74 g·(h·mL)-1,cat-1的性能仍高于cat-2和cat-3,表明了cat-1具有更好的热稳定性。
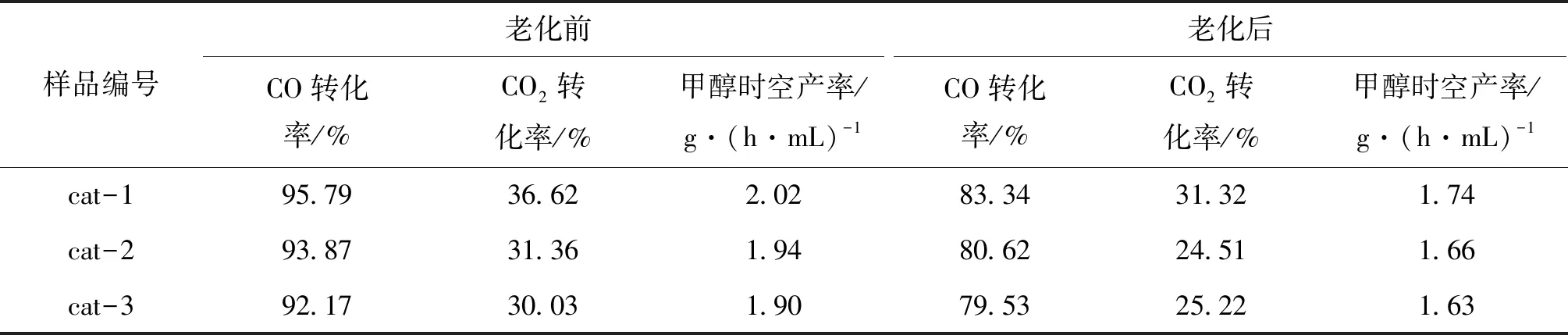
表2 催化剂的催化活性
3 结 论
(1)使用XRD、TPR、TG-DTG和N2低温吸附-脱附对三种甲醇合成催化剂进行表征,结果表明自制cat-1的铜锌协同作用更强,氧化铜晶粒更小,分散更均匀。
(2) 通过对三种甲醇合成催化剂在反应温度、反应压力、反应空速以及热稳定性的考察,发现 cat-1具有更好的低温活性和热稳定性,同时适用的空速范围更广,且本实验最佳的反应条件为反应温度240 ℃、反应压力8 MPa、空速10 000 h-1,在此条件下甲醇时空收率达2.02 g·(h·mL)-1,老化后甲醇时空收率达1.74 g·(h·mL)-1。

