安罗替尼靶向VEGFR2增强食管癌ECA-109细胞对紫杉醇的敏感性*
吴计松,吴 骁,郑家雷,高振远
(蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233000)
食管癌是最常见的恶性肿瘤之一,最近的全球统计数据表明,2020年世界范围新发食管癌病例为604 100例,相关死亡人数为544 076例,分别位于最常见癌症发病率和病死率的第7位和第6位[1]。根据最新发表的2019中国癌症年报[2],中国新确诊食管癌病例数为278 121例,为最常见癌症发病率的第6位;食管癌相关死亡人数为257 316例,位居第4位。食管癌患者以男性为主,占70%,男女发病率为2~3比1[1]。食管癌的病理类型主要有两种:食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC),其中鳞状细胞癌占95%以上。有研究[3]发现,食管癌的发生主要与不良的饮食习惯、经济社会地位低下、常吃粗粮、喜好吸烟和饮酒、新鲜蔬菜水果摄入不足等有关。食管癌预后较整体预后差,5 a生存率低于25%[4]。食管癌发病机制复杂,分子机制尚不清楚。尽管最近在早期诊断和治疗方面取得了进展,但预后仍然不尽如人意。因此,迫切需要新的有效治疗方法,进一步提高临床治疗效果。
本研究通过检测血管内皮生长因子受体2(VEGFR2)在ESCC组织中的表达及与临床病理特征的关系,探讨针对VEGFR2的靶向药物安罗替尼(Anlotinib)联合紫杉醇对食管癌ECA-109细胞的增殖、侵袭和迁移、凋亡的影响及可能存在的作用机制。
1 材料与方法
1.1 材料 选取2019年1月—2020年12月蚌埠医学院第一附属医院手术切除的50例ESCC组织及相对应的距离癌组织2 cm以上的癌旁组织临床标本。排除术前接受免疫治疗、化疗或放疗的患者。在收集和使用临床标本之前,每位患者均签署知情同意书。本研究涉及的临床标本协议由蚌埠医学院第一附属医院伦理委员会授权。VEGFR2、过氧化物酶联合二抗试剂盒购自Abcam公司,人食管癌细胞株ECA-109细胞购自北纳创联生物技术有限公司。胎牛血清、RPMI 1640 培养基购于Gibco公司。Anlotinib购自南京正大天晴制药有限公司,紫杉醇购自山东齐鲁制药有限公司。一抗磷酸化的哺乳动物雷帕霉素靶蛋白(p-mTOR)、磷酸化的蛋白激酶B(p-AKT)购自上海任捷生物科技有限公司,B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2-Associated X的蛋白质(Bax)试剂盒和二抗购于Abcam 公司。CCK8 试剂盒、凋亡检测试剂盒和 ECL 发光试剂盒均购于上海碧云天生物技术有限公司。Transwell试剂盒购自Corning中国公司。
1.2 方法
1.2.1 免疫组化 首先将石蜡切片脱蜡至水,用质量分数3%H2O2室温孵育 5 min,蒸馏水冲洗,然后PBS缓冲液浸泡各5 min,共2次,应用质量分数5%~10% 正常山羊血清(PBS缓冲液稀释)封闭后,室温下孵育10 min,加入VEGFR2一抗(ab2349,Abcam)孵育,4 ℃过夜。PBS缓冲液冲洗,5 min×3次。用过氧化物酶联合二抗(ab7090,Abcam)孵育。显色剂显色 3~15 min,然后依次自来水充分冲洗、复染、脱水、透明及封片。在200倍光镜下评价VEGFR-2染色。人工评分染色强度:无染色=0,弱染色=1,中等染色=2,强染色=3。随机选取5个视野中的肿瘤细胞进行评分,得到阳性细胞的平均百分率(0~100%)。0~5%得分0,6%~35%得分1,36%~70%得分2,>70%得分3。最终免疫组化评分按阳性细胞分数×染色强度分数分为低表达组和高表达组:低表达组为总分<4分,高表达组为总分≥4分,在癌旁组织无表达为阴性表达组。
1.2.2 细胞培养 ECA-109细胞在37 ℃、体积分数5% CO2条件下的湿培养箱中培养,使用含质量分数10%的胎牛血清RPMI-1640培养基。取对数生长期的ECA-109细胞,待细胞生长至90% 融合度时,弃掉培养基,PBS缓冲液反复清洗2遍,质量分数0.25% 胰酶-EDTA消化传代。
1.2.3 CCK8法测定细胞活力 收集呈对数期稳定生长的ECA-109细胞,使用细胞计数板计数,调整细胞悬液浓度至5×104mL-1,向96孔板中每孔加入100 μL细胞悬液,在37 ℃、体积分数5%CO2培养箱中过夜,细胞贴壁生长后,Anlotinib浓度梯度依次设置为0、0.25、0.5、1、2、4、8、16、32 μmol·L-1,每个浓度再设4个复孔,每个复孔加入100 μL不同浓度的Anlotinib。在37 ℃、含体积分数5%CO2培养箱中孵育24、48、72 h后,弃掉培养基,每孔加入100 μL含10% CCK-8的完全培养基,避光,37 ℃培养箱中再孵育2 h,用酶标仪在450 nm处测定吸光度。紫杉醇单独作用24 h的抑制率(0、0.25、0.5、1、2、4、8、16、32 μmol·L-1)和Anlotinib(0、0.25、0.5、1、2、4、8、16 μmol·L-1)联合紫杉醇作用24 h(0、4、4、4、4、4、4、4 μmol·L-1)的抑制率在ECA-109细胞中是由相同的方法测得。
1.2.4 细胞凋亡实验 在6孔板中接种ECA-109细胞,加入完全培养基,待细胞汇合率为70%~80% 时,吸去孔内培养基,将各孔设置为对照组、Anlotinib处理组(0、4、8、16 μmol·L-1)、Anlotinib(0、4、8、16 μmol·L-1)联合紫杉醇(4 μmol·L-1)处理组,各组分别加入不同浓度药物2 mL,37 ℃、体积分数5% CO2孵育24 h。收集5×105个细胞于流式管中,用预冷的PBS缓冲液清洗细胞,1 000 rpm离心8 min,移除上清液,加入200 μL 1×Binding Buffer重悬细胞和3 μL Annexin V-FITC,冰上孵育15 min后加入5 μL PI Staining Solution,轻轻震荡混匀,避光、室温反应10 min;再加入200 μL 1×Binding Buffer,混匀,样品在1 h内用流式细胞仪检测。
1.2.5 Transwell侵袭实验 在Transwell上室内加入50 μL基质胶,置于37 ℃ 恒温箱中30 min。收集ECA-109细胞,使用无血清的RPMI-1640培养基,将Anlotinib(0、4、8、16 μmol·L-1),Anlotinib(0、4、8、16 μmol·L-1)联合紫杉醇(0、4、4、4、4 μmol·L-1)的2×105mL-1浓度细胞悬液。分别取100 μL加入上室,下室加入含质量分数10% 胎牛血清的培养液600 μL,每组设置2个复孔,实验重复3次;培养48 h后取出Transwell 小室,冲洗后用棉签轻轻擦去微孔膜上层细胞;用质量分数4%多聚甲醛溶液室温固定15 min,结晶紫室温染色20 min。光学倒置显微镜下(×100) 计数侵袭至微孔膜下层的细胞,每个样本选取5个视野,取平均值。
1.2.6 Transwell迁移实验 在Transwell上室内不用铺设基质胶,其余步骤同侵袭实验方法。
1.2.7 蛋白免疫印迹(Western blotting)检测ECA-109细胞p-mTOR、p-AKT、p-VEGFR2、Bcl-2、Bax、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)蛋白表达 将ECA-109细胞接种至100 mm培养皿中,当细胞融合度为70%~80%时,加入不同浓度药物处理Anlotinib(0、4、4、8、16 μmol·L-1)联合紫杉醇(4、4、4、4 μmol·L-1)处理,24 h后提取蛋白,BCA法测定蛋白浓度。加入SDS-PAGE蛋白上样缓冲液,充分混合均匀,96 ℃ 加热5 min。每种样品取终浓度30 μg上样电泳,转移至PVDF膜,快速封闭液封闭20 min。按照不同分子量剪切PVDF膜,加入对应的抗体,4 ℃摇床孵育12 h。再用TBST室温清洗3次,每次5 min,加HRP标记的二抗,室温孵育1 h,显色曝光,采用Image J软件分析条带灰度值。
2 结果
2.1 ESCC中VEGFR2的表达与临床病理特征的关系 50例ESCC及癌旁组织进行检测,根据染色强度,将ESCC标本分为VEGFR2高表达组和低表达组。见图1。ESCC组织中VEGFR2表达较癌旁正常组织明显升高(P<0.05)。见表1。并且VEGFR2的表达与性别、年龄、部位、组织学分级、淋巴结转移无关(P>0.05),与TNM分期有关(P<0.05)。见表2。

注:A.VEGFR2在癌旁组织中的表达;B.VEGFR2在肿瘤组织中的低表达;C.VEGFR2在肿瘤组织中的高表达。

表1 VEGFR2在ESCC和癌旁正常组织中的表达(n)

表2 ESCC中VEGFR2的表达与临床病理特征的关系(n)
2.2 Anlotinib、Anlotinib联合紫杉醇对ECA-109细胞增殖的影响 CCK8结果显示,随着Anlotinib药物浓度的增加,ECA-109细胞增殖活性明显降低。联合组较单药组对ECA-109细胞增殖活性的抑制率更高。见图2。

图2 紫杉醇(4 μmol·L-1)联合不同浓度Anlotinib(0、0.25、0.5、1、2、4、8、16、32 μmol·L-1) 对ECA-109细胞增殖能力的影响
2.3 Anlotinib、Anlotinib联合紫杉醇对ECA-109细胞凋亡的影响 流式细胞术检测凋亡显示,联合组较单药组细胞凋亡明显增加,差异有统计学意义(P<0.05)。见图3(A、B、C、D)。

注:与对照组比较,高浓度Anlotinib处理组细胞凋亡明显增加(P<0.05)。与紫杉醇联合用药后,凋亡显著增加(P<0.05)。
2.4 Anlotinib、Anlotinib联合紫杉醇对ECA-109细胞侵袭和迁移的影响 与对照组比较,各治疗组ECA-109细胞的侵袭抑制率随药物浓度的增加而显著升高。见图4(A、B)。
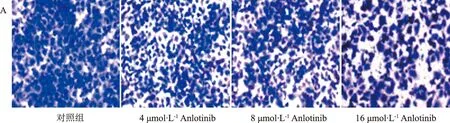
注:A.Anlotinib对ECA-109细胞的侵袭迁移的抑制随药物浓度的增加而显著升高;B.Anlotinib联合紫杉醇可进一步抑制ECA-109细胞的侵袭和迁移。
2.5 Anlotinib联合紫杉醇对ECA-109细胞p-mTOR、p-AKT、p-VEGFR2、Bcl-2、Bax、Caspase-3蛋白的影响 Western blotting结果显示,不同浓度的Anlotinib联合紫杉醇作用ECA-109细胞,p-mTOR、p-AKT、p-VEGFR2和Bcl-2蛋白表达水平降低(P<0.05),Active Caspase-3和Bax蛋白表达水平升高(P<0.05)。见图5(A、B)。

注:A.Western blotting记录图;B.相对表达量;**:与对照组比较,P<0.05。
3 讨论
ESCC是一种常见的消化道肿瘤,是世界上最具侵袭性的恶性肿瘤之一,迄今为止,手术、放疗和化疗仍然是主要的治疗方法。食管癌恶性程度高,发展迅速,治疗效果差,复发和转移率高,据统计2010—2014年美国人群净食管癌生存率仅为20.0%[5]。由于许多患者确诊时多为晚期,ESCC预后很差。化疗一直是转移性食管癌的主要治疗手段,许多单一化疗药物抗肿瘤活性较差,如5-氟尿嘧啶(5-FU)和顺铂,单药有效率仅为6%~17%,中位总生存率为3~7个月。紫杉醇在ESCC中被证明有很高的有效率并且与铂类衍生物有很好的协同作用,然而其单药有效率仅15%,中位无进展生存时间为25周,中位总生存时间为39周[6]。因此,需要进一步研究来确定其发病机制,探寻食管癌新的治疗方法。
近年来,靶向治疗得到了广泛的应用,引起了广泛关注,与细胞毒性药物相比,分子靶向药物具有不良反应少、给药方便、安全可靠、良好的忍受力等优点,其中抗血管生成药物已成为研究热点之一[7]。新生血管的形成是癌症增殖和生长过程中一个关键因素。VEGF是参与肿瘤血管生成的关键促生成因子之一,食管癌术后病理显示,VEGF在30%~60%的患者中出现过表达,并且与临床分期和预后不良有关。VEGF家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D和胎盘生长因子(PlGF),与不同的VEGF受体结合(VEGFRs)并发挥多种生物学功能。VEGFR2主要表达于内皮细胞,是一种酪氨酸激酶受体,VEGFR-2过表达不仅可以促进血管生成,而且还能促进细胞有丝分裂[8]。因此,VEGFR-2表达增加在肿瘤新生血管形成中起着至关重要的作用[9]。VEGF特异性结合VEGFR-2,VEGFR-2被激活,诱导一系列信号转导反应,促进肿瘤细胞生长、增殖和迁移[10]。
本研究结果发现,VEGFR2在ESCC中的高表达率为38%(19/50),在癌旁组织中仅2例高表达4%(2/50),差异有统计学意义(P<0.05),另外,VEGFR2高表达与TNM分期呈正相关(P<0.05),提示VEGFR2是ESCC预后不良因素,因此,通过抗VEGFR2治疗是治疗ESCC的重要策略[11]。
Anlotinib是一种新型口服酪氨酸激酶受体抑制剂,靶向抑制VEGFR-2和VEGFR-3、成纤维细胞生长因子受体1-4(FGFR1-4)、血小板衍生生长因子受体α和β(PDGFR-α和PDGFR-β)、干细胞生长因子(c-Kit)和Ret[12]。有研究[13]表明,Anlotinib抑制肿瘤发展主要是通过对VEGFR2的强特异性抑制,具有抗血管生成和广谱抗肿瘤活性。已经批准用于既往至少接受过2种系统化疗后复发或进展的局部晚期或转移性非小细胞型肺癌患者、既往至少接受过2种化疗方案治疗后进展或复发的小细胞肺癌患者和软组织肉瘤(腺泡状软组织肉瘤、透明细胞肉瘤及既往至少接受过含蒽环类化疗方案治疗后进展或复发的其他晚期软组织肉瘤患者),另外,在肾细胞癌、肝细胞癌、卵巢癌、ESCC、胃癌、大肠癌、鼻咽癌和甲状腺癌的临床研究正在进行中。
本研究结果发现,Anlotinib联合紫杉醇较Anlotinib单药显著抑制ECA-109细胞的增殖、侵袭和迁移并促进了细胞凋亡(P<0.05);并且随着Anlotinib浓度的升高对ECA-109细胞的增殖、侵袭、迁移及凋亡的影响逐渐增强,由此推测Anlotinib可能对紫杉醇的疗效起增敏作用。
AKT/mTOR信号路径是肿瘤细胞主要的生存通路之一,有证据[14]表明,AKT/mTOR信号路径控制着许多关键的细胞过程,如代谢、运动、生长、增殖、分化、侵袭和转移。作为一个VEGFR的下游目标,AKT/mTOR信号通路已成为癌症领域靶向治疗的重点[15-16]。本研究通过Western blotting检测Anlotinib联合紫杉醇处理后ECA-109细胞中p-mTOR、p-AKT、p-VEGFR2、Bcl2、Bax、Caspase-3蛋白的表达。p-mTOR、p-AKT、p-VEGFR2、Bcl2蛋白表达水平显著降低,Active Caspase-3和Bax蛋白表达水平显著升高(P<0.05),Anlotinib可能通过VEGFR2依赖的AKT/mTOR途径,从而抑制ECA-109细胞的增殖、侵袭和迁移,促进其凋亡。
综上所述,Anlotinib联合紫杉醇抑制VEGFR2 的表达,抑制增殖、侵袭和迁移,促进细胞凋亡,进而提高食管癌细胞对紫杉醇敏感性。尽管Anlotinib增强食管癌细胞对紫杉醇的敏感性的详细作用机制仍需进一步研究,但两药联合对食管癌治疗提供了新的理论依据。

