hsa_circ_0005105靶向miR-508-3p对关节炎软骨细胞的影响
张明焕 毛文
湖北省武汉市第三医院骨科,湖北 武汉 430071
骨关节炎(OA)是一种慢性疾病,其病理特征是关节软骨退变和损伤;确定软骨细胞在OA中的作用不仅可揭示该疾病发病机制,还可推动针对特异治疗靶点的新药的开发[1-2]。研究[3-4]表明miRNA、circRNA参与OA的各种病理过程,在骨关节炎中具有治疗潜力。研究[5]报道circ_SEC24A(hsa_circ_0005105)在骨关节炎软骨组织和白细胞介素-1β(IL-1β)诱导的软骨细胞中上调,干扰circ_0005105消除了IL-1β诱导的软骨细胞凋亡、外基质降解以及增殖抑制的作用。然而circ_0005105对IL-1β诱导的软骨细胞炎症因子分泌的影响及机制尚未完全清楚。Circular RNA Interactome在线软件预测发现circ_0005105与miR-508-3p有结合位点。研究[6]报道lncRNA PCAT-1通过miR-508-3p/ZEB1轴促进骨肉瘤的进展。而miR-508-3p对IL-1β诱导的软骨细胞损伤的影响尚未有研究报道。本实验旨在研究circ_0005105是否通过调控miR-508-3p影响IL-1β诱导的软骨细胞损伤。
1 材料和方法
1.1 细胞与主要试剂
人正常软骨细胞C28/I2(深圳市豪地华拓生物科技有限公司);RPMI-1640培养基(美国Gibco公司);Trizol试剂、荧光定量PCR试剂盒(日本Takara);CCK-8试剂盒、凋亡检测试剂盒(日本同仁研究所);蛋白提取试剂盒、TNF-α、IL-6酶联免疫吸附试剂盒(艾美捷科技有限公司);白细胞介素-1β(IL-1β)(上海广锐生物科技有限公司);双荧光素酶报告基因检测试剂盒(美国AAT Bioquest);Bax、Bcl-2抗体(美国Abcam);Cleaved-caspase-9、Cleaved-caspase-3抗体(武汉艾美捷)。
1.2 细胞处理与分组
人正常软骨细胞C28/I2用RPMI-1640培养基常规培养,用5 μg/L的IL-1β处理24 h,作为IL-1β组,正常培养的细胞作为NC组;将si-NC、si-hsa_circ_0005105、miR-NC、miR-508-3p转染至软骨细胞后用5 μg/L的IL-1β处理24 h,记为IL-1β+si-NC组、IL-1β+si-hsa_circ_0005105组、IL-1β+miR-NC组、IL-1β+miR-508-3p组;将si-hsa_circ_0005105分别与anti-miR-NC、anti-miR-508-3p共转染至软骨细胞后用5 μg/L的IL-1β处理24 h,记为IL-1β+si-hsa_circ_0005105+anti-miR-NC组、IL-1β+si-hsa_circ_0005105+anti-miR-508-3p组。
1.3 实时荧光定量PCR(RT-qPCR)检测hsa_circ_0005105和miR-508-3p的表达水平
提取各组软骨细胞的总RNA,反转录成cDNA,按试剂盒说明以GAPDH和U6为内参进行PCR,相对表达量用2-△△Ct法计算。
1.4 蛋白质印迹法检测蛋白表达
提取各组细胞总蛋白,取适量蛋白样品进SDS-PAGE电泳,转膜,封闭1 h,再分别加入抗体(1∶800),4 ℃孵育过夜,洗膜后加山羊抗兔IgG-HRP(1∶2 000)室温孵育1 h,暗室中曝光显影、定影,计算蛋白相对表达水平。
1.5 流式细胞术检测细胞凋亡
各组细胞,按试剂盒说明分别加Annexin V-FITC和PI,避光孵育,上流式细胞仪检测细胞。
1.6 CCK-8检测细胞活性
各组细胞培养24 h,按试剂盒说明加10 μL CCK-8试剂,孵育2 h后检测吸光度值(A)。
1.7 平板克隆形成实验
用6孔板按照每孔500个细胞接种细胞,培养至出现肉眼可见细胞克隆团,弃培养基,加预冷PBS洗涤,用甲醇固定细胞,其用量为500 μL/孔,固定时间为20 min(-20 ℃),用1 %结晶紫染色液染色细胞15 min,反应条件为37 ℃,用量为400 μL/孔,蒸馏水洗涤后晾干,拍照并观察细胞克隆形成数。
1.8 酶联免疫吸附法检测TNF-α、IL-6水平
各组细胞培养48 h后收集细胞培养液,按试剂盒说明操作,检测TNF-α、IL-6水平。
1.9 双荧光素酶报告实验
将hsa_circ_0005105野生型和突变型荧光素酶报告质粒分别与miR-NC和miR-508-3p共转染至软骨细胞,按照试剂盒说明操作,检测细胞荧光素酶活性。
将si-NC、si-hsa_circ_0005105、pcDNA、pcDNA-hsa_circ_0005105转染至软骨细胞,按1.3中方法检测hsa_circ_0005105和miR-508-3p表达水平。
1.10 统计学处理
2 结果
2.1 IL-1β诱导的软骨细胞损伤中hsa_circ_0005105和miR-508-3p的表达情况
与NC组比较,IL-1β组hsa_circ_0005105表达水平升高(1.00±0.10 vs 2.73±0.19)(t=24.172,P<0.05),miR-508-3p表达水平降低(1.00±0.11 vs 0.45±0.04)(t=14.097,P<0.05)。
2.2 低表达hsa_circ_0005105抑制IL-1β诱导的软骨细胞损伤和炎症因子分泌
与NC组比较,IL-1β组hsa_circ_0005105表达水平升高,Bax、Cleaved-caspase-9、Cleaved-caspase-3相对表达水平、细胞凋亡率升高,细胞活性和Bcl-2蛋白水平降低,细胞克隆形成数减少,TNF-α和IL-6水平升高(P<0.05);与IL-1β+si-NC组比较,IL-1β+si-hsa_circ_0005105组hsa_circ_0005105表达水平降低,Bax、Cleaved-caspase-9、Cleaved-caspase-3相对表达水平、细胞凋亡率降低,细胞活性和Bcl-2蛋白水平升高,细胞克隆形成数增多,TNF-α和IL-6水平降低(P<0.05),见图1,表1。

注:A:低表达hsa_circ_0005105后软骨细胞凋亡流式图;B:低表达hsa_circ_0005105后软骨细胞克隆形成图;C:低表达hsa_circ_0005105后Bax、Cleaved-caspase-3蛋白的相对表达。1:NC;2:IL-1β;3:IL-1β+si-NC;4:IL-1β+si-hsa_circ_0005105。

表1 低表达hsa_circ_0005105抑制IL-1β诱导的软骨细胞损伤和炎症因子分泌Table 1 Low expression of hsa_circ_0005105 inhibits IL-1β-induced chondrocyte injury and inflammatory factor
2.3 过表达miR-508-3p抑制IL-1β诱导的软骨细胞损伤及炎症因子分泌
与IL-1β+miR-NC组比较,IL-1β+miR-508-3p组miR-508-3p表达水平、细胞活性、Bcl-2蛋白水平升高,Bax、Cleaved-caspase-9、Cleaved-caspase-3相对表达水平、细胞凋亡率降低,细胞克隆形成数增多,TNF-α和IL-6水平降低(P<0.05),见图2,表2。

表2 过表达miR-508-3p抑制IL-1β诱导的软骨细胞损伤及炎症因子分泌Table 2 Overexpression of miR-508-3p inhibits IL-1β-induced chondrocyte injury and inflammatory factor
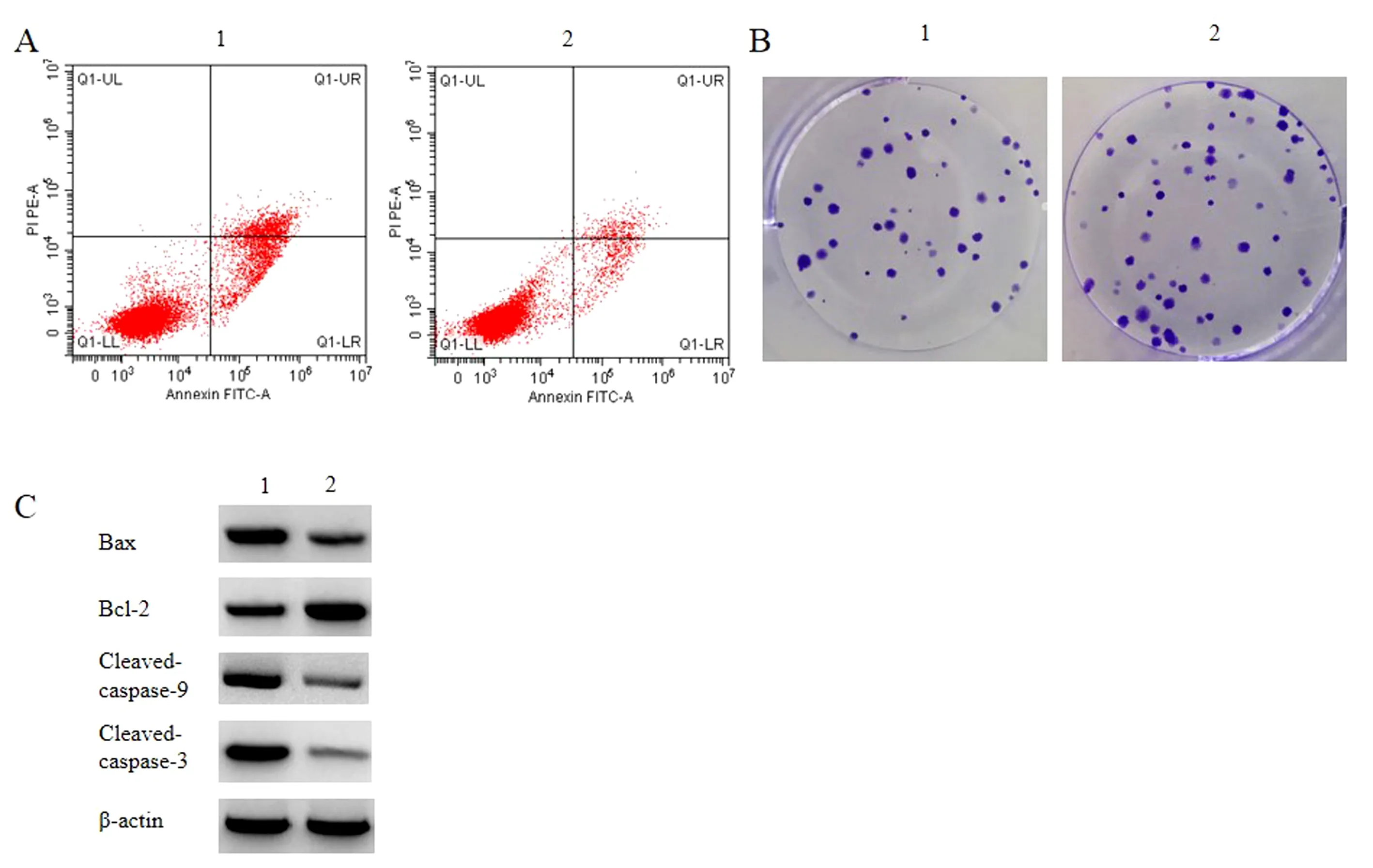
注:A:过表达miR-508-3p后软骨细胞凋亡流式图;B:过表达miR-508-3p后软骨细胞克隆形成图;C:过表达miR-508-3p后Bax、Cleaved-caspase-3蛋白相对表达。1:IL-1β+miR-NC;2:IL-1β+miR-508-3p。
2.4 hsa_circ_0005105靶向miR-508-3p
Circular RNA Interactome预测显示hsa_circ_0005105和miR-508-3p存在结合位点(图3)。miR-508-3p与hsa_circ_0005105荧光素酶活性降低(1.00±0.10 vs 0.41±0.04)(t=16.434,P<0.05)。与si-NC组比较,si-hsa_circ_0005105组hsa_circ_0005105表达水平降低(1.00±0.10 vs 0.35±0.04),miR-508-3p表达水平升高(1.00±0.10 vs 2.24±0.17)(P<0.05);与pcDNA组比较,pcDNA-hsa_circ_0005105组hsa_circ_0005105表达水平升高(1.02±0.09 vs 2.18±0.18),miR-508-3p表达水平降低(1.02±0.11 vs 0.44±0.04)(P<0.05)。

图3 Circular RNA Interactome对hsa_circ_0005105和miR-508-3p结合进行预测示意图Fig.3 Schematic diagram of the prediction of the binding of hsa_circ_0005105 and miR-508-3p by circular RNA Interactome
2.5 低表达miR-508-3p可以逆转hsa_circ_0005105低表达对IL-1β诱导的软骨细胞损伤的影响
与IL-1β+si-hsa_circ_0005105+anti-miR-NC组比较,IL-1β+si-hsa_circ_0005105 +anti-miR-508-3p组miR-508-3p表达水平降低,Bax、Cleaved-caspase-9、Cleaved-caspase-3相对表达水平、细胞凋亡率升高,细胞活性和Bcl-2蛋白水平降低,细胞克隆形成数减少,TNF-α和IL-6水平升高(P<0.05),见图4,表3。

表3 低表达miR-508-3p可以逆转hsa_circ_0005105低表达对IL-1β诱导的软骨细胞损伤的影响

注:A:低表达miR-508-3p和hsa_circ_0005105后软骨细胞凋亡情况;B:低表达miR-508-3p和hsa_circ_0005105后软骨细胞而克隆形成情况;C:低表达miR-508-3p和hsa_circ_0005105后Bax、Cleaved-caspase-3蛋白的相对表达。1:IL-1β+si-hsa_circ_0005105+anti-miR-NC;2:IL-1β+si-hsa_circ_0005105+anti-miR-508-3p。
3 讨论
骨关节炎是常发生于中老年人群的骨科疾病,基因治疗是骨关节炎的一种新兴治疗方式;寻找相关的生物标志物,发现新的治疗靶点已经成为研究热点之一[7-8]。研究[9-10]表明circRNA是骨关节炎发生,发展的重要环节,能够作为诊断标志物和生物治疗靶点,深入的了解circRNA在骨关节炎中的作用机制,以期为骨关节炎的治疗提供理论基础及新的靶点和新的治疗方法。研究[11]报道IL-1β刺激的软骨细胞中hsa_circ_0005105 表达显著上调,hsa_circ_0005105通过海绵miR-26a上调NAMPT表达并促进软骨细胞外基质降解。此外,circ_0005105在胰腺导管癌组织和细胞系中均上调表达,促进癌细胞增殖和转移[12]。IL-1β被认为是骨关节炎的主要诱因,本研究用IL-1β诱导软骨细胞建立骨模型,IL-1β诱导的软骨细胞中hsa_circ_0005105表达水平也升高,与前人研究结果一致[11]。本研究低表达hsa_circ_0005105后,IL-1β诱导的软骨细胞中Bax、Cleaved-caspase-3相对表达水平降低,细胞凋亡率降低,细胞活性升高;表明低表达hsa_circ_0005105可抑制IL-1β诱导的软骨细胞凋亡,促进细胞增殖。炎症在骨关节炎的进展中起重要作用,加强对炎症细胞因子的研究可能会提高骨关节炎的治疗潜力[13-14]。本研究结果还发现,低表达hsa_circ_0005105后,炎症因子TNF-α和IL-6水平降低,表明低表达hsa_circ_0005105还可抑制IL-1β诱导的软骨细胞中炎症因子的分泌。
研究[15-17]报道miR-508-3p可参与调控卵巢癌、透明细胞肾细胞、胃癌等多种肿瘤的进展。然而miR-508-3p对骨关节炎的影响尚不清楚。本研究结果显示,IL-1β诱导的软骨细胞中miR-508-3p表达水平降低,过表达miR-508-3p后IL-1β诱导的软骨细胞中Bax、Cleaved-caspase-3相对表达水平降低,细胞凋亡率降低,细胞活性升高,TNF-α和IL-6水平降低;提示过表达miR-508-3p可抑制IL-1β诱导的软骨细胞凋亡和炎症因子释放,促进细胞增殖。此外,本研究还发现hsa_circ_0005105靶向调控miR-508-3p;低表达miR-508-3p可以逆转hsa_circ_0005105低表达对IL-1β诱导的软骨细胞损伤及炎症因子分泌的影响。
综上所述,hsa_circ_0005105通过靶向上调miR-508-3p减轻IL-1β诱导的软骨细胞凋亡及炎症因子分泌,促进细胞增殖。

