培养基对小鼠单核巨噬细胞RAW264.7诱导分化破骨细胞的影响
刘昕 李圆圆 刘红 李艳 潘静华 王少君 赵宏艳
中国中医科学院医学实验中心 北京市中医药防治重大疾病基础研究重点实验室,北京 100700
破骨细胞是骨骼系统疾病、骨代谢疾病等研究的常用细胞。破骨细胞的培养方法有多种,其中采用小鼠单核巨噬细胞RAW264.7诱导破骨细胞的方法,因操作简单,诱导形成的破骨细胞数目多、均一性好、杂质少,且具有良好的骨吸收能力被广泛应用。课题组在文献研究[1-5]及实验过程中发现,采用小鼠单核巨噬细胞RAW264.7诱导分化的破骨细胞表面可见大量未分化细胞,这影响了破骨细胞形态的观察及功能的检测。通过对文献的分析及课题组的前期实验发现,培养基可能影响小鼠单核巨噬细胞RAW264.7诱导分化破骨细胞的过程。基于此,本研究拟探讨了培养基对小鼠单核巨噬细胞RAW264.7诱导生成破骨细胞的影响。
1 材料和方法
1.1 材料
小鼠单核巨噬细胞RAW264.7(中国医学科学院基础医学研究所细胞资源中心);核因子κ B受体活化因子配体(RANKL,美国R&D公司,货号462-TEC,批号CWA2520083 );抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(美国SIGMA公司,货号387A-1KT,批号SLBZ5562);高糖DMEM培养基(美国GIBCO公司,货号C11885500BT,批号8121231);α-MEM培养基(国家实验细胞资源共享服务平台,货号202000001,批号20200102);二甲基亚砜(DMSO,美国Sigma公司,货号D2660-100 mL,批号RNBK1994);牛骨片(美国IDS公司,货号DT-1BON1000-96,批号J44137);SYBR Fast qPCR Mix(日本Takara公司,货号RR430A,批号AJF2238A);PrimeScript RT Master Mix(日本Takara公司,货号RR036A,批号AJ90850A)。
1.2 方法
1.2.1文献检索和筛选要求:检索中国知网数据库(CNKI)、万方数据库、Pub Med数据库,检索年限为2011年12月至2021年12月。以“RAW264.7”、“破骨细胞”、“RANKL”为中文检索词,以“RAW264.7”、 “Osteoclast”、“RANKL”为英文检索词,使用布尔逻辑“AND”进行检索,分析小鼠单核巨噬细胞RAW264.7细胞向破骨细胞分化的常用培养基。
文献的纳入标准:①纳入对照研究,不限制分组方法;②小鼠单核巨噬细胞RAW264.7使用RANKL诱导的破骨细胞模型。文献的排除标准:①腺病毒感染、转染后的小鼠单核巨噬细胞RAW264.7;②共培养实验;③重复发表的文献只保留一篇;④数据报告不完整;⑤相同培养基文献数量少于10篇;⑥会议论文。
通过检索共获得704篇文献,排除348篇文献,最终纳入356篇文献,其中英文153篇,中文203篇。文献检索流程见图1。其中使用DMEM培养基的文献为225篇;采用DMEM培养基培养、24 h贴壁后改用α-MEM培养基诱导分化的文献为45篇;采用α-MEM培养基的文献为86篇。
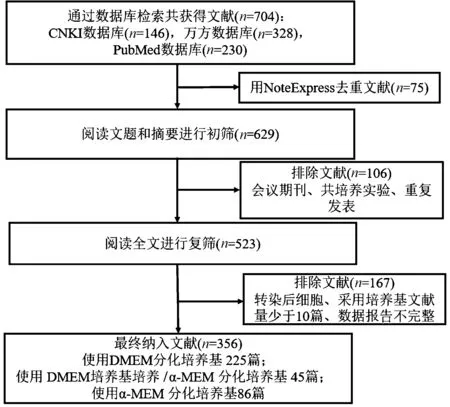
图1 文献检索流程图Fig.1 The flow chart of literature search
1.2.2细胞培养方法及分组:小鼠单核巨噬细胞RAW264.7用含10 %胎牛血清的高糖DMEM培养基或含10 %胎牛血清的α-MEM培养基,在37 ℃、5 % CO2培养箱中进行培养。待细胞状态良好后,按上述文献检索的结果将本实验分为3组:DMEM培养基培养和诱导分化组(DMEM组)、DMEM培养基培养,24 h贴壁后改用α-MEM培养基诱导分化组(DMEM/α-MEM组)、α-MEM培养基培养和诱导分化组(α-MEM组)。将细胞分别以2×103个/孔接种于96孔板、6×104个/孔接种于6孔板,24 h贴壁后更换为相应的含50 ng/mL RANKL的分化培养基,隔天换液一次。
1.2.3破骨细胞形态观察及计数方法[6]:TRAP是破骨细胞的特异性标志酶,按上述方法培养至第5 d,采用TRAP染色方法鉴定破骨细胞。TRAP染色阳性且细胞核大于3个以上者认定为破骨细胞,在倒置相差显微镜下观察破骨细胞的形态并计数。
1.2.4破骨细胞功能的检测方法[7]:按上述方法以2×103个/孔接种于提前放置无菌骨片的96孔板中,24 h后更换为50 ng/mL RANKL的分化培养基,隔天换液。培养11 d后取出骨片在0.25 mol/L氢氧化铵中超声清洗5 min,去除骨片表面的细胞,然后用1 %甲苯胺蓝染色10 min,用蒸馏水冲洗3次。在显微镜下观察骨陷窝形态并拍照,使用Image pro plus软件对骨吸收面积进行分析。
1.2.5破骨细胞分化相关转录调控因子(NFATc-1、c-Fos、TRAF-6)的表达:按上述方法以6×104个/孔密度接种于6孔板中,按上述方法培养5 d后收集各组细胞。加入Trizol裂解液提取各组RNA,反转录为cDNA,采用实时荧光定量 PCR 方法检测NFATc-1、c-Fos、TRAF-6 mRNA的表达。以 GAPDH为内参基因,根据2-△△CT值相对定量样本中目的基因表达水平。引物由上海生工生物工程有限公司设计,目的基因引物序列具体见表1。

表1 目的基因引物序列Table 1 Target gene primer sequences
1.3 统计学处理
2 结果
2.1 不同培养基对破骨细胞分化的影响
小鼠单核巨噬细胞RAW264.7为贴壁细胞,形态较小,增殖快。经RANKL刺激后,细胞逐渐聚集成团,第3 d开始各不同培养基组均可见少量较小的多核细胞,第5 d均可见大小不等的多核细胞,形态不规则,有的呈煎蛋形、有的呈圆形等,且在多核细胞表面均可见不同程度未分化细胞,见图2。

注:红色箭头标记的为破骨细胞。
2.2 不同培养基对破骨细胞分化的影响
培养第5 d后,各组均可以观察到典型的TRAP+破骨细胞。DMEM组TRAP+破骨细胞大小不均一,有细胞脱落的痕迹。此外,在破骨细胞表面有大量成团块状的染色呈黑紫色的未分化细胞。DMEM/α-MEM组和α-MEM组TRAP+破骨细胞分布较均匀,未见有细胞脱落的痕迹,且未分化细胞较少(图3A)。与DMEM组相比,DMEM/α-MEM组、α-MEM组TRAP+破骨细胞数量明显增加(P<0.01),DMEM/α-MEM与α-MEM组之间差异无统计学意义(图3B)。

注:与DMEM组比较,**P<0.01。
2.3 不同培养基对破骨细胞骨吸收功能的影响
骨陷窝可以反映破骨细胞的骨吸收功能。培养11 d后各组均可以观察到明显的骨吸收陷窝,但骨吸收陷窝形态略有不同。DMEM组骨陷窝边界不清晰,形态多为圆形、椭圆形,陷窝染色淡呈紫色,陷窝大小不一,有的可见较大的单个骨吸收陷窝。DMEM/α-MEM组骨陷窝边界清楚,呈小圆形,陷窝染色深呈深紫色,单个骨陷窝面积小,零散分布。α-MEM组骨陷窝边界清楚,呈小圆形、卵圆形,陷窝染色深呈蓝紫色,单个骨陷窝面积不大,多个陷窝聚焦成堆(图4A)。与DMEM组和DMEM/α-MEM组相比,α-MEM组骨陷窝面积明显增加(P<0.01)(图4B)。
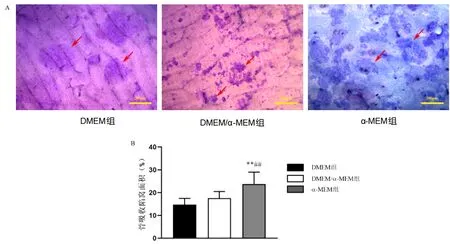
注:A :红色箭头标记的为骨吸收陷窝;B:与DMEM组比较,**P<0.01;与DMEM/α-MEM组比较,##P<0.01。
2.4 不同培养基对破骨细胞分化因子的影响
不同培养基组均可以检测到破骨细胞分化相关转录调控因子NFATc-1、c-Fos、TRAF-6 mRNA的表达。与DMEM组相比,α-MEM组NFATc-1、c-Fos和TRAF-6 mRNA表达显著增加(P<0.01,P<0.05);DMEM/α-MEM组与DMEM组相比,NFATc-1 mRNA表达显著增加(P<0.01),c-Fos和TRAF-6 mRNA表达有增加的趋势,但差异无统计学意义。α-MEM组与DMEM/α-MEM组比较差异无统计学意义(图5)。
3 讨论
小鼠单核巨噬细胞RAW264.7诱导分化为破骨细胞受多种因素的影响[8-10],如传代次数、接种浓度、RANKL 浓度、诱导时间、培养基等。在诸多影响因素中,培养基是最容易被忽视的一个环节。通过文献研究我们发现,使用最多的是高糖DMEM培养基、其次是α-MEM培养基,还有的文献采用高糖DMEM培养基培养、24 h贴壁后改用α-MEM培养基分化。通过本研究,我们证实在RANKL 存在的条件下,以上3种培养基均可诱导小鼠单核巨噬细胞RAW264.7分化成破骨细胞,但破骨细胞形态、破骨细胞分化因子的表达水平及破骨细胞骨吸收功能不尽相同。与高糖DMEM培养基相比,α-MEM分化培养基中成熟的破骨细胞数量及破骨细胞分化相关因子明显的表达增加、破骨细胞骨吸收功能也明显增强。这与曾汝君等[11]研究结果一致,但是研究中具有典型的破骨细胞形态的细胞减少,且没有做破骨细胞骨吸收功能的检测。形态差异的原因可能与细胞传代次数、接种浓度等因素有关。
通过文献研究我们发现,小鼠单核巨噬细胞RAW264.7诱导分化破骨细胞使用最多的是高糖DMEM培养基,这可能与美国模式培养物保藏所(ATCC)推荐高糖DMEM培养基为该细胞培养基有关。许丹等[12]研究也表明用α-MEM培养基培养小鼠单核巨噬细胞RAW264.7时,会出现细胞贴壁不牢的现象;且与低糖型 DMEM 相比,用高糖DMEM 培养的小鼠单核巨噬细胞RAW264.7 传代后贴壁更快,细胞生长速度更快。所以较多研究采用高糖 DMEM 培养小鼠单核巨噬细胞RAW264.7。但也有文献采用α-MEM培养基,这可能与培养目的有关。当小鼠单核巨噬细胞RAW264.7 用于诱导破骨细胞实验时,α-MEM培养基比高糖DMEM培养基更适合。高糖DMEM培养基(葡萄糖浓度为25 mmol/L)与α-MEM培养基(葡萄糖浓度为5.6 mmol/L)在成份上最主要的差别是葡萄糖浓度的不同。Karner 等[13]研究表明,当葡萄糖浓度为5 mmol/L时,破骨细胞生成效果最佳,而高浓度的葡萄糖,虽然可以最大程度地刺激了细胞增殖,但其破骨细胞生成效果较低。
本研究也发现采用高糖DMEM培养基不仅抑制了破骨细胞的分化,还导致小鼠单核巨噬细胞RAW264.7 过快的增殖,这些增殖的细胞粘附于破骨细胞表面,从而影响了破骨细胞的分化及功能。DMEM/α-MEM组虽然破骨细胞形态与未分化细胞数量介于DMEM与α-MEM组之间,但是骨吸收功能明显弱于α-MEM组,可能是培养基的突然更换,虽然对破骨细胞形态影响不明显,但分化因子的表达及骨吸收功能仍未达到α-MEM组水平。本研究结果表明,在采用小鼠单核巨噬细胞RAW264.7 诱导分化破骨细胞的研究中,α-MEM比高糖DMEM更适合做为破骨细胞的分化培养基。

