黄芩素通过BMP-2/Smad通路促进MC3T3-E1成骨作用的实验研究
陈桂锋 尚奇 李娟敏 陈弘林 招文华 余富勇 张鹏 余蝶 崔健超 沈耿杨* 任辉* 江晓兵*
1.广州中医药大学,广东 广州 510405 2.广州中医药大学第一附属医院,广东 广州 510405 3.广州中医药大学岭南医学研究中心,广东 广州 510405
骨质疏松症(osteoporosis,OP)因其具有骨微结构破坏,单位体积骨量减少,骨折风险明显增加的临床特征,发病率逐年上升[1-2]。随着我国人口老龄化的进展,OP已成为最常见的骨骼疾病,OP及由其所引起的骨质疏松性骨折发病率仍逐年上升。因此,开发治疗OP的新药仍然迫在眉睫。
黄芩素(Baicalein,BAI)也称为黄芩黄素。作为中药黄芩含量最高的成分,BAI具有抑制炎症、抗氧化应激、抗肿瘤细胞增殖与迁移、抑制病毒增殖、降低病毒活性等多项药理活性[3-8]。已有研究表明,BAI可促进人牙周膜细胞增殖及成骨标志蛋白RUNX2和BMP-2的表达[9];且可上调GPX4抑制小鼠MC3T3-E1成骨细胞的铁死亡[10];也可通过Wnt/β Catenin通路促进HCEM细胞成骨分化[11]。但目前尚未见BAI对小鼠MC3T3-E1细胞成骨分化的作用及从BMP-2/Smad通路探讨BAI促进成骨作用机制的报道。因此,本研究以MC3T3-E1为研究对象,拟探究BAI通过调控BMP-2/Smad通路对MC3T3-E1成骨分化的影响及其作用机制,为BAI治疗OP的应用提供实验参考。
1 材料和方法
1.1 实验细胞及药物
MC3T3-E1细胞株(广州中医药大学基础医学院赠送),黄芩素(Sellleck公司,S2268)。
1.2 实验仪器及试剂
DMEM低糖培养基(Servicebio公司,G4520-500),胎牛血清(Cyagen公司,FBSAD-01011-500),胰蛋白酶(Servicebio公司,G4001-100),茜素红染料(Cyagen公司),成骨诱导培养基(Cyagen公司,MUXMT-90021),CCK-8试剂盒(GLPBIO,GK1001),荧光定量PCR试剂盒(TAKARA公司,RR420 L),Trizol裂解液(美国Life Invitrogen,15596026),EvoM-mLV反转录试剂(艾科瑞公司,AG11706),RIPA裂解液(Solarbio公司 R0020),BMP-2抗体(Abcam公司,ab14933,稀释比例1∶1 000),Smad1抗体(Abcam公司,ab33902,稀释比例1∶2 000),p-Smad1抗体(CST公司,#9516,稀释比例1∶800),RUNX2抗体(CST公司,#12556,稀释比例1∶1 600),COL1A1抗体(Affinity公司,AF7001,稀释比例1∶500),HRP羊抗兔IgG、HRP羊抗鼠IgG等二抗均购自Affinity公司,CFX 96荧光定量PCR仪(Bio-Rad,美国),DMI3000B倒置荧光显微镜(NIKON公司, 日本),CO2电热隔水式细胞恒温培养箱(Thermo公司,美国),超净工作台(Thermo公司, 美国)。
1.3 实验方法
1.3.1细胞培养:MC3T3-E1细胞每2~3天传代1次,完全培养基由10 %FBS+90 %DMEM培养基配制。
1.3.2药物配制:本研究所使用的BAI通过DMSO溶解,经PBS稀释后加入成骨诱导培养基中进行药物干预。
1.3.3CCK-8检测MC3T3-E1细胞增殖实验:将细胞消化离心后用培养基重悬,并经计数按3×104个/mL密度种入96孔板,共设置6个BAI梯度浓度,分别是0.01、0.1、1、10、100 μmol/L,每组4个复孔。分别进行药物干预后培养1、3、5、7 d后弃去原培养基后,每孔加入110 μL含CCK-8工作液的培养基并孵育1 h,在酶标仪中测定吸光度。
1.3.4MC3T3-E1细胞成骨分化水平与矿化能力检测——ALP与ARS染色:将MC3T3-E1细胞按1×104个/mL种入12孔板后。对照组用成骨诱导培养基进行干预,实验组细胞加入10 μmol/L浓度BAI进行成骨诱导处理,放置于恒温培养箱中培养7 d。7 d后取出培养板吸出诱导液并沿侧壁滴加PBS轻柔洗涤,加4 %多聚甲醛固定15 min后PBS洗板3次,将12孔板置于室温中分别以碱性磷酸酶染色液(ALP)与1 %茜素红染色液(ARS)染色0.5 h,PBS洗摇5 min,操作重复3次。染色后用扫描仪拍摄。
1.3.5MC3T3-E1细胞成骨相关基因表达水平检测——荧光实时定量PCR:①进行药物干预后的72 h内对MC3T3-E1细胞收集后用Trizol法提取RNA。在冰上加入1 mL/孔Trizol对6孔板细胞进行裂解,充分裂解后转入无RNA酶EP管中,加入1/5 Trizol体积的核酸提取液上下摇动后室温静置5 min,在4 ℃下12 000 r/min离心15 min后分次轻柔吸出上层水相,将上层水相打入新EP管并在管中加入等量异丙醇,经充分震荡后静置5 min,随后4 ℃下12 000 r/min离心15 min,将上清液轻柔吸出后加入含DEPC H2O的75 % 乙醇洗脱管中剩余的沉淀,4 ℃下7 500 r/min离心,弃去上清,室温下干燥10~20 min,每孔加入15 μL DEPC H2O进行溶解后测量RNA浓度,分装并保存于-80 ℃冰箱。②将提取的RNA样品按1 μg/20 μL体系配制反应溶液,反转录得到cDNA模板。③按荧光定量PCR试剂盒说明书(TAKARA公司,RR420 L)配制,12.5 μL/孔TB GreenPremix Ex Taq(2×),及2 μL/孔cDNA,上、下游引物各0.5 μL并参照25 μL体系配平后按SYBR法开始RT-PCR反应程序。引物由生工生物工程股份有限公司合成,引物序列见表1。
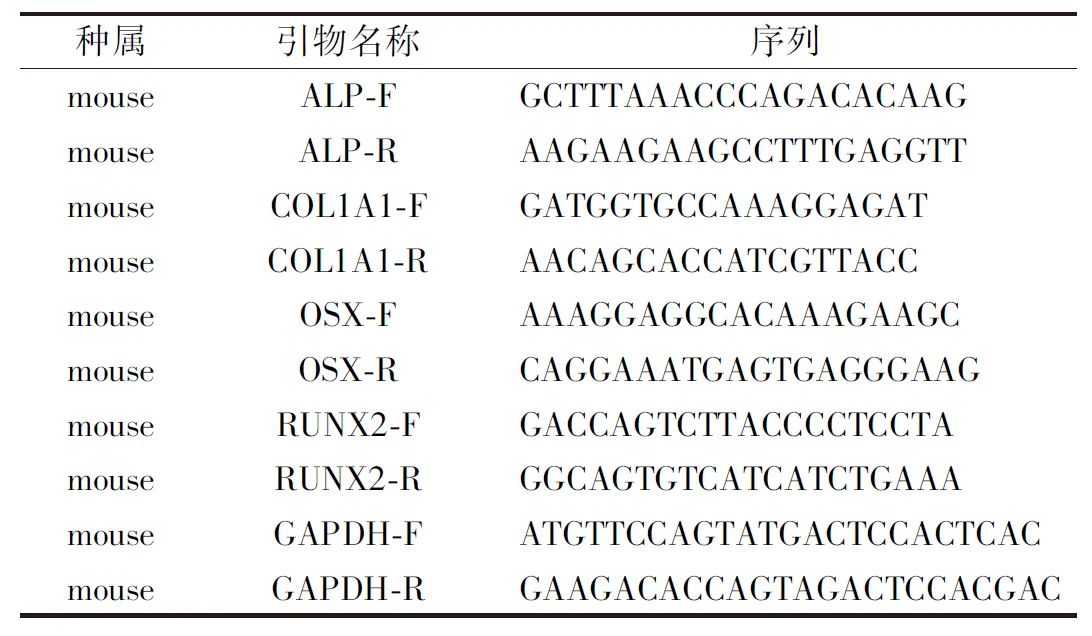
表1 qRT-PCR引物序列Table 1 Primer sequence of qRT-PCR
1.3.6MC3T3-E1细胞成骨相关蛋白表达水平检测——蛋白质印迹法(WB):在6孔板中按每孔2~5×105个/mL细胞密度进行种板,实验组和对照组各干预24 h后,弃去培养基,用PBS清洗后每孔加入等量RIPA裂解液充分裂解后,放入低温离心机内14 000 r/min离心后取上清弃沉淀。将样品稀释液加入96孔板中进行浓度测定,分析浓度加入Loading Buffer并变性蛋白。进行凝胶电泳、转膜后封闭30 min,加入一抗并4 ℃孵育过夜,次日洗膜后孵育对应二抗,显影分析。
1.3.7MC3T3-E1细胞成骨相关蛋白表达水平检测——细胞免疫荧光实验(IF):将细胞培养板从培养箱取出,吸出培养液后沿培养板侧壁滴加PBS 轻柔润洗 2~3 次,用多聚甲醛固定30 min后PBS轻柔洗板3次,每次5 min。室温下加入1 mL 0.3% Triton-X100进行透膜,透膜后PBS洗板,加入1 % BSA室温下封闭1 h后PBS洗板,4 ℃下一抗孵育过夜。室温下进行二抗避光孵育1 h后PBS洗板,进行DAPI避光染色5 min后洗板,加入抗荧光猝灭剂显影。
1.4 统计学处理
2 结果
2.1 细胞增殖实验及成骨分化水平与矿化能力检测
CCK-8检测MC3T3-E1细胞增殖实验:以对照组作为空白对照,BAI组加入不同浓度BAI进行干预。100、1 000 μmol/L组细胞增殖受到抑制(P<0.000 1),而0.01、0.1、1、10 μmol/L等浓度未见细胞增殖被抑制,见图1。

注:与Control组比较,**** P <0.0001。
BAI对MC3T3-E1细胞成骨分化水平与矿化能力检测:将MC3T3-E1细胞种板后分组,按10 μmol/L干预并成骨诱导7 d后,分别进行ALP、ARS染色,发现BAI组的矿化结节明显增加,见图2。
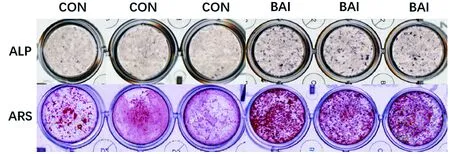
图2 黄芩素促进成骨分化及矿化的染色结果Fig.2 The staining results of Baicalein promoting osteoblast differentiation and mineralization
2.2 BAI对MC3T3-E1细胞成骨相关基因表达水平检测
与对照组比较,10 μmol/L BAI干预1 d后发现,BAI组COL1A1(P<0.001)、RUNX2(P<0.05)、OSX(P<0.05)mRNA表达水平在成骨分化中表达上升,ALP mRNA表达水平有上升趋势,但差异无统计学意义,见图3A。10 μmol/L BAI干预3 d后发现,与对照组相比,BAI组ALP(P<0.05)mRNA表达水平上升,差异具有统计学意义;RUNX2(P<0.001)表达上升,差异具有统计学意义,见图3B。10 μmol/L BAI干预7 d后发现,与对照组相比,BAI组COL1A1 mRNA表达水平上升,差异具有统计学意义(P<0.05),见图3C。

注:与Control组比较,* P <0.05,** P <0.001。
2.3 BAI对MC3T3-E1细胞BMP-2与 p-Smad1、Smad1蛋白的影响
与对照组比较,BAI组中的BMP-2表达水平上升(P<0.05),见图4B。经BAI干预后MC3T3-E1的Smad1表达水平未见差异,p-Smad1表达上升。BAI实验组p-Smad1/ Smad1表达水平较对照组增加(P<0.05),见图4B。
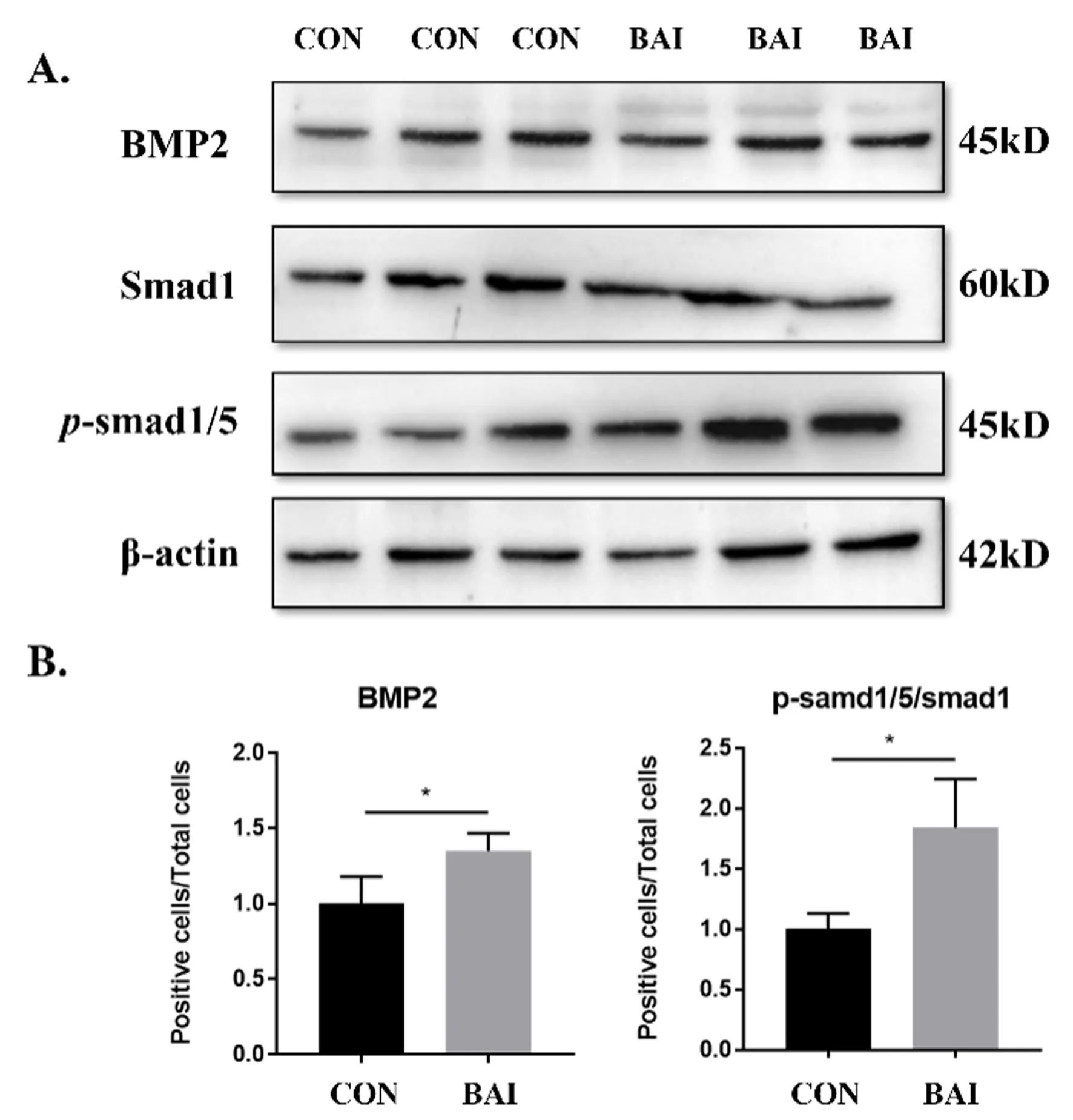
注:与Control组比较,* P <0.05。
2.4 BAI对MC3T3-E1细胞RUNX2、COL1A1蛋白表达的影响
对照组与BAI实验组镜下观察均可见RUNX2、COL1A1蛋白荧光标记,见图5A。与对照组相比,BAI组荧光强度增加,差异具有统计学意义(P<0.01),见图5B。
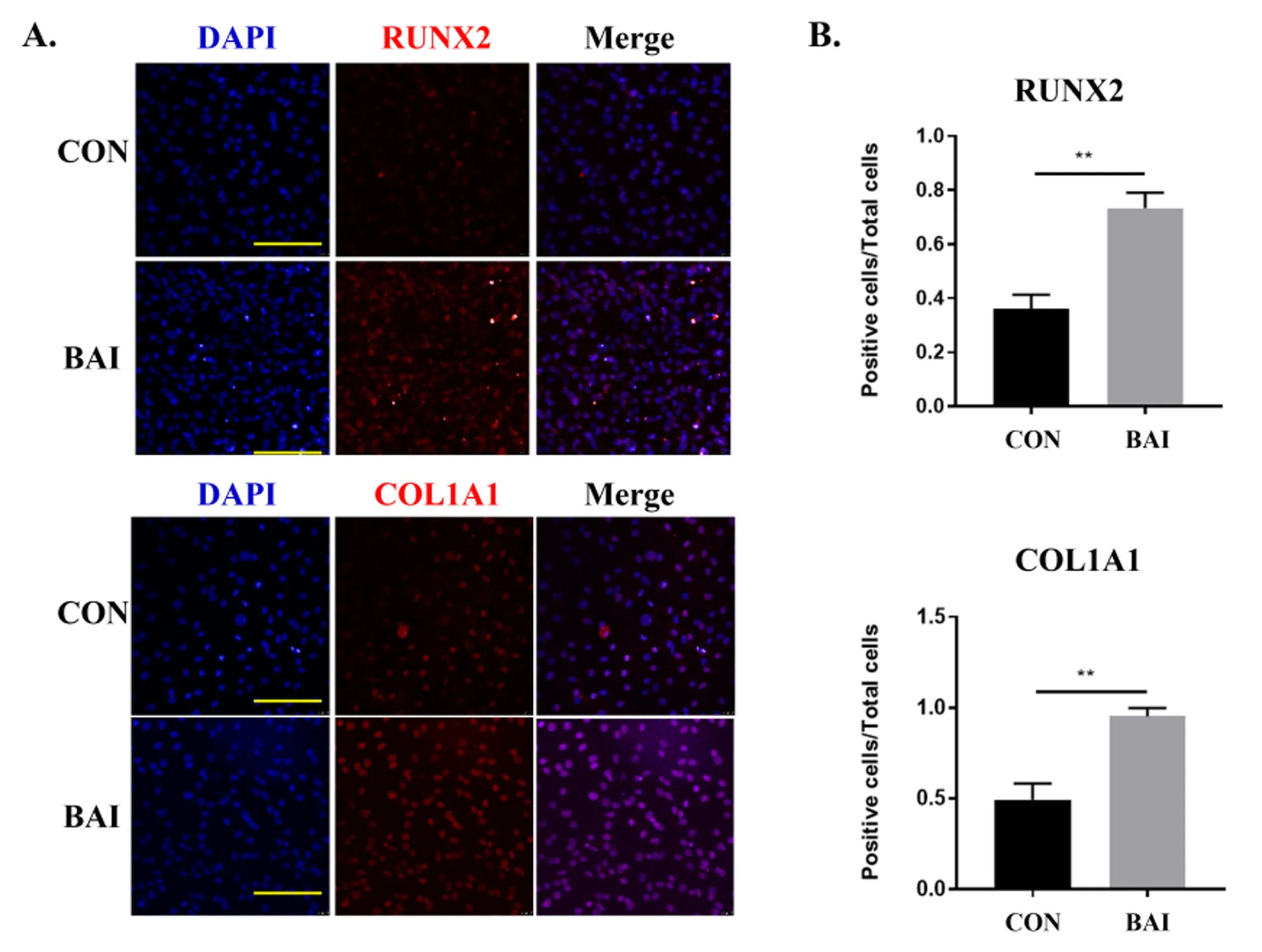
注:与Control组比较,** P <0.001。
3 讨论
OP作为一种代谢性骨病,其骨量受成骨/破骨细胞介导的骨形成-骨吸收平衡调控,目前临床只有通过减少骨量丢失、促进骨形成两种方式进行治疗。大多数治疗OP的方法是通过抑制破骨以减少骨量丢失[2,13-15]。临床应用抗骨吸收药物治疗OP可提高总体生存率,但也有诱发不良反应的风险[2,13-14,16]。通过增加成骨细胞的数量或活性靶向骨形成被认为是一种更有吸引力的治疗方法以增加骨形成和促进骨再生。因此,进一步挖掘促进成骨分化的药物很有必要。BAI作为一种黄酮类化合物,广泛存在于多种中药中,与促进干细胞分化、抑制炎症损伤、减少氧化应激、促进肿瘤细胞凋亡关系密切。近年来已有研究发现BAI在成骨分化、破骨分化、肿瘤凋亡等领域治疗效果显著[17-20],但BAI促进成骨分化的具体机制仍不明确。
不同浓度BAI对细胞增殖的作用略有差异。王彩琼等[9]发现10 μmol/L为BAI干预人牙周膜细胞的适宜浓度且对ALP活性上调最显著。本研究首先通过CCK-8实验筛选BAI的干预浓度,探讨BAI促进MC3T3-E1增殖的作用。CCK-8结果显示,在0.01、0.1、1、10 μmol/L浓度下BAI对MC3T3-E1细胞增殖无影响。当BAI浓度为100 μmol/L和1 000 μmol/L时抑制MC3T3-E1细胞增殖(P<0.000 1)。因此10 μmol/L是不影响细胞正常增殖的最大浓度,我们在后续研究使用10 μmol/L作为BAI干预MC3T3的最佳浓度。该浓度与既往文献探讨BAI对MC3T3-E1的最佳浓度结果一致[9]。
被认为是成骨分化早期标志物的ALP在骨形成和骨矿化中具有重要作用。MC3T3-E1细胞成骨分化可见ALP表达上升。本研究发现BAI可促进ALP活性上升与ARS深染,促进RUNX2、COL1A1、OSX成骨标志物表达。有文献[9]报道不同浓度下BAI均可促进hPDLCs的ALP活性,其中10 μmol/L浓度BAI可明显促进成骨相关标志物RUNX2和BMP-2的mRNA表达水平,与本研究的结果相符,表明BAI可促进MC3T3-E1的成骨分化。
骨形态发生蛋白-2(bone morphogenetic protein-2, BMP-2)/Smad通路被认为在骨稳态中具有重要作用,如何通过激活该通路促进成骨细胞分化,进而促进骨形成以防治OP仍需探索。BMP-2/Smad通路在成骨细胞增殖和分化的作用已被充分证实[19,21-23]。BMP-2作为转化生长因子家族中最大的糖蛋白肽之一,家族成员众多。BMP-2作为驱动成骨分化不可或缺的生长因子,能与细胞膜受体结合,激活细胞内Smad通路,促进Smad1、5、8等转导因子磷酸化,形成Smad复合物进入细胞核,促进RUNX2转录表达,并激活RUNX2以促进早期成骨mRNA的表达[24-25]。本课题组前期已发现BAI可促进成骨分化的基础上,继续研究了BAI对成骨相关基因与蛋白的影响,发现BAI在成骨分化的不同时间可不同程度地上调ALP、RUNX2、COL1A1、OSX、BMP-2等成骨标志基因表达水平。BAI可上调BMP-2、p-Smad1等蛋白表达,提示BAI激活BMP-2/Smad通路可能是BAI促进MC3T3-E1成骨分化的途径之一。
综上所述,本研究发现BAI可通过激活BMP-2/Smad通路以促进MC3T3-E1成骨分化。但本研究只基于细胞水平,存在一定的局限性,后续仍需要动物体内实验进一步探讨并及运用基因敲除及过表达技术对其作用进行深入研究。

