基于非洲猪瘟病毒p30与p54蛋白表位串联多肽的间接ELISA抗体检测方法的建立
马 俊,王志远,梁杏玲,郑泽中,杨汉春,张桂红,4,王 衡,5*
(1.华南农业大学兽医学院 广东省临床重大疾病综合防控重点实验室,广州 510642;2.国家非洲猪瘟区域实验室(广州),广州 510642; 3.中国农业大学动物医学院,北京 100193;4.岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525000;5.华南农业大学非洲猪瘟防控技术研究中心与国家生猪种业工程技术研究中心,广州 510642)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种对家猪和野猪具有高发病率与致死率的高度接触性传染病[1]。不同年龄的家猪与野猪,包括非洲疣猪、丛林猪与欧亚野猪等均易感,软蜱是ASFV传播过程中重要的生物媒介与储存宿主[2]。家猪急性感染的最初临床表现为发热(体温40~42 ℃)、食欲减退及嗜睡,随后病情可发展为呕吐、出血性腹泻,以及怀孕母猪流产等。临床检查可见与血管炎相关的典型病理改变,包括皮肤红斑、肺水肿、充血性脾肿大、出血性淋巴结炎,以及各器官的点状出血。几乎90%~100%有这些症状的猪将在7 d内死亡[3]。1921年,ASF首次报道于非洲肯尼亚,在过去的一个世纪,该病在世界五大洲范围内陆续被报道,已成为危害全球养猪业的重大传染病之一,被世界动物卫生组织列为法定报告的动物疫病[4-6]。自2018年传入我国东北地区以来,该病在各省迅速传播蔓延,给我国生猪产业带来巨大挑战,是我国的一类动物疫病[7]。
ASFV是非洲猪瘟病毒家族已知的唯一成员,属于有囊膜的双链DNA病毒,基因组大小为170~193 kb,编码68种结构蛋白与超过100种非结构蛋白[8]。其中,p30与p54蛋白作为病毒的囊膜蛋白,具有较强免疫原性,均能诱导机体产生中和抗体[9]。p30蛋白主要参与病毒内化,在病毒感染早期即有较高水平表达[10];p54蛋白主要参与病毒粒子的组装,在病毒感染早期可诱导细胞凋亡[11]。
目前,在我国山东与河南等地已经分离出了不同程度的减毒变异毒株,在临床常造成慢性潜伏性感染[12-13],且尚无针对ASFV的有效上市疫苗,因此对ASFV的监测及早期精准诊断成为疫情防控的重点工作内容。酶联免疫吸附试验(ELISA)是世界动物卫生组织推荐的常规血清学诊断方法之一。目前,基于p30与p54等蛋白的血清学诊断方法被广泛建立[14-17],但传统的重组蛋白作为诊断抗原局限于大规模表达与纯化等生产工艺,在临床的应用效果各异。因此,本研究利用噬菌体展示十二肽库筛选ASFV p30与p54蛋白抗原表位,并设计合成表位串联多肽为包被抗原,建立能够特异性检测ASFV血清抗体的间接ELISA方法,对现有检测方法进行补充,为建立精准、稳定的ASFV检测技术提供思路。
1 材料与方法
1.1 血清、菌株及主要试剂材料
ASFV阴性参考血清由本实验室制备并应用法国ID-VET ASFV 间接ELISA抗体检测试剂盒检测确认;ASFV标准阳性血清购自中国兽医药品监察所;经典猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)参考阳性血清与小鼠阴性血清均为本实验室收集保存。ASFV p30蛋白mAb由本实验室制备与保存;ASFV p54蛋白mAb由普莱柯生物工程股份有限公司惠赠。Ph.D.-12噬菌体展示肽库试剂盒为NEB公司产品;HRP-羊抗猪IgG为KPL公司产品,HRP-羊抗鼠IgG购自博士德生物公司;可溶性单组份TMB底物溶液购自天根生化科技有限公司;可拆卸ELISA酶标板购自广州洁特公司;商品化的ASFV间接ELISA抗体检测试剂盒购自北京金诺百泰生物技术有限公司。多肽由上海强耀生物科技公司完成合成及纯化。其他试剂均为国产分析纯。
1.2 p30与p54蛋白抗原表位鉴定
1.2.1 p30与p54蛋白mAbs特异性亲和噬菌体的生物淘选与测序分析 针对p30蛋白mAb的生物淘选与表位肽鉴定方法见本课题组已发表文章[18]。参照该方法对另一株针对ASFV p54蛋白的mAb(1B11)进行特异性亲和噬菌体的淘选与测序分析。试验采用固相淘选的方法,将靶分子用0.1 mol·L-1NaHCO3溶液(pH 8.6)稀释至100 μg·mL-1,包被酶标板,每孔150 μL;样品于湿盒中4 ℃孵育过夜;使用2%BSA溶液封闭,于4 ℃孵育1 h;以0.1%TBST溶液作为第1、2轮洗涤液,0.5%TBST溶液作为第3、4洗涤液;每轮淘选加入100 μL噬菌体文库(滴度控制在1×1011CFU),于室温下孵育1 h;快速洗板10次;加入100 μL 0.2 mol·L-1Glycine-HCl溶液(pH 2.2),于室温下孵育15 min,以洗脱特异性结合的噬菌体;加入15 μL mol·L-1Tris-HCl溶液(pH 9.1),以中和洗脱液;取10 μL产物进行滴度测定,余下产物扩增后用于下一轮淘选。随机挑取第3、4轮淘选洗脱产物进行单克隆噬菌体的扩增及纯化鉴定,将阳性噬菌体单克隆的PCR产物送至上海生物工程有限公司测序(引物如下,F-M13:5′-TCACCTCGAAAGCAAGCTGA-3′;R-M13:5′-CCCTCATAG-TTAGCGTAACG-3′),运用MegAlign(Version 11.0)进行比对分析,筛选获得与p54蛋白氨基酸序列同源性高的十二肽序列,在此基础上设计合成多肽。
1.2.2 ELISA鉴定合成多肽与p54蛋白mAb的反应原性 试验方法参照已发表文章[18]。多肽以碳酸盐缓冲液稀释至0.2 μg·孔-1,以100 μL·孔-1包被酶标板,4 ℃孵育过夜,设置空白与阴性小鼠血清对照孔,p54蛋白mAb(初始浓度为0.2 mg·mL-1)用PBST进行10-3倍~10-5倍稀释,小鼠阴性血清10-3倍稀释,其他操作参照间接ELISA常规程序。
1.2.3 ASFV不同基因型毒株间p54蛋白氨基酸同源性比较分析 通过NCBI(https://www.ncbi.nlm.nih.gov/gene)下载获取21种不同基因型ASFV毒株的p54蛋白氨基酸序列,以及12株ASFV基因Ⅱ型毒株序列,利用MegAlign(Version 11.0)进行同源比对,分析上述鉴定的表位多肽氨基酸位点的保守性。
1.2.4 ASFV p30与p54蛋白空间构象分析 使用QUARK(https://zhanggroup.org/QUARK/)从头算法预测ASFV/HLJ/2018株p30与p54蛋白的空间构象,分析试验鉴定的p30与p54蛋白表位多肽在空间上的结构特点。
1.3 间接ELISA检测方法的建立
1.3.1 包被抗原种类的确定 以本研究通过生物淘选获得与鉴定的抗原多肽结果为基础,设计合成以氨基酸GGG为接头的ASFV p30与p54蛋白表位串联多肽,分别在N端偶联BSA与OVA,参照“1.2.2”的间接ELISA方法,将ASFV阴、阳性血清做1∶40、1∶80、1∶160、1∶320稀释,设置空白与阴性对照孔,比较不同种类包被抗原与血清样本的反应效果,选择最佳的ELISA的包被抗原用于后续试验。
1.3.2 反应条件的优化 采用棋盘滴定法,按照间接ELISA常规程序分别对多肽包被浓度(1.25、2.5、5和10 μg·mL-1,100 μL·孔-1,4 ℃孵育过夜),待检血清稀释度(1∶100、1∶200、1∶400和1∶800,100 μL·孔-1,37 ℃,1 h),HRP标记抗体稀释度(1∶5 000、1∶10 000和1∶20 000,100 μL·孔-1,37 ℃,30 min),封闭液(1%明胶溶液、2%BSA溶液、5%脱脂奶粉溶液和10%马血清),封闭时间(1、2和3 h),血清稀释液(0.05%PBST溶液、1%明胶溶液、2%BSA溶液和5%脱脂奶粉溶液),血清反应时间(45、60和90 min)进行优化,以P值接近1.0且P/N值最大为标准,确定该方法的最佳反应条件。
1.4 特异性试验
用本研究建立的间接ELISA方法检测已知的CSFV、PRRSV、PCV2、PPV与PRV抗体阳性血清各3份,每份血清设3个重复孔,设置阴、阳性对照孔,分析该方法特异性。
1.5 灵敏度试验
用本研究建立的间接ELISA方法检测释1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200倍比稀释的阳性参考血清,分析该方法的检测灵敏度。
1.6 重复性试验
随机选取ASFV抗体强阳性、弱阳性与阴性血清各3份,使用同批次包被的酶标板进行5次重复试验,检验该方法的批内稳定性;使用3个不同批次包被的酶标板进行检测,检验该方法的批间稳定性;分别计算出变异系数,分析该方法的重复性。
1.7 临床样品检测与符合率试验
使用本试验建立的间接ELISA方法检测金宇保灵生物药品有限公司所馈赠的ASFV感染试验的血清及本课题组2018年前收集的临床血清,并与商品化的ASFV间接ELISA抗体检测试剂盒(包被抗原为杆状病毒表达的重组p30蛋白)的检测结果相比较,利用SPSS软件统计并绘制ROC曲线来评价该方法相对的检测敏感性与特异性,并计算两者的符合率。
2 结 果
2.1 p30与p54蛋白mAbs特异性亲和噬菌体的测序分析
针对p30蛋白mAb的生物淘选与表位多肽鉴定结果见本课题组已发表文章[18]。将与p54蛋白mAb特异性亲和的噬菌体PCR产物送公司测序,测序结果与ASFV/HLJ/2018株p54蛋白氨基酸序列进行比对,结果提示该蛋白mAb对应表位分布于146PAEPYTT152之间(图1)。在此基础上,前后延长合成一段多肽进行活性分析,多肽序列见表1。

图1 p54蛋白mAb特异性亲和噬菌体测序分析Fig.1 Sequencing analysis of p54 monoclonal antibody specific affinity phages

表1 合成肽信息
2.2 合成多肽与p54蛋白mAb的反应原性
将合成多肽作为包被抗原与p54蛋白mAb进行结合力验证,间接ELISA结果显示,多肽在0.2~5 μg·孔-1的包被区间与p54蛋白mAb具有相似的结合力,随着mAb稀释倍数增加,结合能力下降,而阴性小鼠血清与多肽几乎不反应(图2)。
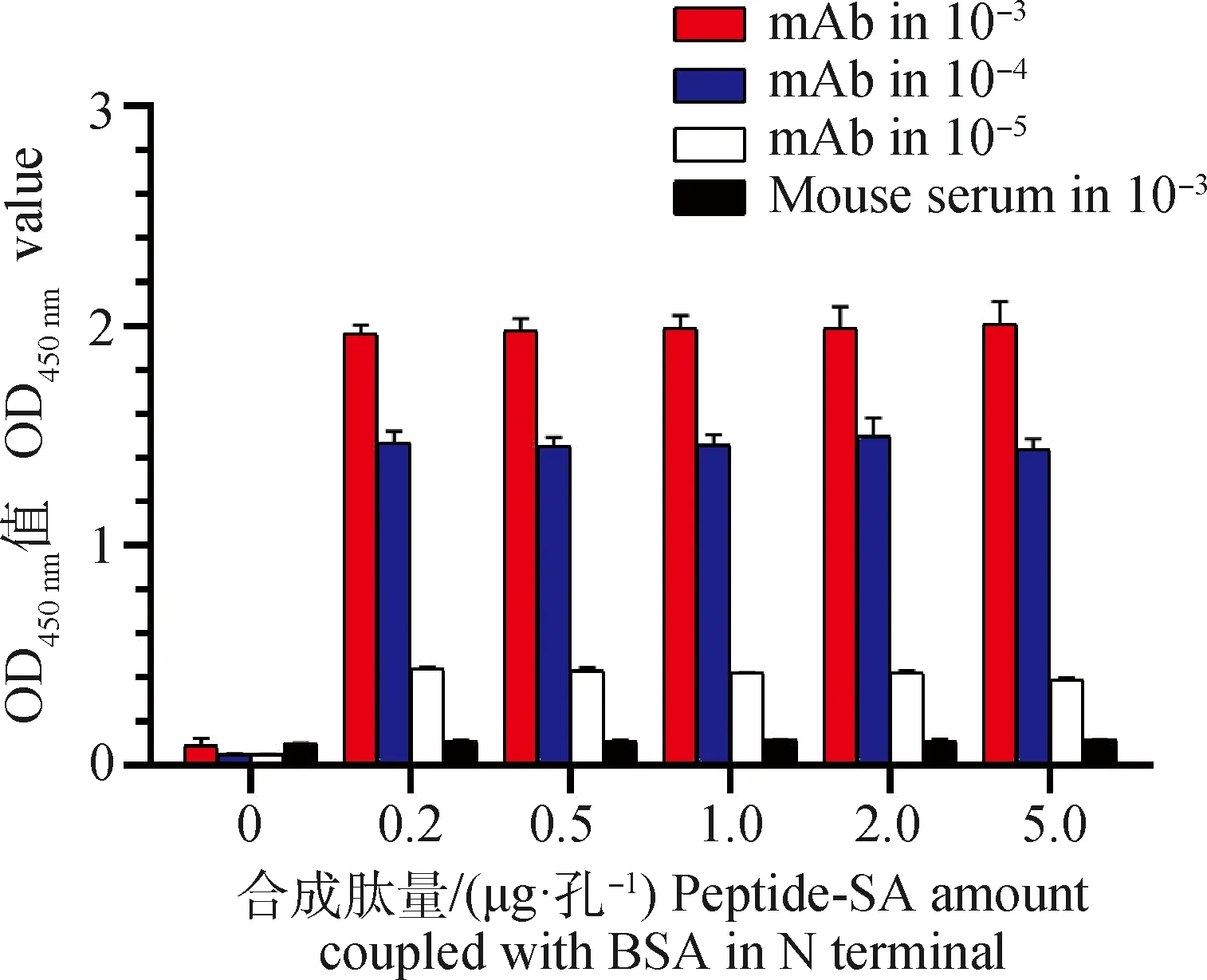
Peptide-SA在N端与BSA相连Peptide-SA was coupled with BSA in N terminal图2 多肽与p54蛋白mAb结合能力Fig.2 Binding activities of the synthetic peptides to p54 monoclonal antibody
2.3 ASFV不同基因型毒株间p54蛋白氨基酸同源性比较分析
ASFV p54蛋白氨基酸序列比对结果显示:141SAPAHPAEPYTT152多肽序列在ASFV 21种不同基因型毒株间相对保守,其中,145与149位氨基酸位点存在一定程度变异(图3),但在12株ASFV基因Ⅱ型毒株间高度保守(图4)。
2.4 QUARK预测p30与p54蛋白空间构象
ASFV/HLJ/2018株p30与p54蛋白空间构象预测结果显示,p30蛋白116—124位多肽主要位于α螺旋区域,而p54蛋白141—152位多肽主要位于不规则卷曲区域,但两者均暴露于蛋白表面(图5)。
2.5 多肽间接ELISA最佳反应条件的确定
2.5.1 包被抗原种类的确定 根据上述结果设计合成的表位串联多肽序列信息见表2。间接ELISA结果显示,以OVA作为N端偶联物的多肽抗原与BSA相比具有较低的非特异性血清结合背景,且阴性对照组(OVA)均不与血清反应(表3)。
2.5.2 反应条件的优化 通过对间接ELISA方法的优化,最终确定:最佳抗原包被浓度为2 μg·mL-1,血清稀释度为1∶100,HRP标记抗体稀释度为1∶5 000(表4);最佳封闭条件为1%明胶溶液封闭1 h(表5);最佳血清反应条件为使用封闭液稀释并作用60 min(表6);综上,得到ELISA检测的基本流程见表7。
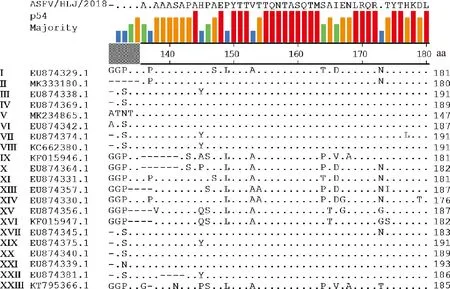
图3 ASFV不同基因型毒株间p54蛋白氨基酸同源性比较分析Fig.3 Comparative analysis of amino acid homology of p54 protein among ASFV genotypes
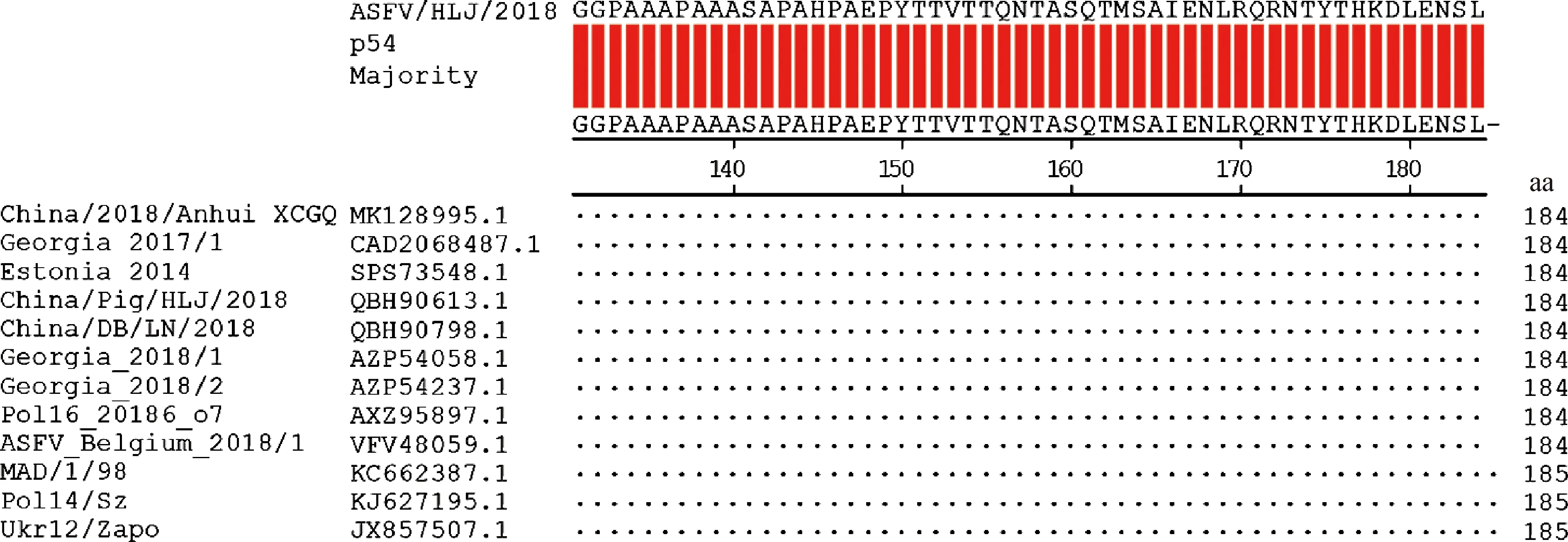
图4 ASFV基因Ⅱ型毒株间p54蛋白氨基酸同源性比较分析Fig.4 Comparative analysis of amino acid homology of p54 protein among ASFV genotype Ⅱ strains

a. ASFV/HLJ/2018株 p30蛋白;b. ASFV/HLJ/2018株 p54蛋白a. ASFV/HLJ/2018 strain p30 protein; b. ASFV/HLJ/2018 strain p54 protein图5 ASFVp30和p54蛋白空间构象Fig.5 Conformational structure of ASFV p30 and p54 protein

表2 合成的表位串联多肽信息
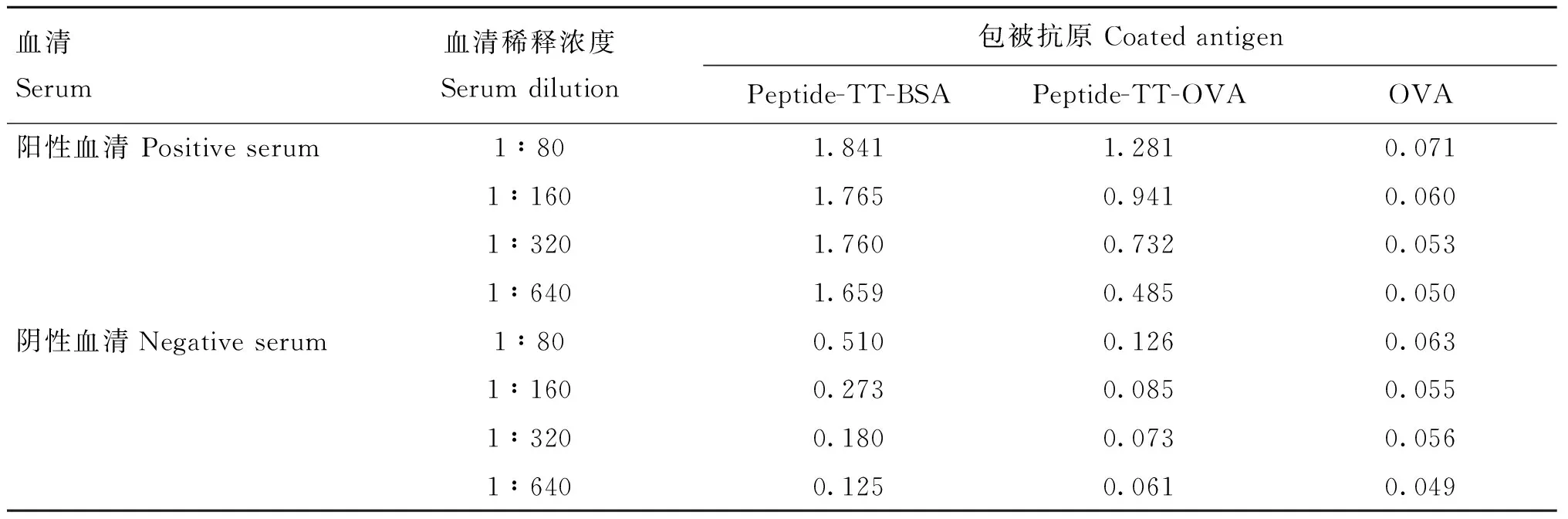
表3 包被抗原种类的确定(OD450 nm)
2.5.3 间接ELISA阈值的确立 利用本研究建立的间接ELISA方法对90份猪阴性血清进行检测(表8),统计学结果计算可得:检测结果的阳性临界值为0.339;即设立间接ELISA检测结果判定标准如下:在阴性对照两孔平均OD450 nm值<0.286,阳性对照两孔平均OD450 nm≥0.571的情况下检测结果成立,当OD450 nm<0.286判为阴性,0.286≤OD450 nm<0.339判为可疑,OD450 nm≥0.339判为阳性,可疑样品复检,若仍小于0.339,则判为阴性。
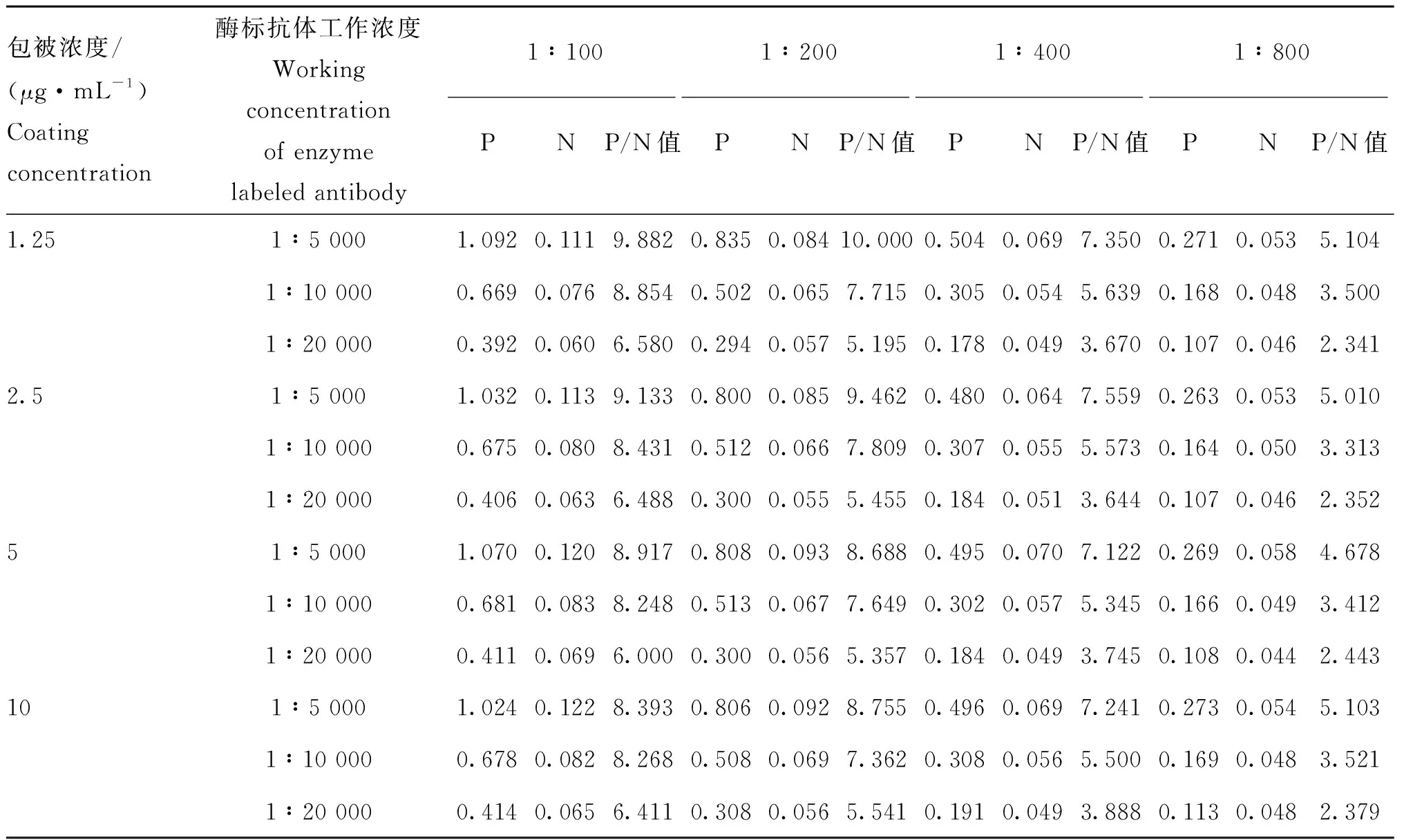
表4 抗原包被浓度、血清稀释度及HRP标记抗体稀释度的确定
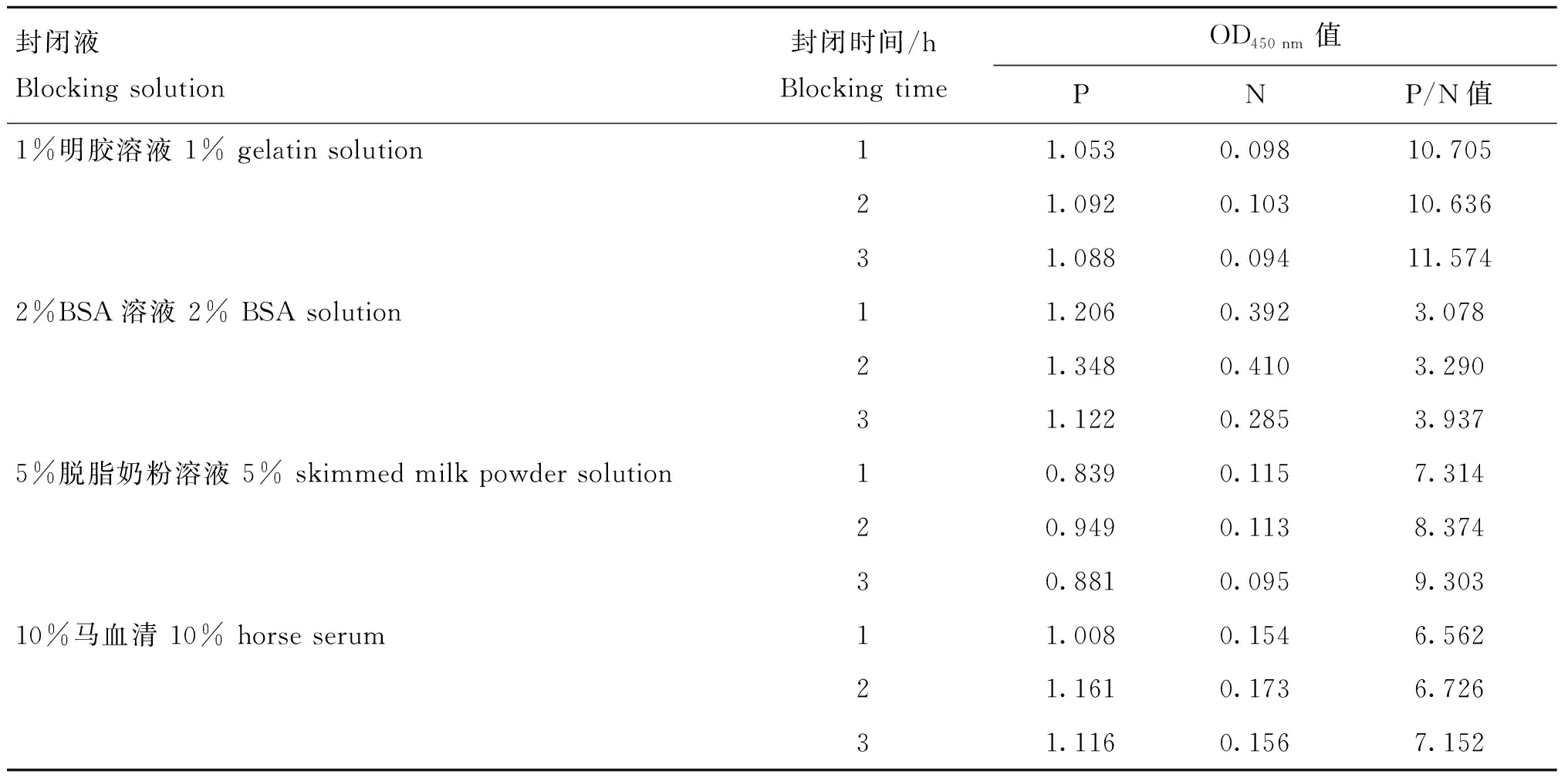
表5 最佳封闭液条件的确定
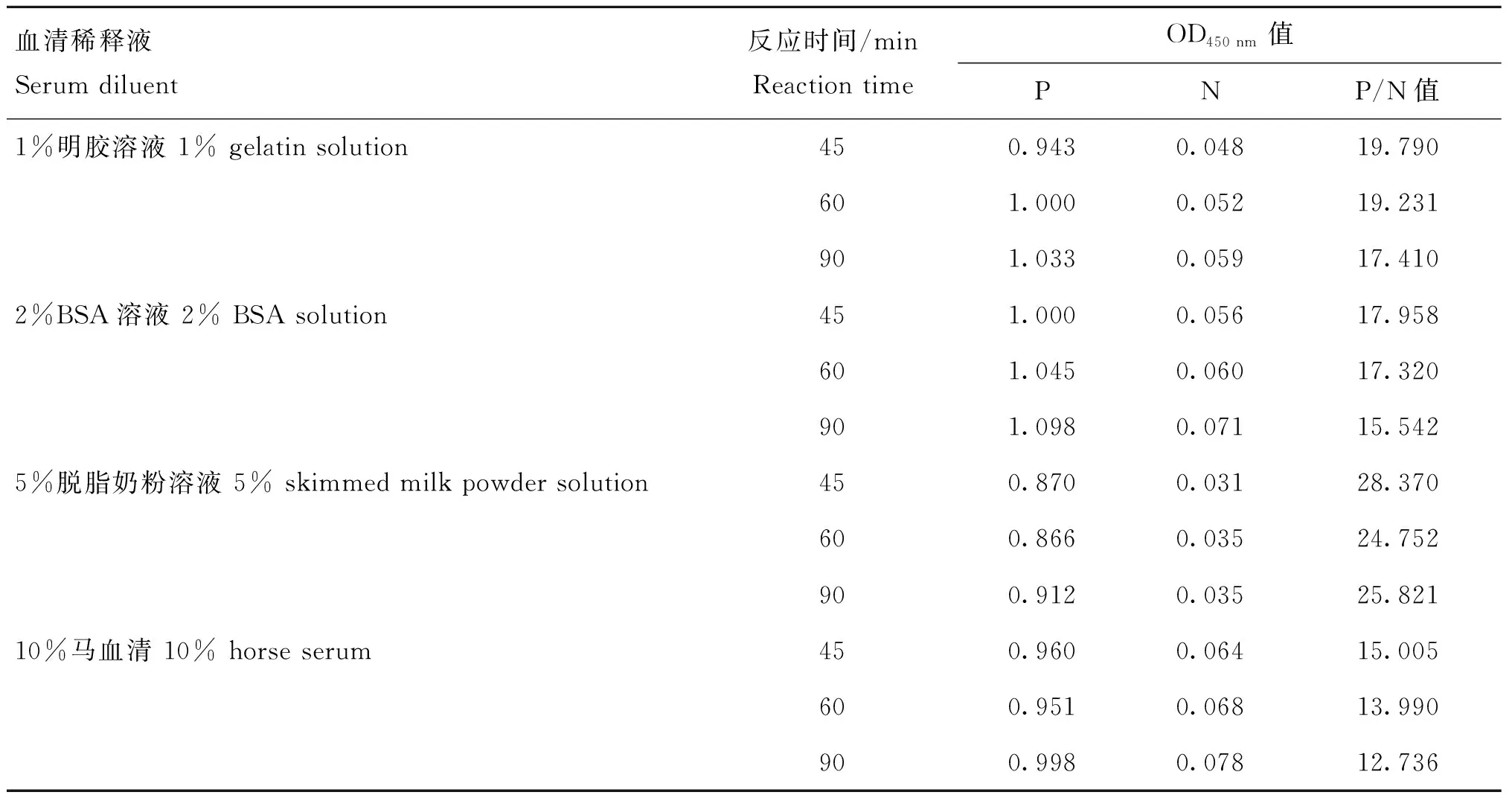
表6 最佳血清稀释液及作用时间的确定

表7 间接ELISA的操作流程
2.6 间接ELISA方法的特异性分析
采用本研究建立的间接ELISA方法分别检测CSFV、PRRSV、PCV2、PPV与PRV抗体阳性血清样本,结果如图6a所示,该方法能特异性检测ASFV抗体血清,具有良好的特异性。
2.7 间接ELISA方法的敏感度分析
利用建立的间接ELISA方法检测倍比稀释的ASFV阳性血清(稀释倍数为1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200),结果显示,该方法最低可检测到1∶1 600稀释的阳性血清样本(图6b)。
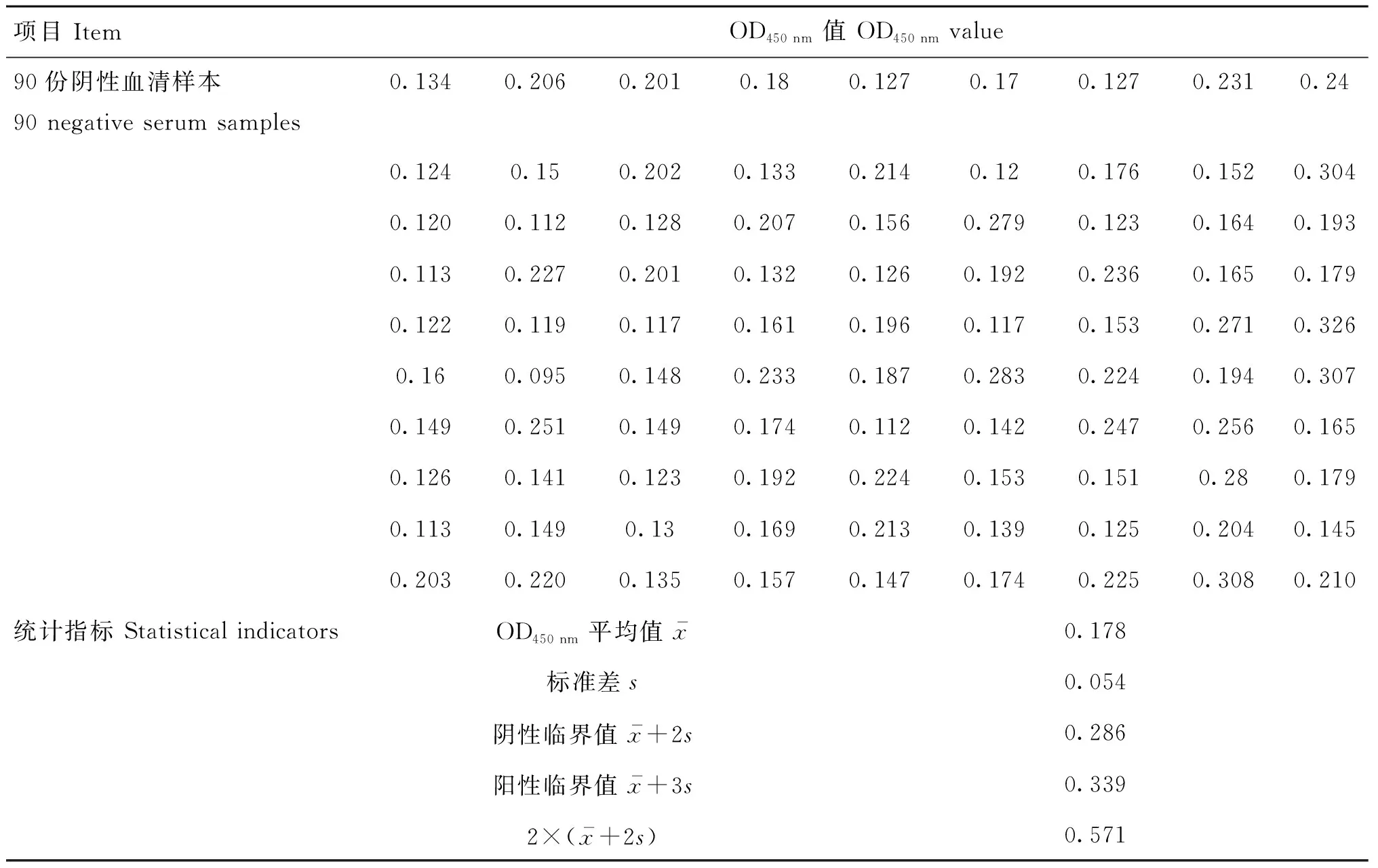
表8 阴性血清样本在优化条件下检测的OD值


图6 间接ELISA特异性(a)和敏感度(b)试验结果Fig.6 The specificity (a) and sensitivity (b) test results by the indirect ELISA
2.8 间接ELISA方法的重复性分析
利用建立的间接ELISA方法对9份血清样本的批内及批间重复试验的变异系数均小于10%(表9),表明该方法具有较好的重复性。
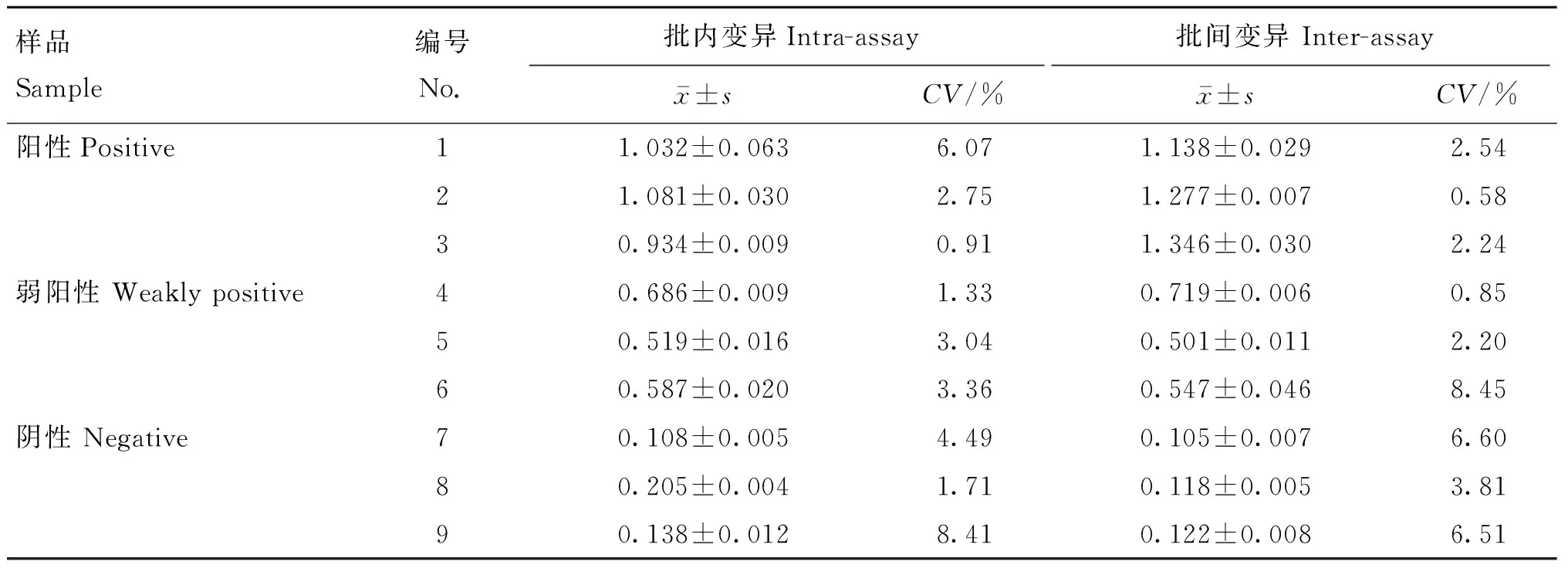
表9 间接ELISA方法的重复性试验结果
2.9 临床样本检测与符合率试验
用本研究建立的间接ELISA方法与北京金诺公司生产的ASFV抗体检测试剂同时检测320份猪血清样品。统计结果并利用SPSS软件分析评估,图7结果显示,该方法与商品化试剂盒的相对敏感性为97.3%;相对特异性为97.6%(P<0.001);两者总体符合率达97.5%(表10)。
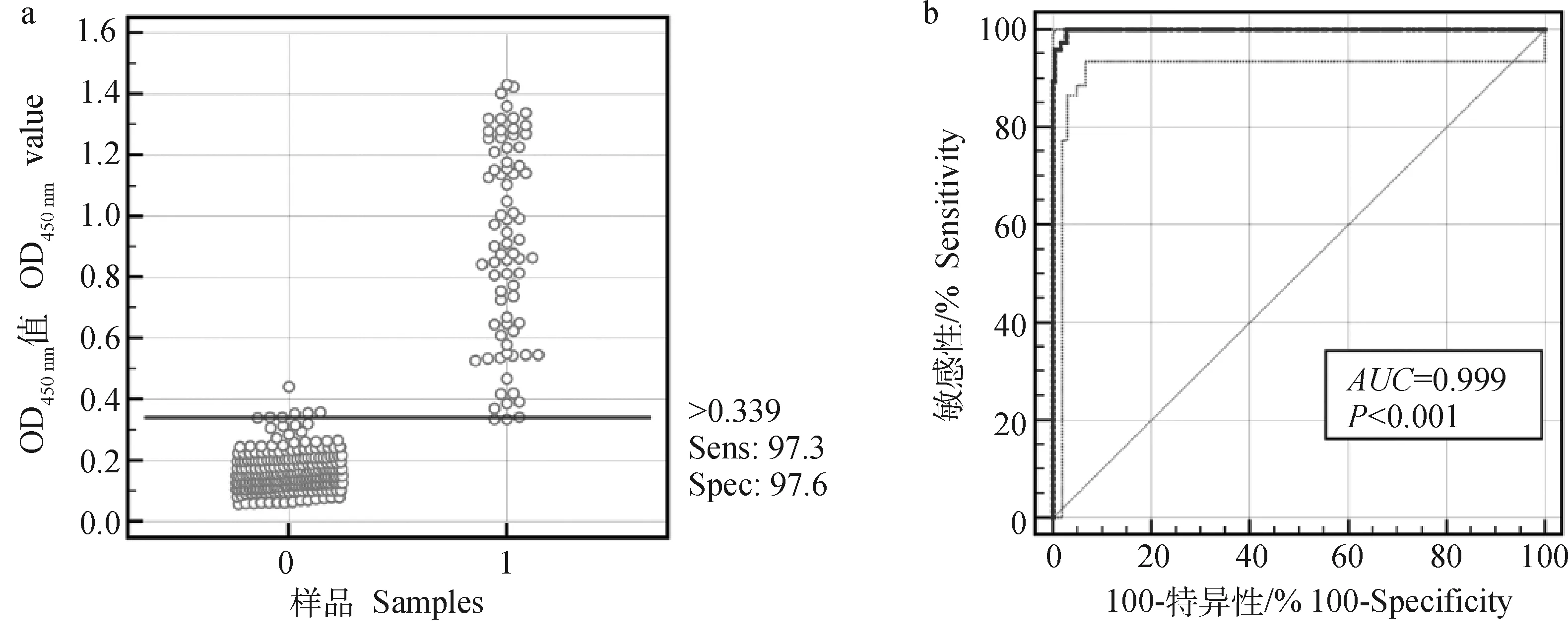
a. 间接ELISA检测的散点图,“0”和“1”分别表示商品化试剂盒检测为阴性和阳性的血清样本(n0=244,n1=76);b. 间接ELISA检测结果的ROC分析a. Dot plot of the indirect ELIS, “0” and “1” represent negative and positive samples detected by commercial kit, respectively (n0=244,n1=76); b. ROC analysis of indirect ELISA result图7 临床血清样品的间接ELISA检测结果Fig.7 Indirect ELISA results of clinical serum samples
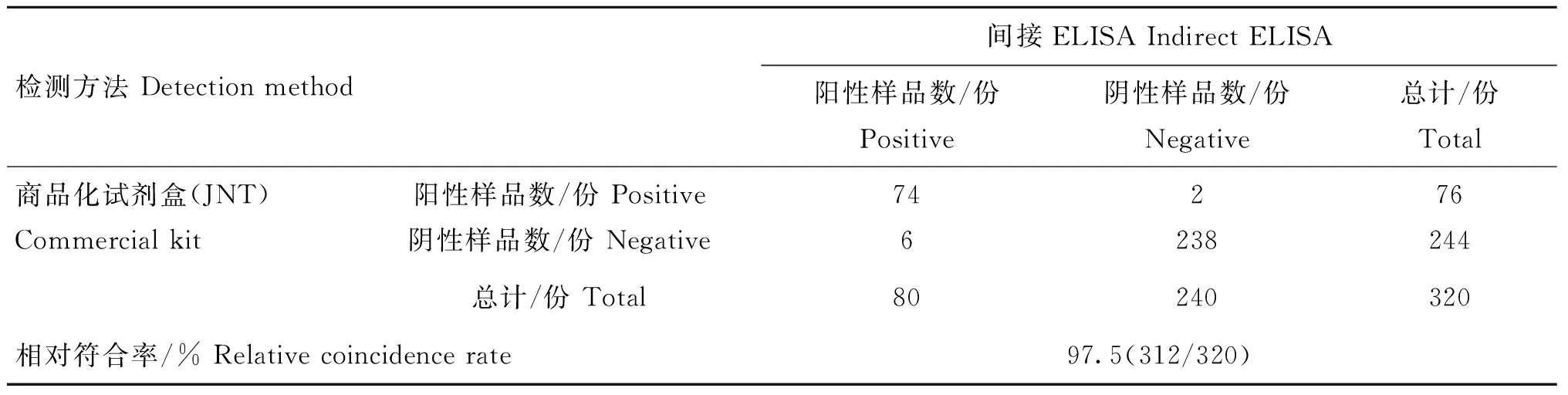
表10 间接ELISA与商品化试剂盒符合率试验结果
3 讨 论
仅依据感染猪的临床症状对ASF进行诊断,容易和经典猪瘟(CSF)、高致病性猪繁殖与呼吸综合征(HP-PRRS)等具有相似临床症状的疫病混淆,因此要辅助采取实验室检测方法进行最终诊断[19-20]。其中,以抗体ELISA检测为代表的血清学诊断方法具备良好的诊断特异性与敏感性,已被广泛应用于非洲猪瘟的监测和防控工作中[21-22]。当猪被低毒力毒株感染时,高特异性与灵敏度的血清学诊断可能是监测被感染动物的最佳方法。因此,研发出高质量的血清学诊断试剂具有十分重要的意义。
ELISA作为世界动物卫生组织推荐的ASFV血清学检测方法,目前常用p30、p54、p72与p62等蛋白作为商业化试剂盒主要的包被抗原,且常见的诊断抗原分子多为全蛋白[14, 23],表达与纯化等生产工艺烦琐,容易造成非特异性识别。本研究应用合成的表位串联多肽分子作为诊断抗原,抗原成分单一,合成工艺成熟,保证了检测的敏感性与特异性,常被用于相关病原的ELISA诊断方法研究。
ASFV p30和p54蛋白作为重要的抗原结构蛋白,其抗原核心区域已被广泛研究。Wu等[24]利用抗原截短与表位作图的方法鉴定出了ASFV Georgia/2007株p30蛋白的4个独立的线性表位,其中位于116—125 aa的抗原区在宿主抗体反应中具有免疫优势。Murgia等[25]联合使用ASFV OURT88/3株及真核表达ASFV BA71V株p30蛋白的免疫血清鉴定了位于111—130 aa的免疫优势区域。曹琛福[17]利用生物信息分析工具结合ASFV标准血清验证了TAN/08株p54蛋白的抗原位点为114HPTEPYT120。高瞻[26]利用生物信息预测与合成多肽验证鉴定了与ASFV阳性血清具有较高反应原性的ASFV/HLJ/2018株p54蛋白145—151 aa区域。本研究通过新型的生物淘选方法筛选得到的p30(116TSSFETLFE124)和p54(143PAHPAEPYTT152)蛋白表位多肽再次验证了上述结果,且两段表位多肽序列在不同基因型毒株间的保守度高,有利于发展免疫学诊断方法。
本试验以上述鉴定的两段表位为基础,设计串联多肽抗原,验证并选取了N端偶联OVA的表位串联多肽为诊断抗原,成功建立了能够特异性检测ASFV抗体的间接ELISA方法。
4 结 论
以噬菌体生物淘选方法获得1株ASFV p54蛋白mAb所识别的抗原表位(143PAHPAEPYTT152),结合本课题组已发表的p30蛋白抗原表位筛选结果,建立了以ASFV p30与p54蛋白的表位串联多肽作为诊断抗原的间接ELISA方法。应用该方法检测临床血清样本,与商品化试剂盒检测结果的符合率为97.5%。该研究结果可为ASFV免疫学诊断方法提供新的思路,为ASFV的防控提供科学工具。

