非洲猪瘟病毒p30蛋白单克隆抗体的制备及阻断ELISA抗体检测方法的建立
周改静,罗俊聪,石正旺,万 颖,杨 波,曹丽艳,宋 锐,田 宏,郑海学
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 OIE/国家口蹄疫参考实验室,兰州 730046)
非洲猪瘟病毒(African swine fever virus,ASFV)是一种有囊膜的大型DNA双链病毒,是非洲猪瘟病毒科非洲猪瘟病毒属的唯一成员,也是目前唯一已知的虫媒DNA病毒[1-2]。野猪感染后一般形成持续性感染而不表现任何疾病形式,而家猪常表现为高热、皮肤发绀、内脏器官出血、淋巴结肿大等症状[3-4],且死亡率高达100%。由于ASFV基因组庞大,编码蛋白复杂,免疫逃逸机制尚不清楚等[5],迄今为止,全球范围内仍没有可用的商品化疫苗,非洲猪瘟(African swine fever,ASF)的防控及净化仍面临着巨大挑战,因此,早期、快速、准确的检测仍是目前国内外ASF防控的重要环节。
在目前已知的50多种ASFV结构蛋白中,p30、p54及p72因具有良好的免疫原性及保守性,是目前ASF血清学诊断的主要靶标[6]。其中,p30蛋白由CP204L基因编码,位于内囊膜上,是ASFV最具有免疫原性的蛋白之一[4,7],能诱导机体产生具有一定中和作用的抗体[8],研究表明,在感染后7~10 d即可产生该抗体,且持续时间较长[9]。此外,p30是一个早期表达蛋白,研究表明,在感染后2 h便可检测到该蛋白,并持续整个感染周期[10],与其他蛋白相比,具有更高的抗体检测效率,大大提高了阴性血清和阳性血清的区分能力[11]。综上所述,p30是用于ASFV抗体检测的一个良好靶标蛋白。
本研究将ASFVCP204L基因进行原核表达,并成功制备出1株具有良好阻断效果的p30单克隆抗体,以此为基础,建立了一种阻断ELISA抗体检测方法,可用于ASFV的感染诊断及流行病学调查,为ASF的防控提供一种有效的检测方法。
1 材料与方法
1.1 材料
pET-32a载体、SP2/0细胞、MA104细胞、ASFV阴性血清、猪瘟病毒(CSFV)阳性血清、O型口蹄疫病毒(FMDV-O)阳性血清、A型口蹄疫病毒(FMDV-A)阳性血清、猪繁殖与呼吸综合征病毒(PRRSV)阳性血清、猪流行性腹泻病毒(PEDV)阳性血清、塞内卡病毒(SVA)阳性血清均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;ASFV CN/GS/2018分离株、ASFV灭活阳性血清及208份灭活猪血清样品均由国家非洲猪瘟区域实验室(兰州)提供;ASFV基因缺失弱毒株由本实验室制备[12];BALB/c小鼠购自中国农业科学院兰州兽医研究所实验动物中心;ASFV阻断ELISA抗体检测试剂盒购自西班牙Ingenasa公司;HRP Conjugation Kit-Lighting-Link®试剂盒购自Abcam公司;Ni柱亲和层析树脂购自OMEGA公司。
1.2 p30重组蛋白的制备及鉴定
将ASFVCP204L基因(GenBank ID:MK128995.1)构建至pET-32a载体中,将重组质粒pET-32a-p30转化至E.coliBL21感受态细胞中。挑取单克隆菌落于含氨苄青霉素的LB培养基中培养,并用IPTG进行诱导表达。收集菌体,用PBS洗涤2次,超声破碎后分离上清和沉淀,通过SDS-PAGE分析可溶性。用缓冲液(50 mmol·L-1Tris-HCl、2 mmol·L-1EDTA及100 mmol·L-1NaCl溶于PBS,pH 7.4)对菌体沉淀进行重悬并超声,重复5次后,用8 mol·L-1尿素对沉淀进行溶解,并于4 ℃过夜透析至4 mol·L-1浓度。将溶解的包涵体蛋白加入平衡液平衡后的Ni柱中结合3~5 min,用50 mmol·L-1咪唑洗杂6次,100 mmol·L-1咪唑洗杂5次,最后用250 mmol·L-1咪唑洗脱目的蛋白。用SDS-PAGE分析纯化结果,用Western blot鉴定与ASFV阳性血清的反应活性。
Western blot:用纯化的p30重组蛋白进行SDS-PAGE,并转印至NC膜上;5%脱脂乳室温封闭2 h;用ASFV阳性血清(1∶500)4 ℃过夜孵育;PBST洗涤30 min,用HRP标记的猪二抗(1∶1 000)室温孵育1 h;PBST洗涤30 min,显色液曝光。
1.3 p30单克隆抗体的制备及鉴定
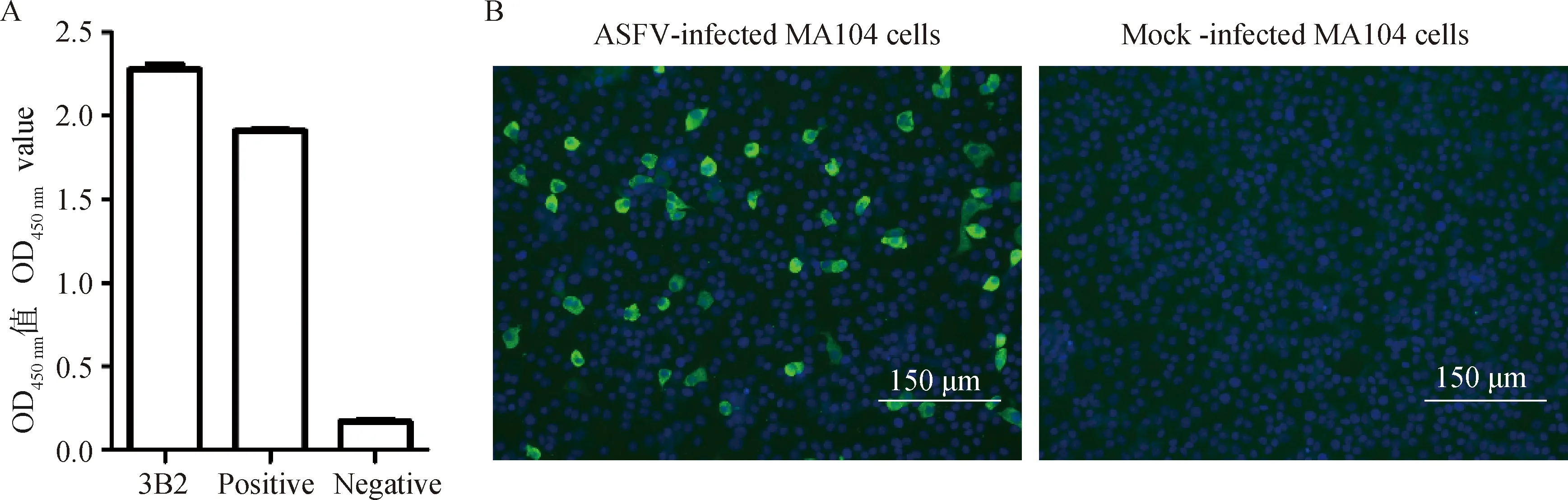
用纯化的p30重组蛋白以100 μg·只-1的剂量免疫6~8周龄的BALB/c小鼠,免疫3次,间隔2周。取免疫小鼠脾细胞与骨髓瘤细胞SP2/0融合[13],采用间接ELISA及间接免疫荧光(IFA)方法筛选阳性杂交瘤细胞株。通过有限稀释法对单克隆阳性孔进行3次亚克隆。对稳定分泌p30单抗的阳性孔进行扩大培养,并制备腹水。腹水单抗用正辛酸-饱和硫酸铵法进行纯化,并进行HRP标记。
间接ELISA:用纯化的p30重组蛋白以2 μg·mL-1的浓度包被酶标板(50 μL·孔-1);将杂交瘤细胞上清加入检测孔中(50 μL·孔-1),并设置阳性对照(融合鼠血清,1∶500)及阴性对照(SP2/0细胞上清),37 ℃孵育30 min;PBST洗4次并拍干,加入HRP标记的鼠二抗(1:20 000,50 μL·孔-1),37 ℃孵育30 min;PBST洗4次并拍干,加入TMB(50 μL·孔-1),37 ℃显色12 min(避光);加入终止液(50 μL·孔-1),酶标仪读取OD450 nm值。
IFA:用1 MOI的ASFV CN/GS/2018分离株感染MA104细胞,同时设置阴性对照;培养48 h后弃培养基,加入4%多聚甲醛,室温固定30 min;PBS洗3次,加入0.1% Triton,室温通透10 min;PBS洗3次,加入5% BSA,室温封闭1 h;PBS洗1次,加入杂交瘤细胞上清,4 ℃过夜孵育;PBST洗3次,加入FITC标记的鼠二抗(1∶100),室温孵育1 h;PBST洗3次,用DAPI染核10 min。置于荧光显微镜下观察荧光并拍照。
1.4 p30阻断ELISA方法的建立及反应条件的优化
根据方阵滴定法,用碳酸盐缓冲液(pH 9.6)将p30重组蛋白从16 μg·mL-1倍比稀释至0.125 μg·mL-1,分别包被至酶标板,50 μL·孔-1,4 ℃包被12 h;PBST洗4次并拍干,加入1% BSA,120 μL·孔-1,4 ℃封闭10 h;弃液并拍干。将ASFV阴、阳性血清用1% BSA分别作0、1∶2、1∶5、1∶10稀释,同时设置空白对照孔(PBST),50 μL·孔-1,每个稀释度重复3孔,37 ℃孵育30 min;PBST洗4次并拍干,加入1∶20 000稀释的酶标单抗,50 μL·孔-1,37 ℃孵育30 min;PBST洗4次并拍干,加入TMB(50 μL·孔-1),37 ℃显色12 min(避光);加入终止液(50 μL·孔-1),酶标仪读取OD450 nm值。
根据阻断率(percentage inhibition,PI)公式:PI(%)=(1-OD450 nm待检血清/OD450 nm空白对照)×100,计算PPI(阳性阻断率)和NPI(阴性阻断率)。并根据公式:DPI=PPI-NPI,计算DPI(阻断率差值)。选择DPI值最高的反应条件作为最佳抗原包被浓度和血清稀释度。
按照上述操作步骤,以确定的最佳抗原包被浓度和血清稀释度继续对最佳封闭液(1% BSA、5%脱脂乳、1%明胶)、血清孵育时间(15、30、45、60 min)、酶标单抗稀释度(1∶5 000、1∶10 000、1∶20 000、1∶30 000、1∶40 000、1∶50 000)、酶标单抗孵育时间(15、30、45、60 min)、底物显色时间(5、10、15、20 min)等条件进行优化。
1.5 阻断ELISA方法临界值的确定
按照已优化的阻断ELISA条件检测155份血清样品(62份ASFV灭活阳性血清和93份ASFV阴性血清),计算每份样品的PI值。用SPSS 23.0 软件将PI值绘制成纵坐标为敏感性、横坐标为(1-特异性)的ROC(receiver operating characteristic)曲线,并以Youden指数[Youden指数=敏感性-(1-特异性)]最大时对应的PI值为临界值(cut-off值)[14-15]。
1.6 阻断ELISA方法特异性检测
按照已优化的阻断ELISA条件检测CSFV、FMDV-O/A、PRRSV、PEDV、SVA阳性血清,同时设置ASFV阳性血清作为对照,每份样品重复2次,计算PI值,评价该方法的特异性。
1.7 阻断ELISA方法敏感性检测
将ASFV阳性血清从原液开始倍比稀释至1∶2 048,用本研究建立的阻断ELISA方法与Ingenasa 公司生产的ASFV阻断ELISA抗体检测试剂盒同时进行检测,分析该方法的敏感性。
1.8 阻断ELISA方法重复性检测
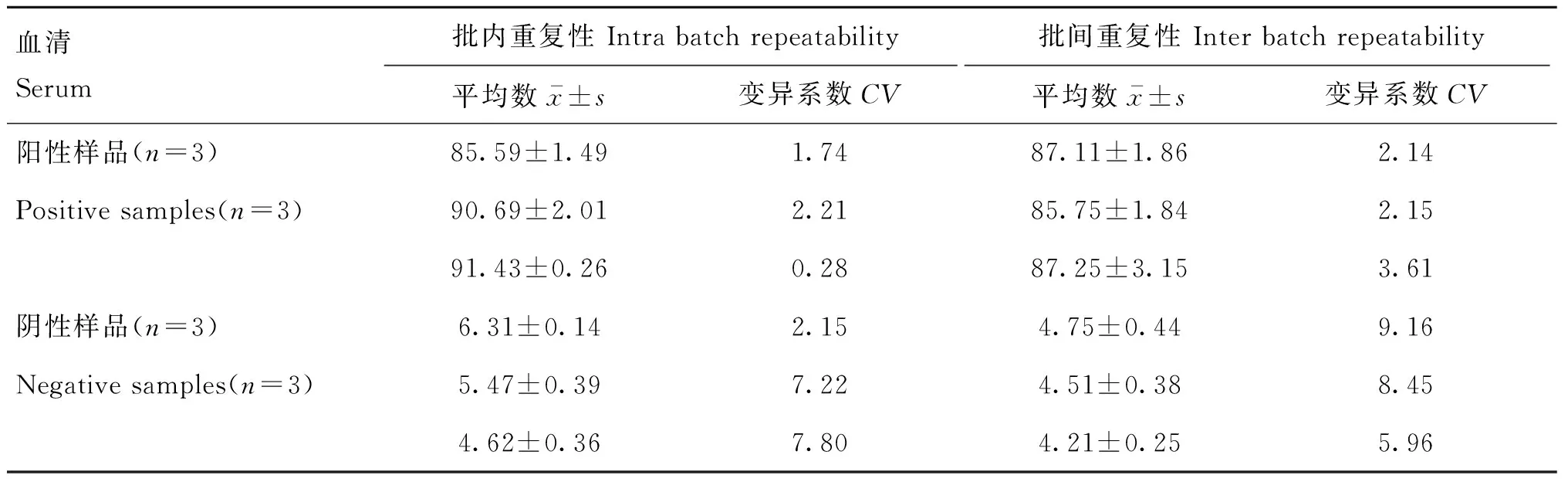
用同一批次包被的酶标板检测随机挑选的3份阳性血清和3份阴性血清,计算批内变异系数。并用3批次包被的酶标板对这6份血清进行检测,计算批间变异系数。每个血清设置2个重复。
1.9 p30抗体检测
为掌握p30抗体消长规律,用本方法对ASFV基因缺失弱毒株攻毒后的猪血清进行追踪检测。5头猪编号分别为:Pig 1、Pig 2、Pig 3、Pig 4、Pig 5,分别于攻毒后第1~17天采集血清,间隔1 d。
1.10 临床样品检测
用本研究建立的阻断ELISA方法与Ingenasa 公司生产的ASFV阻断ELISA抗体检测试剂盒同时检测208份猪血清,根据公式[16]计算Kappa值。若0 SDS-PAGE分析显示,该原核表达的p30重组蛋白主要以包涵体的形式存在(图1A),分子量约为45 ku,且Ni柱纯化后具有较高的纯度(图1B);Western blot结果显示,纯化后的p30蛋白与ASFV阳性血清具有良好的反应性(图1C)。 用间接ELISA及IFA对杂交瘤细胞上清进行鉴定,并通过有限稀释法对阳性孔进行3次亚克隆,最终获得1株p30单抗,命名为3B2。间接ELISA结果显示,该株单抗与p30蛋白具有良好的反应性(图2A);IFA结果显示,该株单抗与ASFV具有良好的反应性(图2B)。 M. 蛋白质分子质量标准;1. pET-32a-p30未诱导菌;2. pET-32a-p30诱导菌;3. pET-32a-p30诱导菌超声上清;4. pET-32a-p30诱导菌超声沉淀;5. 纯化后的p30重组蛋白M. Protein marker;1. Non-induced pET-32a-p30; 2. Induced pET-32a-p30; 3. Ultrasonic supernatant of induced pET-32a-p30; 4. Ultrasonic precipitation of induced pET-32a-p30; 5. Recombinant p30 protein after purification图1 p30重组蛋白的SDS-PAGE分析(A、B)及Western blot鉴定(C)Fig.1 Identification of recombinant p30 protein with SDS-PAGE (A, B) and Western blot (C) 图2 p30单克隆抗体的间接ELISA(A)及IFA(B)鉴定Fig.2 Identification of p30 monoclonal antibody with indirect ELISA(A) and IFA(B) 经条件优化,确定了该阻断ELISA方法的最佳反应条件,如下:抗原最佳包被浓度为2 μg·mL-1,4 ℃包被12 h;最佳封闭液为1% BSA,4 ℃封闭10 h;待检血清最佳稀释度为原液,最佳孵育时间为37 ℃下孵育30 min;酶标单抗最佳稀释度为1∶20 000,最佳孵育时间为37 ℃下孵育30 min;底物溶液最佳显色时间为37 ℃下避光显色15 min。 按照优化的反应条件检测62份阳性血清和93份阴性血清,读取OD450 nm值并计算PI值。用SPSS 23.0将PI值绘制成ROC曲线(图3),计算每个cut-off值对应的Youden指数。结果显示,当PI临界值为16.63%时,Youden指数达到最大值0.98,此时灵敏度为98%,特异性为100%(表1),表明此时本方法具有较好的检测准确性,因此,该方法的临界值定为16.63%。 图3 ROC曲线Fig.3 ROC curve 用本研究建立的阻断ELISA方法同时检测ASFV、CSFV、FMDV-O/A、PRRSV、PEDV、SVA阳性血清,结果显示CSFV、FMDV-O/A、PRRSV、PEDV、SVA阳性血清的PI值均低于16.63%,ASFV阳性血清的PI值远高于16.63%(图4),表明该方法的特异性良好,与其他6种常见的猪病原无交叉反应。 用本研究建立的阻断ELISA方法和Ingenasa 公司的阻断ELISA抗体检测试剂盒同时检测从原液倍比稀释至1∶2 048的ASFV阳性血清,结果显示,本研究建立的阻断ELISA方法最低能检测到1∶128稀释的ASFV阳性血清,Ingenasa公司的阻断ELISA抗体检测试剂盒最低可检测到1∶256稀释的ASFV 阳性血清(图5),两者相差一个稀释度,表明本方法敏感性良好。 表1 不同临界值下的敏感性和特异性 图4 阻断ELISA特异性检测结果Fig.4 The specificity results of blocking ELISA 图5 本方法与Ingenasa 阻断ELISA敏感性检测结果Fig.5 The sensitivity results of the blocking ELISA method established in this study and the Ingenasa method 用本研究建立的阻断ELISA方法检测3个阳性血清和3个阴性血清,进行批内和批间试验,结果显示,批内变异系数为0.28%~7.80%,批间变异系数为2.14%~9.16%,批内、批间变异系数均小于10%(表2),表明该方法具有良好的重复性。 由图6抗体消长曲线可知,5头猪在攻毒后第7天开始产生免疫应答,第9天抗体均转阳,之后抗体水平逐渐升高,与之前的研究报道[9]基本一致。 表2 重复性试验结果 图6 p30抗体消长曲线Fig.6 The curve of p30 antibody growth and decline 用本研究建立的阻断ELISA方法与商品化的Ingenasa ASFV阻断ELISA抗体检测试剂盒同时检测208份猪血清样品,根据公式计算Kappa值。结果显示,Kappa值为0.96>0.75,表明本研究建立的阻断ELISA方法与商品化试剂盒具有高度一致性(表3)。 表3 比对试验结果 ASFV感染家猪后致死率可高达100%,而我国作为世界上最大的生猪养殖和消费国,近年来受到该病的毁灭性打击[18]。在没有有效疫苗及治疗性药物的形势下,早期的诊断检测对ASF防控至关重要。随着疫病的发展和流行,国内耐过猪、亚临床症状的长期感染猪及弱毒性的基因突变缺失毒株不断出现,单一的病原学检测或血清学检测已不能满足对ASFV感染猪进行监测的需要,联合核酸检测与血清学抗体检测的方法成为新形势下我国ASF防控与净化的重要手段,但国内尚无批准的抗体检测试剂盒,国外有西班牙Ingenasa公司、瑞典Svanova公司和法国ID Vet公司生产的试剂盒[19-20],但价格都比较昂贵,因此,亟需研制出国内可用的,精准、快速的ASFV抗体检测方法。 p30蛋白因具有免疫原性好、保守性好、早期表达且长期存在等特点,成为ASFV诊断检测的重要靶点。2000年Barderas等[21]及2006年Pérez-Filgueira等[22]均基于p30蛋白建立了与OIE推荐方法敏感性相当且特异性更好的ELISA检测方法,2016年Giménez-Lirola等[9]基于p30蛋白建立了可检测感染后8~10 d血清和口腔液中ASFV抗体的间接ELISA方法,2021年于浩洋等[23]基于真核表达的p30蛋白也建立了具有良好特异性和敏感性的阻断ELISA方法。此外,p30蛋白也已被应用到商品化ELISA检测试剂盒中,例如ID-Vet公司研制的ASFV间接及竞争ELISA抗体检测试剂盒。 本研究建立的p30阻断ELISA检测方法与同年于浩洋等[23]建立的相比,待检血清及酶标二抗孵育时间均减少一半,且待检样品无需稀释,总的检测时间相对缩短1 h,与Ingenasa公司生产的ASFV阻断ELISA抗体检测试剂盒相比也减少了至少0.5 h。本方法的临界值是由ROC曲线分析所得,ROC曲线是用真阳性率(敏感性)和假阳性率(1-特异性)作图所得出的[24],它可表示灵敏度和特异度之间的相互关系。然后通过计算Youden指数来筛选该方法的最佳临界值,Youden指数=敏感性-(1-特异性),Youden指数越大,所对应的临界值越具有真实性[15, 25]。这种方法与阴性对照平均值±2SD或3SD确定临界值的方法相比,权衡了敏感性与特异性,所确定的临界值最大可能地降低了假阳性与假阴性之和[26],因此是目前最具有科学性的一种临界值确定方法。本方法的Youden指数最大为0.98,此时,敏感性为98%、特异性为100%,所对应的阻断率即临界值为16.63%,这表明该方法具有较好的阴性和阳性血清区分能力。 研究结果表明,本方法具有较好的特异性,与目前猪场常见的其他6种猪病毒的阳性血清均不发生交叉反应;最低可以检测出1∶128稀释的阳性血清;批内及批间变异系数均小于10%,具有良好的重复性。Kappa统计量作为一种矫正机遇可能后衡量一致性的方法,在兽医实验室中评估两种检测方法、两台仪器设备等的符合程度及同一种方法多次测定结果是否可以重现方面均有适用性,Kappa值越大,表明两者的一致性越高。本研究用Kappa值来评估本方法与商品化试剂盒检测结果的一致性,与国内同类研究相比排除了机遇因素,更具有科学依据[17]。此外,利用本方法追踪检测ASFV基因缺失弱毒株攻毒后的血清抗体水平,数据显示攻毒后第9天抗体均为阳性,这与之前研究报道[9]基本一致,进一步说明本方法可用于ASFV感染动物的检测以及猪群ASFV抗体的监测。 本研究利用原核表达系统成功表达了p30蛋白,并筛选到1株具有良好阻断效果的p30单克隆抗体;基于该蛋白及阻断单克隆抗体成功建立了一种操作简便、快速,且具有良好特异性、敏感性及重复性的阻断ELISA方法。本方法与商品化试剂盒相比具有高度一致性,可用于ASF的临床样品检测、流行病学调查及猪群免疫水平监测。本方法将进一步优化测试以形成商品化的ASFV抗体检测试剂盒,为我国ASF的防控提供技术支撑。2 结 果
2.1 p30重组蛋白的纯化及鉴定
2.2 p30单克隆抗体的制备及鉴定

2.3 阻断ELISA方法最佳反应条件的确定
2.4 阻断ELISA方法临界值的确定

2.5 阻断ELISA方法特异性检测
2.6 阻断ELISA方法敏感性检测



2.7 阻断ELISA方法重复性检测
2.8 p30抗体检测

2.9 临床样品检测

3 讨 论
4 结 论

