Pim1调控巨噬细胞M1型极化介导血管内皮细胞炎症在ApoE-/-小鼠动脉粥样硬化中的作用*
钟耕瑞,付萌萌,王小波,王汉琴△
(1湖北医药学院基础医学院解剖学教研室,湖北 十堰 442000;2湖北医药学院附属随州医院转化医学研究中心,湖北 随州 441300)
动脉粥样硬化(atherosclerosis,AS)是一种常见的血管慢性炎症疾病,其发病机制与内皮细胞损伤和巨噬细胞的浸润等因素有关[1-2]。研究表明,巨噬细胞作为斑块中炎症因子的主要来源,受不同环境因子刺激可分化为具有不同功能和细胞表面标记的亚型,主要为经典活化M1型和选择活化M2型,其功能表型影响AS进展及转归,其中,M1型巨噬细胞通过产生和分泌促炎因子,与内皮细胞之间相互作用,损伤内皮引发或加重炎症反应[3]。
Pim1属于丝氨酸/苏氨酸蛋白激酶Pim家族成员[4]。研究表明,Pim1可通过磷酸化多种炎症蛋白底物在炎症信号转导中起作用,参与多种炎症性疾病的发生[5-6]。新近的研究发现,抑制Pim1可以抑制脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞上清液中炎症细胞因子的产生[7-8],但是,Pim1是否对巨噬细胞极化有调控作用?目前尚不清楚。
本研究用LPS诱导小鼠Raw264.7细胞建立M1型巨噬细胞模型,用其上清作为条件培养液孵育人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),体外模拟内皮细胞在AS中的炎症环境。在动物水平,用ApoE-/-小鼠颈动脉局部结扎术建立小鼠颈动脉AS斑块模型。检测Pim1对M1巨噬细胞极化的调节,及对内皮细胞血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin)、细胞间黏附分子1(intercellular adhesion molecule 1,ICAM1)和血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM1)表达的影响。本研究通过体外和体内实验,旨在观察Pim1是否通过调节巨噬细胞M1型极化介导内皮炎症反应,并初步探讨Pim1在ApoE-/-小鼠AS发生中的作用,以期为AS发生机制研究提供参考。
材料和方法
1 细胞及试剂
小鼠来源的巨噬细胞Raw264.7购自中科院上海细胞所;Trizol和Lipofectamine™3000购于Invitrogen;K1621逆转录试剂盒购于Thermo;iTaqTMUniversal SYBR Green Supermix购自Bio-Rad;M199和DMEM培养液购自Gibco;血清购自天杭生物科技公司;酸性成纤维细胞生长因子购自Sigma;LPS和SMI-4a购自上海陶术生物科技有限公司;VE-cadherin抗体购自Abcam;Pim1抗体购自Novus;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、ICAM1和VCAM1抗体购自Immunoway;β-tubulin抗体和辣根酶标记的羊抗兔、羊抗鼠Ⅱ抗购自武汉安特捷生物技术有限公司;ApoE-/-小鼠由湖北医药学院胚胎干细胞实验室郭兴荣教授课题组惠赠。
2 方法
2.1 HUVECs的培养及鉴定取新鲜脐带(湖北医药学院附属随州医院产科提供,标本采集经过患者家属知情同意及医院伦理委员会批准),37℃的PBS冲洗脐静脉3次,0.125%胰酶注入脐静脉消化内皮细胞10 min,含血清的M199终止消化离心重悬,接种到多聚赖氨酸包被的培养瓶中,加入内皮细胞培养液(500 mL的M199全细胞培养液中含有100 mmol/L HEPES、10 nmol/L胸苷、2 mmol/L谷氨酰胺、4 g/L酸性成纤维细胞生长因子、5 000 U/L肝素和100 mL血清),置于37℃、5% CO2培养箱中静置12 h,待细胞完全贴壁后更换新的培养液;5~7 d细胞至融合状态消化传代,血管内皮标志物Ⅷ因子免疫荧光鉴定,取第3~5代细胞进行实验。
2.2 小鼠颈动脉AS模型的建立SPF级6周龄雄性ApoE-/-小鼠27只,体质量(25±1)g,许可证号为SCXK(苏)2016-0004,经湖北医药学院实验动物委员会批准。参考文献[9]行左侧颈动脉(left carotid artery,LCA)部分结扎术建模。5%水合氯醛(50 mg/kg)麻醉小鼠,仰卧位固定于无菌操作台,颈前正中线切开皮肤,小心分离其颈前腺体,左侧下颌处钝性分离颈动脉4分支,7-0丝线结扎左颈内、颈外和枕后动脉,只保留甲状腺上动脉,缝合颈前腺体和皮肤,尾静脉注射抗生素预防感染。建模成功后的小鼠随机分为两组,每组9只,SMI-4a干预组每周尾静脉注射75 mg/kg的SMI-4a,模型(model)组每周尾静脉注射等体积DMSO;两组小鼠8周龄改高脂饮食饲养,2个月后小鼠安乐死,收获左右侧颈动脉,-80℃保存备用。
2.3 siRNA干扰实验搜索GenBank中小鼠Pim1基因全长cDNA序列,委托广州锐博生物科技有限公司设计合成特异性siPim1序列及阴性对照(negative control,siNC)RNA序列,Pim1正义链5′-GTGTCAGC ACCTTATTAAA-3′,反义链5′-TTTAATAAGGTGCTGACAC-3′。待6孔 板 中Raw264.7细 胞 融 合 度 达50%,更换为OptiMEM培养液,Lipofectamine™3000转染siRNA,实验操作按照说明书进行。
2.4 巨噬细胞分组与干预(1)M1型巨噬细胞的诱导极化:使用终浓度20 nmol/L的LPS诱导Raw264.7细胞,作用时间为24 h,使细胞向M1表型极化,为M1型巨噬细胞实验(LPS)组;用DMSO孵育的Raw264.7细胞为M0巨噬细胞对照(control)组。(2)巨噬细胞干预实验:用终浓度50 nmol/L的Pim1抑制剂SMI-4a孵育Raw264.7细胞后,再用LPS诱导24 h,为LPS+SMI-4a组;Raw264.7细胞转染siPim1和siNC后,再用LPS诱导24 h,为LPS+siPim1组和LPS+siNC组。
2.5 巨噬细胞条件培养液(conditioned medium,CM)的制备M1型、M0型、SMI-4a组、siNC组和siPim1组巨噬细胞经PBS洗2次,更换新的含10%血清的DMEM培养液继续培养12 h,收集培养液上清作为CM,即CMM1、CMM0、CMSMI-4a、CMsiNC和CMsiPim1,用于孵育HUVECs。
2.6 油红O染色左右颈动脉组织或者冰冻切片4%多聚甲醛固定20 min,PBS洗两次,60%异丙醇分化90 s,油红O染色20~60 min,60%异丙醇洗掉背景色,拍照记录。
2.7 免疫荧光染色-80℃取出实验组和对照组小鼠颈动脉,冰冻切片,-20℃保存;HUVECs消化重悬接种于多聚赖氨酸包备的玻片,加入CM孵育24 h,吸干培养液,PBS洗2次。切片或细胞爬片4%多聚甲醛固定20 min,0.3% Triton X-100通透10 min,使用免疫组化笔画圈,5%牛血清白蛋白37℃封闭30 min。Ⅰ抗(1∶100)37℃孵育90 min,荧光Ⅱ抗(1∶250)孵育30 min,DAPI染色15 s,滴加抗荧光淬灭剂封片,倒置荧光显微镜观察采集图像。
2.8 Western blot实验用含有蛋白酶抑制剂的全细胞裂解液裂解细胞,血管组织从-80℃冰箱取出用液氮研磨后加入全细胞裂解液,5 000×g离心,蛋白定量后加入5×上样缓冲液,100℃煮10 min。取5 μg蛋白经12% SDS-PAGE分离后,湿转至PVDF膜(300 mA、100 min),5%牛血清白蛋白室温封闭2 h,Ⅰ抗(1∶1 000)4℃摇床过夜,用辣根过氧化物酶标记的Ⅱ抗室温孵育2 h,ECL显色后采用ChemiDocTMXRS成像系统(Bio-Rad)成像,Image Lab凝胶分析软件分析。
3 统计学处理
应用GraphPad Prism 8.0软件进行统计分析。数据均为至少3次独立重复实验结果,以均数±标准差(mean±SD)表示。两组间均数比较采用Student′st检验,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 LPS上调Raw264.7巨噬细胞iNOS和Pim1表达
Western blot结果显示,与对照组相比,LPS(20 nmol/L)干预Raw264.7细胞24 h后,M1型巨噬细胞标志物iNOS表达显著增多(P<0.01),Pim1表达也显著增多(P<0.05),见图1。
2 抑制或敲减Pim1对LPS诱导的巨噬细胞向M1型极化的影响
用不同浓度(0、10、20、30、50和100 nmol/L)的Pim1抑制剂SMI-4a孵育Raw264.7细胞,结果显示,50和100 nmol/L的SMI-4a均可显著抑制Pim1蛋白表达(P<0.05),见图2A。因此后续实验选择用SMI-4a浓度为50 nmol/L。Western blot结果显示,与LPS组比较,用SMI-4a预处理Raw264.7细胞,再经LPS诱导,Raw264.7细胞中Pim1表达和M1型巨噬细胞标志物iNOS表达均显著降低(P<0.05或P<0.01),见图2B。转染siPim1和siNC后,与LPS+siNC组比较,LPS+siPim1组在抑制Pim1表达同时,M1型巨噬细胞标志物iNOS表达也显著下调(P<0.05),见图2C。
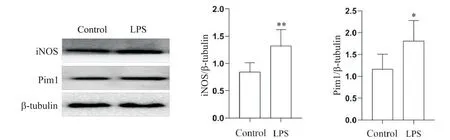
Figure 1.LPS induced M1 macrophage polarization and increased Pim1 expression.Raw264.7 cells were incubated with LPS for 24 h.The protein levels of iNOS and Pim1 in Raw264.7 cells were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图1 LPS诱导巨噬细胞向M1型极化及上调Pim1表达

Figure2.Pim1 inhibitor SMI-4a or knockdown of Pim1 attenuated LPS-induced polarization of macrophages to M1 phenotype.A:Raw264.7 cells were incubated with Pim1 inhibitor SMI-4a at the concentration range of 0~100 nmol/L,and Pim1 expression was detected by Western blot;B and C:Raw264.7 cells were treated with 50 nmol/L SMI-4a(B)or siPim1 transfection(C)followed by LPS induction for 24 h,and the protein levels of iNOS and Pim1 were detected by Western blot.Mean±SD.n=3.△P<0.05 vs 0 nmol/L;*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs LPS group;&P<0.05 vs LPS+siNC group.图2 SMI-4a和敲减Pim1抑制了LPS诱导的巨噬细胞向M1型极化
3 M1型 巨噬 细 胞CM上调HUVEC中VCAM1和ICAM1的表达
免疫荧光结果(图3A)可见,与CMM0组相比,用CMM1孵育HUVECs 24 h,CMM1组ICAM1和VCAM1的红色荧光强度增强;Western blot结果(图3B)显示,CMM1显 著 上 调 了HUVECs中ICAM1(P<0.01)和VCAM1(P<0.05)蛋白表达。
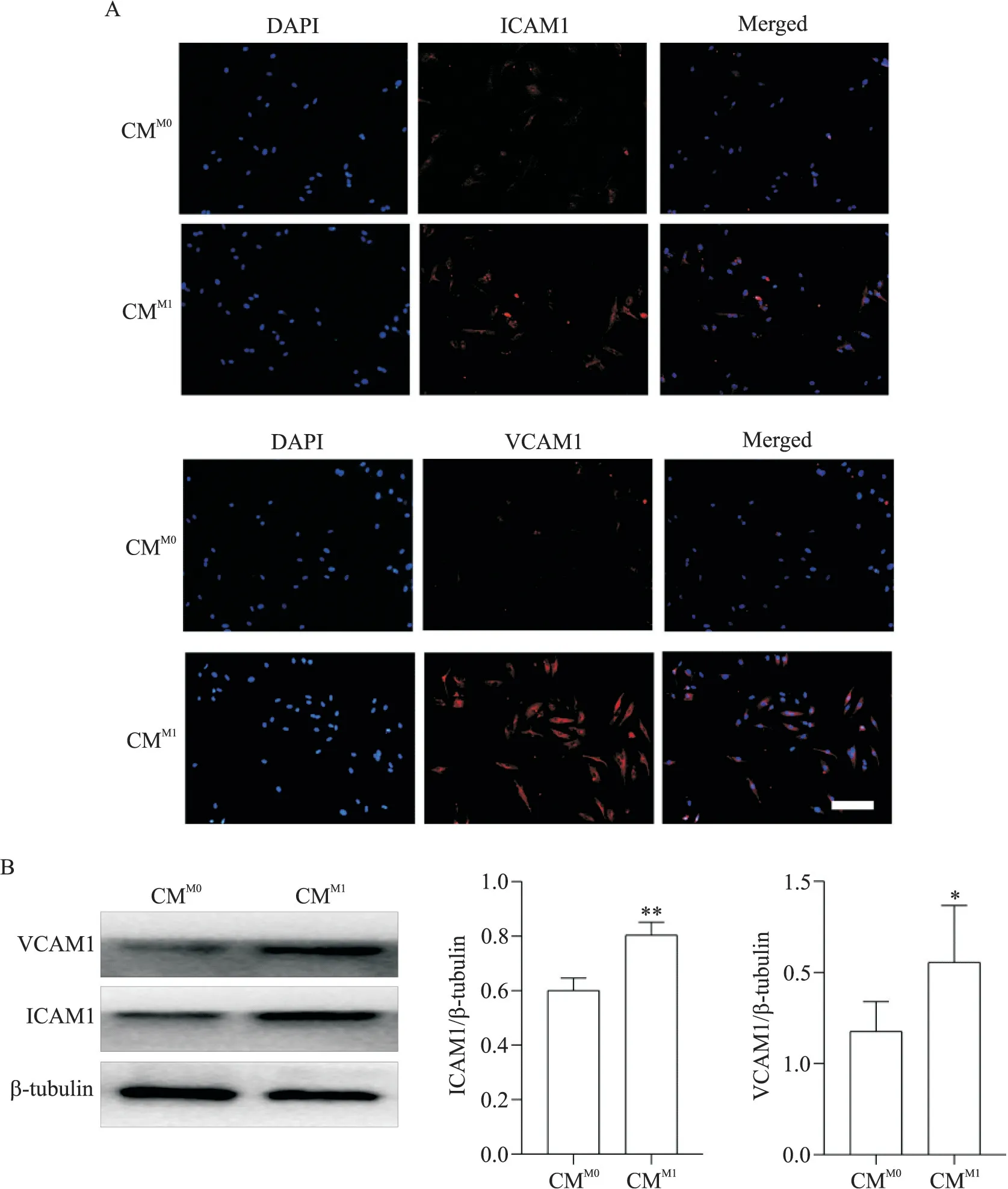
Figure 3.Conditioned medium(CM)of M1 macrophages up-regulated ICAM1 and VCAM1 expression in HUVECs.The HUVECs were incubated with M0 and M1 macrophage CM(CMM0 and CMM1)for 24 h.A:immunofluorescence image of HUVECs(blue is the nucleus,and red is ICAM1 and VCAM1;scale bar=50 μm);B:the protein levels of ICAM1 and VCAM1 were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs CMM0 group.图3 M1型巨噬细胞CM上调内皮细胞VCAM1和ICAM1表达
4 抑制或敲减Pim1对CMM1诱导的内皮细胞VCAM1和ICAM1表达的影响
免疫荧光结果(图4A)可见,CMSMI-4a和CMsiPim1组HUVECs中ICAM1和VCAM1荧光强度显著减弱。与免疫荧光结果一致,Western blot结果(图4B、C)显示,CMSMI-4a和CMsiPim1显著下 调了HUVECs的ICAM1和VCAM1蛋白表达(P<0.01)。
5 ApoE-/-小鼠颈动脉结扎后Pim1、iNOS、VE-cadherin、VCAM1和ICAM1的表达变化

Figure 4.SMI-4a or knockdown of Pim1 inhibited M1 macrophage conditioned medium(CM)-induced expression of VCAM1 and ICAM1 in HUVECs.The Raw264.7 cells were treated with SMI-4a or siPim1 transfection,and then the CM of each group was used to incubate HUVECs for 24 h.A:immunofluorescence image of HUVECs(blue is the nucleus,and red is ICAM1 or VCAM1;scale bar=50 μm);B and C:the protein levels of ICAM1 and VCAM1 in HUVECs were detected by Western blot.Mean±SD.n=3.**P<0.01 vs CMM1 group;##P<0.01 vs CMsiNC group.图4 SMI-4a和敲减Pim1抑制了M1型巨噬细胞CM诱导的内皮细胞VCAM1和ICAM1表达
如图5A,结扎小鼠左颈内、颈外和枕后动脉建立AS模型,选取模型组ApoE-/-小鼠两侧颈动脉,血管壁油红O染色结果显示,左侧颈动脉(LCA)较右侧颈动脉(RCA)脂质显著蓄积,右侧未结扎侧无AS病变,而左侧结扎侧有明显的AS病变。免疫荧光染色(图5B)可观察到,与未结扎侧比较,结扎侧血管壁M1型巨噬细胞标志分子iNOS红色荧光亮度显著增强,而血管内皮标志分子VE-cadherin绿色荧光强度减弱。Western blot结果(图5C)显示,结扎侧血管壁Pim1、iNOS、ICAM1和VCAM1蛋白水平均显著高于未结扎侧(P<0.05或P<0.01),而VE-cadherin表达则显著低于未结扎测(P<0.05)。
6 SMI-4a对ApoE-/-小鼠颈动脉斑块及M1型巨噬细胞极化和黏附分子表达的影响
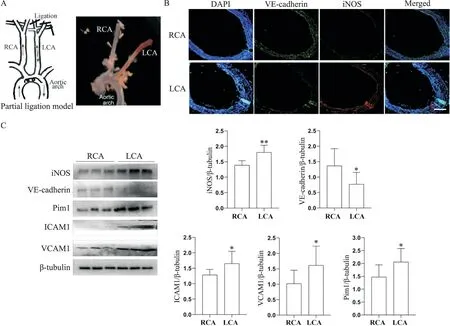
Figure 5.The expression of Pim1,iNOS,VE-cadherin,VCAM1 and ICAM1 in the carotid artery of ApoE-/-mice.A:the diagram of AS model constructed by carotid artery partial ligation in ApoE-/-mice(left),and the AS plaques in the carotid artery detected by oil red O staining(right);B:immunofluorescence staining of VE-cadherin(green)and iNOS(red)in the carotid artery(blue is the nucleus;scale bar=100 μm);C:Western blot was used to detect the protein levels of iNOS,VE-cadherin,Pim1,ICAM1 and VCAM1 in the carotid artery.Mean±SD.n=9.*P<0.05,**P<0.01 vs RCA group.图5 ApoE-/-小鼠AS模型颈动脉Pim1、iNOS、VE-cadherin、VCAM1和ICAM1的表达变化
建模后用SMI-4a干预,油红O染色可见,SMI-4a组LCA脂质沉积明显被抑制(图6A),斑块面积显著减小(图6B)。免疫荧光结果显示,与模型组相比,SMI-4a组iNOS红色荧光明显减弱,VE-cadherin绿色荧光增强(图6C)。Western blot结果(图6D)显示,SMI-4a组血管壁Pim1、iNOS、ICAM1和VCAM1蛋白表达均显著低于模型组(P<0.05或P<0.01),而VEcadherin表达则显著高于模型组(P<0.05)。
讨 论
AS特征是斑块形成,也是缺血性心脏病和外周动脉疾病等多种疾病的病理基础。有多种细胞参与AS进展,斑块中巨噬细胞的主要来源是外周血单核细胞,巨噬细胞极化后释放的炎症因子可能是导致血管内皮损伤、加快AS进展的重要原因[1]。本研究结果可见,AS进展中,M1型巨噬细胞极化增多,伴随Pim1表达显著上调,内皮细胞黏附分子ICAM1和VCAM1的表达升高。
我们课题组前期研究观察到,体外给予内皮细胞切应力刺激,与静止组相比,15 dyn/cm2层流切应力可以显著增加内皮细胞Pim1蛋白水平,促进内皮细胞一氧化氮生成[10]。本研究用小鼠颈动脉部分结扎建立的是低切应力斑块模型[9],即未行结扎侧(右侧颈动脉)为层流切应力,结扎侧左侧颈动脉为低切应力,结果显示低切应力侧血管壁中有斑块形成同时Pim1蛋白水平的异常升高,与体外结果比较,我们推测在斑块中可能还有其他细胞的Pim1表达上调,才导致血管壁Pim1蛋白水平升高。因此我们用小鼠Raw264.7巨噬细胞进行体外实验,检测到Raw264.7细胞在LPS诱导下向M1型巨噬细胞极化增多,并伴随Pim1表达上调,提示是否是Pim1调节了巨噬细胞M1型极化,进而在AS形成中发挥了作用?

Figure 6.Effects of SMI-4a on the expression of Pim1,VE-cadherin,iNOS,VCAM1 and ICAM1 in the carotid artery of ApoE-/-mice.SMI-4a was injected into the tail vein of AS model ApoE-/-mice.A:oil red O staining of mouse carotid artery;B:AS plaque detected by oil red O staining in left carotid artery at cross section(scale bar=100 μm);C:immunofluorescence staining of VE-cadherin(green)and iNOS(red)in left carotid artery(scale bar=100 μm);D:Western blot was used to detect the protein levels of iNOS,VE-cadherin,Pim1,ICAM1 and VCAM1 in left carotid artery.Mean±SD.n=9.*P<0.05,**P<0.01 vs model group.图6 SMI-4a对ApoE-/-小鼠颈动脉Pim1、VE-cadherin、iNOS、VCAM1和ICAM1表达的影响
Pim1蛋白在结构上缺乏调节亚基,Pim1功能被认为与其表达量一致[11]。用LPS诱导的Raw264.7细胞上清液去孵育内皮细胞,观察到内皮黏附分子ICAM1和VCAM1的表达升高,是不是巨噬细胞M1型极化促进了内皮炎症反应?为了验证我们的假设,用Pim1抑制剂SMI-4a和siPim1敲 减Raw264.7细胞Pim1,结果显示,伴随Pim1表达的降低,M1巨噬细胞标志物iNOS表达也下降,其上清诱导内皮细胞黏附分子的表达同时降低,说明Pim1调节了巨噬细胞M1型极化,抑制了内皮细胞炎症反应。在动物实验中,向ApoE-/-小鼠尾静脉注射SMI-4a,Pim1在体内受到整体抑制之后,iNOS红色荧光染色减少,内皮标志物的绿色荧光染色连续性增加,显示内皮损伤减少。考虑到抑制Pim1并不是特异性抑制巨噬细胞Pim1表达,本实验所用浓度SMI-4a在血液中有杀伤单核细胞的作用[12],也就是说可能是通过减少单核细胞在内皮上的黏附数量,导致M1巨噬细胞数量的减少。体内、体外实验,我们得出初步结论,Pim1参与巨噬细胞M1表型极化,M1型巨噬细胞可以诱导内皮细胞黏附分子的表达,造成内皮损伤。
研究表明,巨噬细胞M1型极化后释放的IL-6、IL-1β和TNF-α等促炎因子是重要的炎性外泌蛋白,是导致包括AS在内的等多种炎症性疾病发生的因素[13-15]。本研究只观察了Pim1可以调控M1型巨噬细胞的极化,未检测上清中IL-6、IL-1β和TNF-α等的作用,虽然有文献证实,抑制Pim1可以抑制LPS诱导的Raw264.7细胞上清液中炎症因子的产生[7-8]。但Pim1是否通过调节这些炎症因子表达,从而影响内皮细胞黏附分子的合成,以及哪些信号分子参与了这个过程,有待进一步探讨。
综上所述,Pim1参与AS进展中M1型巨噬细胞极化,M1型巨噬细胞高表达Pim1促进了内皮黏附分子ICAM1和VCAM1的表达。但是Pim1作为丝氨酸/苏氨酸激酶,与M1巨噬细胞极化有关的NF-κB等信号之间的关系,还需要我们接下来进一步的探索。同时,在AS进展中我们采用高脂饮食饲养,实验中也观察到Pim1参与了脂代谢的过程,但是内皮细胞、巨噬细胞和平滑肌细胞都参与了脂质代谢,Pim1在脂代谢中的作用我们也会在以后的研究中加以阐述。

