FAM3C介导TGF-β1诱导的人血管平滑肌细胞表型转换、活力增强及迁移*
訾亚飞,王正力,訾亚婉,李雅馨,刘杨东,赵 渝△
(1重庆医科大学附属第一医院血管外科,重庆 400016;2重庆医科大学附属第一医院呼吸及重症医学科,重庆 400016;3深圳大学附属华南医院血管外科,广东深圳 518100)
内膜增生(intimal hyperplasia)是一种特别的血管重塑状态,发生于动静脉内瘘、动脉粥样硬化及血管再狭窄病变[1-2]。而引起内膜增生的主要原因是由于血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在多种信号分子[如转化生长因子β1(transforming growth factor-β1,TGF-β1)]刺激下,由收缩表型[标志物为α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)]转化为合成表型[标志物为骨桥蛋白(osteopontin,OPN)及波形蛋白(vimentin)等],且自身发生肥大及活力增强,并由中膜迁移至内膜引起血管内膜增生[1-3]。虽然目前对VSMCs表型转换有较多研究,但其有效治疗靶点仍不清楚。
序列相似家族3成员C(family with sequence similarity 3 member C,FAM3C)又称白细胞介素样上皮-间充质转化(epithelial-mesenchymal transition,EMT)诱导因子(interleukin-like EMT inducer,ILEI)[4],是FAM3家族的成员,也是重要的细胞因子样蛋白。研究表明,FAM3C在组织中普遍表达[5],由细胞内分泌至细胞外,并且在多种癌细胞中高表达,促进癌症进展和转移,而循环中的FAM3C是自噬和癌症的生物标志物[6-8]。另外,FAM3C作为TGF-β1的靶基因,其蛋白参与TGF-β1在肾小管上皮细胞及癌症中诱导的EMT,其下调可抑制TGF-β1诱导的改变[9-10]。还有研究提示,FAM3C通过降低糖异生和脂肪相关基因的mRNA和蛋白水平而抑制糖异生,从而减轻肥胖小鼠的胰岛素抵抗、高血糖及脂肪变性[11]。不仅如此,FAM3C还参与成骨细胞的分化[12]。然而,FAM3C是否参与TGF-β1诱导的VSMCs表型转换尚未见报道。
蛋白激酶B(protein kinase B,PKB/Akt)是一种丝氨酸/苏氨酸蛋白激酶,可被许多生长因子和细胞因子以磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)依赖的方式激活[13]。Akt是一种重要的细胞内分子,其激活对细胞存活和凋亡有重要影响,并在心血管疾病中调节多种细胞功能[14]。有研究报道Akt活化在TGF-β1促进VSMCs表型转换及增殖的过程中起着重要作用[15-16],而抑制Akt的激活可减轻血管重构[17]。
本研究旨在探讨FAM3C在TGF-β1诱导VSMCs表型转换、活力增强及迁移中的作用及其潜在机制,以期获得干预内膜增生的相关靶点。
材料和方法
1 材料与试剂
原代人主动脉平滑肌细胞(HTX3138)购自深圳豪地华拓生物科技有限公司;DMEM/F12培养液购自Gibco;胎牛血清购自Biosharp;青霉素和链霉素(C0222)购自碧云天;TGF-β1(100-21-2)购自杭州联科生物技术股份有限公司;CCK-8(AR1160)购自武汉博士德生物工程有限公司;Akt inhibitor VIII(Akti-VIII;T3346)购自TargetMol;FAM3C小干扰RNA(si-FAM3C)和阴性对照小干扰RNA(si-NC)均由广州锐博生物技术有限公司合成;jetPRIME transfection reagent(101000046)购自Polyplus;FAM3C过表达慢病毒(LV-FAM3C)及空载病毒(LV-GFP)由赛业(苏州)生物科技有限公司合成;Transwell小室购自Corning;增强化学发光(enhanced chemiluminescence,ECL)显影试剂盒(4AW011-500)购自北京四正柏生物科技有限公司;OPN兔抗(22952-1-AP)和辣根过氧化物酶标记的山羊抗鼠IgG(SA00001-1)购自Proteintech;vimentin鼠抗(BF8006)、FAM3C兔抗(DF12605)、α-SMA兔抗(AF1032)、Akt兔抗(AF0836)、磷酸化Akt(phosphorylated Akt,p-Akt)兔抗(AF0016)及β-actin兔抗(AF7018)购自Affinity;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(D3H8P)购自Cell Signaling Technology;辣根过氧化物酶标记的山羊抗兔IgG(A21020)、荧光标记的山羊抗兔IgG(A23420)及荧光标记的山羊抗鼠IgG(A23210)购自Abbkine。
2 主要方法
2.1 细胞培养及处理原代人VSMCs用DMEM/F12培养液加10%胎牛血清和1%青霉素-链霉素在37℃及5%CO2环境下培养。首先用不同浓度(0、1、2、5及10 μg/L)的TGF-β1作用24 h和10 μg/L的TGF-β1作用不同时间(0、6、12、24及48 h),以确定最佳作用浓度和时间,并以10 μg/L的TGF-β1作用不同时间(0、6、12及24 h)来诱导VSMCs表型转换。在验证敲减FAM3C效率的实验中,将细胞分为control(CTL)组、si-NC组和si-FAM3C组,之后再分为si-NC组、si-NC+TGF-β1组、si-FAM3C组和si-FAM3C+TGF-β1组;在荧光显微镜下验证过表达慢病毒是否转染成功的实验中,将细胞分为空白(blank)组、LVGFP组和LV-FAM3C组,之后再分为LV-GFP组、LVGFP+TGF-β1组、LV-FAM3C组和LV-FAM3C+TGF-β1组;在Akt抑制剂处理的实验中,将细胞分为LV-GFP组、LV-GFP+TGF-β1组、LV-FAM3C组、LV-FAM3C+TGF-β1组、LV-FAM3C+Akti-VIII组 和LV-FAM3C+TGF-β1+Akti-VIII组,Akti-VIII(5 μmol/L)提前2 h加入处理组。各组处理前均饥饿细胞24 h。
2.2 细胞活力的测定以每孔1×104细胞在96孔板种板孵育。细胞贴壁后根据分组进行处理,同时设置空白对照组及5个复孔。次日按照CCK-8试剂盒说明书,在各孔加入10 μL CCK-8溶液,37℃避光孵育2 h,酶标仪在450 nm处测量各孔吸光度。
2.3 细胞转染细胞传代至6孔板中,融合70%~80%时,按照转染说明书将2 μL si-FAM3C(20 μmol/L)或2 μL si-NC(20 μmol/L)与2 μL jetPRIME transfection reagent加 入 到200 μL jetPRIME buffer中,充分混合15 min后,加入到各孔中,加入2 mL有血清培养液继续培养,转染48 h后,Western blot检测转染效率,收集细胞进行后续实验。si-FAM3C的序列 为5′-CTACAAAGCCTCCCAGATA-3′,si-NC的 序列为5′-GGCUCUAGAAAAGCCUAUGC-3′。
2.4 慢病毒转染将状态良好的对数期VSMCs种于6孔板中,次日将LV-GFP组和LV-FAM3C组细胞根据赛业公司提供的说明书按感染复数(multiplicity of infection,MOI)=50进行慢病毒感染实验。转染10 h后,更换新鲜培养液,培养48 h后在荧光显微镜下拍照验证,收集细胞进行后续的实验。
2.5 Transwell实验将3×105细胞用无血清培养液悬浮,取200 μL加入到上室,700 μL含20%胎牛血清的培养液加入下室,并在37℃培养箱中孵育24 h,次日用甲醛固定15 min,结晶紫染色,棉签擦拭上室残留细胞,显微镜下拍照并计数。
2.6 免疫荧光染色将细胞种于24孔板中盖玻片上。经处理后,4%多聚甲醛固定细胞15 min,PBS洗涤3次,0.3%Triton X-100破膜10 min,正常山羊血清封闭1 h,加入vimentin和α-SMA抗体(1∶150稀释),4℃过夜孵育。次日用荧光标记的山羊抗兔及抗鼠IgG(1∶200稀释)孵育1 h,经4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染核后,抗荧光淬灭剂封片,避光条件下荧光显微镜获取图像。
2.7 Western blot实验细胞处理后,用含磷酸酶及蛋白酶抑制剂的RIPA裂解液在冰上提取蛋白,BCA蛋白检测试剂测定蛋白浓度。加入上样缓冲液并加热变性,SDS-PAGE分离蛋白,转移到聚二氟乙烯膜。5%脱脂奶粉室温下封闭2 h,OPN、vimentin、β-actin、PCNA、α-SMA、FAM3C、Akt及p-Akt抗体(1∶1 000稀释)4℃孵育过夜。次日用TBST洗涤3次,辣根过氧化物酶标记的山羊抗兔IgG(1∶10 000稀释)和山羊抗鼠IgG(1∶5 000稀释)室温孵育2 h,TBST洗涤3次。ECL发光液显影,ImageJ软件分析图像。
3 统计学处理
所有统计分析及制图均使用GraphPad Prism 8进行。数据以均数±标准差(mean±SD)表示。采用单因素方差分析检验多组间差异,后用Turkey法进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 TGF-β1对VSMCs中FAM3C表达的影响
TGF-β1在作用24 h时随着浓度(0、1、2、5和10 μg/L)增加上调VSMCs中FAM3C的表达,TGF-β1(10 μg/L)随作用时间(0、6、12、24及48 h)增加上调FAM3C表达,以10 μg/L及24 h时最为显著(P<0.05),故作为后续实验条件,见图1。此结果亦提示FAM3C是TGF-β1的靶基因。
2 TGF-β1诱导VSMCs表型转换
10 μg/L TGF-β1呈时间依赖性(0、6、12和24 h)上调OPN及vimentin表达,下调α-SMA表达,0、6、12及24 h组间均有显著差异(P<0.05),vimentin免疫荧光与Western blot结果趋势类似,见图2。
3 敲减FAM3C抑制TGF-β1诱导的VSMCs表型转换、活力增强及迁移

Figure 1.Effects of TGF-β1 on the expression of FAM3C in VSMCs.Primary human VSMCs were treated with 0,1,2,5 and 10 μg/L of TGF-β1 for 24 h(A)or 10 μg/L TGF-β1 for 0,6,12,24 and 48 h(B).Mean±SD.n=3.*P<0.05 vs 0 μg/L or 0 h;#P<0.05 vs 2 μg/L;&P<0.05 vs 5 μg/L;△P<0.05 vs 12 h.图1 TGF-β1对VSMCs中FAM3C表达的影响

Figure 2.TGF-β1 induced phenotypic switch of VSMCs.A:the protein expression of OPN,vimentin and α-SMA detected by Western blot;B:immunofluorescence staining for vimentin(scale bar=50 μm).Mean±SD.n=3.*P<0.05 vs 0 h;#P<0.05 vs 6 h;&P<0.05 vs 12 h.图2 TGF-β1诱导VSMCs表型转换
与si-NC和CTL组相比,si-FAM3C组中FAM3C表达降低(P<0.05),提示已敲减FAM3C(图3A)。与si-NC组相比,si-NC+TGF-β1组细胞活力增强(P<0.05),OPN、vimentin和PCNA表达增加(P<0.05),α-SMA表达降低(P<0.05),细胞迁移数量增加(P<0.05);与si-NC+TGF-β1组相比,si-FAM3C+TGF-β1组中TGF-β1对VSMCs的上述作用被削弱;此外,与si-NC组相比,si-FAM3C组细胞活力减弱(P<0.05),OPN、vimentin和PCNA表达减少(P<0.05),α-SMA表达增加(P<0.05),细胞迁移数量减少(P<0.05),见图3B~D。上述结果提示敲减FAM3C抑制VSMCs表型转换、活力及迁移。
4 过表达FAM3C促进TGF-β1诱导的VSMCs表型转换、活力增强及迁移
与blank组 相比,LV-GFP和LV-FAM3C组荧 光强度增加,提示慢病毒转染成功(图4A)。与LVGFP组相比,LV-FAM3C组细胞活力增强(P<0.05),OPN、vimentin和PCNA表达增加(P<0.05),α-SMA表达减少(P<0.05),细胞迁移数量增多(P<0.05),vimentin和α-SMA免疫荧光结果与Western blot结果趋势类似;与LV-GFP+TGF-β1组相比,LV-FAM3C+TGF-β1组趋势与LV-FAM3C组类似,提示过表达FAM3C增强TGF-β1对VSMCs表型转换、活力及迁移的作用,见图4B~D及图5。
5 FAM3C通过Akt介导TGF-β1诱导的VSMCs改变
与si-NC组和LV-GFP组相比,TGF-β1提高p-Akt蛋白水平(P<0.05);敲减FAM3C可降低p-Akt蛋白水平及减弱TGF-β1的诱导作用(P<0.05);过表达FAM3C对p-Akt蛋白水平的作用与敲减FAM3C相反;而加入Akti-VIII后,p-Akt蛋白水平降低(P<0.05),OPN和vimentin表达减少(P<0.05),α-SMA表达增加(P<0.05),见图6。
讨 论
正常VSMCs以收缩表型存在,有利于对抗血管张力,维持血管壁稳态。然而,在多种病理状态下,VSMCs的合成表型转化增加,导致增殖、迁移和细胞外基质合成,从而引起内膜增生,是引起动脉粥样硬化、血管再狭窄和高血压的重要原因之一[14,18-19],许多细胞因子参与VSMCs表型转换的调节,其中TGFβ1通过激活其下游Smad2/3和PI3K/Akt等通路来发挥作用[2,16]。此外,TGF-β1还可通过促进缝隙连接蛋白(connexin)43表达而导致VSMCs的增殖活力增加[20]。在本研究中,TGF-β1呈时间依赖性调节VSMCs表型转换,并可增强细胞活力及迁移能力,与既往研究结果一致[2],因此对TGF-β1下游靶基因的调节是干预内膜增生的关键。
FAM3C作为FAM3家族重要成员之一,较多研究涉及细胞EMT及迁移。FAM3C通过Akt及细胞外信号调节激酶通路参与TGF-β1诱导的肾小管上皮EMT,促进肾纤维化[10],还可通过PI3K/Akt途径参与胃癌的EMT及细胞迁移过程[8],但是否参与血管内膜增生还未见报道。本研究结果表明,在VSMCs中,TGF-β1可使FAM3C蛋白表达增加,验证了FAM3C是TGF-β1的靶基因。为进一步研究FAM3C在VSMCs表型转换中的作用,我们分别对FAM3C行敲减及过表达处理。敲减FAM3C可提高收缩表型标志物α-SMA表达,降低TGF-β1诱导的合成表型标志物OPN和vimentin表达,同时降低VSMCs活力及迁移能力,而过表达FAM3C可促进TGF-β1对VSMCs表型转换、活力及迁移的调节,因此我们证实FAM3C介导TGFβ1诱导的VSMCs表型转换、活力增强及迁移。FAM3C的作用可能与其形态变化有关,研究表明二聚体FAM3C较单聚体可使癌细胞侵袭增加[21],但在VSMCs中是否发生形态改变还需进一步研究。此外,有研究指出FAM3C上调阴阳1(yin yang 1,YY1)表达,最终激活Akt-cyclin D1通路促进乳腺癌细胞增殖和迁移[7];而在颈动脉血管损伤后上调YY1,可抑制VSMCs收缩型标志物的表达,从而导致内膜增生[22]。在本实验中,过表达及敲减FAM3C均可独立于TGFβ1调节VSMCs表型转换、活力及迁移,因此FAM3C可能通过调节YY1或Akt参与对VSMCs的调节。
Akt作为重要的细胞内因子,参与调控细胞增殖、分化及凋亡等细胞功能。研究表明Akt通过抑制VSMCs凋亡而导致内膜增厚[16,23],此外,Akt通过激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)而介导摄食抑制因子(nesfatin-1)诱导的VSMCs表型转换、周期转换及增殖[24]。另有研究表明,芙蓉叶通过抑制Akt/激活蛋白1(activator protein-1,AP-1)通路,抑制肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)诱导的VSMCs迁移[25]。因此,Akt在内膜增生发生发展中发挥重要作用。在本研究中,TGF-β1使Akt活化,且Akt活化在FAM3C敲减后被阻断,提示Akt是FAM3C的下游蛋白。有研究提示,过表达FAM3C可激活热休克因子1(heat shock factor 1,HSF1)-钙调素(calmodulin,CaM)-Akt通路,并增加Akt磷酸化,从而抑制糖异生[26],另外,血管紧张素II(angiotensin II,Ang II)通过增加Ca2+的摄入而诱导早期生长反应因子1(early growth response protein-1,Egr-1)表达,而导致内膜增生,敲减CaM抑制Ang II对VSMCs表型的改变[27]。更重要的是,作为CaM的下游激酶,钙/CaM依赖性蛋白激酶II(Ca2+/CaM-dependent protein kinase II,CaMKII)通过调控线粒体对Ca2+的摄取及VSMCs迁移,导致血管损伤后的新生内膜形成[28]。在本研究中,过表达FAM3C激活Akt,促进TGF-β1对Akt的活化,其机制可能与CaM的表达有关,而Akt抑制剂作用后阻断了FAM3C对VSMCs表型转换的作用,因此FAM3C可能通过调节Akt参与TGF-β1诱导的VSMCs表型转换。这也可解释敲减及过表达FAM3C独立调节VSMCs表型转换的作用与Akt的激活有关,所以抑制Akt对VSMCs表型转换调节起到重要作用。

Figure 3.Knockdown of FAM3C inhibited TGF-β1-induced phenotypic switch and attenuated viability and migration of VSMCs.A:verification of FAM3C knockdown by Western blot;B:the cell viability detected by CCK-8 assay;C:the expression of phenotypic markers,PCNA and FAM3C detected by Western blot;D:the cell migration detected by Transwell assay(×200).Mean±SD.n=3.*P<0.05 vs CTL or si-NC group;#P<0.05 vs si-NC+TGF-β1 group.图3敲减FAM3C抑制TGF-β1诱导的VSMCs表型转换并减弱细胞活力和迁移能力
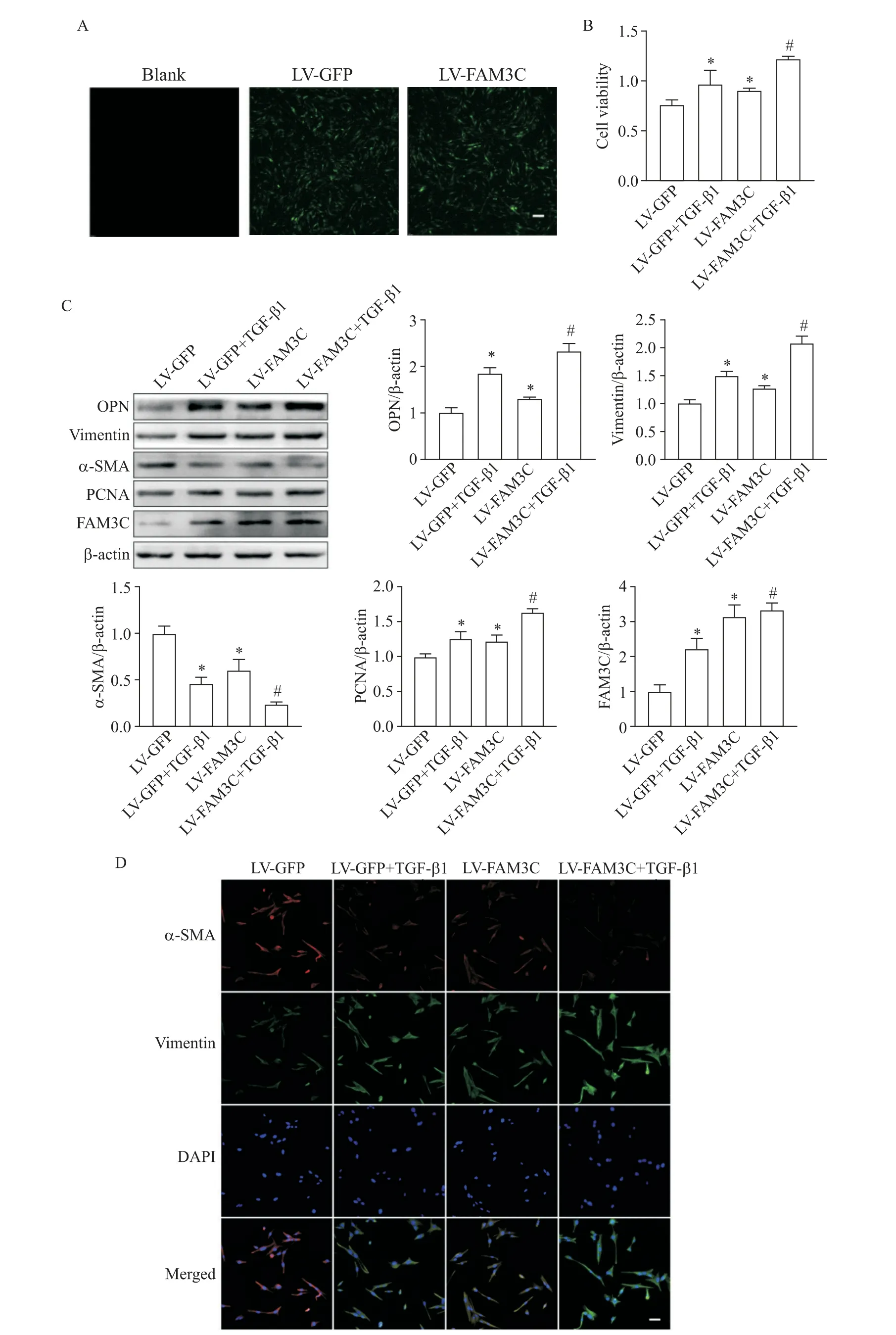
Figure 4.Overexpression of FAM3C promoted TGF-β1-induced phenotypic switch and enhanced viability of VSMCs.A:verification of lentivirus(LV)infection(scale bar=100 μm);B:the cell viability detected by CCK-8 assay;C:the expression of phenotypic markers,PCNA and FAM3C detected by Western blot;D:immunofluorescence staining for α-SMA and vimentin(scale bar=50 μm).Mean±SD.n=3.*P<0.05 vs LV-GFP group;#P<0.05 vs LV-GFP+TGF-β1 group.图4过表达FAM3C促进TGF-β1诱导的VSMCs表型转换并增强细胞活力

Figure 5.Overexpression of FAM3C promoted TGF-β1-induced migation of VSMCs.The cell migration was detected by Transwell assay(×200).Mean±SD.n=3.*P<0.05 vs LV-GFP group;#P<0.05 vs LV-GFP+TGF-β1 group.图5过表达FAM3C促进TGF-β1诱导的VSMCs迁移

Figure 6.FAM3C mediated TGF-β1-induced phenotypic changes in VSMCs through Akt.A:effects of TGF-β1 and/or FAM3C knockdown on Akt phosphorylation;B:effects of TGF-β1 and/or FAM3C overexpression combined with Akt inhibitor VIII(Akti-VIII)on Akt phosphorylation and phenotypic marker expression.Mean±SD.n=3.*P<0.05 vs LV-GFP group;#P<0.05 vs LV-GFP+TGF-β1 group;&P<0.05 vs LV-FAM3C group;△P<0.05 vs LV-FAM3C+TGF-β1 group.图6 FAM3C通过Akt介导TGF-β1诱导的VSMCs表型改变
总之,本研究发现FAM3C通过激活Akt参与并介导TGF-β1诱导的VSMCs表型转换、活力增强及迁移,因此FAM3C可能是干预内膜增生的潜在靶点。

