FAD通过激活SCAD抑制tBHP诱导的大鼠H9C2心肌细胞凋亡*
陈春雨,秦 学,马智超,徐庆萍,彭 欢,周四桂△
(1广东药科大学中药学院,广东 广州 510006;2广东药科大学附属第一医院临床药学重点专科,广东 广州 510699)
心脏的主要收缩细胞是心肌细胞,占据心脏质量的85%[1]。细胞凋亡是细胞在各种病理或者生理因素刺激下主动结束细胞生命的一种特殊自主而有序的死亡方式,又称程序性死亡,对维持机体内环境稳态具有重要意义[2]。心肌细胞凋亡是心脏代偿期向失代偿期转变的重要原因,在失代偿期,由于心肌细胞的不断丢失,而心肌细胞增殖能力有限,心肌细胞丢失所造成的影响不能通过细胞的有效增殖来弥补,导致心肌收缩功能受损,心收缩力下降,最终引起心力衰竭[3]。
线粒体氧化磷酸化和糖酵解是心脏产生ATP供能的两个主要途径[4]。在病理性心肌重塑期间,心肌能量代谢主要方式由脂肪酸β氧化转变为糖酵解[5],从而维持心肌供能。短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase,SCAD)是脂肪酸β氧化的关键酶,在FAD的作用下可催化线粒体脂肪酸脱氢反应[5]。我们的前期研究显示,SCAD在慢性心力衰竭、急性心肌梗死后心力衰竭、心肌细胞凋亡模型中表达均显著下调[6-8]。SCAD重组腺病毒对心力衰竭大鼠具有保护作用[9]。黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)作为SCAD的潜在稳定剂,能够增加蛋白质的稳定性[10]。FAD作为SCAD的辅助因子,不仅参与氧化还原过程,还参与核苷酸形成,tRNA甲基化以及蛋白质折叠[11]。我们的前期研究显示,FAD能够激活心脏SCAD表达,抑制自发性高血压大鼠心肌肥厚和纤维化[12]。然而,FAD是否能够通过激活SCAD,从而抑制心肌细胞凋亡,尚不清楚。本项工作采用叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)构建心肌细胞凋亡模型,探究FAD对H9C2心肌细胞凋亡的影响。
材料和方法
1 实验细胞
大鼠心肌细胞系H9C2购于上海生命科学研究院。
2 主要试剂
BCA蛋白定量试剂盒购于Thermo Fisher Scientific;SCAD酶活性试剂盒购于上海杰美基因医药科技有限公司;多克隆兔抗Bcl-2、Bax、SCAD、cleaved caspase-3、pro-caspase-3和单克隆鼠抗GAPDH购于Proteintech;tBHP和FAD购于Sigma;ATP试剂盒购于碧云天生物技术有限公司;游离脂肪酸试剂盒购于南京建成生物工程研究所。
3 主要方法
3.1 tBHP处理H9C2心肌细胞迅速取出低温保存的大鼠H9C2心肌细胞,置于37℃水浴锅快速摇晃使其融化,将细胞液吸至含有9 mL完全培养液的离心管中,重悬后离心弃上清,加入3 mL含有10%胎牛血清的培养液,吹散细胞后转移至培养皿培养。当细胞密度达到80%时,细胞饥饿处理24 h,加入不同浓度的tBHP处理相同的时间或加入相同浓度的tBHP处理不同时间,以研究tBHP诱导心肌细胞凋亡的量效和时效关系。
3.2 FAD预处理实验分组为:对照(control,Con)组、tBHP组、FAD组和tBHP+FAD组。H9C2细胞传代隔天后,FAD组和tBHP+FAD组吸走含有10%胎牛血清的培养液,PBS漂洗细胞后加入含有FAD(10 μmol/L)[12]的培养液,Con组和tBHP组同样操作后加入等体积不含FBS的高糖DMEM,24 h后,tBHP组和tBHP+FAD组加入tBHP(200 μmol/L)溶液处理6 h。
3.3 心肌细胞活力测定用CCK-8法检测细胞活力,按照每孔1×104个细胞浓度,将90 μL细胞悬液种植于96孔板中,设置空白组,细胞生长稳定后给药组给予相应的药物,作用终止后吸去原有培养液,PBS漂洗2次后每孔加入10 μL CCK-8稀释液,37℃孵育4 h后,于450 nm下测量吸光度(A)。
3.4 SCAD酶活性检测各组细胞给予相应药物处理后,加入RIPA裂解液后,收集心肌细胞并于冰上裂解15 min,离心后取少量上清液用BCA试剂盒在波长570 nm处检测样品A值,代入标准曲线计算细胞蛋白浓度。按照VReagentC∶VReagentD∶VReagentE∶VReagentF=78∶10∶5∶5的比例于遮光处配制反应体系,以每孔100 μL加入酶活性板,置于酶标仪孵育20 min后加入20 μL的样品,于660 nm波长下检测样品A值,计算各组细胞SCAD酶活性。
3.5 细胞游离脂肪酸含量检测参照文献中的方法[13],游离脂肪酸与铜离子结合形成的脂肪酸盐溶于氯仿,其含量与铜离子含量成正比,通过检测铜离子即可检测游离脂肪酸含量。各组细胞给予相应的药物处理,作用终止后收集心肌细胞,测定蛋白浓度。在波长440 nm下通过紫外分光光度计检测细胞的A值。按照游离脂肪酸试剂盒说明书公式计算出各组别游离脂肪酸含量。
3.6 ATP含量检测严格按照ATP检测试剂盒说明书把ATP标准溶液稀释成适当的浓度梯度,按照VATP检测试剂∶VATP检测试剂稀释液=1∶9的比例配制工作液,于不透光的96孔板中每孔加入100 μL的工作液,室温下放置3~5 min后加入20 μL的标准品或者样品,用连续波长多功能酶标仪检测标准品和样品的RLU值,并制定标准曲线,把检测到的样品RLU值代入到标准曲线中,检测细胞蛋白浓度,计算出各组细胞ATP含量。
3.7 流式细胞术检测细胞凋亡利用荧光探针annexin V-FITC识别凋亡细胞外翻的磷脂酰丝氨酸,而PI拒染活细胞的实验原理,检测心肌细胞凋亡情况。各组细胞给予相应的药物处理后用不含EDTA的胰酶消化收集H9C2心肌细胞,离心后倒掉上清液,用冷的PBS漂洗细胞以洗去残余的胰酶,尽可能吸去PBS。加入400 μL annexin V结合液重悬细胞调整细胞浓度,转移至流式管中,于流式管中加入5 μL annexin V-FITC染色液,混匀后冰上避光孵育15 min,再加入10 μL PI染色液,混匀后避光孵育5 min,上机检测并统计心肌细胞凋亡百分比。
3.8 Western blot分析将H9C2细胞裂解收集于EP管中,离心后取部分上清用于检测蛋白浓度。蛋白在100℃下煮5 min。配制12%和10%的SDSPAGE凝胶。上样,按照浓缩胶70 V、30 min,分离胶120 V、90 min的条件电泳。电泳完后,将蛋白转移到PVDF膜上,330 mA、38 min快速转膜,配制5%的BSA溶液封闭PVDF膜1.5 h。封闭完后加入Ⅰ抗(SCAD抗体,1∶2 000;Bcl-2、pro-caspase-3和cleaved caspase-3抗体,1∶1 000;Bax抗体,1∶10 000;GAPDH抗体,1∶100 000),4℃孵育过夜。第二天将膜与Ⅱ抗室温下孵育1 h。洗膜后与化学发光底物结合在化学发光成像仪下曝光显影,检测蛋白表达。
3.9 ROS检测将H9C2细胞种植于6孔板,当细胞量达到80%加入相应的药物。作用终止后吸去原有培养液,PBS漂洗2遍后每孔加入浓度为10 μmol/L不含血清的DCFH-DA稀释液,在避光条件下置于细胞孵育箱孵育20 min,于黑暗处用不含FBS的高糖DMEM漂洗细胞以洗去未能与细胞充分结合的探针染料,用荧光显微镜于激发波长488 nm下观察荧光,并用ImageJ软件统计荧光强度。
3.10 RT-qPCR检测提取总RNA,测定RNA的浓度和纯度,选择纯度在1.8~2.0之间的样品进行RTqPCR。采用逆转录PCR试剂盒去除gDNA后逆转录合成cDNA,冻存于-20℃。根据SYBR Green试剂盒配制反应体系,进行cDNA的扩增和检测,详细引物序列见表1。
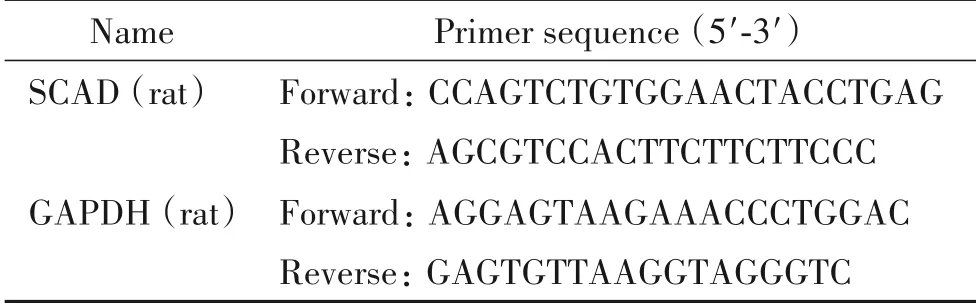
表1 RT-qPCR引物序列Table 1.Sequences of primers for RT-qPCR
4 统计学处理
以上所得数据用SPSS 25.0进行统计和分析,数据以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 不同浓度及作用时间的tBHP对H9C2心肌细胞活力的影响
如图1A所示,经浓度分别为0、50、100、200、300和400 μmol/L的tBHP干预6 h,心肌细胞活力随着tBHP浓度的增大而减小。如图1B所示,心肌细胞在200 μmol/L的tBHP作用下,作用时间分别为0、1、4、6和8 h时,细胞活力随着作用时间的增加而减小。tBHP浓度为200 μmol/L时干预心肌细胞6 h后,心肌细胞的活力降至50%左右,因此后续实验采用tBHP浓度为200 μmol/L干预6 h的实验条件进行研究。
2 不同浓度及作用时间的tBHP对H9C2心肌细胞SCAD蛋白和mRNA表达的影响
如图2所示,Western blot结果显示,心肌细胞在tBHP的干预下,SCAD蛋白表达随着tBHP浓度的增高和作用时间的延长而降低。RT-qPCR结果与Western blot结果趋势一致,tBHP浓度为200 μmol/L干预6 h时,SCAD mRNA的表达下降最为显著。该结果亦支持200 μmol/L的tBHP干预6 h作为后续实验条件。
3 FAD对H9C2心肌细胞SCAD表达水平的影响
0、0.1、1、10和20 μmol/L FAD预处理心肌细胞24 h后,tBHP作用6 h的条件下,与Con组相比,给予tBHP后,SCAD蛋白表达均显著下降(P<0.01);与tBHP组相比,不同浓度的FAD作用下,SCAD蛋白表达随着FAD浓度的增高而增加,在浓度为10 μmol/L时,SCAD蛋白表达增加最为显著(P<0.01),因此后续采用10 μmol/L作为FAD的实验剂量,见图3A。与Con组相比,tBHP诱导心肌细胞凋亡模型中SCAD的蛋白和mRNA表达显著减少,SCAD酶活性显著下降(P<0.01),给予FAD干预后,SCAD的蛋白和mRNA表达显著增加,SCAD酶活性显著增强(P<0.01),见图3B~D。
4 FAD对H9C2心肌细胞凋亡率和活力的影响
与Con组比较,tBHP组心肌细胞大量凋亡,凋亡率显著升高,给予FAD处理后心肌凋亡率显著下降,见图4A。与Con组比较,tBHP组心肌细胞活力显著减弱(P<0.01);经FAD干预后,与tBHP组相比,tBHP+FAD组心肌细胞活力显著增强(P<0.01),显示出与细胞凋亡率相同的趋势,见图4B。
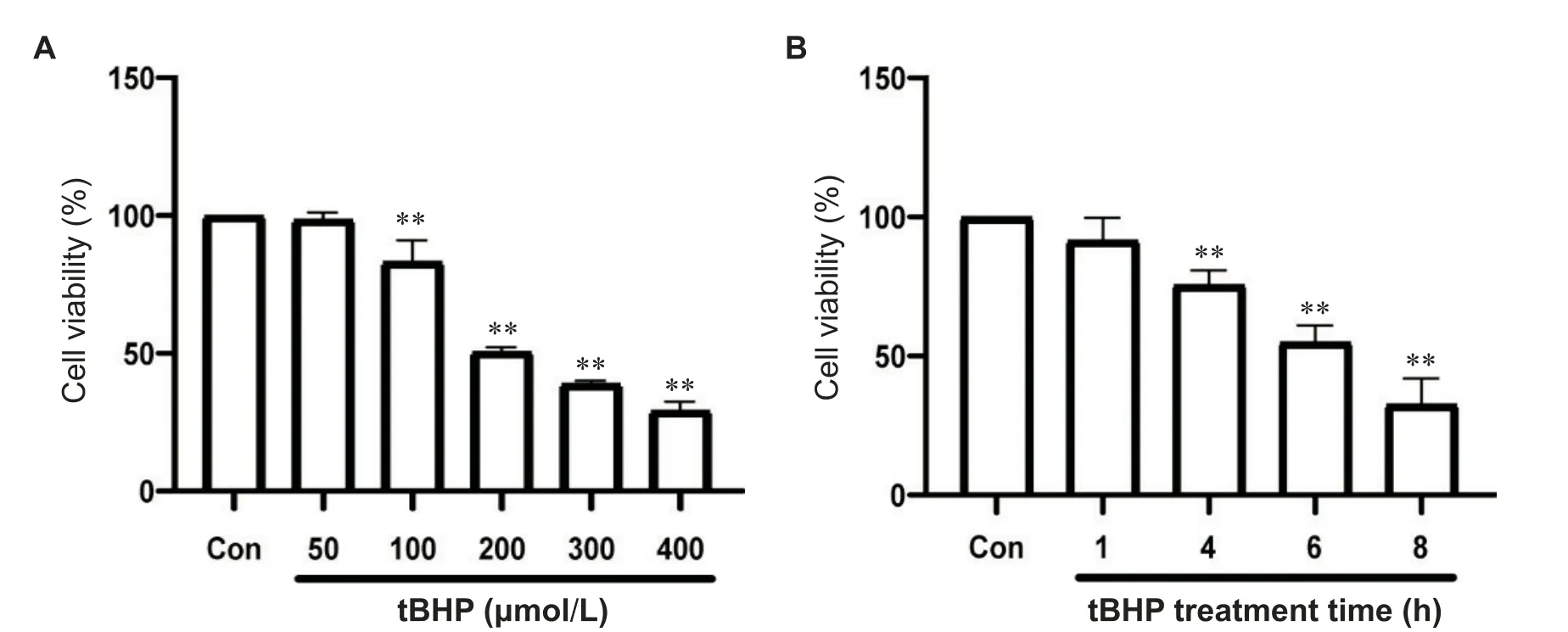
Figure 1.The effect of tBHP on the viability of H9C2 cardiomyocytes.A:the viability of H9C2 cardiomyocytes treated with different concentrations of tBHP for 6 h;B:the viability of H9C2 cardiomyocytes treated with tBHP(200 μmol/L)for different time periods.Mean±SD.n=3.**P<0.01 vs control(Con)group.图1 tBHP对H9C2心肌细胞活力的影响

Figure 2.The effect of tBHP on the protein and mRNA expression of SCAD in H9C2 cardiomyocytes.A:the protein expression of SCAD in H9C2 cardiomyocytes treated with different concentrations of tBHP;B:the protein expression of SCAD in H9C2 cardiomyocytes treated with tBHP for different time periods;C:the mRNA expression of SCAD in H9C2 cardiomyocytes treated with different concentrations of tBHP;D:the mRNA expression of SCAD in H9C2 cardiomyocytes treated with tBHP for different time periods.Mean±SD.n=3.**P<0.01 vs control(Con)group.图2 tBHP对H9C2心肌细胞SCAD蛋白和mRNA表达的影响
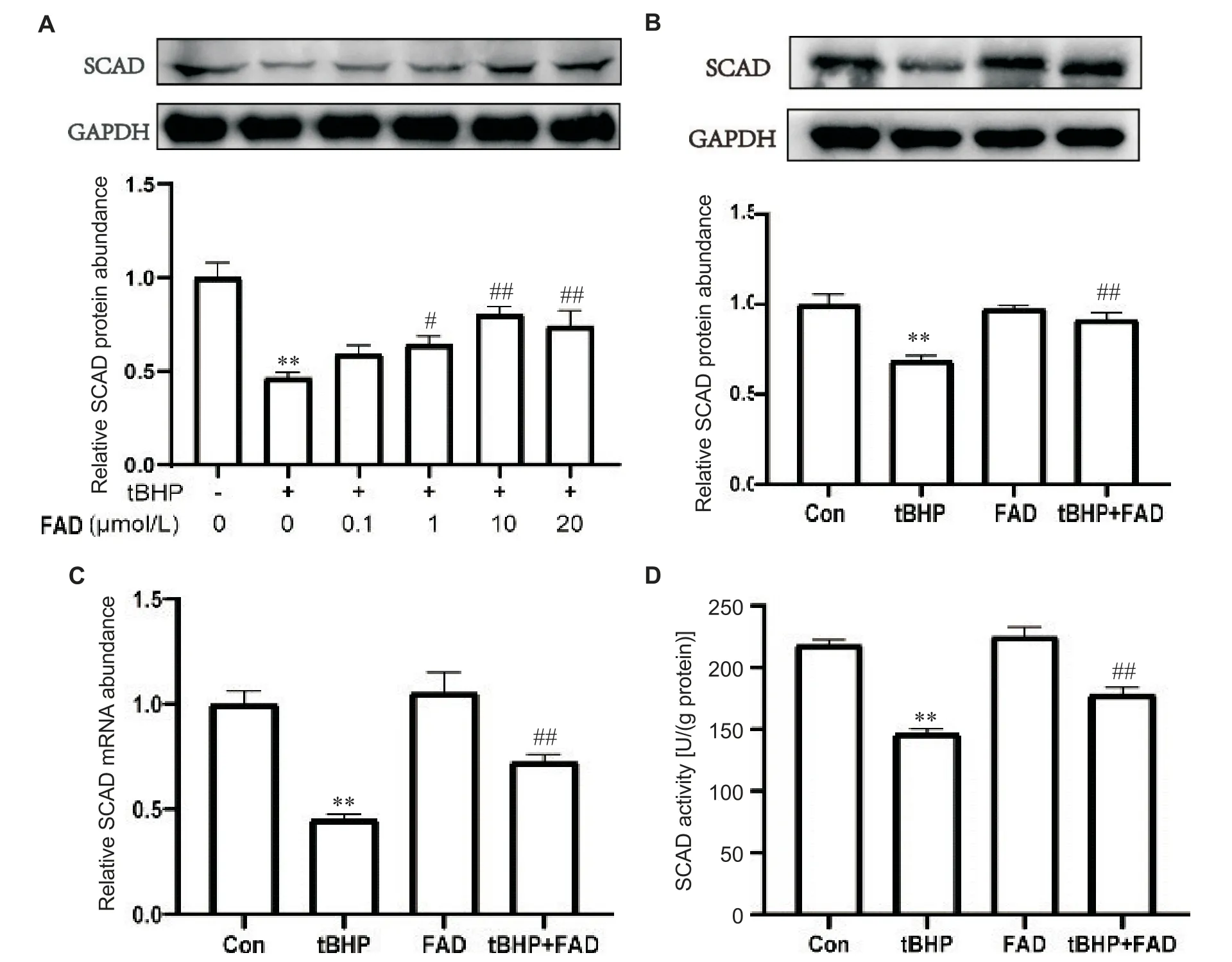
Figure 3.The effect of FAD on SCAD protein and mRNA expression in H9C2 cardiomyocytes.A:the SCAD protein expression in H9C2 cardiomyocytes treated with different concentrations of FAD;B:the SCAD protein expression in H9C2 cardiomyocytes treated with 10 μmol/L FAD;C:the SCAD mRNA expression in H9C2 cardiomyocytes treated with 10 μmol/L FAD;D:SCAD enzyme activity in H9C2 cardiomyocytes treated with 10 μmol/L FAD.Mean±SD.n=3.**P<0.01 vs control(Con)group;#P<0.05,##P<0.01 vs tBHP group.图3 FAD对H9C2心肌细胞SCAD蛋白和mRNA表达的影响
5 FAD对H9C2心肌细胞凋亡相关蛋白表达的影响
如图5所示,与Con组相比,tBHP组心肌细胞促凋亡蛋白cleaved caspase-3表达显著增加(P<0.01),抗凋亡蛋白Bcl-2与促凋亡蛋白Bax比值显著降低(P<0.01);经FAD干预,心肌细胞内cleaved caspase-3表达显著减少(P<0.01),Bcl-2/Bax比值显著上升(P<0.01)。
6 FAD对H9C2心肌细胞能量代谢的影响
与Con组相比,tBHP组心肌细胞ATP含量显著减少(P<0.01);给予FAD干预后,与tBHP组相比,tBHP+FAD组心肌细胞ATP含量显著增加(P<0.01),见图6A。与Con组相比,tBHP组心肌细胞游离脂肪酸含量显著增加(P<0.01);给予FAD干预后,与tBHP组相比,tBHP+FAD组心肌细胞离脂肪酸含量显著减少(P<0.01),见图6B。
7 FAD对H9C2心肌细胞ROS含量的影响
如图7所示,与Con组相比,tBHP组ROS含量显著增加(P<0.01),心肌细胞内氧化应激水平显著增强;与tBHP组相比,经过FAD处理后,tBHP+FAD组心肌细胞内ROS含量显著减少(P<0.01),心肌细胞氧化应激水平显著下降。
讨 论
SCAD是脂肪酸β氧化的限速酶,也是黄素蛋白之一,在心肌能量代谢中发挥重要作用。FAD是电子转移黄素蛋白泛醌氧化还原酶的辅助因子,构成了许多线粒体黄素蛋白脱氢酶的电子传递途径,参与脂肪酸和氨基酸代谢。生理浓度下的FAD能够显著提高酰基辅酶A脱氢酶的稳定性,FAD的结合对于黄素蛋白的催化活性以及正确的折叠、组装和蛋白质稳定性非常重要[14],FAD结合位点的不稳定性可能损害电子传递系统从而引起多酰基辅酶A脱氢酶缺乏症[15]。
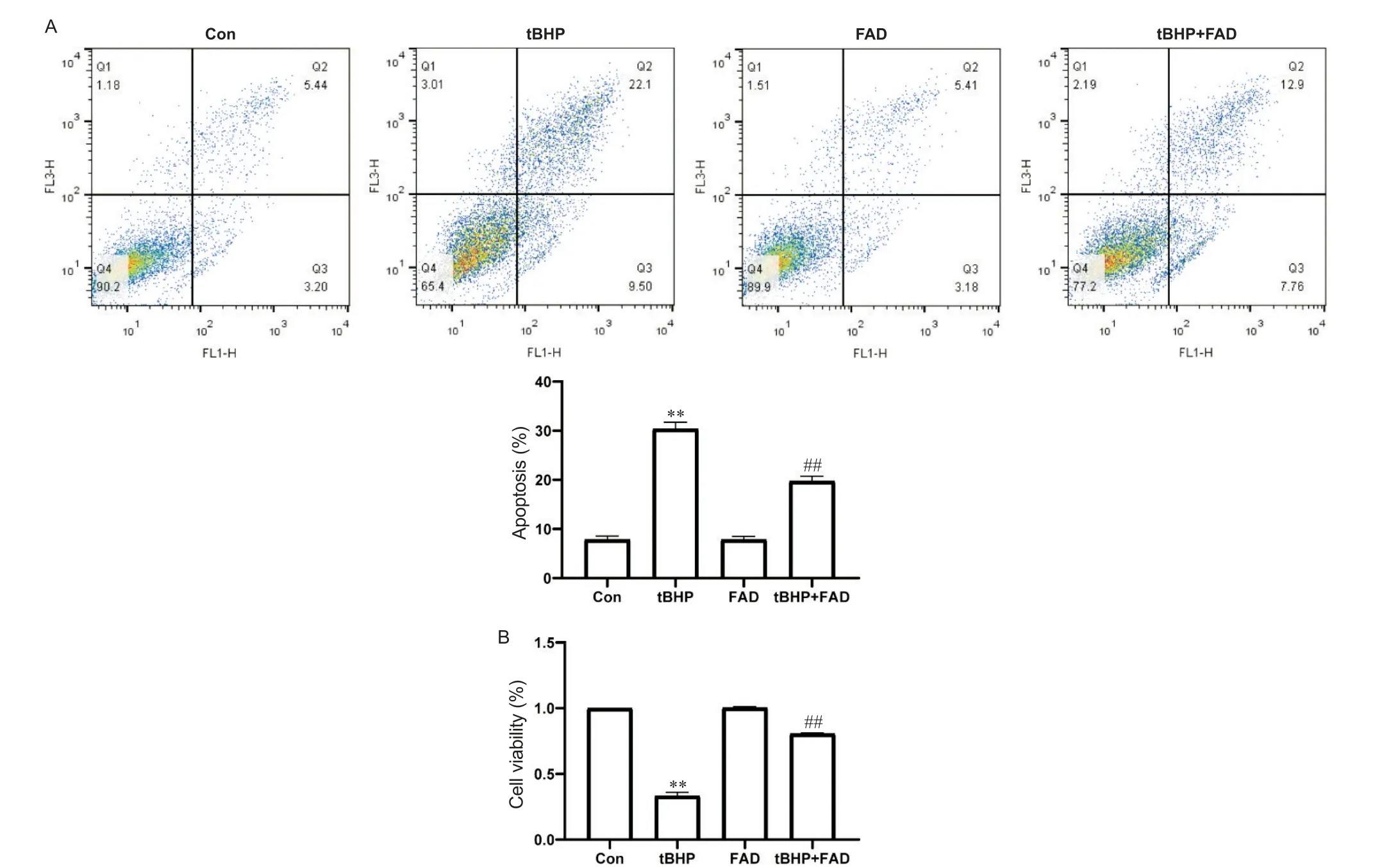
Figure 4.The effect of FAD on the apoptosis(A)and viability(B)of H9C2 cardiomyocytes.Mean±SD.n=3.**P<0.01 vs control(Con)group;##P<0.01 vs tBHP group.图4 FAD对H9C2心肌细胞凋亡率和细胞活力的影响

Figure 5.The effect of FAD on the expression of apoptosis-related proteins in H9C2 cardiomyocytes.Mean±SD.n=3.**P<0.01 vs control(Con)group;##P<0.01 vs tBHP group.图5 FAD对H9C2心肌细胞凋亡相关蛋白表达的影响
我们前期研究证明,SCAD表达下调与原代乳鼠心肌细胞凋亡密切相关,敲低SCAD基因的原代乳鼠心肌细胞,其凋亡程度显著增加[8]。FAD可抑制自发性高血压大鼠心肌肥厚和纤维化[12];改善内皮细胞功能,保护内皮细胞免受tBHP诱导的损伤[16]。tBHP与H2O2性质相似,具有稳定性高,不易降解的优点,可诱导细胞体外凋亡[17]。因此,本研究进一步采用tBHP构建心肌细胞凋亡模型,探究FAD对tBHP诱导H9C2心肌细胞凋亡的影响及其可能的作用机制,为FAD用于临床防治心肌细胞凋亡相关疾病提供实验依据。
本研究中,在tBHP刺激下,H9C2心肌细胞凋亡率显著增加,促凋亡蛋白表达增加,抗凋亡蛋白表达减少。经FAD干预后,H9C2心肌细胞凋亡情况缓解,促凋亡蛋白表达显著减少,抗凋亡蛋白表达显著增多,表明FAD对H9C2心肌细胞具有保护作用。tBHP诱导的H9C2心肌细胞,SCAD表达显著下调;经FAD干预后,SCAD酶活性增加,蛋白和mRNA表达增多,H9C2心肌细胞凋亡率显著下降,表明FAD可能通过增加SCAD表达,进而抑制H9C2心肌细胞凋亡。

Figure 6.The effect of FAD on energy metabolism in H9C2 cardiomyocytes.A:content of ATP in H9C2 cardiomyocytes;B:content of free fatty acid in H9C2 cardiomyocytes.Mean±SD.n=3.**P<0.01 vs control(Con)group;##P<0.01 vs tBHP group.图6 FAD对H9C2心肌细胞能量代谢的影响

Figure 7.The effect of FAD on the content of ROS in H9C2 cardiomyocytes.Mean±SD.n=3.**P<0.01 vs control(Con)group;##P<0.01 vs tBHP group.图7 FAD对H9C2心肌细胞ROS含量的影响
研究结果显示,在tBHP刺激下,H9C2细胞ATP含量减少、游离脂肪酸含量增加,ROS蓄积增多,表明H9C2细胞出现了明显的能量代谢障碍。给予FAD干预后,H9C2细胞ATP含量增加、游离脂肪酸含量减少,ROS蓄积减轻,表明FAD能显著改善H9C2细胞能量代谢障碍。心肌细胞能量的70%来源于脂肪酸β氧化[18]。在tBHP刺激下,H9C2细胞SCAD表达下调,引起脂肪酸β氧化减少,ATP含量减少,游离脂肪酸含量增多。细胞内沉积的游离脂肪酸进入线粒体,破坏线粒体功能,损坏磷酸复合物,影响线粒体呼吸链的电子传递,导致ROS蓄积[19-21]。表明FAD可能通过增加H9C2细胞SCAD表达,促进脂肪酸β氧化,改善细胞能量代谢障碍,降低细胞内氧化应激水平,从而抑制细胞凋亡信号途径。
我们前期研究证实,在分子动力学模拟中,与APO体系(无底物无FAD)相比,FAD-SCAD体系(无底物,有FAD)中SCAD蛋白结构的均方根偏差与回转半径值更低,原子波动幅度更小,二聚体的膨胀程度更低,具有更高的稳定性和更紧密的分子结构[12]。此外,与FAD-SCAD体系相比,APO体系的底物口袋塌陷,而FAD的存在可防止底物口袋塌陷,有利于底物顺利进入催化口袋完成催化反应。FAD对SCAD蛋白结构的紧密度以及催化口袋的稳定至关重要,表明FAD是SCAD稳定发挥催化反应的前提。因此,增加FAD在SCAD中结合位点的饱和度,可能是FAD促进脂肪酸β氧化,抑制心肌细胞凋亡的机制之一。
综上所述,FAD可能通过结合SCAD口袋,稳定其结构,提高SCAD酶活性,增加SCAD表达,促进脂肪酸β氧化,改善心肌细胞能量代谢,降低细胞内氧化应激水平,从而抑制心肌细胞凋亡。本研究从心肌细胞能量代谢视角阐明FAD在心肌细胞凋亡中的作用,为临床上FAD用于防治心肌细胞凋亡相关疾病提供了实验依据。然而,FAD通过激活SCAD抑制心肌细胞凋亡的分子机制,尚需深入研究。

