青光眼的微创手术治疗和引流装置
汪传梅
传统的青光眼治疗手术(如小梁切除术)创口较大、组织损伤严重、并发症较多,且出现瘢痕化,继而会造成两个严重问题:(1)机体总会倾向于修复手术建立的人工通道,造成滤过通道瘢痕化。瘢痕化的形成会再次阻塞房水的通过,眼压也就再次升高。因此一般需要在术中、术后使用抗瘢痕生长药物(如丝裂霉素C、5-氟尿嘧啶C4H3FN2O2等);(2)抗瘢痕药物能控制瘢痕形成,但也不可避免地会杀死结膜组织中的正常细胞,使得正常细胞减少。而房水又长期在滤过泡内流动和冲刷,必将造成结膜组织越来越薄,甚至穿破,发生滤过泡渗漏。更为严重的是外界各类致病微生物也可能从此进入眼内引发眼内炎,对眼球造成毁灭性损伤。
随着医学技术的发展和临床研究的深入,微创青光眼手术(minimally invasive glaucoma surgery,MIGS)出现并推广起来,它可以在微创的基础上实现房水外流降低眼压,而尽量不损伤患眼的结膜和巩膜。和传统的手术方法原理不同,MIGS改“破”为“通”,为轻、中度进展性青光眼患者提供了简单、有效而且安全的手术方式,优势突出且安全性强。由于医学界的努力,MIGS实现方式多样,且研发出多种新装置来形成房水引流途径,保证患者眼压长期稳定,并使临床医师可在青光眼早期就可进行有效干预,及时治疗,大大降低了患者因青光眼致盲的可能性。
一、引流方式
根据引流实现原理和装置植入位置的不同,MIGS有四种增加房水流出的引流方式(见图1:MIGS手术分类和代表性植入装置),具体如下。
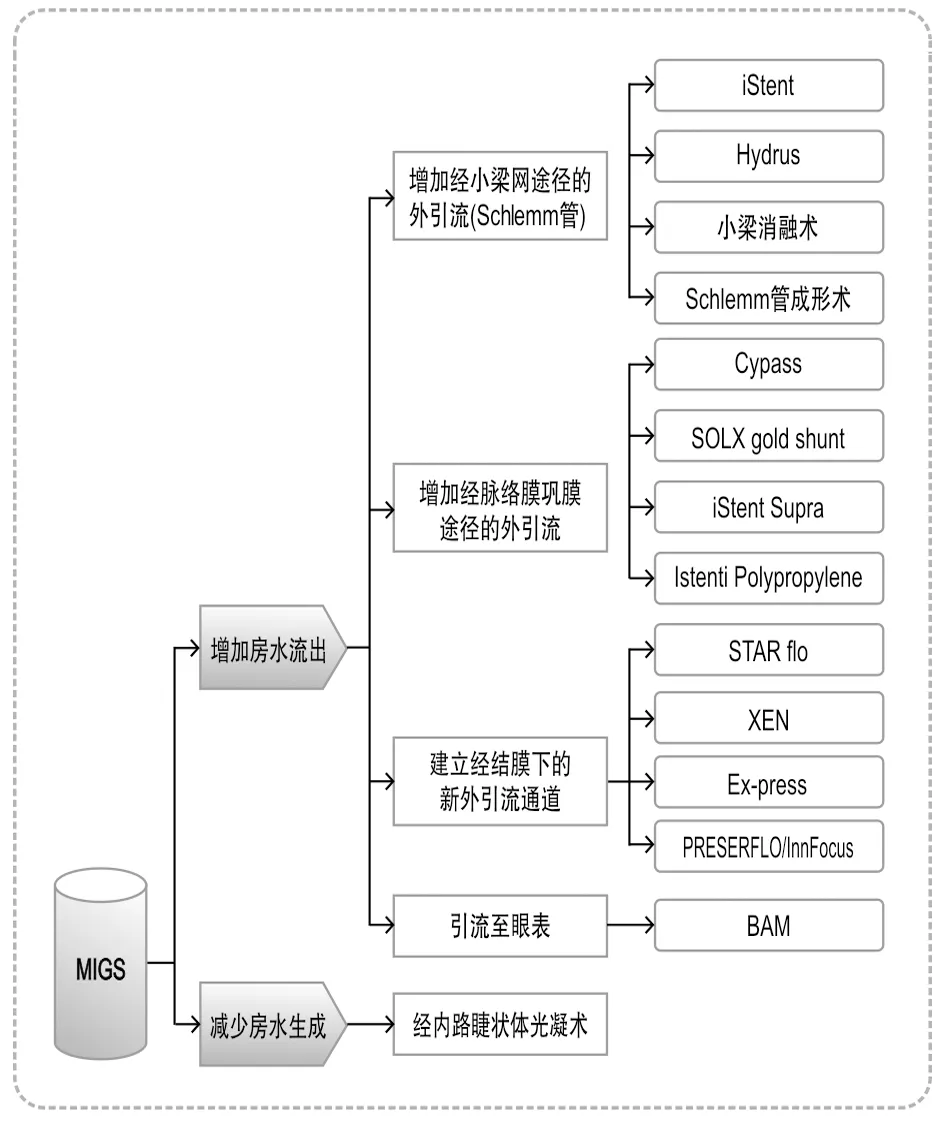
图1 MIGS手术分类和代表性植入装置
1.小梁网旁路引流 应用特殊的微型引流装置将房水直接引流入Schlemm管,再进入集液管。该手术依赖于除小梁网以外的外引流通道功能,其降眼压幅度依赖于房水的静脉压,受到一定的限制。采用这类引流方式的装置主要有iStent(第一、二代)和Hydrus等。
2.脉络膜上腔引流 该引流方式是基于前房和脉络膜上腔的压力差来增加房水自葡萄膜、巩膜途径的排出,在房角镜辅助下标定引流目标在脉络膜上腔植入引流器。采用这类引流方式的植入装置有iStentSupra,GMS(TheSOLXgoldmicroshunt)和CyPassMicroStent等。
3.结膜下引流 通过植入装置连通结膜下间隙和前房,使得前房的房水排出以降低眼压。该治疗方法损伤小,安全有效性高。采用这类引流方式的植入装置主要有XEN凝胶支架(Allergan)、Ex-PRESS引流钉和PRESERFLO Micro Shunt(InnFocus Micro Shunt)等。
4.眼表引流 这是一类新型的房水引流方式,即通过植入装置内部设置的一条水凝胶通道引导房水从前房直达眼表,直接把房水引流至角膜外以控制眼压。当前采用这类引流方式的植入装置有Beacon Aqueous Microshunt(BAM)。
不同引流方式原理上的差异造成使用的引流装置不同,同一种引流方式也有着不止一种的引流装置,所以当前青光眼微创治疗的引流装置种类很多,原理各异,使用方法也各不相同(常见的MIGS引流装置见图2:部分MIGS引流装置所示)。
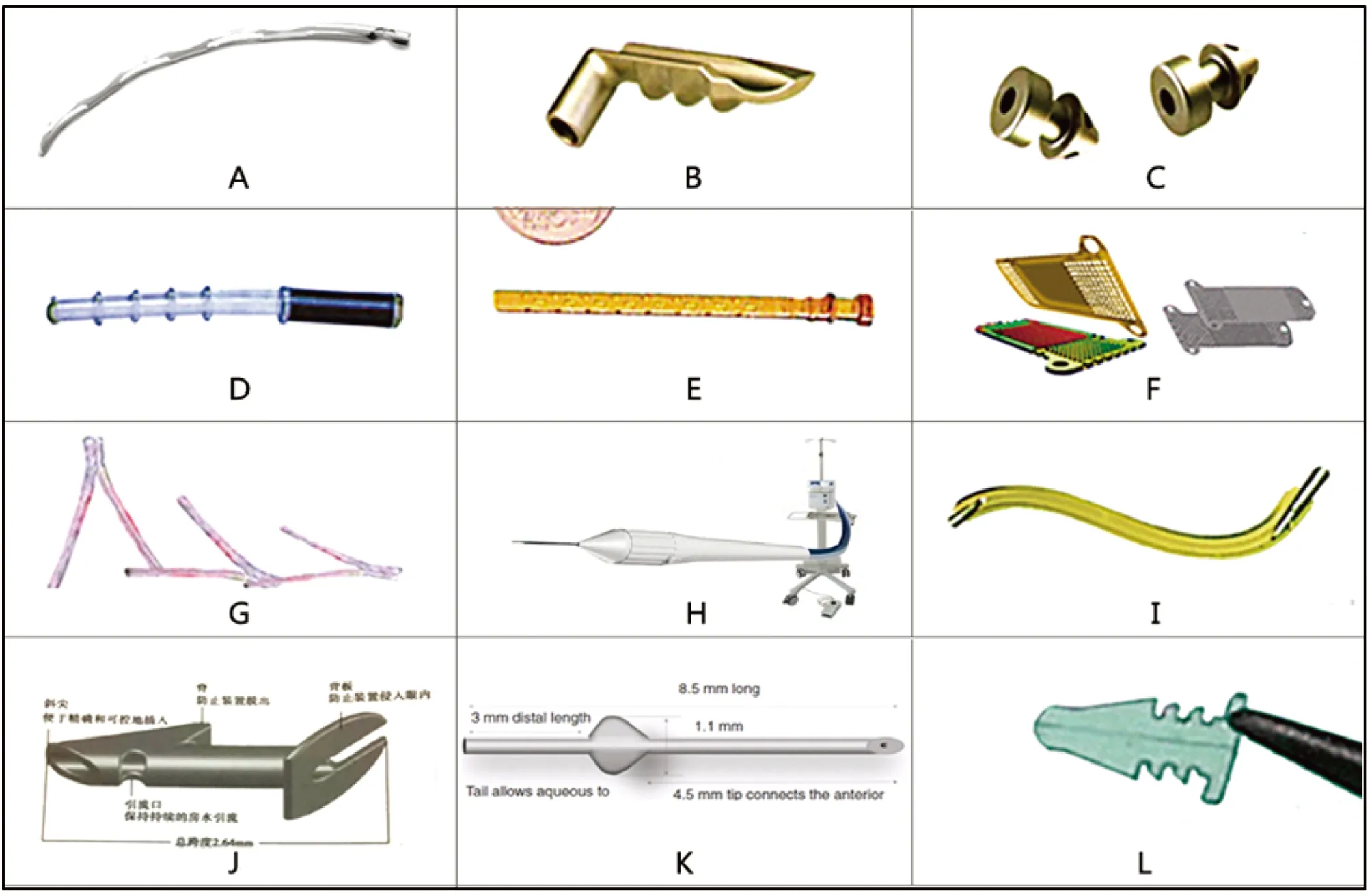
图2 部分MIGS引流装置A:Hydrus B:iStent(第一代) C:iStent(第二代) D:iStent(第三代) E:Cypass F:GMS G:Eyepass H:小梁消融仪 I:Xen J:Ex-PRESS K:PRESERFLO/InnFocus L:BAM
二、引流装置
1.小梁网旁路引流装置 Hydrus微型支架(图2A):Hydrus由Ivantis公司在2011年研发,于2018年8月获得FDA批准,用于治疗轻、中度原发性开角型青光眼患者,获得欧洲统一(CONFOR MITE EU ROPEENNE. CE)认证,在欧洲和澳大利亚也都有销售。Hydrus微型支架由镍钛记忆合金制成,长约8 mm,内有数个通向后部的管腔,主要适用于治疗慢性开角型青光眼。Hydrus预装在植入器内,使用时可通过颞下1~1.5 mm透明角膜切口植入鼻侧一个象限的Schlemm管内,释放后支架扩张增进房水的引流。2019年,Samuelson等[1]对伴有原发性开角型青光眼(primary open-angle glaucoma,POAG)的白内障受试者在行超声乳化白内障手术后,分为观察组(HMS组:植入Hydrus微型支架)和对照组(NMS组:不放置支架)随访24个月的疗效分析,两组均无严重的眼部不良事件,观察组眼压平均减少(7.6±4.1)mmHg,平均使用降眼压药物从基线检查时的(1.7±0.9)mmHg降低到(0.3±0.8)mmHg;对照组眼压平均减少(5.3±3.9)mmHg,平均使用降眼压药物从基线检查时的(1.7±0.9)mmHg降低到(0.7±0.9)mmHg。该项目研究结论是与单纯白内障超声乳化术相比,接受Hydrus微型支架联合白内障超声乳化术的轻度至中度POAG受试者比未接受支架植入的受试者在眼压控制和降眼压药物使用数量上效果更佳。 James等[2]报道了对11例人工晶状体眼患者接受Hydrus植入术治疗开角型青光眼的长期眼压控制情况和抗青光眼药物使用数量的随访结果,术前每天使用3种或更多降眼压药物,术后1、3、6、11、24、36、48个月和60个月对患者进行随访,发现每隔12个月和24个月,药物负担可减少75.6%,眼压分别降低43.8%和34.1%。并发症包括4例前房积血和1例角膜上皮缺损,每例均痊愈。说明Hydrus植入术对于人工晶状体眼患开角型青光眼的治疗和减少患者药物负担的长期有效性。Ahmed等[3]对152名年龄45~84岁的开角型青光眼患者的152只眼分别植入Hydrus和Istent装置进行术后效果跟踪研究,有148名(97.3%)完成了12个月的随访。结果表明Hydrus具有更高的手术成功率和更少的药物使用,在控制眼压和减少降压药物需求方面有很好效果。和iStent植入者相比,更多的Hydrus受试者在12个月时已无需药物治疗。iStent组2只眼进行继发性青光眼手术,而Hydrus组无行此手术。
2.小梁旁路引流(内引流)装置 小梁网微分流支架iStent(图2B-C):2012年FDA批准了美国Glaukos公司研发的iStent支架使用,当前iStent已成为全美最普遍的MIGS术式装置。iStent采用非磁性钛材料制成,使用时要通过小梁网植入Schelmm管,使房水从前房流入Schelmm管而降低眼压。第一代iStent(GTS-100)(图2B)呈L型,长1 mm,是目前最小的眼内植入装置。iStent的植入通常是终身稳定的,一般只在房角镜检查时可见。iStent能持续稳定降低眼压,即24 h/7 d不间断。白内障联合iStent植入手术对降低眼内压有较显著的效果,但由于操作者对手术熟练程度的不同,在植入时可能会有微量前房出血。
2015年,Jay等[4]对119例POAG患者行多枚iStent植入术并进行前瞻性研究,患者分三组:第一组38只眼,植入1枚iStent支架;第二组41只眼,植入2枚iStent支架;第三组40只眼,植入3枚iStent支架,术后不使用降眼压药物,随访18个月发现:第一组眼压控制在(15.9±0.9)mmHg;第二组眼压控制在(14.1±1.0)mmHg;第三组眼压控制在(12.2±1.1)mmHg,说明患者的眼压下降程度和植入的iStent支架数量相关。因此对患者而言,iStent的植入能有效控制眼压,且能免除使用抗青光眼药物的麻烦,这一作用至少可持续至术后18个月,植入的支架数目越多眼压控制越明显,但临床上应考虑患者对植入多个iStent的经济承受能力。
根据HadiZiaei等[5]在2021年发布的对41例开角型青光眼患者接受了超声乳化联合第一代istent植入术的为期84个月的有效性和安全性研究,主要观察指标为眼压(IOP)和视力,次要观察指标为青光眼药物滴眼数、视力、杯盘比率(cup to disc ratio,CDR)、平均偏差(mean deviation,MD)和视野指数(visual field index,VFI)等。结果显示眼压平均降低4.87 mmHg,青光眼药物滴眼次数平均降低0.59次,logMAR VA改善了0.21(95%可信区间0.08~0.34),CDR、MD和VFI等指标无明显变化。术前患者每年的平均就诊次数为2.4次,而术后为1.7次,说明该手术后,患者的生活质量得以提高,第一代Istent支架有持续降低眼压和减少青光眼药物使用数量的效果。
第二代iStent名为iStent inject(图2C),使用钛金属材料制成,最大长宽尺寸为360 μm×230 μm。该装置在手术时经推注器植入,操作难度相比第一代有所降低。2015年,Klamann等[6]发表了对35例青光眼患者行iStent inject植入的疗效分析,这些患者分别患有不同类型的青光眼,其中有原发性开角型青光眼(POAG)17例,色素性青光眼(PG)3例,假剥脱性青光眼(PEX)15例。术后随访6个月显示POAG患者的平均眼压平均下降了33%,PG患者眼压由术前的(28.31±3.21)mmHg下降到(12.33±4.93)mmHg,而PEX患者的眼压平均下降了35%,该研究表明iStent inject对不同青光眼患者治疗的有效性,且支架阻塞的发生率低,阻塞区域可以用YAG激光治疗。
根据Thomas等[7]研究,显微小梁微旁路支架的植入比大型青光眼装置的侵入性小,虽然其眼压的降低比晚期青光眼所需的滤过手术更为温和,但术式更加安全可靠,且并发症发生很少,根据对387只Istent支架植入患眼术后随访24个月结果,未出现滤过手术所见的并发症(如眼内炎、低眼压、滤过泡感染、角膜失代偿、脉络膜出血或渗出等)。
3.脉络膜上腔引流装置 (1)iStent Supra(图2D):iStent Supra是第三代的iStent支架,也是由Glaukos公司研发。与前两代的原理完全不同,iStent Supra通过内路植入脉络膜上腔引导房水流入,即通过建立沟通前房与脉络膜上腔的房水流出通道来降低眼压,避开了小梁网和巩膜静脉窦,适用于多种类型的青光眼患者。在Myers等[8]进行的一项长期研究中,对80例平均眼压为(26.4±2.4)mmHg的难治性青光眼患者进行Istent和Istentsupra联合植入的方法进行治疗,这些患者在此前均已接受过1次或多次青光眼手术,日常需使用1~3种降眼压药物,但眼压仍然高于18 mmHg。联合植入时,所有患者接受了1个iStentSupra和2个iStent的植入进行治疗,术后随访48个月发现有97%的患者眼压小于15 mmHg,且控制稳定。
(2)CyPass(Alcon)(图2E):CyPass支架是美国Alcon公司研发的MIGS植入装置,由聚酰胺材料制成,长度6.35 mm,内径300 μm,外径510 μm,可在房角镜辅助下通过透明角膜切口植入,从而创建一条从前房到脉络膜上腔的房水引流通道,使房水避开小梁网流入睫状体和脉络膜上腔。CyPass微型支架获得了CE认证,主要被用来治疗轻中度开角型青光眼。
2012年,Hoeh等[9]报导的一项对184例患者随访6个月的研究结果表明进行超声乳化联合Cypass植入的方法对治疗开角型青光眼手术有效,且较少发生并发症,有13.8%的患者发生早期一过性低眼压,10.5%患者发生短暂的眼压上升。ItayEGabbay等[10]于2019年发表的对2017~2018年共计69例接受CyPass治疗患者的随访研究,其中27例(42%)患者进行了超声乳化联合CyPass手术。术后3个月时,患眼平均眼压由(24.6±7.2)mmHg降低到(16.2±7.5)mmHg,随访12个月后平均眼压为(16.4±4.5)mmHg。2016年,VoldS等[11]的一项针对开角型青光眼的多中心随机对照研究发现:超声乳化白内障摘除联合CyPass微型支架植入组中有77%的患者眼压下降20%以上,对照的单独超声乳化白内障摘除手术组只有60%患眼达此标准,且Cypass支架阻塞发生率仅为2.1%左右,研究结果表明CyPass微支架可安全、持续地降低轻、中度POAG合并白内障患者的眼压和控制青光眼药物使用数量。
2018年,Alcon公司宣布,基于COMPASS-XT长期安全性研究的五年术后数据表明,Cypass支架植入组可观察到角膜内皮细胞损失增加,且具有临床和统计学意义,该植入装置同年8月退出全球市场。
(3)The SOLX gold micro shunt(GMS)(图2F):GMS是由SOLX公司研发的一种长方形双层结构无瓣扁平板状MIGS引流装置,为脉络膜引流手术植入装置的代表。GMS由24K金制成,尺寸为5.2 mm×3.2 mm×44μm(长×宽×厚度,厚度另有24 μm、48 μm等不同尺寸,最新一代厚度为68 μm)。GMS的两层间有9个并排的管道,供房水自前房引流进入脉络膜上腔;一端为前房端,有1个直径300 μm的大孔和60个直径100 μm的小孔,这些孔洞可以将前房的房水引流进其中间的引流管;另一端为其脉络膜上腔端,有117个直径110 μm的孔隙用于将房水从引流管引入脉络膜上腔;GMS植入后房水就可以通过“前房→GMS(前房端→大、小孔洞→引流管→孔隙→脉络膜上腔端)→脉络膜上腔”过程引流入脉络膜;脉络膜上腔端还有两个圆形突出物通过锚可以固定在脉络膜上空间以确保植入物的稳定。GMS已在加拿大及部分欧洲国家批准用于临床,目前正进行治疗开角型青光眼的多中心临床试验。
2016年,Skaat等[12]比较了GMS与Ahmed青光眼阀(AGV)的疗效:29名患有难治性青光眼的成人(29只眼)被随机分配进行AGV、24 μm GMS或48 μm GMS植入术,术后随访60个月,各组患者的最终眼压均显著低于术前:AGV组术后眼压对比术前为(17.3±2.6)mmHg .vs.(33.5±6.7)mmHg;24 μm GMS组对比为(17.8±2.4)mmHg .vs.(25.7±0.7)mmHg;48 μm GMS组对比为(19.6±5)mmHg.vs.(35.6±2.2)mmHg;初始和最终平均用药次数之间的差异不显著,60个月累积成功率分别为77.8%、77.8%和72.7%,表明两种GMS和Ahmed的长期疗效均近似。2017年,Tanito等[13]报道了对24例植入GMS的患眼的临床研究,随访12个月眼压平均降幅为23%,局部用药减少40%,但发现前房积血的发生率较高,达到21%。
4.外引流装置 Eyepass小梁网分流器(图2、G):Eyepass小梁网分流器由GMP(Corp.,US)研发,呈“Y”字形,由硅橡胶材料制成。该装置多用于治疗原发性开角型青光眼(primaryopenangleglaucoma,POAG)。临床上在常规小梁切除术作结膜瓣和巩膜瓣成功后植入,植入时先打开Schlemm管外壁并用黏弹剂扩张管腔,把Eyepass两臂完全插入Schlemm管,巩膜瓣下行前房穿刺,把约1 mm长的引流管联合端插入前房(无需缝线固定),分别缝合巩膜瓣和结膜瓣完成。
Dietlein等[14]对12例(12只眼)患有POAG或剥脱性青光眼合并白内障患者行白内障超声乳化术联合Eyepass引流管植入并随访(7.1±3.3)个月显示:手术成功率为88.33%(术中发生小梁网穿孔2例),术后第1天的最高眼压由(30.4±7.5)mmHg降到(12.0±6.1)mmHg,术后4周眼压是(17.2±4.1)mmHg,至随访结束时眼压为(18.3±4.5)mmHg,同时视力提升(0.9±0.8)行,患者使用的抗青光眼药物数量从术前的(3.2±0.8)种降到(0.9±0.7)种,眼压控制结果和超声乳化联合小梁切除术的治疗效果相当。
2017年,Barbara Wittmann等[15]对植入Eyepass的15例(16只眼)进行60个月随访,其中14只眼植入成功,平均眼压从(26.4±8.1)mmHg降到(16.4±5.3)mmHg。抗青光眼药物的平均数量从(2.1±1.2)种降到(0.9±1.2)种;平均最佳矫正视力无明显变化,5例术后60个月无需降压治疗。出现的并发症是暂时性低眼压,另有两名患者因植入物位置不当进行翻修手术。
Eyepass小梁网分流器植入术相对安全但也有一定局限性:(1)青光眼患者的Schlemm管并不一定完好,部分Schlemm管可能因小梁网硬化造成闭塞;(2)术后房水流出可能仅在部分管段得到增强,无法改善所有闭塞部分的管腔;(3)有研究显示靶眼压值相对较低会影响其疗效,但详细情况尚需进一步研究以证实。
5.解除小梁网阻塞 小梁消融术(图2H):小梁消融术是一种使用探针在前房插入Schlemm管内来消融部分小梁使房水直接进入Schlemm管回流的手术方式,代表装置为小梁消融仪Trabectome(NeoMedix公司),其作用部位是上1/3的小梁网,不破坏Schlemm管外壁、集液管和房水静脉。手术时可以选择性去除小梁网和Schlemm管内壁使房水直接流入集液管中,而房水外流系统则保留相对完整。Trabectome适用于开角型青光眼(含色素性青光眼、剥脱性青光眼及激素敏感型青光眼等),适用于要服用多种药物降眼压却不够理想的情况。该术式对患者的目标眼压定义较高,在(14~18)mmHg之间,且要求可清晰观察到房角结构,既往未施行过房角手术和睫状体激光光凝手术,可联合白内障超乳手术同步进行。国内对于小梁消融术的疗效有不少研究成果,如张思瑶等[16]对具有青光眼滤过性手术联合白内障超声乳化手术指征的原发性闭角型青光眼合并白内障的患者16例行白内障超声乳化加人工晶状体植入和房角分离手术,再行小梁消融术(小梁消融范围为鼻侧90°~120°),术后随访6个月发现眼压由术前的(33.4±12.4)mmHg降低到(13.3±1.8)mmHg,用降眼压药从原来的(2.1±0.5)种减少到(0.5±0.7)种。李雪等[17]通过对108例开角型青光眼患者的手术疗效进行分组研究,其中外路组(行外路小梁切开术)和消融组(行小梁消融术)各54 例。消融组治疗的总有效率为 98.15%,高于外路组的94.44%;治疗6个月后两组的眼压、局部降眼压用药无显著差异,但消融组的并发症总发生率仅为5.56%,远低于外路组的20.37%。说明外路小梁切开术与小梁消融术均是治疗开角型青光眼的有效手术方法,但小梁消融术的安全性高、创口更小、患者恢复更快且并发症的发生率较低。
6.结膜下引流装置 (1)Xen gel stent(图2I):Xen凝胶支架(Xengelstent)由Allergan研发,属于结膜下引流装置,通过巩膜脉络膜途径降低眼压。Xen由猪胶原蛋白和戊二醛交联材料制成,该材料和眼表组织相容性很好。Xen凝胶支架是通过不同长度和内径来控制房水外流量,共有三种型号,分别是Xen45、Xen63和Xen140,其长度均为6.0 mm,但内腔的内径不同(分别为45 μm、63 μm和 140 μm),目前商用的是Xen45。XEN可独立于白内障手术植入,适用于原发性开角型青光眼、难治性开角型青光眼、合并白内障的开角型青光眼及各类继发性开角型青光眼等的治疗,也适用于难治性青光眼的治疗。
2016年,Ahmed Galal等[18]进行一项XEN治疗POAG的疗效研究,对眼压失控、治疗不耐受,或接受了最大限度药物治疗的POAG患者共13眼接受了结膜下丝裂霉素C的XEN植入,其中3眼为人工晶状体眼,10眼行超声乳化术和XEN。对所有患者随访一年,观察包括眼压、药物使用量、视力和并发症等情况。治疗完全成功(眼压降低≥术前12个月基线检查的20%,无任何青光眼药物治疗)和部分成功(眼压降低≥服用药物1年时为20%)。术后随访表明患者眼压下降,BCVA(logMAR)为0.33±0.34提高了0.13±0.11,平均用药数量从1.9±1种降至0.3±0.49种,42%的眼睛获得完全成功。并发症包括2眼脉络膜脱离,1眼植入物挤出。研究表明Xen凝胶支架引流装置植入手术的作用确实有效。2020年,据Lotte等[19]报道,对行XEN凝胶支架引流装置植入和行PRESERFLO MicroShunt植入术的各41眼进行分组研究,随访24个月,XEN组降低眼压的药物数量从(2.5±1.4)种下降到(0.9±1.2)种,PRESERFLO组从(2.3±1.5)种下降到(0.7±1.1)种;Xen组和PRESERFLO组24个月的合格成功率分别为73%和79%;两组均未发生严重和非自限性术后并发症。说明两种装置在降眼压和手术成功率方面均有较高的有效性和安全性。Xen凝胶支架植入手术过程方便快捷,而且不良事件发生率低。2019年5月,Xen45凝胶支架作为我国首个微创青光眼植入装置在海南植入成功。
(2)Ex-PRESS青光眼引流钉(图2J):Ex-PRESS青光眼引流器早在2002年就经美国FDA批准,适用于各种类型的青光眼治疗。这是一种具有生物相容性的不锈钢管,用于将房水引流至结膜下空间。装置根据不同内径的大小及排水阻力分为P-200、P-50和R-50三种类型,全长均为3 mm,外径均为400 μm,P-200模型内径为200 μm,R-50和P-50模型内径均为50 μm,术中需在结膜上创建巩膜瓣和滤过泡,把前部2.5 mm植入前房。其标准化的管腔直径和长度转化为固定的预定义流动阻力,提供均匀的过滤。
因引流装备的成本较高,对于那些期望手术更安全、术程更短、手术效果好的患者,可以考虑推荐使用Ex-PRESS青光眼引流钉:P-200型引流钉适用于年轻或需要长期药物治疗,以及滤过泡瘢痕化因素较多的患者;P-50型引流钉更适用于年龄偏大、病情较轻、滤过泡瘢痕化因素较少的患者。2019年,孙重等[20]发表了对2016-2018年的POAG患者32眼分别行P-50型和P-200型Ex-PRESS植入术的疗效分析结果,在术后12个月时,两组的最佳矫正视力均有轻微下降,但差异均无统计学意义。术后12个月,P-50组手术成功率为75%,P-200组手术成功率为87.5%。P-50型和P-200型Ex-PRESS青光眼引流钉植入术均能有效治疗POAG,且P-200型晚期滤过泡包裹率发生较低。
Ex-PRESS青光眼引流钉可作为新生血管性青光眼治疗的方法之一,2020年,黄海等[21]研究了2015-2018年的新生血管性青光眼患者21例21眼,术前均先行康柏西普玻璃体内注射,5-10d后虹膜新生血管消退,接受Ex-PRESS植入术,2~3周后行全视网膜光凝术(PRP:pan retina photocoagulation),术后随访12个月,观察眼压、视力、虹膜新生血管复发率、术后并发症情况。至末次随访时,手术成功率为95%,有术后浅前房1眼、高眼压5眼,虹膜新生血管复发1眼。说明康柏西普注射玻璃体后行Ex-press植入联合PRP可有效降低新生血管性青光眼的眼压。
梁亚等[22]通过对比32 例(34 只眼)难治性青光眼患者分别植入Ex-PRESS(17眼)和Ahmed引流阀(17眼)并随访12个月的结果,发现两组的眼压值和使用降眼压药数量均有下降,Ex-PRESS 组治疗成功率为41.2% ,Ahmed 组为58.8%;Ex-PRESS 组中有5眼发生并发症,Ahmed 组有3眼发生并发症。对比结果说明在上述难治性青光眼的治疗中,两种装置均有较好的治疗效果,但Ahmed引流阀疗效更优于Ex-PRESS。
总之,Ex-PRESS青光眼引流器具有安全、有效、简便、微创、可重复性等特点,且术中对小梁、虹膜、葡萄膜和玻璃体等结构干扰小,并发症少,可作为难治性青光眼(如外伤性青光眼、人工晶状体眼青光眼、无晶状体眼、葡萄膜炎继发性青光眼和虹膜角膜内皮综合征等)的优先选择装置。
(3)PRESERFLOMicro Shunt(InnFocusMicroShunt)(图2K):PRESERFLO Micro Shunt原设计名称为MIDI管(Miami InnFocus),和InnFocusMicro Shunt是同种设备。PRESERFLO Micro Shunt是一种长约8.5 mm的微型引流管,外径350 μm,内径70μm,侧翼宽1 mm,由超稳定的高分子聚合物SIBS(苯乙烯分子聚合物)制成,完全具有生物相容性,不会被机体排斥,也不会随时间而消融或降解,可长期保持通畅。该设备通过建立一条新的房水引流通路以降眼压,治疗原理和小梁切除术及传统的房水引流阀植入术(Ahmed或Baervledt引流阀)类似,极少出现显著的炎症反应、前房反应、新生血管化以及纤维化、滤过泡包裹等现象。
2021年,Juan F Batlle等[23]发表了对23例原发性开角型青光眼(POAG)患者植入PRESERFLO Micro Shunt的疗效进行长期研究的结果。经过60个月的随访,平均眼压从术前基线检查时的(23.8±5.3)mmHg分别降低到(12.8±5.6)mmHg(第48个月)和(12.4±6.5)mmHg(第60个月);总体成功率为87.0%(第48个月)和82.6%(第60个月);平均用药量从基线检查时(2.4±1.0)种减少到(0.8±1.3)种;发生的不良事件包括暂时性低眼压(4例)、角膜水肿(4例)及滤泡相关并发症(3例)等。研究得出该装置植入后患眼平均眼压控制长期有效,药物治疗数量持续下降,不良事件少且不会长期威胁视力,术后干预率低的结论。
Luciano Quaranta等[24]通过分析2019年3至11月小梁切除失败后的31例POAG眼患者在两个意大利青光眼中心接受PRESERFLO Micro shunt植入的31次手术,术前眼压(24.12±3.14)mmHg,用药量(3.29±0.64)种。术后随访12个月,眼压降至(12.56±2.64)mmHg,用药量降低到(0.46±0.77)种。不良事件有暂时性低眼压(6眼,19.3%)和脉络膜积液(3眼,9.6%),所有病例均观察到自发消退,无需干预,表明PRESERFLO Micro Shunt植入术对于降低眼压安全有效,可能是第二次手术的可行性选择。
和其他植入装置(如iStent、Hydrus或CyPass)相比,PRESERFLO Micro Shunt的降眼压效果更强,适用于眼压控制不良的患者,效果可以媲美小梁切除术,更适用于中晚期青光眼患者。2021年,Karin等[25]发表对52例POAG患者的52只眼进行随访分析比对结果:其中植入PRESERFLO Micro Shunt的26眼为A组;行小梁切除术的26眼为B组。随访的主要观察指标有平均日眼压(mdIOP,6次测量的平均值)、日峰值眼压、日眼压波动、青光眼药物治疗、成功率、视力、视野、手术并发症和干预措施,以及可能出现的严重不良事件。随访6个月,A组的mdIOP中位数为10.8(9.5~12.2)mmHg,B组为10.3(7.6~11.8)mmHg;组间mdIOP、峰值日眼压和中值日波动的降低无统计学差异;B组的干预率显著高于A组;所有患者均未发生严重不良事件。该研究表明两种方法在降低POAG患者mdIOP方面同样有效和安全,但PRESERFLO micro shunt的侵入性小,术后干预少。
7.眼表引流装置 BAM(图2L):Beacon Aqueous Microshunt(BAM)是一种新型的外眼操作的MIGS微型支架,其外形类似一片带“倒钩”的塑料片,可稳定地固定于植入部位。BAM装置材料为超亲水的聚乙二醇聚合物,具有抗生物污染性。BAM宽1.70 mm,长3.30 mm,内部有一个很小的水凝胶通道(尺寸约为0.03 mmx0.048 mm)沟通前房与外界,可以引导房水从前房达到眼睛表面,直接引流到角膜外。由于BAM水凝胶装置的引流通道的尺寸很小,可避免眼压的骤降。由于其材料可抗生物污染,加之引流管口的泪液剪切力作用,可防止粘附在眼表的微小物质(如细菌和杂物)进入,理论上可避免发生眼内炎。BAM为新型引流装置,尚无确切的长期临床研究成果,但有案例表明BAM的引流效果明显,植入后房水能持续从中央流出,眼压即刻下降,且患者无不适感。医学界对其进一步临床应用效果研究还在持续进行。
三、围手术期管理
MIGS的术前评估很重要,包括对患眼解剖结构的全面检查,对患者的告知,使患者清楚地了解到哪些治疗可行或之前的手术哪些组织保存完好或被损伤。一般来说,只要整体上术中涉及到的解剖结构完整,那么MIGS就是有可能适用的。鉴于这些通常是房角的手术,眼科手术医师需要掌握房角镜使用技术并掌握房角的解剖。
术后的管理和白内障术后类似,要建立严格的随访制度,及时掌握各时段的术后疗效。通常是植入后的4至6周开始眼压下降,要注意及时调整用药。术后要定期进行眼压测定、OCT检查、视野检测和角膜迟滞反应检测等。同时,术后治疗人员应清楚地认识到:即使手术再成功,术后他们依旧是青光眼患者,医护人员应认真对待病情和治疗的进展,做好观测记录和分析总结,应对治疗周期中可能出现的各类问题,及时准确地发现和处理并发症。
MIGS技术使得青光眼专科医师和初级视光医师能共同诊疗和管理患者,其安全性使患者们能在初级眼保健阶段就得到治疗。我们应以正确的态度和充分的重视程度来做好全周期治疗过程管理,对手术前后的病情进展(术前分析、手术过程、术后护理、随访结果、出现的并发症、术后短期和长期病程特点等)了解越多就越能管理好这些患者。
四、总结
MIGS及植入装置种类繁多,适应症各异。其技术优势在于其采用的引流原理符合眼部自然生理结构,且切口小、安全性高、不形成滤过泡、疗效较好并发症少。同时我们看到MIGS也存在着不足:无法将眼压降至巩膜上静脉压以下(8~12 mmHg,一般情况下多数MIGS难以实现目标眼压低于13 mmHg),而滤过性手术(如小梁切除术)可将眼压降到10 mmHg以下,因此传统的滤过性手术联合抗代谢药物治疗对于目标眼压更低的晚期青光眼患者仍然是首选术式,但由于很多MIGS手术和植入装置可以相互叠加、联合或先后依次使用,不像小梁切除术那样总是医师的最后选择,因此MIGS可使医师创造性地开展治疗工作。
在对POAG治疗中,应综合考虑MIGS手术和非MIGS手术:若目标眼压设定高于16 mmHg,可考使用SOLX、Trabectome、iStent、内路准分子激光小梁切开术(ELT)等治疗方式;若目标眼压设定范围在(13~16)mmHg范围,宜选择Trabectome或根管成形术(canaloplasty);若目标眼压设定≤13 mmHg,可考虑行PRESERFLO/InnFocus植入或小梁切除术。有研究表明,MIGS及植入装置在临床上具有装置暴露的风险,这是一种潜在的视力威胁并发症。2015年,美国亚特兰大埃默里大学(Emory University)的Levinson JD教授进行过一项研究[26]回顾分析了从2000年到2010年间接受过MIGS和引流装置(多种)植入的763例青光眼患者(其中702例为初次植入患者,61例为再次植入患者)的疗效,结果表明:初次植入患者中有5.8%发生暴露(41/702),再次植入患者的暴露率则更高,达到了13.1%(8/61);暴露的发生可能和植入物质量相关。2021年,Roxane Bunod等[27]也发布了两例POAG患者在植入PreserFlo MicroShunt 后的第7天和3个月发生暴露的案例,最终不得已拆除了植入装置。
由于MIGS技术一直处于发展和创新中,对于其疗效的长期研究还很不足,如Cypass经过多年临床研究最终退出了全球市场;SOLX设备植入的创伤较大,但操作简单,且术后可以通过非侵入性激光穿过角膜和前房来增加房水外流,医疗前景很好;BAM和iStent Supra等新型设备的疗效需更大范围、更多样本、更长时间来进行进一步研究确认。
随着现代医学研究的深入和治疗水平的提升,在医疗技术人员的不懈努力下,青光眼治疗方法不断创新和改进,各种MIGS新方法、新技术和新生植入装置不断涌现,治疗效果和安全性持续增加。就全球范围来说,虽然MIGS应用的远期疗效尚未得到广泛临床评估,但其技术的临床应用程度和使用覆盖范围在不断加深和扩大。可以说,当前对于抗青光眼手术的研究和使用已进入了一个新的时代:一个植入的时代、一个装置的时代、一个引流的时代、一个微创的时代。

