BMSCs外泌体来源miR-133a对大鼠脊髓损伤修复的影响
贾祎佳 陆廷盛 姚书眈 杨建文 姬林松 杨再松 罗春山
脊髓损伤(spinal cord injury,SCI)是最严重的损伤之一。全世界每年25~50万人受SCI的影响[1]。SCI可引发一系列的并发症如呼吸问题、自主神经反射异常、痉挛等,严重妨碍患者健康及生活质量,亟需新方法解决该问题[2]。骨髓间充质干细胞(bone marrow stromal stem cells,BMSCs)具有较强的更新能力及干细胞特性,可用于治疗各种疾病[3]。研究发现不同细胞来源的外泌体包含miRNA、蛋白质、脂质等活性物质,具有免疫调节、抑制瘢痕形成、促神经再生等作用,为SCI治疗提供广阔的治疗前景[4]。miRNA是一类小的非编码RNA,通过直接结合基因的3’非翻译区调节其下游靶基因,在疾病中发挥重要作用,已证实其在脊髓损伤中的表达及功能[5]。但miR-133a作为家族成员之一,研究发现外泌体来源miR-133a可以对受体细胞产生生物学影响,参与去神经支配等病理学变化[6]。但BMSCs外泌体来源miR-133a是否可以介导SCI的发展尚不清楚。本研究探讨BMSCs外泌体来源miR-133a对SCI大鼠修复的影响研究。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞来源:①兰州大学实验动物中心提供55只SD清洁级雄性大鼠,体重210~240 g,7周龄,许可证号:SCXK(甘)2018-0002。所有大鼠均喂养在标准鼠笼中,房间温度(23±2)℃、湿度(50±10)%,12 h光照-12 h黑暗循环,大鼠均自由摄食和饮水。所有程序经机构动物伦理委员会批准。②无锡欣润生物科技有限公司提供大鼠小胶质细胞(BV-2),细胞置于DMEM/F12培养基中,并加入100 U/ml链霉素及青霉素、10%胎牛血清,于CO2培养箱中培养。
1.1.2 实验试剂及仪器:①广州锐博生物科技有限公司提供miR-133a抑制剂及抑制剂对照(NC);Roche公司提供TUNEL凋亡试剂盒;赛默飞公司提供双荧光素酶报告基因试剂盒;Umibio公司提供外泌体提取试剂盒;CST公司提供CD90、CD45抗体;Abcam公司提供Alix、CD63及胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经元核抗原(neuronal nuclear antigen,NeuN)、炎性小体3(NOD-like receptor family pyrin domain-containing 3,NLRP3)、半胱氨酸天冬氨酸酶(caspase)-1一抗。②赛默飞公司提供qRT-PCR仪;南京上多川进出口贸易有限公司提供HD-2700透射电镜;Olympus公司提供CX21显微镜。
1.2 方法
1.2.1 BMSCs分离及鉴定:随机选取5只SD大鼠,脱颈处死,将其浸泡于质量分数为75%的乙醇溶液中,取出胫骨、股骨,剔除软组织,暴露骨髓腔,并反复冲洗骨髓腔,冲洗其中的骨髓置于离心管中,离心10 min后制备细胞悬液,调整细胞密度并接种到25 cm2塑料瓶中,置于培养箱中培养。每2天更换1次培养液,同时洗掉未贴壁细胞。待细胞融合达90%时进行传代培养,取生长至第7代的BMSCs,采用流式细胞仪检测细胞表面标记物[CD90、CD45]抗体,鉴定BMSCs细胞。
1.2.2 外泌体提取及鉴定:当BMSCs细胞融合度达80%~90%时,以外泌体培养基培养24 h,参照外泌体提取试剂盒说明书获得外泌体沉淀,无菌PBS重悬,透射电镜及Western blot分别观察外泌体的形态特征并对其表面蛋白进行鉴定。
1.2.3 BMSCs转染:采用Invitrogen Lipofectamine 2000分别将miR-133a抑制剂(85 nmol/L)、NC(60 nmol/L)转染BMSCs,转染24 h后,离心取上清液,按照1.2.2方法提取含miR-133a抑制剂、NC的外泌体,并通过qRT-PCR检测证实未转染及转染NC的BMSCs外泌体中miR-133a表达量高于转染miR-133a抑制剂的BMSCs外泌体,然后用于体内实验注射。
1.2.4 SCI大鼠的制备及干预:将剩余50只大鼠随机分为造模组(40只)、假手术组(10只),参照文献[7]制备SCI大鼠:麻醉所有大鼠,俯卧位固定大鼠,背部剃毛并消毒,找到脊背T10棘突,行纵向约2 cm切口,分离肌肉,去除T10椎板,以暴露脊髓。利用冲击器快速挫伤损伤,当大鼠出现尾巴翘起并迅速倒下、双下肢迅速回缩、剧烈抽搐时认为SCI模型制备成功,假手术组仅去除T10椎板。造模组大鼠均符合SCI模型标准,并将其随机为SCI组、外泌体组、外泌体-NC组、外泌体-miR-133a抑制剂组。其中假手术组、SCI组给予0.9%氯化钠溶液干预;外泌体组给予鞘内注射100 μg/ml外泌体干预[8],外泌体-NC组、外泌体-miR-133a抑制剂组给予鞘内注射0.2 ml含NC或miR-133a抑制剂的外泌体[9],每周1次,注射4周。
1.2.5 BBB评估大鼠脊髓损伤程度:干预结束后,采用BBB评分对大鼠脊髓损伤程度进行评估[10],将各组大鼠置于清洁平台上,自由活动5 min,同时由2名未参加该实验研究的观察者记录大鼠躯干及前、后肢运动情况,BBB评分越低,大鼠脊髓损伤越严重。
1.2.6 HE染色检测大鼠脊髓组织形态学变化:麻醉大鼠,分离脊髓组织,常规脱蜡、包埋、切片后苏木精-伊红染色,于显微镜下观察脊髓组织形态学变化。
1.2.7 TUNEL染色检测大鼠脊髓组织细胞凋亡变化:提取适量脊髓组织,包埋、切片。脱蜡切片与稀释蛋白酶K在37℃下孵育30 min,然后用4%多聚甲醛固定。清洗后,将切片固于0.3% H2O2-甲醛溶液中,加入Triton X-100在冰上孵育。按照TUNEL细胞凋亡检测试剂盒说明书制备TUNEL反应混合物。将切片与TUNEL反应混合物一起孵育,荧光显微镜下观察细胞凋亡变化。
1.2.8 RT-PCR检测脊髓组织中miR-133a表达水平:用TRIzol试剂提取组织中总RNA,逆转录试剂盒进行逆转录,SYBR Premix试剂盒进行定量PCR,miR-133a引物序列正向:5’-ATAAGAATGCGGCCGCATTCCAAA CTAGCAGCACTA-3’,反向:5’-AGCTTTGTTTAAACTT AACCATTCTAGCTTTTCC-3’,U6引物序列正向,5’-CTTCGGGCAGCACATATACT-3’,反向:5’-AAAATATG GAACGCTTCACG-3’。采用2-△△Ct确定miR-133a的相对表达水平。
1.2.9 Western blot检测脊髓组织中相关通路蛋白表达:取适量组织,加入RIPA裂解缓冲液裂解总蛋白裂解,离心收集上清液,并用BCA试剂盒测定蛋白质浓度。通过10% SDS-PAGE分离,转膜,并用各种一抗(Alix、CD63、GFAP、NeuN、NLRP3、caspase-1)进行探测。然后将膜与二抗一起孵育,以-actin为内参,Image J软件评估蛋白质表达水平。
1.2.10 双荧光素酶实验检验miR-133a、NLRP3关系:采用Lipofectamine 3000将含有NLRP3的3’UTR片段的野生(WT)或突变(MUT)载体与模拟物阴性对照(mimics NC)或miR-133a模拟物(miR-133a mimics)共转染到BV-2细胞中。48 h后收获细胞,测量荧光素酶活性。
1.3 统计学分析 应用SPSS 21.0统计软件。采用单因素方差分析多组间比较,进一步行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs鉴定:流式细胞仪鉴定结果显示细胞中CD90,CD45表达率分别为98.07%、0.09%。见图1。
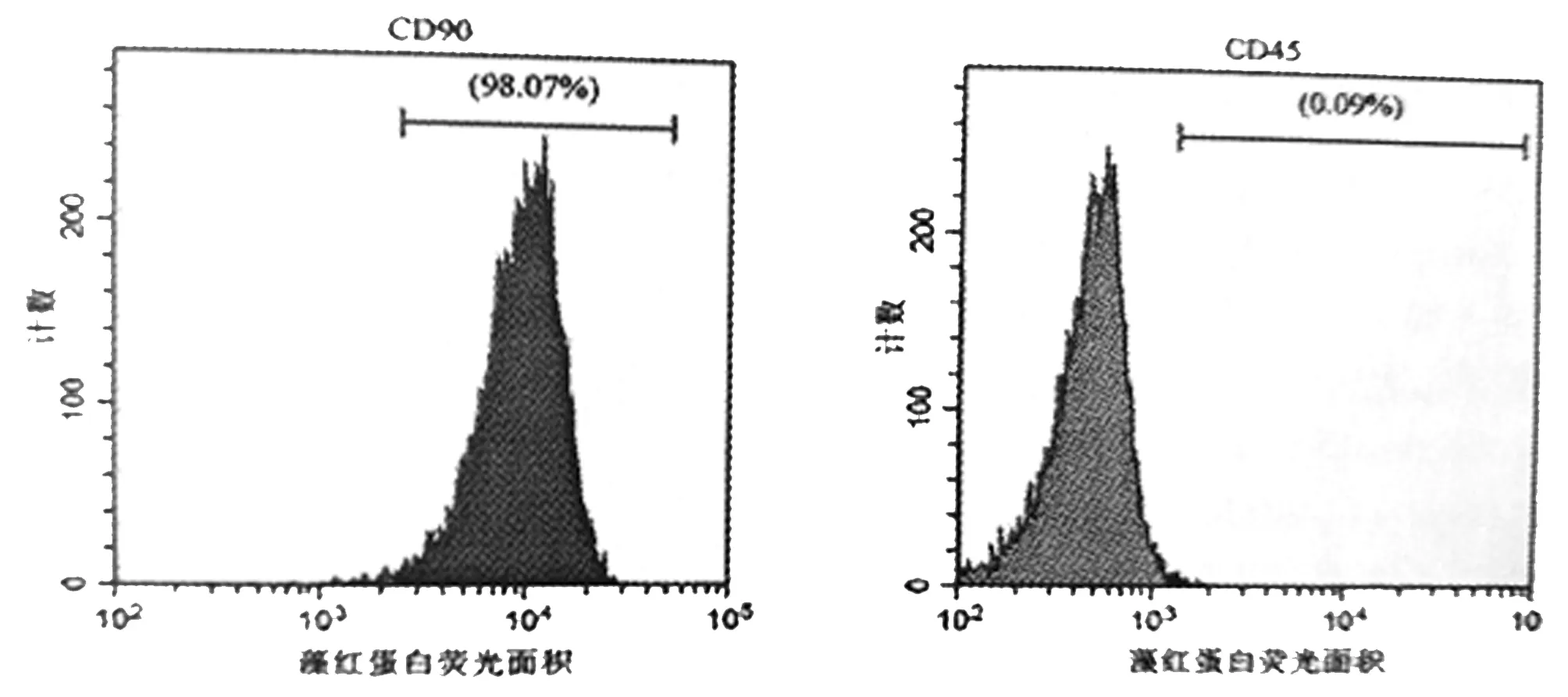
图1 BMSCs的鉴定
2.2 BMSCs外泌体鉴定 透射电镜观察到外泌体为近似球形的囊泡,外部包绕双层膜,且外泌体中Alix、CD63呈阳性表达。见图2、3。
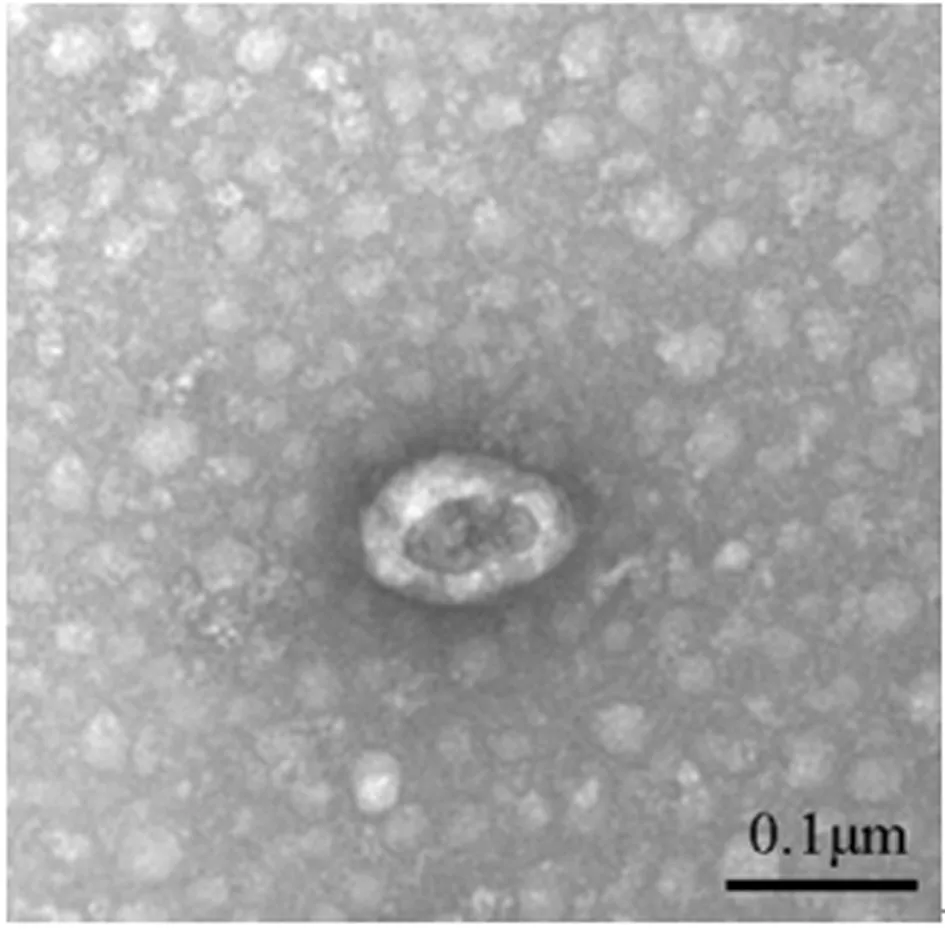
图2 透射电镜观察BMSCs外泌体(比例尺=0.1 μm)

图3 Western blot检测BMSCs外泌体Alix、CD63表达
2.3 5组大鼠BBB评分 SCI组较假手术组BBB评分显著降低(P<0.05);外泌体组较SCI组BBB评分显著增加(P<0.05);外泌体-miR-133a抑制剂组较外泌体-NC组BBB评分显著降低(P<0.05)。见表1。

表1 5组大鼠BBB评分比较 n=10,分,
2.4 5组大鼠脊髓组织细胞凋亡变化 SCI组较假手术组细胞凋亡率显著增加(P<0.05);外泌体组较SCI组细胞凋亡率显著降低(P<0.05);外泌体-miR-133a抑制剂组较外泌体-NC组细胞凋亡率显著增加(P<0.05)。见表2,图4。

表2 5组大鼠脊髓组织中细胞凋亡率比较 n=10,%,

图4 TUNEL染色观察细胞凋亡变化(TUNEL染色×400)
2.5 5组大鼠脊髓组织形态学变化 假手术组大鼠脊髓组织无明显变化;SCI组脊髓组织表现为结构破坏严重,有大量胶质瘢痕、空洞形成;外泌体组、外泌体-NC组脊髓结构紧密,损伤部位趋于正常;外泌体-miR-133a抑制剂组胶质瘢痕、空洞依然清晰可见。见图5。

图5 观察脊髓组织形态学变化(HE染色×100)
2.6 5组大鼠脊髓组织中miR-133a表达 SCI组较假手术组miR-133a表达显著降低(P<0.05);外泌体组较SCI组miR-133a表达显著增加(P<0.05);外泌体-miR-133a抑制剂组较外泌体-NC组miR-133a表达显著降低(P<0.05)。见表3。

表3 5组大鼠脊髓组织中miR-133a表达比较 n=10,
2.7 5组大鼠脊髓组织中相关蛋白表达 SCI组较假手术组GFAP、NLRP3、caspase-1表达显著增加,NeuN表达显著降低(P<0.05);外泌体组较SCI组GFAP、NLRP3、caspase-1表达显著降低,NeuN表达显著增加(P<0.05);外泌体-miR-133a抑制剂组较外泌体-NC组GFAP、NLRP3、caspase-1表达显著增加,NeuN表达显著降低(P<0.05)。见图6,表4。

表4 5组大鼠脊髓组织中GFAP、NeuN、NLRP3、caspase-1表达比较 n=10,
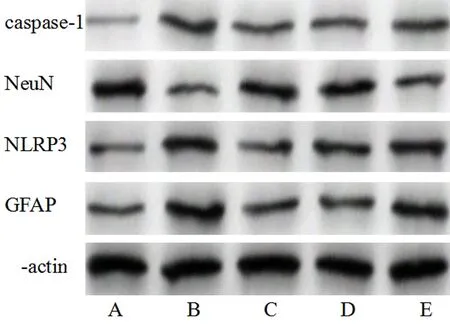
图6 Western blot检测脊髓组织GFAP、NeuN、NLRP3、caspase-1蛋白表达;A 假手术组;B SCI组;C 外泌体组;D 外泌体-NC组;E 外泌体-miR-133a抑制剂组
2.8 miR-133a、NLRP3关系验证 Online数据库显示miR-133a、NLRP3存在结合位点。miR-133a mimics+NLRP3 WT组荧光素酶相对活性较mimics NC+NLRP3 WT组显著降低,差异有统计学意义(P<0.05)。见图7,表5。

表5 4组细胞荧光素酶相对活性比较 n=6,
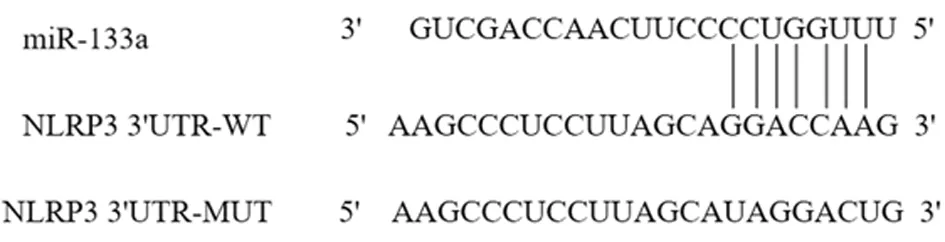
图7 Online数据库预测miR-133a、NLRP3的结合位点
3 讨论
SCI是破坏性的中枢神经系统疾病,伴有运动、感觉和自主神经功能障碍[11]。SCI的治疗是基础科学及临床研究的难点,需研究更有效的治疗方案[12]。
BMSCs外泌体可以替代细胞治疗,发挥细胞生物学功能,具有无成瘤性、免疫原性更低等优势[13]。Liu等[14]研究发现BMSCs外泌体显著增强人脐静脉内皮细胞增殖、迁移和血管生成,抑制炎症、A1神经毒性星形胶质细胞的活化,是治疗创伤性SCI的有效策略。静脉输注BMSCs外泌体可以特异性靶向SCI损伤部位的M2型巨噬细胞,改善非免疫抑制大鼠挫伤性SCI后的功能恢复[15]。本研究通过分离大鼠胫骨、股骨获得BMSCs细胞,经鉴定后从中得到BMSCs外泌体,并通过电镜观察及外泌体标记分子(Alix、CD63)的检测确定为BMSCs外泌体,并用于后续实验治疗。本研究中,与假手术组大鼠比较,SCI大鼠BBB评分、NeuN表达显著降低,细胞凋亡率、GFAP、caspase-1表达显著增加,但SCI大鼠经BMSCs外泌体干预后,均可逆转上述指标,表明BMSCs外泌体减少SCI大鼠中空洞、胶质瘢痕的形成,促进脊髓损伤修复。
BMSCs外泌体通过递送特定的miRNAs对靶细胞发挥生物学功能。在创伤性SCI研究中[16],低氧预处理的BMSCs外泌体来源miR-216a-5p通过改变小胶质细胞M1/M2极化进而进行损伤修复。miR-133a属于BMSCs外泌体中的一种miRNA,研究表明BMSC-Exo分泌的miR-133a可以改善病毒性心肌炎大鼠上皮间质转化、心肌纤维化[17]。Online数据库显示miR-133a、NLRP3存在结合位点。Dai等[18]研究证明抑制NLRP3炎症小体的激活,改善了脊髓损伤后运动功能、保护神经元,为SCI发生后的炎症反应提供临床治疗方案。本研究发现NLRP3为miR-133a的下游靶标,且SCI大鼠脊髓组织中miR-133a表达降低,NLRP3表达增加,表明miR-133a低表达可能参与SCI的发生。但研究还发现经BMSCs外泌体干预后,miR-133a表达增加,NLRP3表达下降,进一步促进脊髓损伤修复,表明BMSCs外泌体来源miR-133a,可改善SCI大鼠损伤。为进一步验证该结论,实验以si miR-133a进行回复实验,但抑制miR-133a表达逆转了BMSCs外泌体对SCI大鼠的修复作用。
综上所述,BMSCs外泌体来源miR-133a,可能通过靶向抑制NLRP3表达,促进SCI大鼠的损伤修复,为临床治疗提供新方案。

