颅内椎基底动脉干大动脉瘤栓塞的时机及术后脑血管痉挛的因素分析
段 佳 潘飞豹 谭关平
遂宁市中心医院,四川 遂宁 629000
后循环动脉瘤与不良的自然病程有关,已发表的报告显示,这种动脉瘤比前循环动脉瘤有更大的破裂倾向[1]。后循环动脉瘤一旦破裂,在48 h 内病死率高,预后差[2]。在整个后循环动脉瘤中,位于椎基底动脉干动脉的动脉瘤很少见,流行病学资料有限[3],尤其是椎基底动脉干大动脉瘤(vertebral basilar trunk large aneurysm,VBTLAs)。VBTLAs 定义为起源于椎动脉动脉段直至小脑上动脉起源的大动脉瘤(直径≥10 mm)[4]。如果不及时治疗,缺血性卒中和出血可能导致丧失性命。其常常采取手术治疗,包括开放手术或血管内栓塞手术[5]。血管内栓塞包括线圈、支架辅助线圈和血流分流与开放手术相比具有一定优势,但由于其位置、手术可及性、病理特征,与位于前循环的动脉瘤相比,VBTLAs 仍与并发症风险增加有关。除此之外,感染、炎症、夹层、动脉瘤和肿瘤会影响大的颅内动脉。因此,早期治疗及准确识别这些病变有助于患者进行适当的及时管理。然而,关于VBTLAs 的血管内治疗报道有限,长期临床预后仍需进一步证实,因此本研究探究颅内VBTLAs 栓塞的时机及影响术后脑血管痉挛的因素。
1 对象与方法
1.1 研究对象选择2017-01—2021-03 收治的颅内VBTLAs 患者186 例,治疗时机≤3 d 为早期组(n=109)和>3 d 为延期组(n=77)。纳入标准:(1)首次诊断为VBTLAs[5]的患者。(2)年龄≥18 岁;(3)临床资料及随访资料完整者。排除标准:(1)患有结缔组织病或连发性病的患者;(2)存在手术禁忌证及过敏者;(3)合并恶性肿瘤及其他神经系统病变者;(4)复发性动脉瘤患者。
1.2 手术方法管道栓塞装置通过微导管(深圳北芯生命科技有限公司)输送和部署。使用辅助线圈,重叠管道栓塞装置,球囊血管成形术,根据操作人员的偏好和经验。因为本文研究是回顾性分析,所以方案中没有规定使用线圈的方法,使用线圈的管道栓塞装置由治疗医师自行决定。患者接受抗血小板治疗方案,包括阿司匹林(100~300 mg/d)和氯吡格雷(75 mg/d)的联合治疗;然而,被确定为氯吡格雷无反应的患者给予阿司匹林(100 mg/d)和替格瑞洛(90 mg,2次/d)。术前血小板功能检测后调整阿司匹林/氯吡格雷剂量。所有试验点均以相同方式进行血小板功能检测。
1.3 观察指标(1)临床基线:记录患者性别、BMI、吸烟史、肿瘤直径、糖尿病、动脉瘤数量、出血次数、年龄、Hunt-Hess分级、高血压、Fisher分级、动脉瘤部位等一般资料。(2)实验资料:所有纳入本研究者禁食8~10 h后,于清晨空腹抽取静脉血5 mL,进行离心(3 000 r/min,15 min)后收集血清样本。在空腹的情况下用Modular DP全自动生化分析仪(瑞士Roche公司)检测血糖(fasting blood glucose,FBG)、三酰甘油(triacylglycerol,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、血尿酸(uric acid,UA)、尿素氮、血红蛋白、总胆红素、白细胞(white blood cell count,WBC),血肌酐水平;采用离子色谱法检测糖化血红蛋白A1c(hemoglobin A1c,HbA1c)水平;降钙素原(procalcitonin,PTC)采用免疫层测定;应用化学发光法检测胰岛素(fasting insulin,FINS)水平;采用免疫透射比浊法测定C 反应蛋白(C-reactive protein,CRP);白细胞介素-6(interleukin-6,IL-6)、血清缺氧诱导因子-2α(hypoxia-inducible factor-2α,HIF-2α)、基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、高迁移率族蛋白B1(high mobility group protein B1,HMGB1)采用酶联免疫吸附法测定。(3)栓塞结局采用Raymond 动脉瘤栓塞程度分级[7]呈现:Ⅰ级(动脉瘤完全闭塞,无囊内造影剂混浊),Ⅱ级(动脉瘤颈残余,囊内造影剂混浊),Ⅲ级(动脉瘤部分闭塞,囊内造影剂混浊)。(4)神经功能缺损程度采用美国国立卫生院脑卒中量表(National Institutes of Health stroke scale,NIHSS)[8]评估,得分越高,神经功能损害程度越大。(5)日常活动能力采用改良Barthel 指数(modified Barthel index,MBI)[9]评估,得分越高,日常活动能力越强。(6)肺部感染、脑积水、癫痫、下肢静脉血栓、脑血管痉挛等术后并发症。随访:所有患者随访时间为24个月,由介入神经放射科医生和神经外科医生进行,具体取决于治疗技术。使用临床信函和电话问卷来确定术前和术后功能状态、手术状态和并发症发生率。栓塞治疗后根据是否出现脑血管痉挛情况分为2组,脑血管痉挛组(n=47)和无脑血管痉挛组(n=139)。以患者的经颅多普勒超声检查显示,大脑中动脉血流速峰值>200 cm/s或平均血流速>120 cm/s为脑血管痉挛[6]。
1.4 统计学方法通过SPSS 26.0 软件统计分析。计数资料以频数百分比(%)描述,通过χ2检验进行组间比较。计量资料以均数±标准差(±s)描述,采用t检验进行组间比较。多因素回归分析TN 患者手术治疗后脑血管痉挛的影响变量。构建列线图模型,采用Bootstrap 法对列线图采取内外部验证,通过受试者工作者特征(receiver operating characteristic,ROC)曲线评价模型的区分度,模型的准确性通过校准曲线评价,通过X-tile(Version 3.6.2)软件获得列线图预测模型的截断值,检验水准α=0.05。
2 结果
2.1 早期组和延期组的临床资料、栓塞效果及并发症情况比较延期组的Raymond动脉瘤栓塞程度分级(Ⅰ、Ⅱ级)、治疗后NIHSS评分、MBI评分及术后并发症优于早期组(P<0.05),见表1。
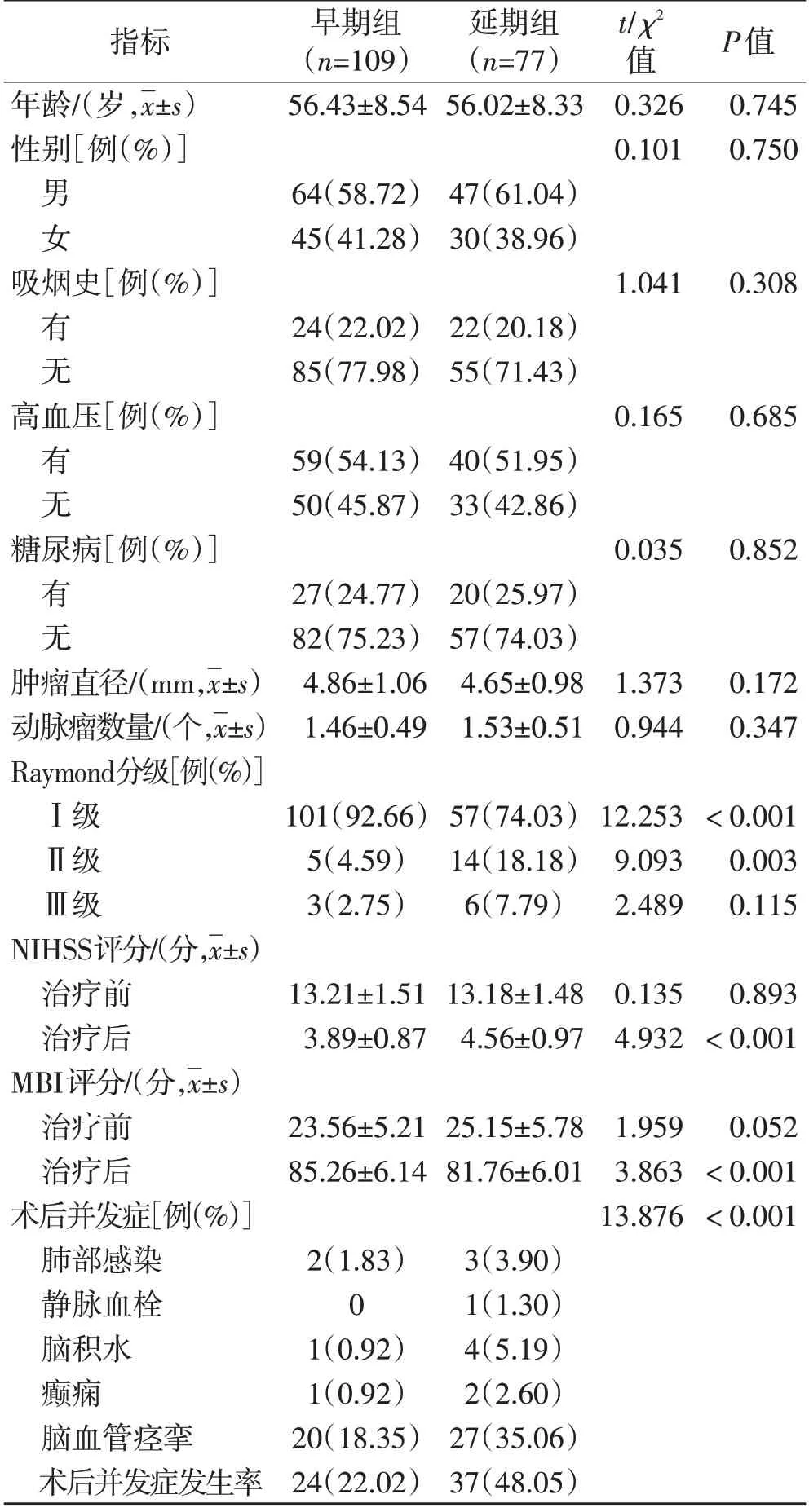
表1 早期组和延期组的临床资料、栓塞效果及并发症情况比较Table 1 Comparison of clinical data,embolization effect and complications between the early and delayed groups
2.2 脑血管痉挛组和无脑血管痉挛组临床资料比较随访24 个月结果可知186 例VBTLAs 患者治疗后发生脑血管痉挛47 例(25.27%)。脑血管痉挛组在年龄≥55 岁、出血次数≥2 次、Hunt-Hess 分级(Ⅲ、Ⅳ级)、手术时机(晚期)、Fisher 分级(3、4 级)、HIF-2α、MMP-2、MMP-9、HMGB1、CRP、IL-6、PCT、TNF-α方面高于无脑血管痉挛组,比较差异具有统计学意义(P<0.05)。2 组患者的其他资料比较差异无统计学意义(P>0.05),见表2。
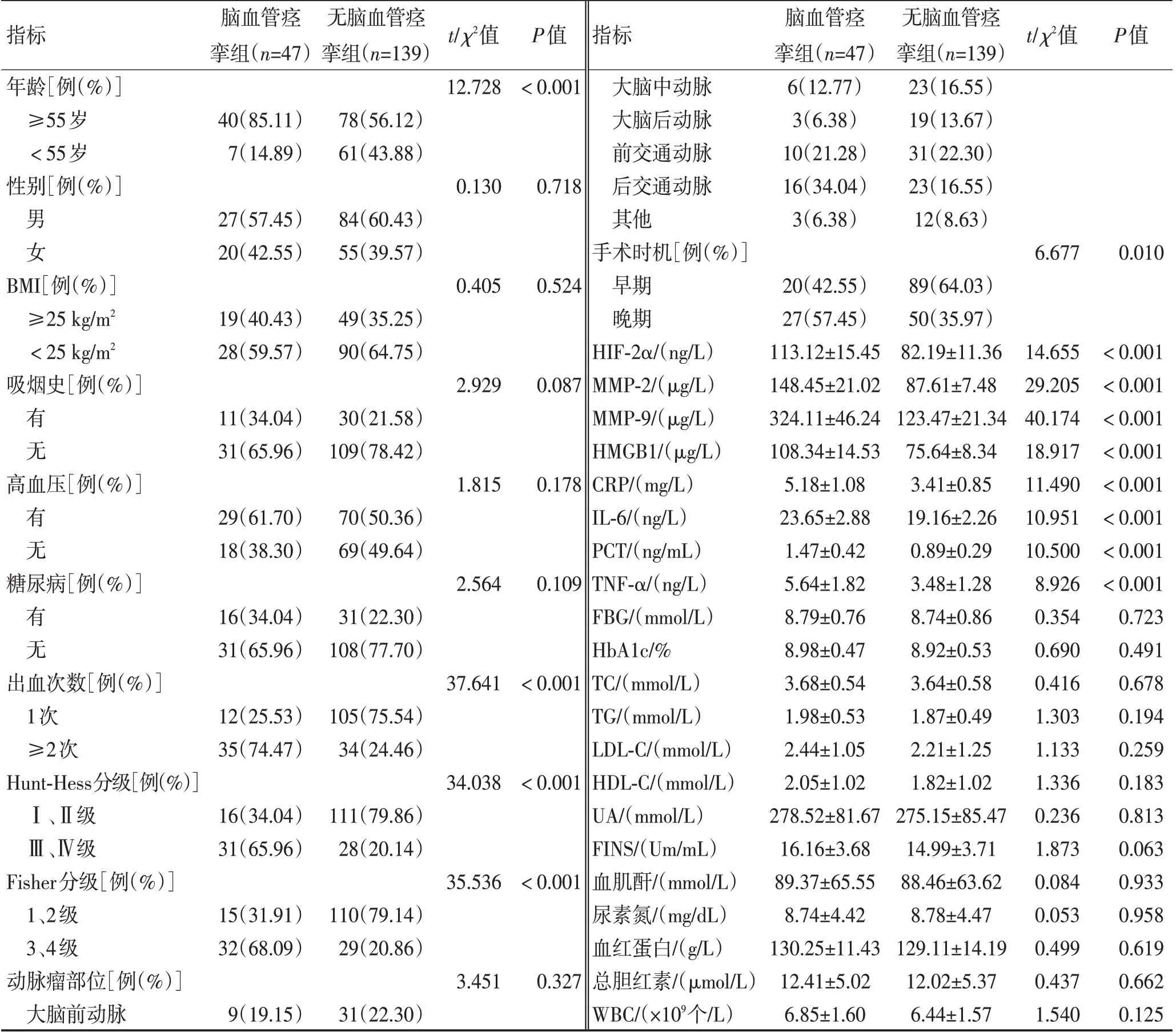
表2 脑血管痉挛组和无脑血管痉挛组临床资料比较Table 2 Comparison of clinical data between the group with cerebral vasospasm and the group without cerebral vasospasm
2.3 多因素分析影响术后脑血管痉挛的因素以VBTLAs 患者术后是否发生脑血管痉挛作为因变量(未发生=0,发生=1),以2.2中P<0.05的因素作为自变量(赋值见表3),结果显示,年龄≥55岁、出血次数≥2 次、Hunt-Hess 分级(Ⅲ、Ⅳ级)、Fisher 分级(3、4级)、手术时机(晚期)、HIF-2α≥97.66 ng/L、MMP-2≥118.03 μg/L、MMP-9≥223.79 μg/L、HMGB1≥91.99 μg/L、CRP≥4.29 mg/L是影响VBTLAs患者术后脑血管痉挛的独立危险因素(P<0.05),见表4。
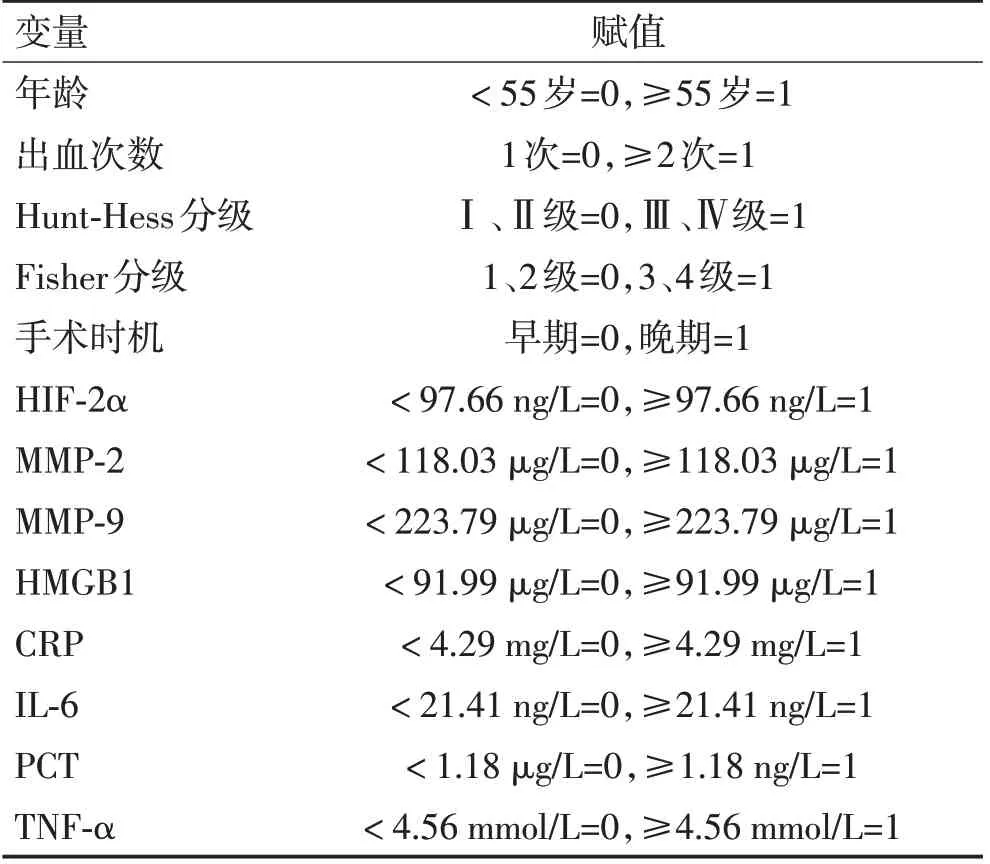
表3 分类变量赋值表Table 3 Assignment of categorical variables
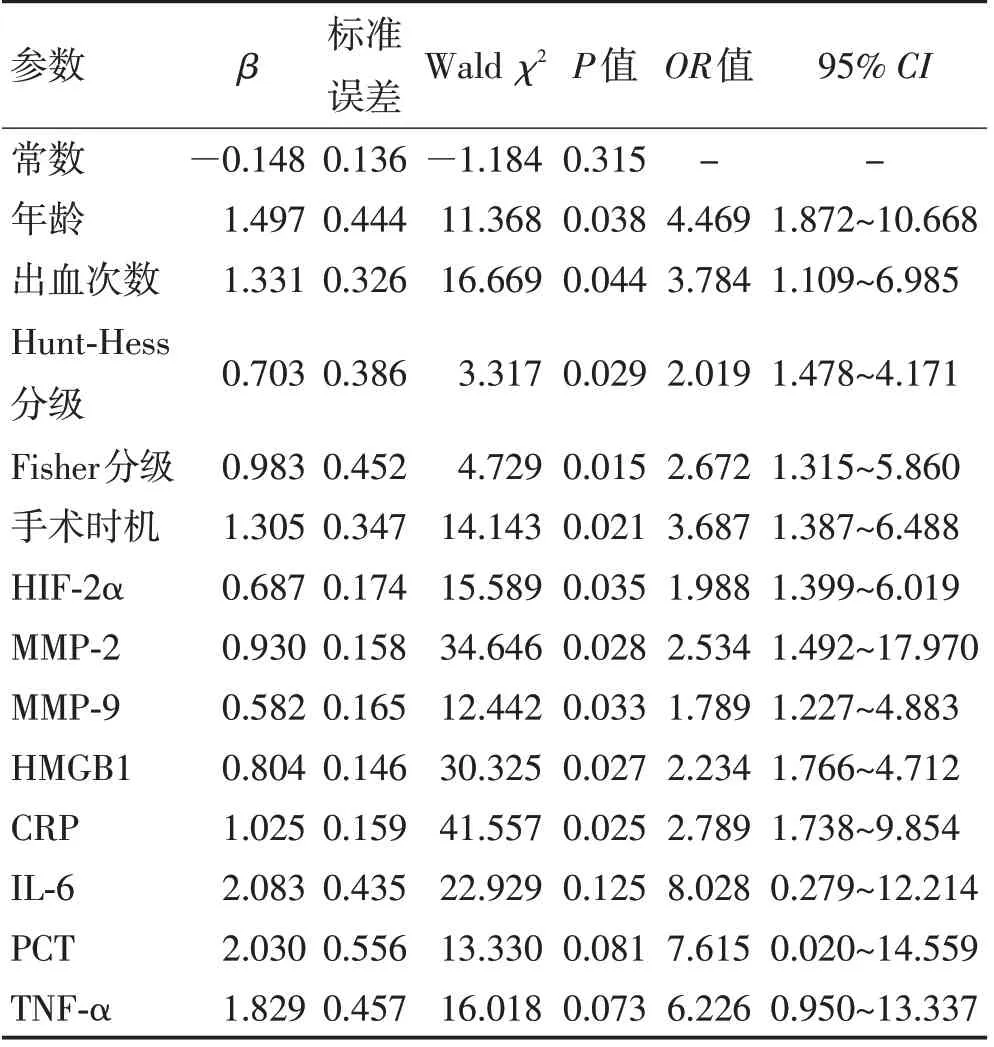
表4 多因素Logistic回归分析影响VBTLAs患者术后脑血管痉挛的因素Table 4 Logistic regression analysis of factors affecting postoperative cerebral vasospasm in patients with VBTLAs
2.4 共线性检验将表4中独立危险因素带入共线性诊断分析,结果显示方差膨胀因子(variance inflation factor,VIF)均<10,则说明变量之间相互独立,无共线性,见表5。
2.5 建立患者术后脑血管痉挛风险预测模型基于9 个危险因素建立的预测模型,见图1。术后脑血管痉挛的发生风险的计算公式:Logit(P)=-0.148+年龄×1.497+出血次数×1.331+Hunt-Hess 分级×0.703+Fisher 分级×0.983+手术时机×1.331+HIF-2α×0.687+MMP-2×0.930+MMP-9×0.582+HMGB1×0.804+CRP×0.687。采用Bootstrap 重抽样103次,得到验证前的C-index 值为0.834(95%CI:0.333~1.345),Hosmer Lemeshow 偏差度检测χ2=8.763(P>0.05);验证后的C-index 值为0.812(95% CI:0.245~1.367),Hosmer Lemeshow偏差度检测χ2=8.945(P>0.05),提示拟合度结果可靠,预测模型稳健,见图2。验证前后的ROC 曲线下面积(AUC)分别为0.843(95% CI:0.778~0.898,P<0.001)和0.814(95% CI:0.773~0.864,P<0.001),见图3。有效性评价结果显示,决策曲线显示阈值概率在0.01~0.91 时,净获益率>0,具有较高的净获益值,安全可靠,实用性强,见图4。
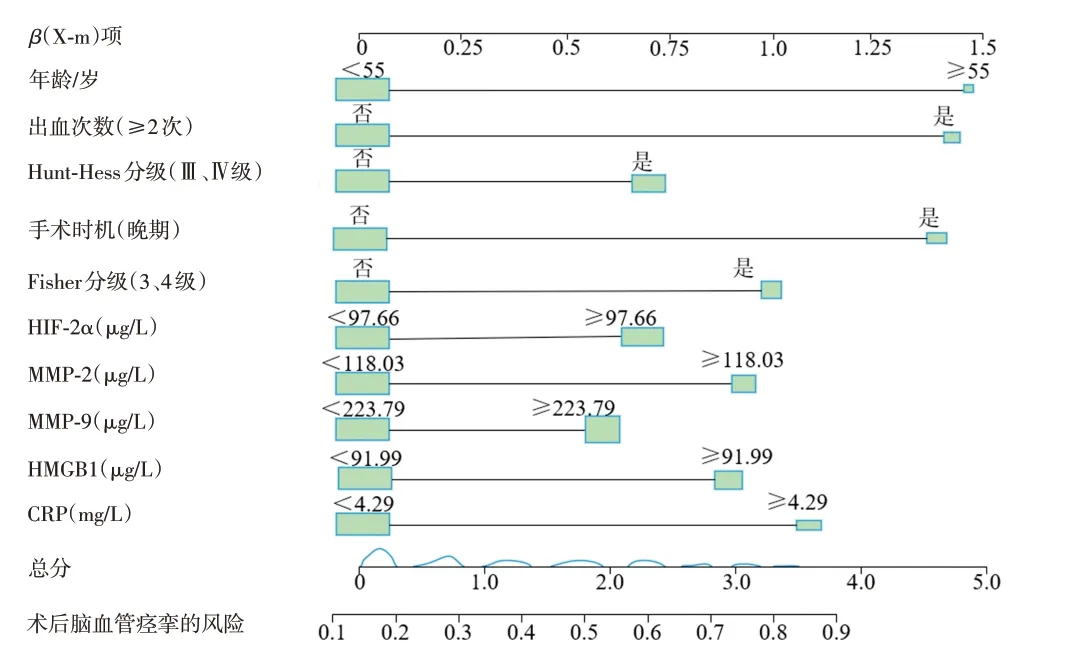
图1 预测VBTLAs患者术后脑血管痉挛发生风险列线图Figure 1Predictive risk of postoperative cerebral vasospasm in patients with VBTLAs
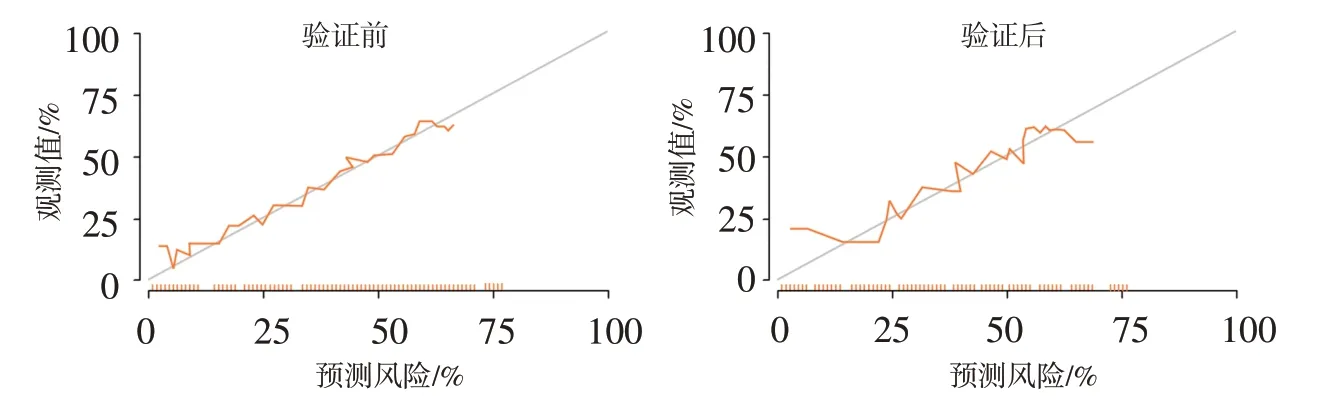
图2 VBTLAs患者术后脑血管痉挛发生风险列线图预测模型的分类校准曲线Figure 2 Categorical calibration curve of the column graph prediction model for the risk of postoperative cerebral vasospasm in VBTLAs patients
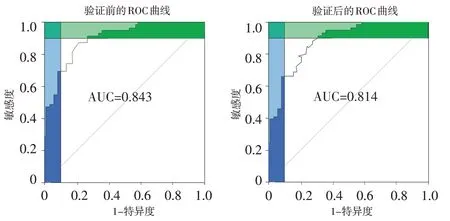
图3 VBTLAs患者术后脑血管痉挛发生风险列线图预测模型的ROC曲线Figure 3 The ROC curve of the graph predicting the risk of postoperative cerebral vasospasm in VBTLAs patients
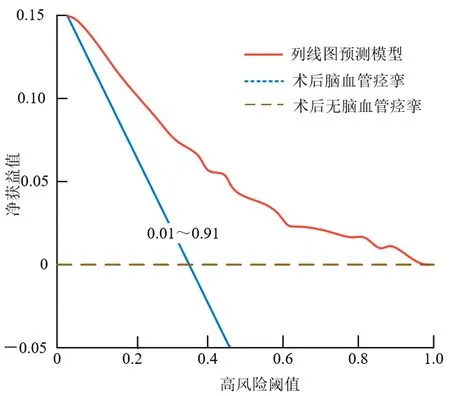
图4 VBTLAs患者术后脑血管痉挛发生风险的列线图预测模型的临床决策曲线Figure 4 Clinical decision curve of the prediction model for the risk of postoperative cerebral vasospasm in VBTLAs patients
2.6 风险分层系统的构建应用X-tile 软件将该模型根据Logistic风险得分分为低(>14.5分)、中(5.7~14.5 分)、高(<5.7 分)风险3 个水平,VBTLAs 患者术后脑血管痉挛发生率分别为10.87%、23.04%和61.74%,高风险组脑血管痉挛发生率明显高于中风险组和低风险组(χ2=6.456,P=0.005)。见图5。
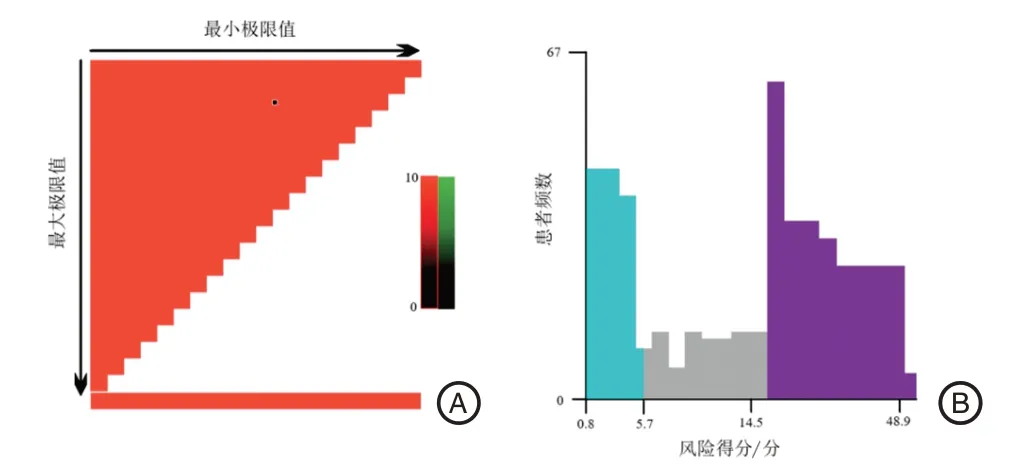
图5 列线图预测模型风险分层Figure 5 Risk stratification of the forecast model
3 讨论
目前,关于IVBTLAs 的流行病学报道有限。既往研究表明,椎基底动脉或大脑后动脉瘤(不包括基底动脉尖部动脉瘤)在所有动脉瘤部位中的比例为6.6%[10],动脉瘤破裂后预后总体较差[11]。通常开颅夹闭手术可直接切除动脉瘤并降低颅内血肿情况,患者复发概率极低,但因手术留下的创伤较大,导致术后恢复过慢且易造成不良预后[12]。因此,本研究探讨的血管内介入栓塞治疗,无需开颅、侵袭性较小、手术风险较低[13]。若准确选择手术时机,会降低并发症概率及提高患者满意度。此外,本研究还探讨术后并发症脑血管痉挛的影响因素,旨在为临床提供有效的数据理论。
本研究中延期组的Raymond动脉瘤栓塞程度分级(Ⅰ、Ⅱ级)、治疗后NIHSS评分、MBI评分及术后并发症优于早期组,提示早期治疗对IVBTLAs 患者的治疗效果比较好,与黄梓雄等[14]研究一致。推测原因是IVBTLAs 患者发病期间,早期血流动力学状态相对比较健康,局部炎症反应不是很剧烈,此时治疗的难度较小。但术后并发症中脑血管痉挛较为多见,严重导致患者致残及死亡,所以对此类手术患者应加大术后脑血管痉挛的防控与诊治。本研究就颅内IVBTLAs患者术后脑血管痉挛发生情况及影响因素进行调查研究及分析,结果显示,186 例颅内IVBTLAs 患者术后脑血管痉挛者47 例,发生率为25.27%,说明其术后脑血管痉挛发生率相对较高。在本研究中,年龄≥55 岁、出血次数≥2 次、Hunt-Hess 分级(Ⅲ、Ⅳ级)、Fisher 分级(3、4级)、手术时机(晚期)、HIF-2α≥97.66 ng/L、MMP-2≥118.03 μg/L、MMP-9≥223.79 μg/L、HMGB1≥91.99 μg/L、CRP≥4.29 mg/L 影响VBTLAs 患者术后脑血管痉挛的独立危险因素。(1)年龄≥55岁颅内IVBTLAs患者的血管功能状态较差,尤其是弹性状态,普遍弹性较差,代偿能力弱,尤其是在重大手术后易于出现血管痉挛[15]。(2)出血次数≥2 次,IVBTLAs 患者术后出血次数越多,就会导致血管功能状态越差,且加大血管损伤程度,导致血管痉挛加剧[16]。(3)Hunt-Hess分级(Ⅲ、Ⅳ级)。(4)Fisher 分级(3、4 级)。(5)手术时机(晚期)的IVBTLAs患者神经功能严重受损,与此同时凝血功能较差,术后严重影响脑血管痉挛[17-18]。(6)HIF-2α≥97.66 ng/L,颅内IVBTLAs患者发病时,脑血管的机械性牵拉,造成脑局部组织血流灌注减少,造成缺氧、缺血,从而促进HIF-2α的大量释放,同时加剧脑损伤程度,严重导致术后脑血管痉挛的风险[19]。(7)MMP-2≥118.03 μg/L 及MMP-9≥223.79 μg/L,基质金属蛋白酶是含锌的蛋白水解酶,主要参与细胞外基质的降解,造成细胞侵袭、迁移和脑血管痉挛等不良事件。其中,MMP-2和MMP-9主要在各种肿瘤中表达,并在肿瘤血管生成和侵袭中起至关重要的作用。当脑血屏障严重破坏时,导致MMP-2、MMP-9的大量分泌[20],严重导致术后脑血管痉挛的风险。(8)HMGB1≥91.99 μg/L及CRP≥4.29 mg/L,炎症因子的大量释放是导致术后脑血管痉挛发生的一个原因,HMGB1和CRP 具有强烈的促炎作用,导致大量的炎症因子释放,对颅内动脉细胞结构产生破坏[21]。本文局限性:纳入样本数量较少,VBTLAs 发病机制复杂,术后脑血管痉挛影响的因素较多,未完全纳入。对此,我们将在未来研究中进一步证实本研究的分析结果。颅内VBTLAs 患者越早期栓塞治疗,并发症越少。年龄≥55 岁、出血次数≥2 次、Hunt-Hess 分级(Ⅲ、Ⅳ级)、Fisher 分级(3、4 级)、手术时机(晚期)、HIF-2 α ≥97.66 ng/L、MMP-2≥118.03 μg/L、MMP-9≥223.79 μg/L、HMGB1≥91.99 μg/L、CRP≥4.29 mg/L 是影响VBTLAs 患者术后脑血管痉挛的独立危险因素,且与术后脑血管痉挛严重程度有关,应引起临床重视,且为临床上提供参考价值。

