分枝杆菌T7SS(ESX)分泌系统功能研究进展
蒋智勇,谢建平
综 述
分枝杆菌T7SS(ESX)分泌系统功能研究进展
蒋智勇,谢建平
西南大学生命科学学院现代生物医药研究所,重庆 400715
分枝杆菌感染宿主后能够通过分泌至胞外的效应蛋白去影响宿主的免疫功能,其中ESX (或VII型)系统在效应蛋白分泌方面发挥了重要作用。ESX分泌系统是分枝杆菌和许多放线菌中的蛋白质输出系统,但目前ESX系统如何将底物运输穿过外膜的分子机制以及调控机制尚不清楚。本文对ESX系统的组成、功能、分类以及将底物运输至周质空间的相关研究进展展开了综述,并探讨了ESX系统在抗生素耐药、持留及与宿主-噬菌体相互作用中的功能,以及作为新药物靶标的潜力,以期为结核病新药物和疫苗抗原的发现提供新的见解。
ESX系统;分枝杆菌;膜复合体;抗生素;毒力因子
许多致病菌通过分泌的效应蛋白影响宿主免疫功能,从而促进自身的存活。分枝杆菌多数蛋白通过Sec和Tat途径分泌,不少毒力因子也通过其他分泌系统分泌。分枝杆菌 VII分泌系统 (type VII secretion systems,T7SSs),也称作ESX(ESAT6 protein family secretion systems)系统,能够将多种不同的毒力蛋白转运通过细胞膜。VII分泌系统已经发现近20年,ESX系统共发现有5种不同的亚型,分别为ESX-1、ESX-2、ESX-3、ESX-4、ESX-5[1]。该系统可以将底物从胞质运输到胞外,穿过复杂的细胞膜,且不会停留在周质空间中,这与Tat和Sec分泌途径不同。ESX系统最初发现的功能是它的毒力因子作用,能够逃避和修饰宿主的免疫,但是近些年研究发现该系统及其底物还存在其他的作用,如水平基因转移,营养物质和代谢物的摄取等[2],在致病分枝杆菌中的生活史中十分重要,也是新药物以及疫苗开发的主要方向之一。因此,了解ESX系统结构及功能有助于研发控制分枝杆菌()感染引起的疾病。本文综述了分枝杆菌的ESX系统的组成、功能及底物的运输过程,以及ESX系统在抗生素耐药、持留及与宿主-噬菌体相互作用中的功能,特别是作为新药物靶标的潜力。
1 ESX系统分类
分枝杆菌具有5个ESX系统,其中ESX-2的研究比较少[3]。ESX-4系统是最古老的系统,其他4个ESX系统是通过基因复制、基因多样化(diversification)和基因水平转移产生的类ESX-4系统(表1)。ESX-2与ESX-5进化同源性较高,它们都是在ESX-1产生后通过质粒介导的基因水平转移产生[4]。
ESX-1是最早被发现的VII型分泌系统。在致病菌中,它能够破裂吞噬体膜,因此能够移动到宿主胞质中。ESX-1突变的细菌则会被滞留在吞噬体的隔间中[5]。ESX-1还可介导细菌DNA片段引起的I型干扰素分泌[6]。其次,ESX-1有助于肉芽肿的形成,促进分枝杆菌的持留与后续传播。将Esx-1完全敲除会导致结核分枝杆菌与海分枝杆菌的溶血活性丧失[7]。在非致病菌中,ESX-1作用不同,它可以与ESX-4协同作用,能够单向的将大片段的染色体DNA转移,引起水平基因的转移[8]。在受体菌中,ESX-1和ESX-4都是必需的,但在供体菌中,ESX-4不是必需的[4]。
ESX-3可能在调节宿主免疫中其重要作用,它可能与铁离子和锌离子摄取相关,并且能干扰宿主胞内的免疫[9]。在结核分枝杆菌中,的转录以及其他相关与铁离子吸取的基因被IdeR负调控,并且结核分枝杆菌中的小RNA MTS1338能够上调ESX系统中3和(ESX conserved component)的表达[10]。此外,ESX-3系统与生物被膜的形成相关,敲除会导致生物被膜无法形成,也会导致耻垢分枝杆菌出现严重的生长缺陷[11]。
ESX-4被认为最古老的ESX系统,目前研究尚未清楚。在多数物种中,ESX-4缺乏存在于其他ESX系统中的保守基因,例如和,以及保守的系统组分EspG和EccE[4]。在耻垢分枝杆菌()中,ESX-4与水平基因转移相关。在脓肿分枝杆菌中,ESX-4与毒力作用相关。在海分枝杆菌中,ESX-4能够影响肌动蛋白细胞骨架的重排从而影响巨噬细胞的吞噬作用,并且发现敲除EccD4能够提高ESX-1与ESX-5底物的分泌[12],体现了ESX系统的进化渊源。
ESX-5存在于缓慢生长的分枝杆菌中,与营养摄取以及免疫修饰蛋白的分泌相关。在海分枝杆菌中,ESX-5涉及脂肪酸的摄取与利用[4]。低磷酸条件下,结核分枝杆菌通过Pst-SenX3-RegX3系统上调了ESX-5的表达[13]。此外,ESX-5系统与分枝杆菌的细胞壁完整性以及毒力相关,可以通过减弱外膜的通透性来降低对ESX-5的需求[14]。突变ESX-5系统中的PE相关基因导致分枝杆菌的毒性减弱以及在巨噬细胞中的存活能力下降[15]。而与则是结核分枝杆菌存活的必需基因,转座子突变这两个基因会导致分枝杆菌的死亡,当导入与的重组质粒时,敲除系统不会引起分枝杆菌的死亡[11]。但Tiwari等[16]将基因簇敲除后,结核分枝杆菌能够存活,但是毒性大幅度降低。将Δ系统的结核分枝杆菌−异种BCG作为增强免疫方案,显著增强了豚鼠()在感染分枝杆菌的存活率,表明ESX-5系统具有作为疫苗研发新靶标的潜力[16]。
2 Esx底物
Esx的底物分为3类,这些底物都具有WxG和YxxxD/E基序(X代表任意氨基酸)。第一类是Esx蛋白,Esx蛋白是一种异源二聚物蛋白,总长约为100个氨基酸,具有保守的WxG基序位于2个α螺旋之间。它的配体蛋白在C端具有保守的YxxxD/E基序,是分泌所必需的[17]。目前研究比较多的是EsxA/EsxB (表2)。第二类是PE与PPE蛋白,PE与PPE蛋白在N端具有保守的脯氨酸和谷氨酸,在C端是多变的,保守的PE与PPE结构域长度为110或180氨基酸[9]。此外,除了ESX-4,其他ESX系统中都存在与基因簇。PE与PPE结构与Esx蛋白结构类似,具有WXG基序,且在C端也具有YXXXD/E基序。部分PE与PPE蛋白可能与ESX系统分泌至外膜的通道形成相关[9]。第三类是Esp (ESX-specific protein)蛋白,这类蛋白是ESX-1系统的特异性底物。其中EspB蛋白的结构比较清楚,它是一种单体蛋白,被MycP1切割裂解,Esp蛋白的N端与PE/PPE蛋白高度相似,并且能形成7聚物的疏水圆环插入细胞膜中[18]。EspA,C,D蛋白由同一操纵子编码,与ESX-1的功能相关,也与致病菌的毒力相关。其中,EspE,F,H与EspA,C,D类似。此外,底物形成异源二聚体的两种配对蛋白在分泌上相互依赖,如EspC/EspA依赖于EsxA/EsxB,PE35/PPE68_1依赖于EsxA底物[19]。
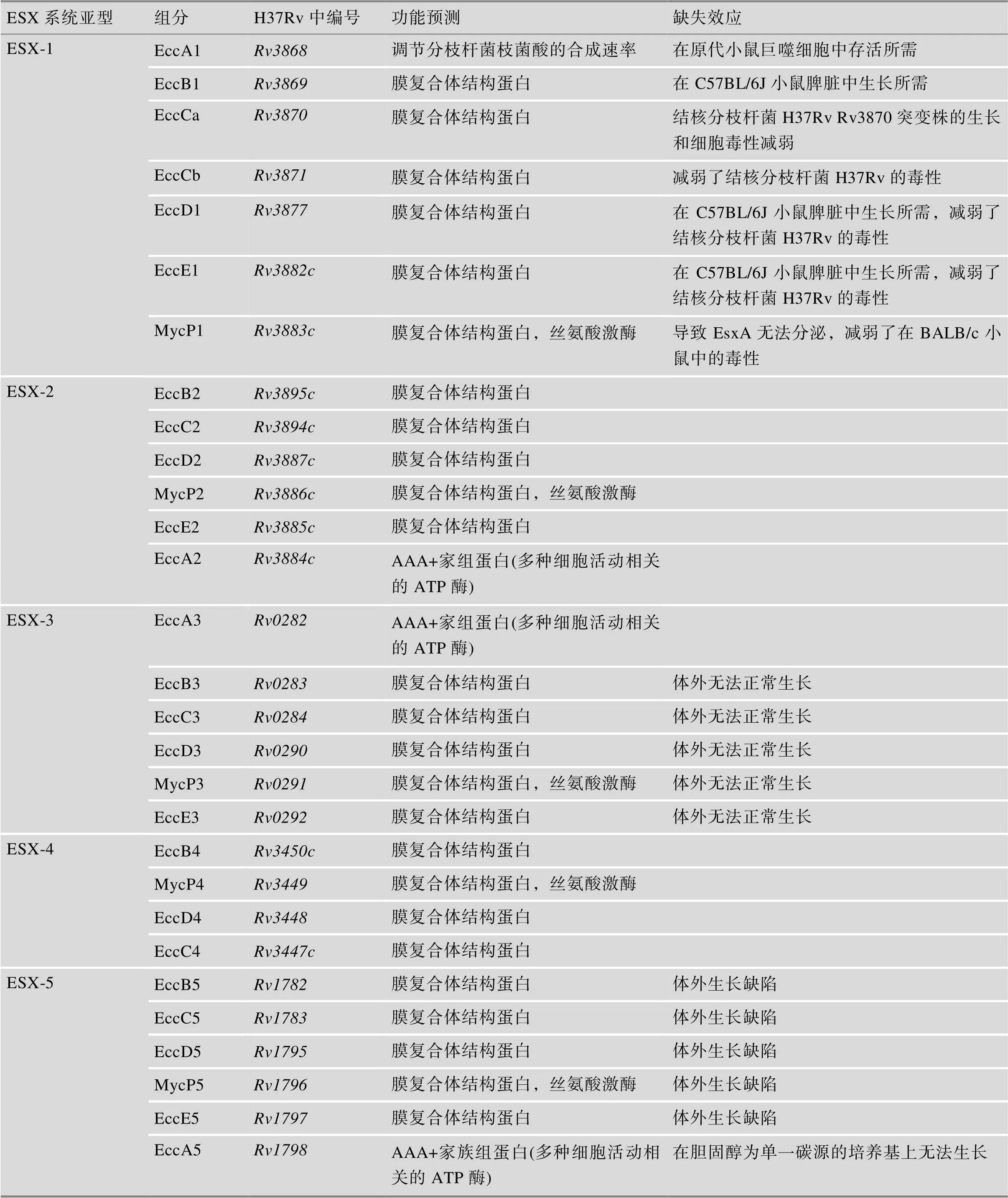
表1 不同ESX系统的组分
3 ESX系统的胞浆组分
EspG蛋白是ESX系统在胞浆中保守的分子伴侣,存在于所有编码PE/PPE底物的分枝杆菌基因座中。尽管不同的基因座的EspG序列的相关性低,但是结构却十分相似[20,21]。EspG的β2-β3环是与PE/PPE的结合位点以及区别于其他同源系统的关键因素。
EspH是存在于Esp底物的分子伴侣,结构与YbaB类似,是EspE/EspF的分子伴侣,在感染宿主进程中发挥重要作用。但是在斑马鱼幼体中,敲除EspH却显著增加了海分枝杆菌的毒力[22]。
EccA是ESX系统胞浆中的保守组分,属于AAA+家族蛋白(多种细胞活动相关的ATP酶),具有类分子伴侣活性。与、一样,存在于除外的基因座中。EccA由两个结构域构成,C端的AAA+ATPase结构域和由6个串联的重复4肽构成N端,参与蛋白与蛋白之间的互作,且EccA的N端具有调控作用,能够调节海分枝杆菌中枝枝菌酸的合成速率[6]。
4 ESX系统膜复合体
ESX系统包含5个保守的蛋白,分别为EccB、EccC、EccD、EccE、MycP。除了ESX-4系统和脓肿分枝杆菌通常缺乏EccE外,其他ESX系统都存在这5个组分。以结核分枝杆菌中的ESX-5系统为例,ESX系统膜复合体大小为2320 kDa,通过165跨膜螺旋(transmembrane helices,TMH),锚定在细胞内膜上,膜组件可以理解为3个二聚体,其中每个二聚体包括单个拷贝的MycP5和两个原体,每个原体由单拷贝的EccB5、EccC5、EccE5和两个拷贝的EccD5组成[23]。
EccB是定位于周质空间中的单跨膜蛋白,有延长的准双重对称的扭曲螺旋桨结构域,包含有疏水中心结构域,由中心的2个β平行和两侧的两个重复结构域构成[24]。单体具有明显可区分内部与外部构象,通常与MycP在周质空间形成二聚体。此外,EccB的N端和α螺旋结构能与内膜的胞质侧平行,还能与EccD以顺时针方向结合,形成类似篮子的结构[23]。
EccD具有11个跨膜结构域,是最疏水的膜组分,其N端的110个氨基酸结构类似于泛素构象(ubiquitin like domains,Ubl),在溶液中为二聚体。ESX系统中通常由6个EccD的二聚体形成具有内腔的圆形筏子,天然环境下腔内部含有大量膜脂[23]。
EccE点位于膜复合体的外部,具有2个跨膜螺旋,并且C端的胞质部分虽然缺乏结合位点和催化位点,但是与糖基转移酶具有微弱的同源性,对于膜复合体的稳定以及底物的分泌十分必要。
EccC是ATP酶,N端具有2个TMH形成二聚体,中间具有茎(stalk)结构域,连接C端的具有4个的FtsK/SpoIIIE样核酸结合结构域(nucleotide binding domain,NBD),是ESX系统中最保守的中心蛋白。FtsK/SpoIIIE ATP酶家族的成员形成六聚体,形成了3个4-TMH束,这些束通过疏水相互作用结合在一起,有效地密封了被EccB包围的膜复合体的中心空间。此外每个束中的EccC-TMH与内部的EccB结合,从而不与外部的EccB发生作用[23]。EccC具有可塑性,它的存在状态与ESX膜复合体的开放程度相关[25]。
MycP是一种膜结合,类似于枯草芽孢杆菌蛋白酶的丝氨酸蛋白酶,并非膜复合体的核心组分,但是在放线菌中的ESX系统中高度保守。MycP与枯草芽孢杆菌蛋白酶不同的是,它N端具有不能够阻塞活性位点的延伸,并且不会降解,包裹于蛋白酶结构域表面。MycP的蛋白酶结构域和TMH与周质内侧EccB和镶嵌在膜外侧EccD的相互作用,更好地将周质MycP-EccB组装锚定在膜上,同时也稳定了二聚体单元,并且通过促进MycP-MycP与内部和外部的EccB形成交叉二聚体稳定了整个膜复合体[23]。
5 ESX系统跨内膜的可能运输机制
5.1 中心孔隙模型
膜复合体EccC在胞质结构域的6个亚基是可塑并且失活的。Esx底物与第三个NBD(D3)结合,降低了EccC的可塑性,并且组装成带有3个NBD的六聚物。同时,第二个结合事件发生在LINKER-2结构域(LINKER-2结构域将NBD1和NBD2连接在一起),它与PE/PPE或与它们作用的分子伴侣结合,将LINKER-2与NBD1分离,解除对NBD1的抑制活性,从而激活膜复合体。此外,第二个结合事件还能促使EccB的构象发生改变,允许膜复合体能够通过转运的蛋白。底物EsxB同源二聚体能够促进EccC的寡聚化,但是不足以使ATP酶激活,还需要将D1结构域邻近的精氨酸指结构寡聚化才能激活,但是EsxA却具有抗EccC寡聚化作用。在激活过程中,EccC从延伸的构象转变为具有ATP酶活性的水桶结构,重排了大量的NBD结构域,当EccC的NBD从原来位点移向Ubl锚定的平台以及本身具有ATP酶活性时,能够促使膜复合体孔的开放[2,25,26]。
5.2 煽动者模型
煽动者转运模型是中心孔隙模型的变体,主要区别是EccA作为分泌的煽动者。EccA四肽重复结构域装载Esx底物,它本身具有ATP酶的活性为底物进入ATP酶水桶中提供能量。EccA与D3六聚体尺寸能够兼容,与EccA结合能够稳定D3结构域的活性。这种模型只在特定的条件下发挥作用[26]。
5.3 原体孔隙模型
EccD二聚物作为在6个原体中的分泌孔,EccD孔隙几乎完全疏水并且被脂质堵住,具有亲水性表面的基质不太可能通过。PPE底物可以插入EccD孔隙中并且不会被排斥,然后引起EccD构象的改变,可能是PE-PPE复合体在LINKER-2的结合位点与EccD孔隙邻近,然后引起了EccC的NBD结构域或D1结构域重排导致了EccD孔隙发生移动。6对PE-PPE底物通过原体孔的同时会有1对Esx底物通过中心孔[26]。
6 ESX系统跨外膜的可能运输机制
由于ESX系统的大小不足以跨过外膜(outer membrane,OM),说明底物通过OM存在其他的机制,可能是由于OM转运部分与核心膜复合体部分作用不够稳定,共纯化无法将OM转运部分分离出来。有研究发现EsxE/EsxF可以通过WXG基序与细胞膜发生作用,形成异源低聚物的跨膜孔,允许外毒素CpnT通过OM。此外,PE38/PPE7是分泌许多ESX-5系统底物所必需的,推测PE38/PPE71与外膜分泌ESX-5系统底物的机制有关[28]。鉴于底物依赖的共同转运机制,推测ESX系统特异性的底物很可能介导了跨OM的过程[2,25,27]。
7 ESX系统的调控
ESX系统的调控与双组分系统相关(two component system,TCS)。结核分枝杆菌被吞噬体吞噬之后,PhoPR双组分系统的PhoR感受环境pH的改变,活化同源反应调节器PhoP,上调基因簇上游操纵子的表达(图1),破裂吞噬体,促进结核分枝杆菌的胞内存活[28]。双组分系统MprAB能调控操纵子对细胞表面压力变化的应答[29]。操纵子的转录调控间接影响基因簇中编码的蛋白质的分泌,因为Esp和Esx1蛋白的分泌相互依赖。EspR、Phop和MprA的调控序列位于启动子区域,与RD8区域重叠[29]。
转录因子调节ESX系统,ESX膜复合体会诱导的表达,会诱导Esx底物的表达,从而防止Esx底物在胞质中积累。当ESX复合体缺乏时,不会诱导表达,从而防止Esx底物的积累。其中EspE和EspF在的自动调整中发挥了重要作用[17,19]。

图1 VII型分泌系统的结构模型
PhoPR双组分系统感应pH改变,上调操纵子的表达,促进Esx底物的积累并分泌至胞外,破裂吞噬体膜。ESX系统还存在负反馈调节机制,通过调节Esx底物的含量。
8 ESX系统与抗生素的关系
针对ESX系统进行抗生素作用机理或者新药研发的工作较少,但分析NIH各种化合物处理结核分枝杆菌后的转录组数据发现[30],靶向细胞壁的抗生素(表3)下调大部分Esx底物编码基因的表达(图2A),但是部分ESX系统组分基因的表达也上调,推测可能是细胞壁上存在ESX系统膜复合体的感应元件,能够让细菌感知ESX膜复合体的含量。但是由于细胞壁合成受阻,ESX系统膜复合体的感应元件无法正常定位,无法向细菌传递饱和的信号,导致细菌持续表达膜复合体相关基因,从而导致相关组分基因的表达上调。其次,由于存在的负反馈机制,在感知膜复合体成分不足时,底物的表达量也降低,从而导致多数ESX系统底物基因的表达下调。缬氨霉素上调ESX-4中的膜复合体组分相关基因表达,表明ESX-4系统在结核分枝杆菌中的作用可能与氧化磷酸化相关,这需要进一步验证。靶向核糖体的抗生素下调几乎所有ESX系统组分的表达,但上调少数ESX系统底物的表达,这种明显差异调控的具体原因尚不清楚。此外,Ioerger等[31]基于全细胞筛选,并且通过耐药突变的全基因组测序和重组工程技术,发现了EccB3能够对全细胞活性化合物1产生抗性(图2B),表明化合物1可能作为新抗生素的骨架[31]。
Rybniker等[32]发现苯并噻吩类抑制剂BTP15能够通过抑制组氨酸激酶活性,解除对操纵子的调控,影响EsxA的分泌。这表明ESX系统可能作为新药物靶标[32]。
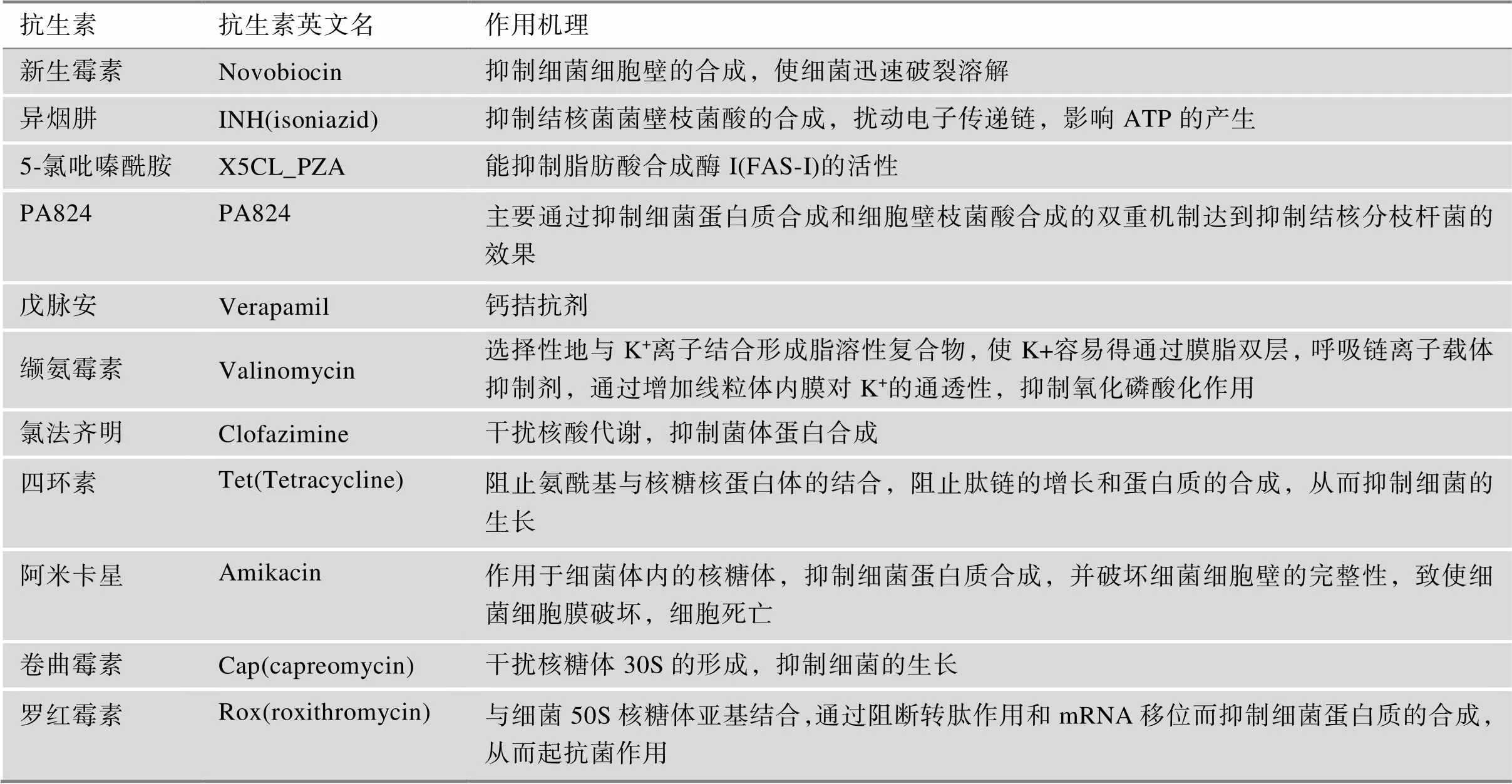
表3 抗生素作用靶标
9 ESX系统在噬菌体感染中的作用
耐药细菌是细菌感染治疗的难点,而噬菌体治疗可克服细菌的耐药且具有高度的特异性,是感染控制的一重要方向。Chatterjee等[33]发现粪肠球菌()感染噬菌体后,会诱导ESX系统相关基因的转录,引起了细菌对于非噬菌体靶点的非亲属细菌细胞的拮抗作用,这说明噬菌体治疗会改变微生物群落。此外,他们还发现在亚致死浓度的靶向膜损伤的抗生素也会引起这种效应[33]。通过对龟分枝杆菌感染BP原噬菌体转录组的分析,发现基因的转录明显上调(表4),这与Chatterjee等[34]的结论一致。
10 ESX系统与宿主的相互作用
通过分析感染结核分枝杆菌ΔRD1与WT的巨噬细胞48 h转录组数据(GSE132283)[35]发现:等基因的表达显著下调(图3A)。其中EXT1是硫酸乙酰肝素生物合成的必需酶。硫酸乙酰肝素作为结核分枝杆菌表面蛋白肝素结合血凝素的受体,在启动结核分枝杆菌在宿主中的持留发挥重要作用,这表明ESX-1的ΔRD1影响了分枝杆菌在宿主中的持留[36]。通过KEGG富集分析感染ΔRD1与WT结核分枝杆菌48 h后的巨噬细胞的相关炎症因子以及免疫途径发现:与WT相比,ΔRD1菌株感染的巨噬细胞的Toll-like receptor、TNF、NF-κB信号通路途径的相关基因表达受到不同程度的影响(图3B),这与Hinman等[37]研究结果一致,即ESX-1通过影响吞噬体的酸化而钝化依赖内吞体特异性TLR2反应的激活,影响TNF等炎症因子的表达。
此外,ESX-1系统底物EsxA可以穿透多泡小体腔内膜,有利于分枝杆菌利用胞内的营养物质,从而促进细菌在胞内的存活。ESCRT蛋白(endosomal sorting complex required for transport) Tsg101、Vps32和Vps4会定位于损伤处,修复被破坏的腔内膜,但是由于分枝杆菌中的EsxA与PDIM造成的损伤是持续性的,因此仅仅依靠ESCRT的修复是仅仅不够,此时还会通过自噬来进行修复,但是目前具体的修复机制尚不清楚。此外,还可以通过对细菌泛素化修饰从而将胞质中的细菌作为靶标进行自噬降解。但是上述的修复机制是通用的,在其他胞内致病菌的感染中也存在这种修复方式[38]。脓肿分枝杆菌ESX-3底物EsxH和EsxG能够与肝细胞生长因子调节的酪氨酸激酶底物(hepatocyte growth factor- regulated tyrosine kinase substrate)组分结合,降低了HGS与胞内分选复合体的亲和性,影响吞噬体的成熟,从而影响巨噬细胞的炎症信号和细胞因子的产生,损害了CD4+细胞的激活[39,40]。

图2 不同抗生素差异调控ESX系统相关基因的转录
A:NIH数据中抗生素差异调控的基因转录热图;B:化合物1结构式。
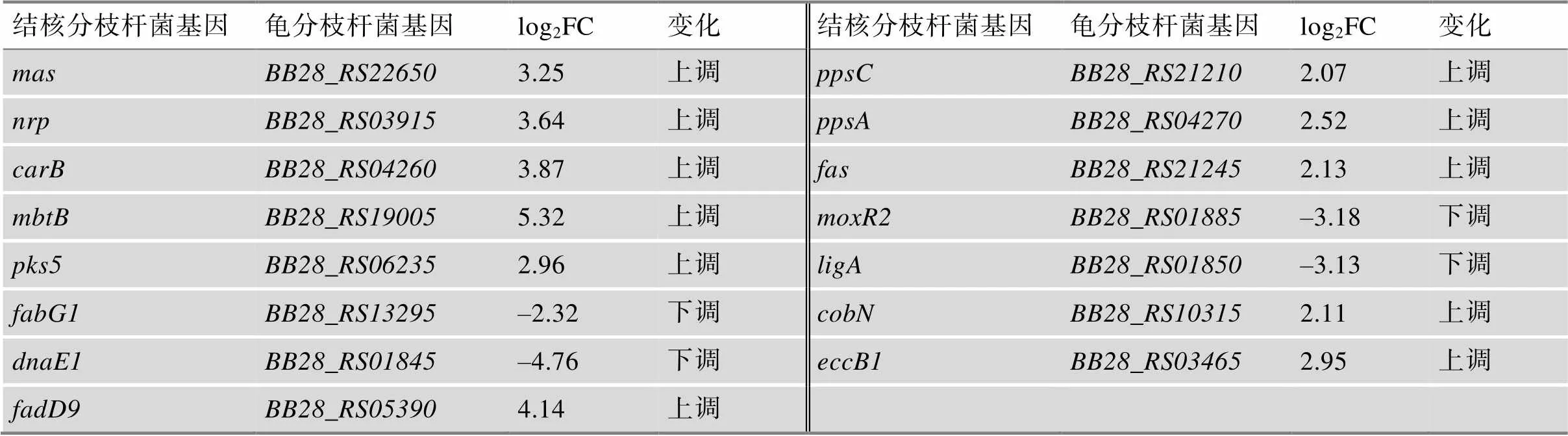
表4 龟分枝杆菌感染噬菌体后Esx相关基因的变化情况

图3 ΔRD1改变巨噬细胞Toll-like receptor、TNF、NF-κB信号通路相关基因表达
A:感染ΔRD1与WT结核分枝杆菌48 h后巨噬细胞差异表达基因的火山图。蓝点显示基因上调表达2倍,<0.05。红点显示基因表达低于0.5倍,<0.05。蓝点显示基因<2倍表达上调或下调,<0.05。绿点表达的基因在不同条件下无显著差异,>0.05。B:比较ΔRD1与WT结核分枝杆菌感染48 h后样本差异表达基因的KEGG分析中值最高的20条途径。
11 ESX系统与持留的关系
持留结核分枝杆菌是结核病治疗的一大难点,容易导致耐药性细菌的产生。有研究发现,在BCG中回补MTB的RD1的相关基因会增强BCG在宿主细胞的持留性,表明RD1中的基因与结核分枝杆菌的持留密切相关[41]。ESX系统底物中PE/PPE家族与持留也存在联系,在耻垢分枝杆菌中异源表达ESX5的底物(PPE25、PPE26、PPE27),显著增强了细菌在宿主中的持留能力[42,43]。此外,结核分枝杆菌可以将糖酵解途径转化为酮体合成途径,去激活抗脂聚物G蛋白偶联受体GPR109A,扰动宿主脂质代谢的动态平衡,影响宿主细胞内部脂滴的积累,促进“皂化”细胞的形成去适应自身的持留状态,EsxA可以促进3-羟基丁酸的产生,介导这个转化过程,从而促进细菌的持留[44]。通过ESX系统底物的YXXXD/E特征序列并且结合Tucci等[45]鉴定的结核分枝杆菌培养滤液蛋白对ESX系统底物进行预测[45]发现Rv0467、Rv0981、DosT与分枝杆菌的持留相关,表明ESX系统在分枝杆菌的持留方面发挥着重要作用,但目前ESX系统还有许多底物的功能尚未清楚,需要进一步验证。
12 结语与展望
ESX系统作为致病分枝杆菌毒力因子的关键,其组成、结构以及功能的研究日益受到关注。耻垢分枝杆菌ESX-3和结核分枝杆菌ESX-5的部分高分辨率结构已经解析,据此可以预测ESX系统的运输机制。这有助于靶向ESX系统的新抗生素研发。结核病治疗新药物贝达喹啉与德拉马尼未改变ESX系统相关基因的转录[46,47],但PA824、氯法齐明、缬霉素上调系列基因的转录,四环素下调基因的转录[30]。深入研究这些抗生素和ESX系统基因表达之间的关系,有助于发现新靶标。
目前关于Esx底物的功能研究多是为了寻找合适的蛋白作为疫苗研发的新靶标,其中关于EsxA/EsxB的研究最多。重组BCG菌株中单独回补EsxA基因片段,EsxA蛋白还可以通过ESX-5系统分泌至胞外,并且只会增强疫苗的免疫原性,不会增加疫苗反应原性[41]。此外,EsxA/EsxB还可以作为结核分枝杆菌感染的诊断标志物。然而,EsxA和EsxB不能同时用于疫苗接种和诊断,因为它们应用于在接种含有EsxA和EsxB制剂的人群中无法区分接疫苗和结核分枝杆菌感染的效果。因此迫切需要寻找新的蛋白作为疫苗的研发靶标,目前已发现Esx样蛋白有23种,这些蛋白可能具有作为疫苗靶标的潜力,但与其相关的功能研究较少。ID93是一种多蛋白候选疫苗,包含4种结核分枝杆菌蛋白,其中两种是Esx样蛋白,即Rv3619c (EsxV)和Rv3620c (EsxW),这种亚单位疫苗的免疫并没有诱导对结核分枝杆菌纯化蛋白衍生物(purified protein derivatives,PPD)的敏感性,这表明它作为疫苗的使用不会干扰PPD作为对结核病诊断的皮肤测试试剂的使用。ID93/GLA-SE (glucopyranosyl lipid adjuvant in a stable nano‑emulsion)疫苗也已在接种了卡介苗的成人中进行了I期临床试验,结果显示该疫苗耐受性良好,疫苗接种者没有出现严重或严重的疫苗相关不良反应。目前IIa期临床试验正在南非开普敦附近的3个临床地点进行。这表明Esx样蛋白底物具有较大的应用前景,但相关的作用机制仍需要更多研究。
[1] Stanley SA, Raghavan S, Hwang WW, Cox JS. Acute infection and macrophage subversion byrequire a specialized secretion system., 2003, 100(22): 13001–13006.
[2] Bunduc CM, Bitter W, Houben ENG. Structure and function of the mycobacterial type VII secretion systems., 2020, 74: 315–335.
[3] Gröschel MI, Sayes F, Simeone R, Majlessi L, Brosch R. ESX secretion systems: mycobacterial evolution to counter host immunity., 2016, 14(11): 677–691.
[4] Newton-Foot M, Warren RM, Sampson SL, van Helden PD, Gey van Pittius NC. The plasmid-mediated evolution of the mycobacterial ESX (Type VII) secretion systems., 2016, 16: 62.
[5] Houben D, Demangel C, van Ingen J, Perez J, Baldeon L, Abdallah AM, Caleechurn L, Bottai D, van Zon M, de Punder K, van der Laan T, Kant A, Bossers-de Vries R, Willemsen P, Bitter W, van Soolingen D, Brosch R, van der Wel N, Peters PJ. ESX-1-mediated translocation to the cytosol controls virulence of mycobacteria., 2012, 14(8): 1287–1298.
[6] Lienard J, Nobs E, Lovins V, Movert E, Valfridsson C, Carlsson F. TheESX-1 system mediates phagosomal permeabilization and type I interferon production via separable mechanisms., 2020, 117(2): 1160–1166.
[7] Osman MM, Pagan AJ, Shanahan JK, Ramakrishnan L.phthiocerol dimycocerosates enhance macrophage phagosomal permeabilization and membrane damage., 2020, 15(7): e0233252.
[8] Gray TA, Clark RR, Boucher N, Lapierre P, Smith C, Derbyshire KM. Intercellular communication and conjugation are mediated by ESX secretion systems in mycobacteria., 2016, 354(6310): 347–350.
[9] Ates LS. New insights into the mycobacterial PE and PPE proteins provide a framework for future research., 2020, 113(1): 4–21.
[10] Bychenko O, Skvortsova Y, Ziganshin R, Grigorov A, Aseev L, Ostrik A, Kaprelyants A, Salina EG, Azhikina T.small RNA MTS1338 confers pathogenic properties to non-pathogenic., 2021, 9(2): 414.
[11] Nath Y, Ray SK, Buragohain AK. Essential role of the ESX-3 associated eccD3 locus in maintaining the cell wall integrity of., 2018, 308(7): 784–795.
[12] Wang YC, Tang YT, Lin C, Zhang JL, Mai JT, Jiang J, Gao XX, Li Y, Zhao GP, Zhang L, Liu J. Crosstalk between the ancestral type VII secretion system ESX-4 and other T7SS in., 2022, 25(1): 103585.
[13] White DW, Elliott SR, Odean E, Bemis LT, Tischler AD.Pst/SenX3-RegX3 regulates membrane vesicle production independently of ESX-5 activity., 2018, 9(3): e00778.
[14] Ates LS, Ummels R, Commandeur S, van de Weerd R, Sparrius M, Weerdenburg E, Alber M, Kalscheuer R, Piersma SR, Abdallah AM, Abd El Ghany M, Abdel-Haleem AM, Pain A, Jiménez CR, Bitter W, Houben ENG. Essential role of the ESX-5 secretion system in outer membrane permeability of pathogenic mycobacteria., 2015, 11(5): e1005190.
[15] Bottai D, Di Luca M, Majlessi L, Frigui W, Simeone R, Sayes F, Bitter W, Brennan MJ, Leclerc C, Batoni G, Campa M, Brosch R, Esin S. Disruption of the ESX-5 system ofcauses loss of PPE protein secretion, reduction of cell wall integrity and strong attenuation., 2012, 83(6): 1195– 1209.
[16] Tiwari S, Dutt TS, Chen B, Chen M, Kim J, Dai AZ, Lukose R, Shanley C, Fox A, Karger BR, Porcelli SA, Chan J, Podell BK, Obregon-Henao A, Orme IM, Jacobs WR Jr, Henao-Tamayo M. BCG-Prime and boost with Esx-5 secretion system deletion mutant leads to better protection against clinical strains of., 2020, 38(45): 7156–7165.
[17] Chirakos AE, Nicholson KR, Huffman A, Champion PA. Conserved ESX-1 substrates EspE and EspF are virulence factors that regulate gene expression., 2020, 88(12): e00289–20.
[18] Solomonson M, Setiaputra D, Makepeace KAT, Lameignere E, Petrotchenko EV, Conrady DG, Bergeron JR, Vuckovic M, DiMaio F, Borchers CH, Yip CK, Strynadka NCJ. Structure of EspB from the ESX-1 type VII secretion system and insights into its export mechanism., 2015, 23(3): 571–583.
[19] Abdallah AM, Weerdenburg EM, Guan QT, Ummels R, Borggreve S, Adroub SA, Malas TB, Naeem R, Zhang HM, Otto TD, Bitter W, Pain A. Integrated transcriptomic and proteomic analysis of pathogenic mycobacteria and their esx-1 mutants reveal secretion-dependent regulation of ESX-1 substrates and WhiB6 as a transcriptional regulator., 2019, 14(1): e0211003.
[20] Bitter W, Houben EN, Bottai D, Brodin P, Brown EJ, Cox JS, Derbyshire K, Fortune SM, Gao LY, Liu J, Gey van Pittius NC, Pym AS, Rubin EJ, Sherman DR, Cole ST, Brosch R. Systematic genetic nomenclature for type VII secretion systems., 2009, 5(10): e1000507.
[21] Tuukkanen AT, Freire D, Chan S, Arbing MA, Reed RW, Evans TJ, Zenkeviciute G, Kim J, Kahng S, Sawaya MR, Chaton CT, Wilmanns M, Eisenberg D, Parret AHA, Korotkov KV. Structural variability of EspG chaperones from mycobacterial ESX-1, ESX-3, and ESX-5 type VII secretion systems., 2019, 431(2): 289–307.
[22] Phan TH, van Leeuwen LM, Kuijl C, Ummels R, van Stempvoort G, Rubio-Canalejas A, Piersma SR, Jiménez CR, van der Sar AM, Houben ENG, Bitter W. EspH is a hypervirulence factor forand essential for the secretion of the ESX-1 substrates EspE and EspF., 2018, 14(8): e1007247.
[23] Bunduc CM, Fahrenkamp D, Wald J, Ummels R, Bitter W, Houben ENG, Marlovits TC. Structure and dynamics of a mycobacterial type VII secretion system., 2021, 593(7859): 445–448.
[24] Poweleit N, Czudnochowski N, Nakagawa R, Trinidad DD, Murphy KC, Sassetti CM, Rosenberg OS. The structure of the endogenous ESX-3 secretion system., 2019, 8: e52983.
[25] Beckham KS, Ciccarelli L, Bunduc CM, Mertens HD, Ummels R, Lugmayr W, Mayr J, Rettel M, Savitski MM, Svergun DI, Bitter W, Wilmanns M, Marlovits TC, Parret AHA, Houben ENG. Structure of the mycobacterial ESX-5 type VII secretion system membrane complex by single-particle analysis., 2017, 2: 17047.
[26] Rivera-Calzada A, Famelis N, Llorca O, Geibel S. Type VII secretion systems: structure, functions and transport models., 2021, 19(9): 567–584.
[27] Tak U, Dokland T, Niederweis M. Pore-forming Esx proteins mediate toxin secretion by., 2021, 12(1): 394.
[28] Frigui W, Bottai D, Majlessi L, Monot M, Josselin E, Brodin P, Garnier T, Gicquel B, Martin C, Leclerc C, Cole ST, Brosch R. Control ofESAT-6 secretion and specific T cell recognition by PhoP., 2008, 4(2): e33.
[29] Cao GX, Howard ST, Zhang PP, Wang XS, Chen XL, Samten B, Pang XH. EspR, a regulator of the ESX-1 secretion system in Mycobacterium tuberculosis, is directly regulated by the two-component systems MprAB and PhoPR., 2015, 161(Pt 3): 477–489.
[30] Boshoff HI, Myers TG, Copp BR, McNeil MR, Wilson MA, Barry CE 3rd. The transcriptional responses ofto inhibitors of metabolism: novel insights into drug mechanisms of action., 2004, 279(38): 40174–40184.
[31] Ioerger TR, O'Malley T, Liao RL, Guinn KM, Hickey MJ, Mohaideen N, Murphy KC, Boshoff HI, Mizrahi V, Rubin EJ, Sassetti CM, Barry CE 3rd, Sherman DR, Parish T, Sacchettini JC. Identification of new drug targets and resistance mechanisms in., 2013, 8(9): e75245.
[32] Rybniker J, Chen JM, Sala C, Hartkoorn RC, Vocat A, Benjak A, Boy-Röttger S, Zhang M, Székely R, Greff Z, Orfi L, Szabadkai I, PatóJ, Kéri G, Cole ST. Anticytolytic screen identifies inhibitors of mycobacterial virulence protein secretion., 2014, 16(4): 538– 548.
[33] Chatterjee A, Willett JLE, Dunny GM, Duerkop BA. Phage infection and sub-lethal antibiotic exposure mediatetype VII secretion system dependent inhibition of bystander bacteria., 2021, 17(1): e1009204.
[34] Cushman J, Freeman E, McCallister S, Schumann A, Hutchison KW, Molloy SD. Increased whiB7 expression and antibiotic resistance incarrying two prophages., 2021, 21(1): 176.
[35] Bernard EM, Fearns A, Bussi C, Santucci P, Peddie CJ, Lai RJ, Collinson LM, Gutierrez MG.infection of human iPSC-derived macrophages reveals complex membrane dynamics during xenophagy evasion., 2020, 134(5): jcs252973.
[36] Huang TY, Irene D, Zulueta MM, Tai TJ, Lain SH, Cheng CP, Tsai PX, Lin SY, Chen ZG, Ku CC, Hsiao CD, Chyan CL, Hung SC. Structure of the complex between a heparan sulfate octasaccharide and mycobacterial heparin-binding hemagglutinin., 2017, 56(15): 4192–4196.
[37] Hinman AE, Jani C, Pringle SC, Zhan WR, Jain N, Martinot AJ, Barczak AK.canonical virulence factors interfere with a late component of the TLR2 response., 2021, 10: e73984.
[38] López-Jiménez AT, Cardenal-Muñoz E, Leuba F, Gerstenmaier L, Barisch C, Hagedorn M, King JS, Soldati T. The ESCRT and autophagy machineries cooperate to repair ESX-1-dependent damage at the- containing vacuole but have opposite impact on containing the infection., 2018, 14(12): e1007501.
[39] Kim YS, Yang CS, Nguyen LT, Kim JK, Jin HS, Choe JH, Kim SY, Lee HM, Jung M, Kim JM, Kim MH, Jo EK, Jang JC.ESX-3 plays an important role in host inflammatory and pathological responses during infection., 2017, 19(1): 5–17.
[40] Mehra A, Zahra A, Thompson V, Sirisaengtaksin N, Wells A, Porto M, Köster S, Penberthy K, Kubota Y, Dricot A, Rogan D, Vidal M, Hill DE, Bean AJ, Philips JA.type VII secreted effector EsxH targets host ESCRT to impair trafficking., 2013, 9(10): e1003734.
[41] Heijmenberg I, Husain A, Sathkumara HD, Muruganandah V, Seifert J, Miranda-Hernandez S, Kashyap RS, Field MA, Krishnamoorthy G, Kupz A. ESX-5-targeted export of ESAT-6 in BCG combines enhanced immunogenicity & efficacy against murine tuberculosis with low virulence and reduced persistence., 2021, 39(50): 7265– 7276.
[42] Mi YJ, Bao L, Gu DQ, Luo T, Sun CF, Yang GP. Mycobacterium tuberculosis PPE25 and PPE26 proteins expressed inmodulate cytokine secretion in mouse macrophages and enhance mycobacterial survival., 2017, 168(3): 234–243.
[43] Yang GP, Luo T, Sun CF, Yuan JN, Peng X, Zhang CX, Zhai XQ, Bao L. PPE27 in mycobacterium smegmatis enhances mycobacterial survival and manipulates cytokine secretion in mouse macrophages., 2017, 37(9): 421–431.
[44] Singh V, Jamwal S, Jain R, Verma P, Gokhale R, Rao KVS.-driven targeted recalibration of macrophage lipid homeostasis promotes the foamy phenotype., 2012, 12(5): 669–681.
[45] Tucci P, Portela M, Chetto CR, González-Sapienza G, Marín M. Integrative proteomic and glycoproteomic profiling ofculture filtrate., 2020, 15(3): e0221837.
[46] Immanuel SRC, Arrieta-Ortiz ML, Ruiz RA, Pan M, Lopez Garcia de Lomana A, Peterson EJR, Baliga NS. Quantitative prediction of conditional vulnerabilities in regulatory and metabolic networks using PRIME., 2021, 7(1): 43.
[47] Van den Bossche A, Varet H, Sury A, Sismeiro O, Legendre R, Coppee JY, Mathys V, Ceyssens PJ. Transcriptional profiling of a laboratory and clinicalstrain suggests respiratory poisoning upon exposure to delamanid., 2019, 117: 18–23.
Progress on the function ofT7SS (ESX) secretion system
Zhiyong Jiang, Jianping Xie
infection can affect the host’s immune function by secreting extracellular effector proteins. ESX (or type VII) system plays an important role in the secretion of effector proteins. ESX system is the protein export system in mycobacteria and many actinomycetes. However, how ESX system secretes and underlying mechanism of action remain unclear. In this review, we introduce the components, function, classification of ESX system and the process of substrates transfer to the peripheral space via this system, and discuss the roles of ESX system in antibiotics resistance, persistence, host-phage interaction, new drug targets. We hope to provide insights into the discovery of new drugs and vaccine antigens for tuberculosis.
ESX system;; membrane complex; antibiotic; virulence factor
2023-07-10;
2023-09-12;
2023-09-18
国家自然科学基金项目(编号:4112000164)资助[Supported by the National Natural Science Foundation of China (No. 4112000164)]
蒋智勇,硕士研究生,专业方向:微生物遗传学与感染免疫。E-mail: 2287834994@qq.com
谢建平,博士,二级研究员,研究方向:结核分枝杆菌等重要病原致病耐药机理与新防控措施研发。E-mail:georgex@swu.edu.cn
10.16288/j.yczz.23-188
(责任编委: 梁海华)