宁乡猪皮下脂肪与肌内脂肪组织转录组差异分析
王芳,张跃博,蒋谦,印遇龙,谭碧娥,陈家顺
研究报告
宁乡猪皮下脂肪与肌内脂肪组织转录组差异分析
王芳1,2,3,张跃博1,2,蒋谦1,3,印遇龙1,2,3,谭碧娥1,2,3,陈家顺1,2,3
1.湖南农业大学动物科学技术学院,动物营养基因组与种质创新研究中心,长沙 410128 2. 农业农村部畜禽资源(猪)评价利用重点实验室,长沙 410128 3. 畜禽产品品质调控湖南省重点实验室,长沙 410128
为了比较分析宁乡猪皮下脂肪(subcutaneous fat,SAF)和肌内脂肪(intramuscular fat,IMF)组织脂肪沉积的分子机制,本文利用RNA-seq技术鉴定和分析宁乡猪SAF和IMF组织中差异基因表达谱。选取6头250日龄健康状况良好、种内个体体重相近(约85 kg)的雄性宁乡猪为实验材料,采集SAF与IMF组织样品。通过对两个脂肪组织转录组测序并进行GO (Gene Ontology)功能注释及KEGG (and Genomes)信号通路富集分析,得到与脂肪沉积和脂质代谢相关的差异基因。为验证测序数据结果的可靠性,本研究随机选取6个差异基因进行qRT-PCR验证。结果表明,宁乡猪SAF和IMF组织中有2406个基因差异表达,其中1422个基因表达上调,984个基因表达下调。通过GO功能注释分析发现,差异表达基因主要通过参与类固醇生物合成、不饱和脂肪酸的生物合成、甘油磷脂代谢及自噬途径等与脂质代谢相关途径,调控宁乡猪SAF和IMF的沉积。KEGG通路富集结果显示,差异基因主要富集在脂质结合、脂肪酸代谢过程、甘油酯代谢过程、脂类生物合成等与脂质代谢相关的生物学过程。qRT-PCR结果与测序结果一致,表明测序结果可靠。通过对宁乡猪SAF与IMF组织进行转录组测序以及生物信息学分析,筛选到、、、、、、、、、、和等基因与脂质代谢相关,这些基因可能在宁乡猪SAF与IMF组织中脂肪沉积和代谢过程发挥重要调控作用,对进一步研究宁乡猪脂肪沉积机制具有重要意义。
宁乡猪;肌内脂肪;皮下脂肪;RNA-seq;差异表达基因
猪肉是我国居民肉食的主要来源,在我国居民的膳食结构中扮演着重要角色,可为人们提供优质蛋白质和必需的脂肪酸[1]。肌内脂肪(intramuscular fat,IMF)是影响猪肉品质的关键因素之一,影响肉的嫩度、系水力、风味和多汁性[2]。一般认为,IMF含量在2.5%~3.5%的猪肉其口感较为理想[3]。地方猪种具有繁殖力高、抗逆性强和IMF含量高等特点,例如宁乡猪IMF含量高达7.11%,不饱和脂肪酸含量在IMF中高达59.6%,被认为是具有较好肉质的猪种之一,但是其生长速度极其缓慢[4]。而改良型猪种虽然生长速度快、瘦肉率高、皮下脂肪(subcutaneous fat,SAF)沉积少,但同时IMF含量低、肉品质差。IMF与SAF的沉积(背膘厚度)呈现一定正相关性,SAF厚度可用于预测IMF含量[5]。因此,如何在不影响生长速度的前提下,减少猪SAF的沉积、增加IMF的含量已成为当前养猪业亟待解决的关键问题之一。
黄万龙等[6]采用RNA测序(RNA-seq)技术分析了大白猪SAF和IMF组织基因表达谱,发现不同部位的脂肪在脂肪代谢与脂肪细胞分化能力上存在着差异。这为寻找调控脂肪在不同组织差异沉积的分子机理提供了可能性。目前,RNA-seq技术已被广泛用于挖掘调控畜禽肉质性状的候选基因和生物学通路[5,7,8]。Chen等[9]利用RNA-seq技术分析比较了莱芜猪和大白猪肌肉组织转录组表达谱,结果表明差异表达基因主要富集在脂肪细胞因子信号通路、脂肪酸代谢和脂肪酸生物合成途径。Sodhi等[5]研究表明,巴克夏猪和济州岛本地猪的皮下、肌间与IMF组织中差异表达基因主要富集在脂质代谢相关的生物学过程和信号通路中。以上研究揭示了决定脂肪差异沉积的关键基因和途径。目前,关于同一品种及不同品种间猪不同组织脂肪差异沉积的机制研究较多[10,11],但有关宁乡猪品种内不同脂肪组织脂肪沉积差异的分子机制研究鲜见报道,尤其是宁乡猪SAF与IMF组织脂肪沉积的生物学机制,有待深入探究。因此,本研究利用RNA-seq技术对宁乡猪SAF与IMF组织进行转录组测序分析,得到SAF与IMF组织中差异表达的mRNA,并从中筛选出与脂肪沉积相关的候选基因,为进一步探究宁乡猪脂肪沉积机制提供理论依据。
1 材料与方法
1.1 实验动物及样品制备
本研究所选用的猪只由湖南楚沩香农牧股份有限公司提供。猪只选自相同饲养单元、同批次、同胎次,饲养于相同饲养管理环境下,体重接近、健康状况良好的6头250日龄宁乡猪。对猪放血屠宰后,立即采集宁乡猪SAF和IMF组织样本存放于液氮中。IMF组织的分离具体步骤如下[10,11]:
(1)将所需的眼科镊子和手术刀及其他实验器具经DEPC水浸泡并高压灭菌,烘箱烘干后待用。
(2)取出部分于液氮中保存的背最长肌组织,浸入–80℃预冷的RNAKeeper-ICE Tissue Transition Buffer (Vazyme)中解冻以防止RNA降解以及使组织解冻转变至易于处理的状态。
(3)在适度解冻后,在背最长肌组织趋向于透明时,白色的IMF组织比较明显。置于冰上,使用眼科镊子和手术刀分离IMF组织,并小心地剔除肌纤维和结缔组织,避免其他组织的污染。为了减少RNA降解,分离程序在冰上并在5 min内完成。分离出的IMF组织置于装有1 mL Trizol的2 mL无RNA 酶离心管中,储存于液氮中待提取RNA。
之后转入–80℃冰箱保存,直至后续分析。实验设置两组样本,每组6个重复:IMF及SAF,分别命名IMF1、IMF2、IMF3、IMF4、IMF5、IMF6和SAF1、SAF2、SAF3、SAF4、SAF5、SAF6。
1.2 RNA提取及质量检测
利用Trizol (美国Invitrogen公司)法提取IMF及SAF样本总RNA。Nanodrop 2000对提取的RNA浓度及纯度进行检测,使用1.0%琼脂糖凝胶电泳对RNA完整性进行检测,Agilent 2100对其RIN值进行测定,以确保转录组测序所用样本的质量。单次建库要求RNA总量1 μg,浓度≥50 ng/μL,260 nm/280 nm值介于1.8~2.2之间。测序文库的建立采用TruSeqTMRNA sample preparation Kit (美国Illumina公司)试剂盒。文库使用Illumina HiSeq xten/NovaSeq 6000测序平台进行高通量测序,测序读长为PE150。对每个样本原始测序数据进行过滤的步骤如下:(1)去除reads中的接头序列,去除由于接头自连等原因导致没有插入片段的reads;(2)将序列末端(3'端)质量值小于20的碱基修剪,若质量值小于10,则将整条序列剔除;(3)去除含N比率超过10%的reads;(4)舍弃adapter及质量修剪后长度小于20 bp的序列。通过以上过程得到高质量测序数据(clean data)以确保后续分析。将高质量clean data与参考基因组比对,获得用于后续转录本组装、表达量计算等的mapped reads。
1.3 基因表达水平及差异分析
在RNA-seq分析中,通过定位到基因组区域的序列(clean reads)数量(reads counts)来计算基因的表达水平。使用软件RSEM (http://deweylab.biostat.wisc. edu/rsem/)进行定量分析,并进一步分析其差异表达情况。获得基因的read counts后,使用DESeq2软件进行样本间基因的表达差异分析。
1.4 差异表达基因GO及KEGG通路富集分析
利用在线软件Network Analyst进行主成分分析(principal component analysis,PCA)。利用Goatools软件(https://godtoolsapp.com/en/)对差异表达基因进行富集分析。利用GO (Gene Ontology,http://wwwgeneontology.org/)数据库,将基因按照它们参与的生物学过程(biological process,BP)、构成细胞的组分(cellular component,CC)和实现的分子功能(molecular function,MF)进行分类。利用KEGG库(Kyoto Encyclopedia of Genes and Genomes,http://wwwgenomejp/kegg/)对基因参与的pathway通路或行使的功能进行分类。对差异表达基因进行KEGG注释,可将差异基因显示在KEGG pathway通路图上。计算差异表达基因显著富集的GO条目和信号通路,当<0.05时,则显著富集。
1.5 实时荧光定量PCR验证
为了进一步验证测序结果的准确性,随机挑选、、、、和共6个差异表达基因进行qRT-PCR,用于验证基因的表达水平。以猪肌动蛋白β (actin beta,)为内参基因。反应体系为10 μL:cDNA模板1 μL,上下游引物各0.2 μL,2× QuantiFast®SYBR®Green PCR预混液5 μL,DEPC水3.6 μL。qRT-PCR 扩增程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,40个循环。采用2–ΔΔCt计算基因的相对表达量。
2 结果与分析
2.1 RNA-seq数据分析
通过RNA-seq分析,结果显示,宁乡猪SAF、IMF平均原始测序数据的总条目数分别为46,260,748和62,821,105条,通过质控后得到平均测序数据的总条目数为45,856,365和61,793,414条。Q-score>30的reads平均为94.803% (SAF)及93.860% (IMF)以上,未检出的碱基比为0.024% (SAF)及0.025% (IMF),GC碱基含量分别为51.745% (SAF)和56.345% (IMF)。由此可见,clean reads的数量及比对结果符合要求(表1)。
2.2 差异表达基因鉴定
根据FPKM法计算得到基因的FPKM值,比较了宁乡猪SAF和IMF组织中基因差异性表达情况。将校正后的值FDR<0.01及差异倍数FC≥2作为筛选标准,对宁乡猪两种组织中的极具显著差异基因进行分析。PCA分析结果显示(图1A),同一组基因表达模式更加接近,各组样本明显分离,说明本研究的数据可靠,且组内一致性和组间差异性较好。
分析结果显示,宁乡猪SAF和IMF组织间的差异表达基因共2406个,其中1422个基因上调表达,984个基因下调表达(图1B)。具有100倍以上差异倍数的差异基因共328个,其中上调基因300个,下调基因28个。具有500倍以上差异倍数的差异基因共142个,其中上调基因136个,下调基因6个(图2)。其中,肌联蛋白帽(titin-cap,)基因在宁乡猪IMF组织中表达量较高,与SAF表达量的差异倍数最大(为252,288.86倍),FDR较低,表明该基因可能是宁乡猪SAF和IMF组织特异性差异沉积的关键基因。
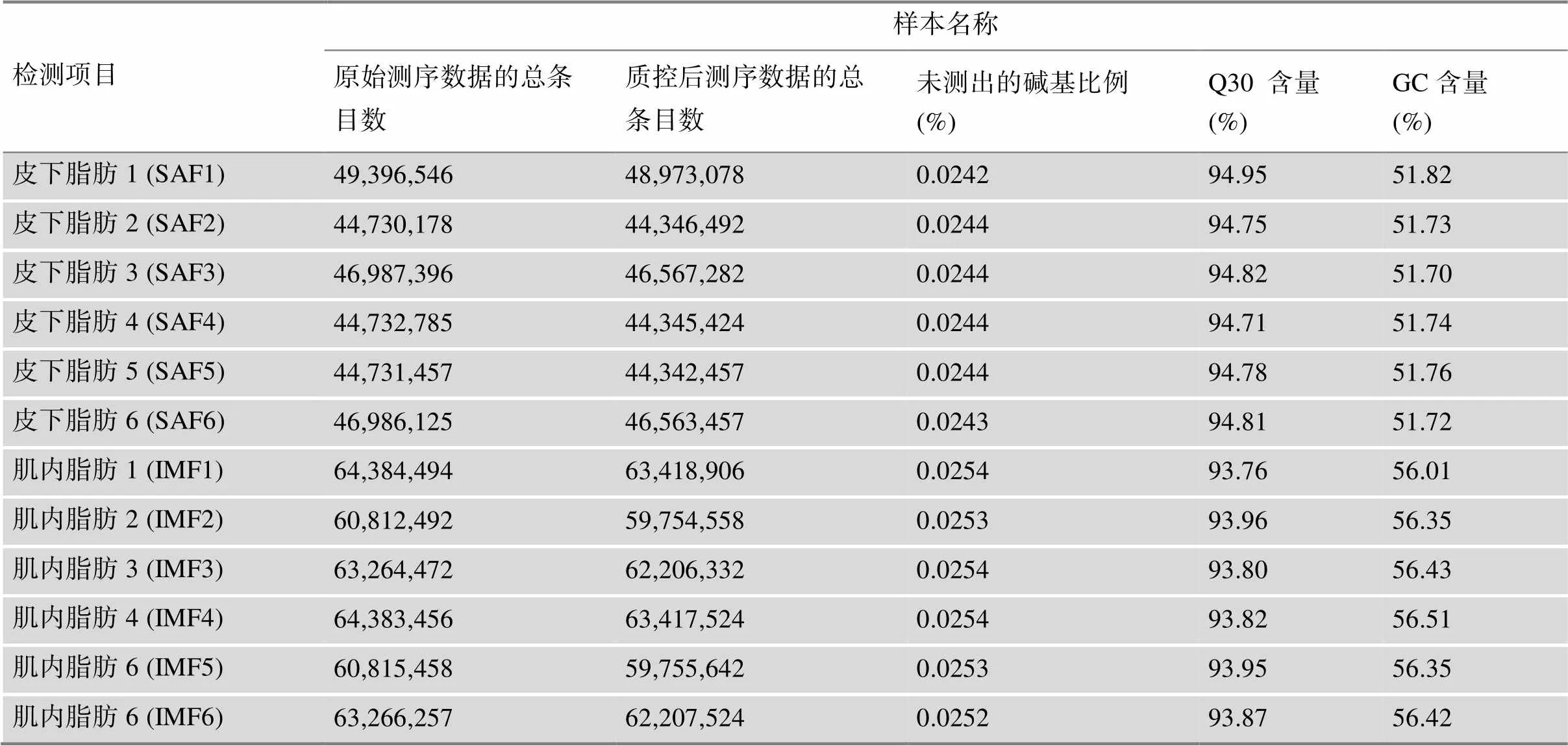
表1 宁乡猪SAF和IMF转录组数据分析结果
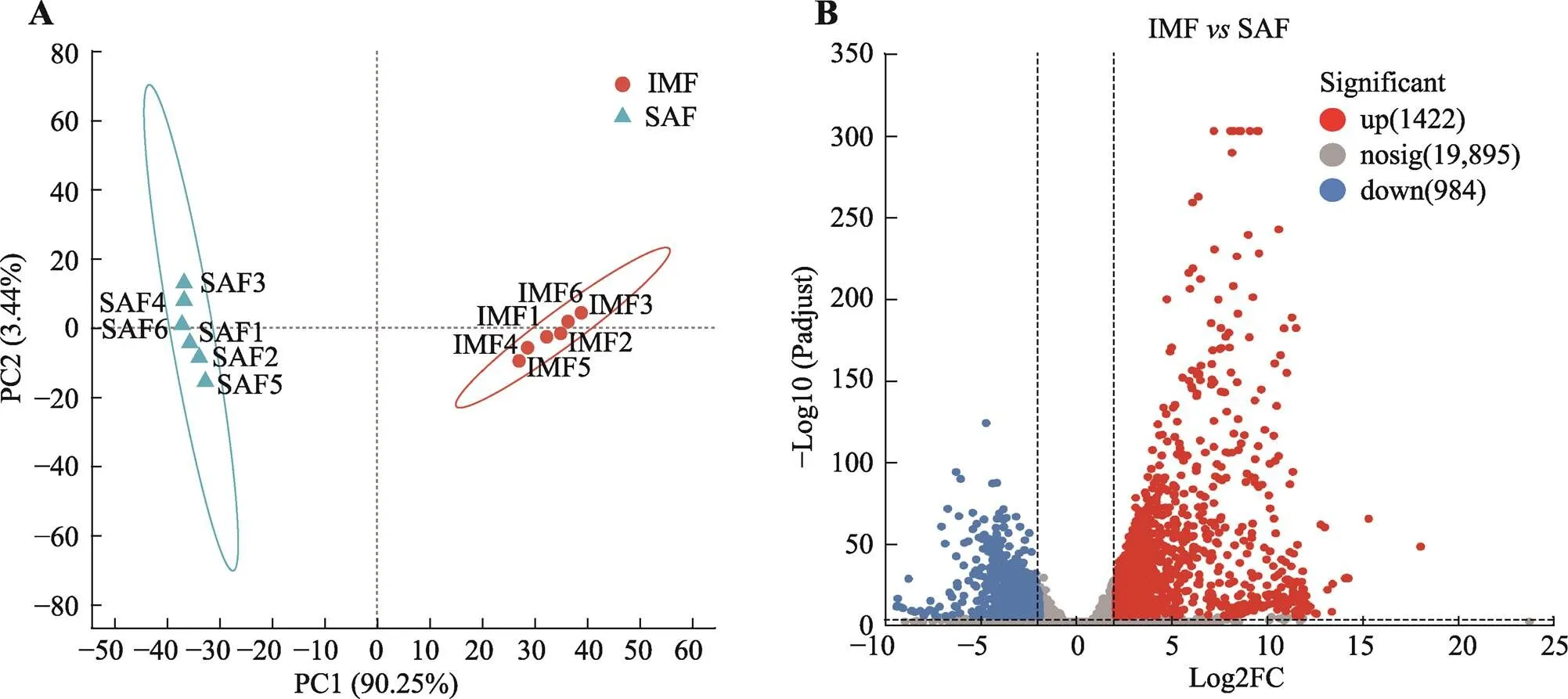
图1 差异表达基因分析
A:转录组主成分分析;B:差异表达基因火山图。SAF:皮下脂肪;IMF:肌内脂肪。
2.3 差异表达基因GO富集及KEGG通路分析
利用GO富集分析对差异性表达基因进行基因功能注释。GO富集分析结果显示,差异表达基因显著富集的条目共有271个,其中生物学过程有197个,占73%;分子功能有36个,占13%;细胞组分有38个条,占14% (图3A)。差异表达基因与脂质代谢相关的生物学过程较多,主要富集在脂质合成、脂肪酸代谢过程、甘油三酯代谢过程和脂类生物合成等,上述注释到GO功能中可能与脂质差异沉积相关的基因包括、ACACA、、、和。
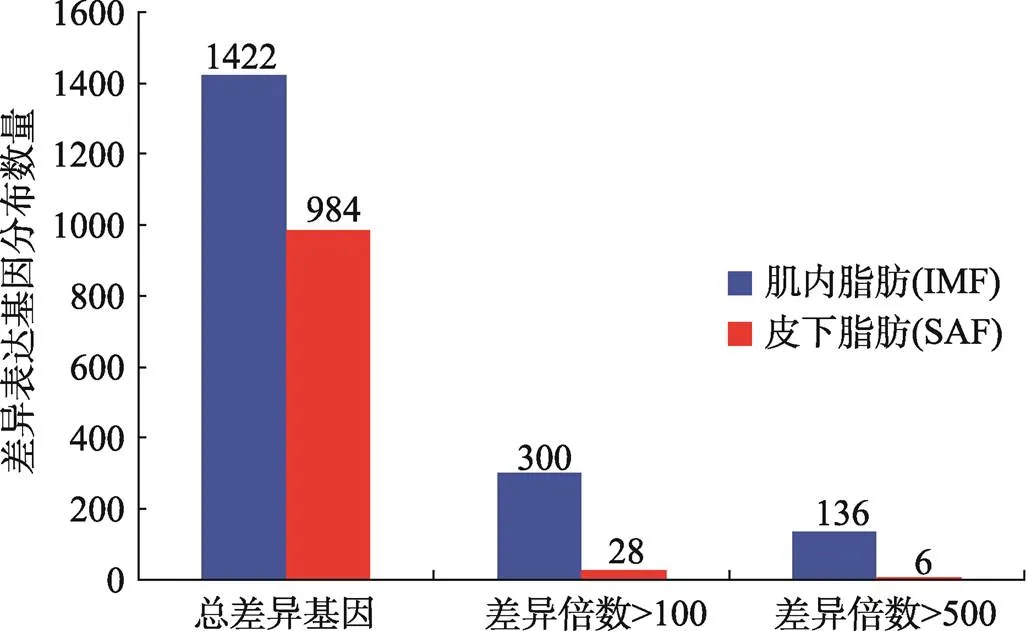
图2 宁乡猪皮下脂肪和肌内脂肪组织差异表达基因分布
通过对宁乡猪SAF和IMF组织差异表达基因进行KEGG信号通路富集分析,结果显示,共富集到114条生物学代谢通路。其中,极显著性富集的KEGG通路有75条(<0.01);类固醇生物合成、不饱和脂肪酸的生物合成、甘油磷脂代谢和自噬途径等与脂肪细胞分化和脂质代谢相关信号通路显著富集,涉及到133个差异表达基因(图3B),差异表达基因信息见表2。
2.4 脂质代谢差异表达基因筛选
基于以上分析,筛选出主要在脂质代谢中起调控作用的差异表达基因12个(、、、、、、、和),与SAF组织相比,IMF组织中差异表达基因上调5个(、和),差异表达基因下调7个(、、、、、和) (<0.05) (表3)。
2.5 qRT-PCR验证
为了进一步验证RNA-seq结果的可靠性,随机选取6个差异表达基因(、、、、和)进行验证。结果显示,乙酰辅酶A羧化酶α (acetyl-CoA carboxylase α,)、长链脂肪酸延伸酶6 (ELOVL fatty acid elongase 6,)、脂肪酶A (lipase A,)、角鲨烯环氧酶(aqualene epoxidase,)、硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,)基因在SAF组织中显著上调表达,法尼基转移酶1(farnesyl-diphosphate farnesyltransferase 1,)基因在SAF组织中显著下调表达(图4),与测序结果一致,表明测序结果可靠。
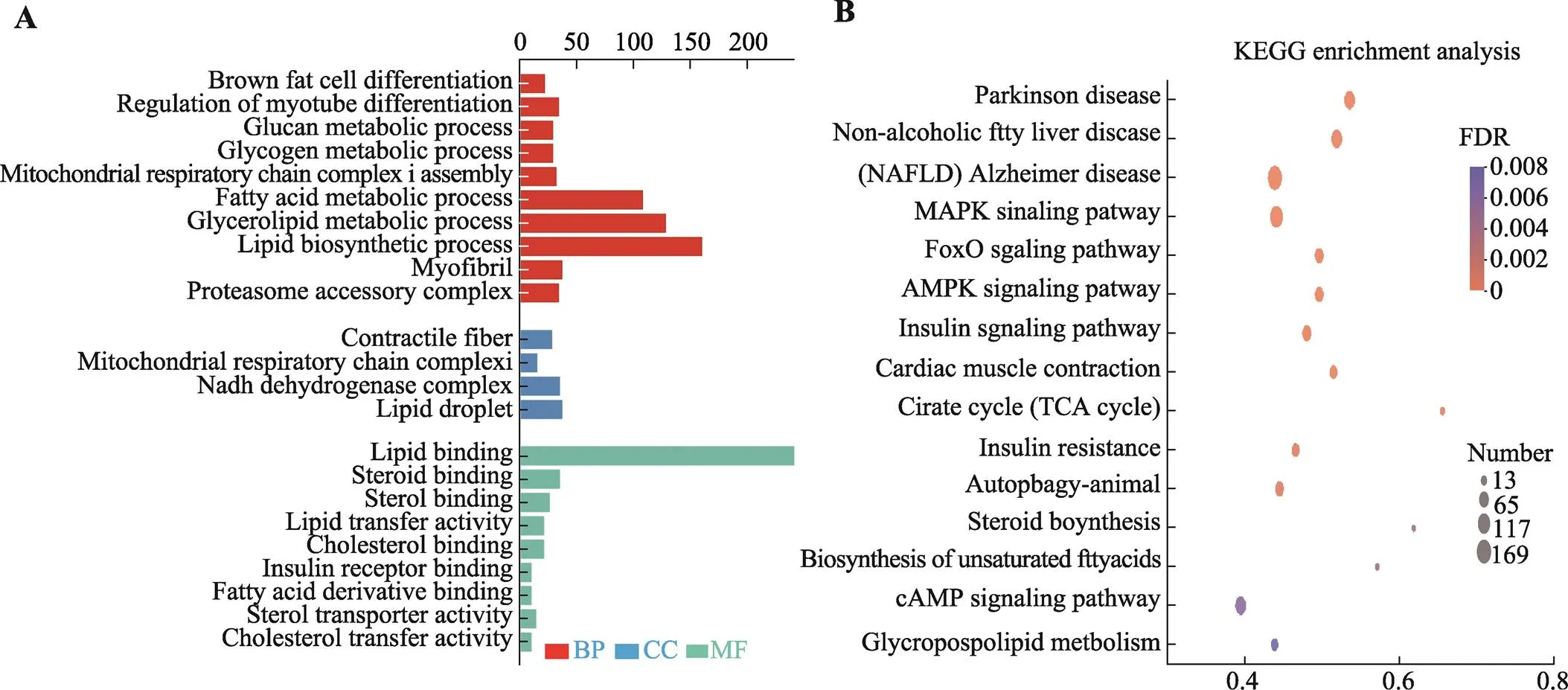
图3 功能富集分析
A:差异表达基因GO富集分析;B:差异表达基因KEGG富集分析。
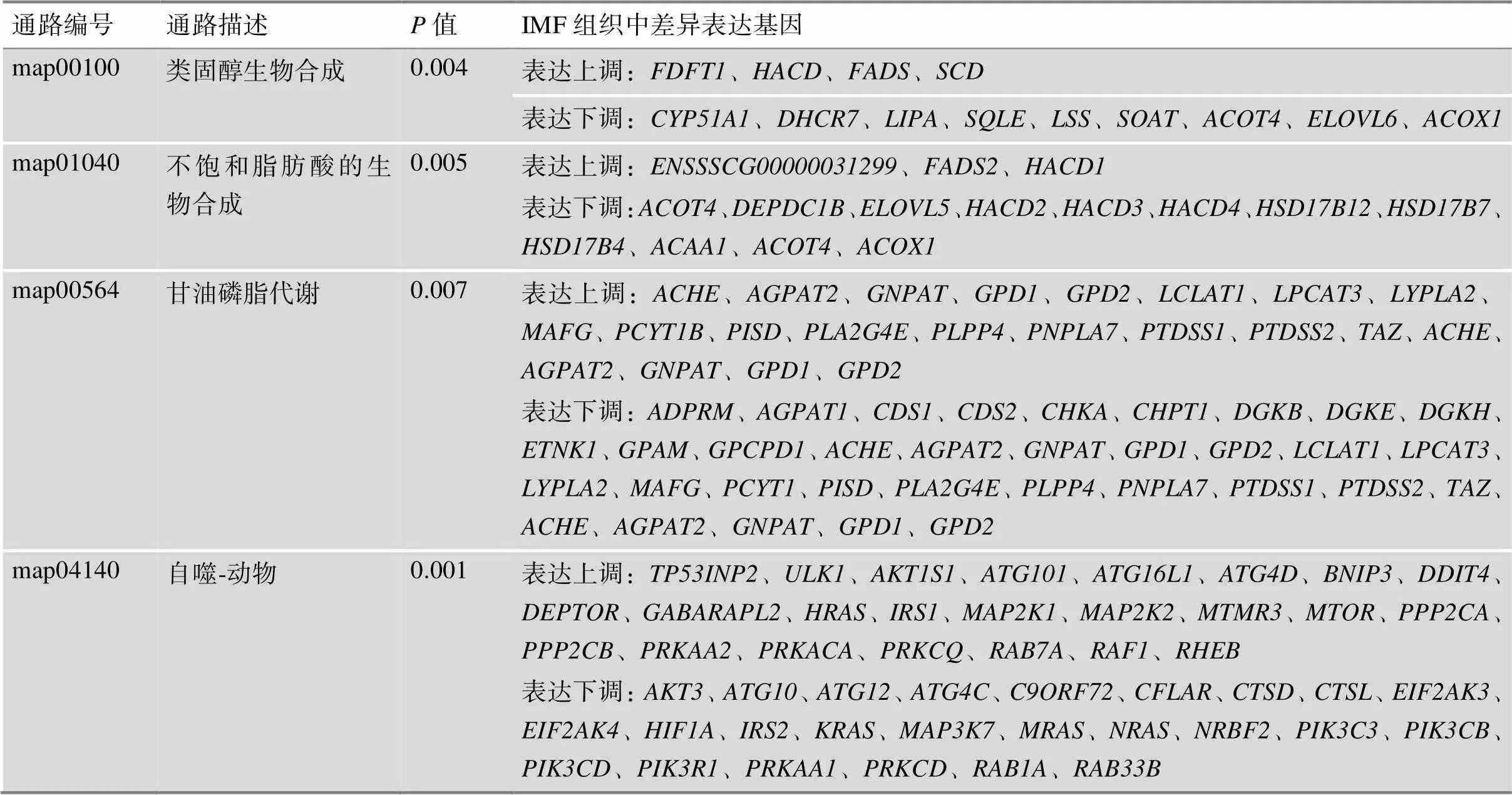
表2 可能与脂质代谢相关的富集通路(差异倍数FC>2)
>0.05表示差异不显著,<0.05为差异显著。

表3 脂质代谢显著差异表达基因
<0.05表示差异显著。
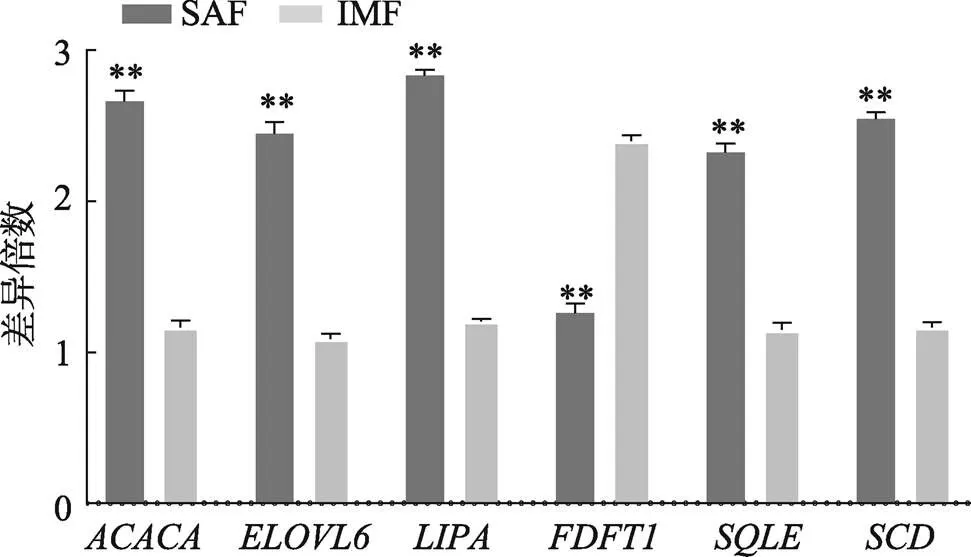
图4 差异表达基因qRT-PCR验证
SAF:皮下脂肪;IMF:肌内脂肪;**表示<0.01,差异极显著。
3 讨论
本研究基于转录组测序对宁乡猪SAF和IMF组织中差异表达基因进行分析,鉴定差异表达基因及其参与的关键生物学过程,以期筛选出与宁乡猪脂肪差异沉积的相关关键基因。本研究共鉴定差异表达基因2406个,其中1422个基因表达上调,984个基因表达下调。通过qRT-PCR对、、、、和基因进行了验证,与测序结果一致,表明测序结果可靠。
脂质代谢是由多个基因和调控因子通过多种信号途径调节的复杂的生物学过程。TCAP作为一种肌丝蛋白在肌原纤维的组装过程中发挥着重要作用,且已被证明在不同肌间脂肪含量的肌肉中存在差异表达[12]。本研究中,在宁乡猪IMF组织中表达量较高,显著高于在SAF组织中的表达量,这提示基因可能是调控宁乡猪SAF和IMF组织特异性脂肪差异沉积的关键基因。吴怡琦等[13]通过比较牛前体脂肪细胞在成脂分化前后基因的表达差异,发现基因可诱导C3H10T1/2细胞的成脂分化,表明可调控脂肪前体细胞成脂分化。周乾等[14]发现是调节肌间脂肪差异沉积的重要基因,表明在具有不同脂肪沉积程度的牛肉中存在差异表达,对肌肉中脂肪的沉积具有潜在的影响。与本研究结果一致,在秦川牛背膘中表达量较低,而在IMF组织中表达量较高,表明与秦川牛胴体性状显著相关[15]。由此可见,以上研究证明了基因在不同组织中差异表达规律的一致性,暗示基因对猪脂肪生成、特别是SAF沉积起到抑制作用。
通过GO富集分析,差异基因主要富集在脂质结合、脂肪酸代谢过程、甘油酯代谢过程以及脂类生物合成等与脂质代谢相关的生物学过程。上述过程筛选出核受体亚家族4 A族成员1(nuclear receptor subfamily 4 group A member 1,)、脂蛋白脂肪酶(lipoprotein lipase,)、长链脂肪酸延伸酶6 (ELOVL fatty acid elongase 6,)、二酰基甘油O-酰基转移酶1 (diacylglycerol O-acyltransferase 1,)、蛋白激酶AMP激活的催化亚单位α1 (protein kinase AMP-activated catalytic subunit alpha 1,)、乙酰辅酶A羧化酶α (acetyl-CoA carboxylase α,)等与脂质沉积相关基因。是核受体NR4A家族中的重要一员,可通过对靶细胞基因转录的调节,参与调控体内多种生理过程,包括细胞存活与凋亡、脂质代谢等生命活动[16]。本研究中,在宁乡猪IMF组织中表达上调,与其在山羊不同组织中相对表达模式一致,即与SAF组织相比,IMF组织中表达较高[17]。通常在脂肪组织中,对脂质沉积起到抑制作用[18]。也有研究指出,对脂肪分解过程无直接调控作用,但可以通过直接激活GATA结合蛋白2 (GATA binding protein 2,)基因的表达来抑制过氧化物酶体增殖激活受体(peroxisome proliferator activated receptor gamma,)的转录表达,上调p53降低甾醇调节元件结合转录因子1 (sterol regulatory element binding transcription factor 1,)和脂肪酸合成酶(fatty acid synthase,)的表达,抑制脂肪细胞的分化和脂肪生成[19]。脂蛋白脂酶是由脂肪细胞、心肌细胞等实质细胞合成及分泌的一种三酞甘油蛋白酞基水解酶,可经血管内皮将血液中的乳糜颗粒和极低密度脂蛋白与甘油三酯水解成甘油和脂肪酸,运输到机体组织贮存及利用。IMF组织中脂肪主要成分为磷脂,其中不饱和脂肪酸含量较SAF组织高(主要成分为甘油三酯)[20]。猪基因可能是影响猪脂肪沉积的重要候选基因之一。在苏钟猪SAF中基因表达上调,基因表达水平与IMF含量、大理石纹评分均呈现正相关,表明基因对猪SAF沉积和肉品质调控具有重要作用[21,22]。甘油二酯酰基转移酶(diacylgycerol acyltransferase,DGAT)是三酰甘油合成的限速酶,可通过催化二酰甘油加上脂肪酸酰基生成三酰甘油。过表达显著增加小鼠脂肪组织及骨骼肌中甘油三酯的含量[23,24],促进前体脂肪细胞甘油三酯合成[25]。而在敲除基因的小鼠骨骼肌中,骨骼肌内甘油三酯的含量显著降低,这表明基因在脂质代谢过程中具有重要的调控作用[26]。为甘油三酯合成提供基质,其过表达可使油酸(甘油三酯合成的首选底物)的合成增加,促进脂滴的形成[27]。此外,ACACA酶参与调控脂肪酸从头合成,其表达水平能够调控脂肪酸的合成速率,影响机体的脂肪沉积[28]。姚大为等[29]研究证实,基因被干扰表达后,和基因的表达量显著下调,降低了脂肪合成,以上研究结果表明,基因及其底物参与甘油三酯的合成。由此可见,、、及基因在SAF组织中特异性高水平表达,提示这些差异表达基因可作为影响猪脂肪沉积的重要候选基因。
通过对宁乡猪SAF和IMF组织差异表达基因进行KEGG信号通路富集分析,发现差异表达基因显著富集到类固醇生物合成、不饱和脂肪酸的生物合成及甘油磷脂代谢通路,这3条通路中法尼基转移酶1 (farnesyl-diphosphate farnesyltransferase 1,)、酰基辅酶A氧化酶1 (acyl-CoA oxidase 1,)和硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,)可能是脂肪在宁乡猪SAF和IMF组织中差异沉积的3个相关基因。其中,在宁乡猪IMF组织中表达上调,及在宁乡猪SAF组织中表达上调。ACOX1是脂肪细胞内特异性与脂肪酸β-氧化过程中脱氢反应相关的限速酶,通过改变脂肪酸代谢影响甘油三酯的沉积[30]。在3T3-L1前体脂肪细胞中,基因过表达可显著降低脂肪细胞脂滴沉积量,且能够抑制脂肪分化后期脂代谢关键基因、脂肪酸合成基因——脂肪酸合酶(fatty acid synthase,)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,)的表达,促进脂肪分解基因激素敏感脂肪酶的表达,抑制脂肪合成[31]。SCD是机体内催化饱和脂肪酸(主要包括棕榈酰CoA、硬脂酰CoA等)向单不饱和脂肪酸转化的关键酶,对肌肉组织脂肪沉积有重要调控作用。
此外,值得注意的是,通过通路富集分析,发现差异表达基因显著富集到细胞自噬途径,包括腺苷单磷酸活化蛋白激酶α1亚基(protein kinase AMP- activated catalytic subunitα1,)、自噬相关蛋白101 (autophagy related 101,ATG101)及肿瘤蛋白p53诱导的核蛋白2(tumor protein p53-induced nuclear protein 2,)。其中,在SAF组织中高表达,和在IMF组织中高表达。自噬是真核生物中一种进化上高度保守的、用于降解和回收利用细胞内生物大分子和受损细胞器的过程[31,32]。自噬在脂肪细胞分化、脂质代谢等方面发挥着重要作用[33,34]。研究表明,基因可调控脂肪前体细胞中脂肪代谢相关基因(、、)的表达,推测基因在脂肪代谢过程中发挥重要作用[35]。马静远等[36]研究发现,在米色脂肪细胞分化过程中表达量增加,但基因的缺失抑制了ULK1自噬起始复合物形成,降低了米色脂肪细胞分化、脂质合成降低,表明自噬活动维持细胞器功能受损,从而影响了脂肪细胞分化。也被称为糖尿病和肥胖调节蛋白(diabetes and obesity regulatedprotein,DOR),与细胞自噬、糖尿病、肥胖的调节及成脂分化的调控等密切相关。在Zucker糖尿病脂肪大鼠模型中,肌肉组织的mRNA表达水平显著下调[37]。Romero等[38]在3T3-L1前体脂肪细胞上的研究发现,通过慢病毒过表达基因,导致脂肪细胞中脂滴减少,甘油三脂减少且脂肪细胞分化标志性基因的表达量也显著下调,表明能负调控前体脂肪细胞分化。以上研究结果提示,可负调节脂肪前体细胞成脂分化及机体脂质代谢,可能作为治疗脂肪代谢疾病的潜在靶标。但是最近的研究表明,过表达秦川牛前体脂肪细胞中基因,导致形成的脂滴增加,脂肪细胞分化标志基因的表达量升高,表明基因促进牛前体脂肪细胞的分化[39]。推测造成这种结果的原因可能是物种间差别,也可能是基因参与的脂肪细胞分化通路不同,具体机制有待进一步的探讨。
黄万龙等[6]应用RNA-seq对大白猪SAF和IMF组织中的基因表达谱进行分析,鉴定出180个差异表达基因(75个上调表达,105个下调表达),发现大白猪基因对SAF沉积起到抑制作用。本课题组前期研究结果发现,基因在宁乡猪IMF组织中表达下调,与本研究结果一致[4]。由此可见,在调控不同品种猪脂质沉积中的功能是一致的。但在大白猪IMF组织转录组研究中,并不是差异表达基因[38],表明对宁乡猪的脂质代谢调控具有高度的特异性。此外,、、、、以及在大白猪SAF与IMF组织中并不是差异表达基因,表明这些基因可能参与了宁乡猪脂肪代谢过程[4]。
本研究初步揭示了宁乡猪SAF和IMF组织脂质沉积相关的差异基因的表达特征。其中,基因在宁乡猪IMF组织中表达量较高,与SAF组织表达量的差异倍数最大,提示该基因可能是脂肪在宁乡猪SAF和IMF组织中差异沉积的关键基因。注释到GO功能中可能与脂质代谢相关的候选基因为、、、、和。值得注意的是,在自噬途径中存在与脂肪沉积差异相关的候选基因,分别为、和。KEGG通路富集到与脂质代谢相关的有类固醇生物合成、不饱和脂肪酸的生物合成及甘油磷脂代谢通路,筛选到、和为候选基因。
[1] Ren ZQ, Wu WJ, Liu WH, Zheng R, Li JL, Zuo B, Xu DQ, Li FE, Lei MG, Ni DB, Xiong YZ. Differential expression and effect of the porcine ANGPTL4 gene on intramuscular fat., 2014, 13(2): 2949–2958.
[2] Zhao SM, Ren LJ, Chen L, Zhang X, Cheng ML, Li WZ, Zhang YY, Gao SZ. Differential expression of lipid metabolism related genes in porcine muscle tissue leading to different intramuscular fat deposition., 2009, 44(11): 1029–1037.
[3] Liu XQ, Yang FY, Liu ZH, Huang JX. Research on cultivating, regulating and controlling pigs’intramuscular fat., 2010, 31(20): 52–54. 刘雪芹, 杨飞云, 刘作华, 黄金秀. 营养调控猪肌内脂肪的研究. 饲料工业, 2010, 31(20): 52–54.
[4] Wang F, Lei LF, Wang ZB, Yin YL, Yang HS, Yang Z, Chen JS. Differentially expressed genes in the longissimus dorsi muscle between the Chinese indigenous Ningxiang pig and Large White breed using RNA sequencing.,2022, 67(11): 442–453.
[5] Sodhi SS, Park WC, Ghosh M, Kim JN, Sharma N, Shin KY, Cho IC, Ryu YC, Oh SJ, Kim SH, Song KD, Hong SP, Cho SA, Kim HB, Jeong DK. Comparative transcriptomic analysis to identify differentially expressed genes in fat tissue of adult Berkshire and Jeju Native Pig using RNA-seq., 2014, 41(9): 6305–6315.
[6] Huang WL, Zhang XX, Li A, Miao XY. Identification of differentially expressed genes between subcutaneous and intramuscular adipose tissue of Large White pig using RNA-seq., 2017, 39(6): 501–511. 黄万龙, 张秀秀, 李嫒, 苗向阳. 利用RNA-seq技术筛选大白猪皮下和肌内脂肪组织差异表达基因. 遗传, 2017, 39(6): 501–511.
[7] Xu JG, Wang CL, Jin EH, Gu YF, Li SH, Li QG. Identification of differentially expressed genes in longissimus dorsi muscle between Wei and Yorkshire pigs using RNA sequencing., 2018, 40(4): 413–421.
[8] Liu Z. Effects of surgical tail removal in fat-tail sheep on carcass traits, fat deposition, and liver transcriptome differential gene expression[Dissertation]. Gansu Agricultural University, 2015. 刘政. 断尾对脂尾型绵羊肉用性能、脂肪沉积及肝脏转录组差异基因表达的影响[学位论文]. 甘肃农业大学, 2015.
[9] Chen W, Fang GF, Wang SD, Wang H, Zeng YQ. Longissimus lumborum muscle transcriptome analysis of Laiwu and Yorkshire pigs differing in intramuscular fat content., 2017, 39(7): 759–766.
[10] Chu WW. Study on the mechanism of differential glucocorticoid sensitivity between intramuscular and subcutaneous fat in pigs[Dissertation]. Nanjing Agricultural University, 2016. 褚维伟. 猪肌内脂肪和皮下脂肪的糖皮质激素敏感性差异及其机理初探[学位论文]. 南京农业大学, 2016.
[11] Liu HC. MiR-32-5p regulates differential accumulation of intramuscular and subcutaneous fat via suppressing KLF3 in pigs[Dissertation]. Nanjing Agricultural University, 2016. 刘宏程. Micro-RNA-32-5p通过靶向KLF3调控猪肌内与皮下脂肪差异沉积的机制研究[学位论文]. 南京农业大学, 2020.
[12] Olivé M, Shatunov A, Gonzalez L, Carmona O, Moreno D, Quereda LG, Martinez-Matos JA, Goldfarb LG, Ferrer I. Transcription-terminating mutation in telethonin causing autosomal recessive muscular dystrophy type 2G in a European patient., 2008, 18(12): 929–933.
[13] Wu YQ, Li WX, Yang S, Zhang YW, He ZQ, Li WX, Yang Y, Zhao Y, Liu H, Zhang MQ, Gao PF, Cai CB, Guo XH, Li BG, Cao GQ. MYOZ2 promoted adipogenic differentiation of C3H10T1/2 cells by negatively regulating the expression of TCAP., 2021, 37(3): 380–390. 吴怡琦, 李文霞, 杨帅, 张燕伟, 何志强, 李文新, 杨阳, 赵燕, 刘宏, 张明青, 高鹏飞, 蔡春波, 郭晓红, 李步高, 曹果清. MYOZ2通过负调控TCAP的表达促进C3H10T1/2细胞成脂分化. 中国生物化学与分子生物学报, 2021, 37(3): 380–390.
[14] Zhou Q, Zhou BG, Yue Y, Li QY, Ren SQ, Wu XH, Xu JJ, Xu FF, Jiang H, Zhang JB, Chen CZ. Differential expression analysis of intramuscular fat deposition related genes in preadipocyte differentiation., 2015, 35(5): 828–831. 周乾, 周佰刚, 岳媛, 李青莹, 任书强, 吴心慧, 徐嘉君, 徐芳芳, 姜昊, 张嘉保, 陈承祯. 肌间脂肪沉积能力相关基因在前脂肪细胞分化前后的差异表达. 中国兽医学报, 2015, 35(5): 828–831.
[15] Chi ZJ, Chelmeg, Cheng G, Su Y, Cheng LX, Liu JF, Cao GF, Bao SQ, Zan LS, Tong B. Association analysis between polymorphisms in FABP4, FASN and TCAP genes and growth and carcass traits in qinchuan cattle ()., 2022, 30(8): 1488–1498. 迟志娇, 澈力木格, 成功, 苏雅, 成立新, 刘剑锋, 曹贵方, 包斯琴, 昝林森, 佟彬. 秦川牛FABP4、FASN和TCAP基因多态性位点与生长和胴体性状的关联性分析. 农业生物技术学报, 2022, 30(8): 1488–1498.
[16] Zhang SS, Yin YL, Sun J, Chen H, Xie LW. NR4A1 regulates systemic glucose and lipid metabolism., 2021, 33(4): 449–459. 张素素, 印遇龙, 孙嘉, 陈宏, 谢黎炜. NR4A1调控系统糖脂代谢的分子机制. 生命科学, 2021, 33(4): 449– 459.
[17] Cui S, Wang Y, Zhu JJ, Xiong Y, Lin QY. Overexpression of NR4A1 promotes goat subcutaneous adipocytes differentiation., 2021, 52(5): 1258–1266. 崔胜, 王永, 朱江江, 熊燕, 林亚秋. 过表达NR4A1促进山羊皮下脂肪细胞分化. 畜牧兽医学报, 2021, 52(5): 1258–1266.
[18] Qin DD, Wang XD. The regulation of NR4A1 on glucolipid metabolism., 2018, 48(11): 1229–1237. 秦丹丹, 王向东. NR4A1对糖脂代谢的调控作用. 中国科学: 生命科学, 2018, 48(11): 1229–1237.
[19] Qin DD, Yang YF, Pu ZQ, Liu D, Yu C, Gao P, Chen JC, Zong C, Zhang YC, Li X, Wang XD, Liu YT. NR4A1 retards adipocyte differentiation or maturation via enhancing GATA2 and p53 expression., 2018, 22(10): 4709–4720.
[20] Xue S. A review of the current knowledge of fatty acid contents, composition and physiological functions of animal-derived intramuscular phospholipids., 2016, 30(9): 40–44. 薛山. 动物源肌内磷脂及其脂肪酸含量、组成与生理功效研究进展. 肉类研究, 2016, 30(9): 40–44.
[21] Huang YN, Jiang QY. Research progress on major candidate genes of meat quality traits in pigs., 2014, 41(2): 163–169. 黄艳娜, 蒋钦杨. 影响猪肉质性状主要候选基因的研究进展. 中国畜牧兽医, 2014, 41(2): 163–169.
[22] Fu YF, Li BX, Li L, Fang XM, Wang XM, Ren SW. Expression profile and bioinformatics analysis of lipoprotein lipase in Suzhong pigs., 2012, 43(12): 1871–1878. 付言峰, 李碧侠, 李兰, 方晓敏, 王学敏, 任守文. 苏钟猪脂蛋白脂肪酶的组织表达谱及其生物信息学分析. 畜牧兽医学报, 2012, 43(12): 1871–1878.
[23] Yen CLE, Stone SJ, Koliwad S, Harris C, Farese RV. Thematic review series: glycerolipids. DGAT enzymes and triacylglycerol biosynthesis., 2008, 49(11): 2283–2301.
[24] Chen HC, Stone SJ, Zhou P, Buhman KK, Farese RV. Dissociation of obesity and impaired glucose disposal in mice overexpressing acyl coenzyme a: diacylglycerol acyltransferase 1 in white adipose tissue., 2002, 51(11): 3189–3195.
[25] Yang CH, Li Q, Huang W, Lin YQ, Wang Y, Xiang H, Zhu JJ. Cloning of goat DGAT1 gene and its regulation on lipid deposition in preadipocytes., 2022, 53(1): 76–87. 昌恒, 李琪, 黄维, 林亚秋, 王永, 向华, 朱江江. 山羊DGAT1基因的克隆及对前体脂肪细胞脂质沉积的调控作用研究. 畜牧兽医学报, 2022, 53(1): 76–87.
[26] Liu L, Shi XJ, Choi CS, Shulman GI, Klaus K, Nair KS, Schwartz GJ, Zhang YY, Goldberg IJ, Yu YH. Paradoxical coupling of triglyceride synthesis and fatty acid oxidation in skeletal muscle overexpressing DGAT1., 2009, 58(11): 2516–2524.
[27] Green CD, Ozguden-Akkoc CG, Wang Y, Jump DB, Olson LK. Role of fatty acid elongases in determination ofsynthesized monounsaturated fatty acid species., 2010, 51(7): 1871–1877.
[28] Harris CA, Haas JT, Streeper RS, Stone SJ, Kumari M, Yang K, Han XL, Brownell N, Gross RW, Zechner R, Farese RV. DGAT enzymes are required for triacylglycerol synthesis and lipid droplets in adipocytes., 2011, 52(4): 657–667.
[29] Yao DW, Zhao SY, Zhao X, Yang CL, Li YP, Ding XB, Ma Y. Effect of ELOVL6 knockdown on the gene expression involved in lipid metabolism and triacylglycerol accumulation in dairy cow mammary epithelial cells., 2021, 19: 1–8. 姚大为, 赵淑颖, 赵欣, 杨春蕾, 李玉鹏, 丁向彬, 马毅. 干扰ELOVL6基因对奶牛乳腺上皮细胞脂代谢相关基因的表达及甘油三酯合成的影响. 中国饲料, 2021, 19: 1–8.
[30] Zeng J, Deng SW, Wang YP, Li P, Tang L, Pang YF. Specific inhibition of acyl-coA oxidase-1 by an acetylenic acid improves hepatic lipid and reactive oxygen species (ROS) metabolism in rats fed a high fat diet., 2017, 292(9): 3800–3809.
[31] Zhang F, Zeng QH, Tao H, Xiong Q, Zhang N, Liu Y, Jiang S, Chen MX. Construction of over-expression vector of bovine ACOX1 gene and preliminary study on fat deposition., 2017, 53(11): 42–47. 张凤, 曾倩晖, 陶虎, 熊琪, 张年, 刘洋, 蒋思, 陈明新. 牛ACOX1基因过表达载体构建及对脂肪沉积的初步研究. 中国畜牧杂志, 2017, 53(11): 42–47.
[32] Zhai XY. Autophagy: cell homeostasis and organelle renewal., 2017, 39(21): 43–50. 翟祥云. 自噬: 细胞稳态和细胞器的更新. 中国家禽, 2017, 39(21): 43–50.
[33] Baerga R, Zhang Y, Chen PH, Goldman S, Jin SK. Targeted deletion of autophagy-related 5 (atg5) impairs adipogenesis in a cellular model and in mice., 2009, 5(8): 1118–1130.
[34] Singh R, Xiang YQ, Wang YJ, Baikati K, Cuervo AM, Luu YK, Tang Y, Pessin JE, Schwartz GJ, Czaja MJ. Autophagy regulates adipose mass and differentiation in mice., 2009, 119(11): 3329–3339.
[35] Wu XM. Screening and identification of PRKAAlgene- related lncRNA and its expressionregulation in intramuscular fat[Dissertation]. Guizhou University, 2020. 吴小敏. PRKAA1基因相关LncRNA的筛选鉴定及其在肌内脂肪中的表达调控研究[学位论文]. 贵州大学, 2020.
[36] Ma JY, Li SB, Yang D, Bai NN, Miriayi-Alimujiang, Yang Y, Han JF. Effect of autophagy core protein ATG101 on the differentiation and thermogenesis of beige adipocytes., 2020, 30(4): 320– 325. 马静远, 李少博, 杨迪, 白宁宁, 米日阿依·阿里木江, 杨颖, 韩峻峰. 自噬核心蛋白ATG101对米色脂肪细胞分化和产热的影响. 江苏大学学报(医学版), 2020, 30(4): 320–325.
[37] Baumgartner BG, Orpinell M, Duran J, Ribas V, Burghardt HE, Bach D, Villar AV, Paz JC, González M, Camps M, Oriola J, Rivera F, Palacín M, Zorzano A. Identification of a novel modulator of thyroid hormone receptor-mediated action., 2007, 2(11): e1183.
[38] Romero M, Sabaté-Pérez A, Francis VA, Castrillón- Rodriguez I, Díaz-Ramos Á, Sánchez-Feutrie M, Durán X, Palacín M, Moreno-Navarrete JM, Gustafson B, Hammarstedt A, Fernández-Real JM, Vendrell J, Smith U, Zorzano A. TP53INP2 regulates adiposity by activating β-catenin through autophagy-dependent sequestration of GSK3β., 2018, 20(4): 443–454.
[39] Zhang WY, Li PW, Wang SJ, Cheng G, Wang L, Mi X, Su X, Wang YN, Zan LS. TP53INP2 promotes bovine adipocytes differentiation through autophagy activation., 2019, 9(12): 1060.
Analysis of transcriptome differences between subcutaneous and intramuscular adipose tissue of Ningxiang pigs
Fang Wang1,2,3, Yuebo Zhang1,2, Qian Jiang1,3, Yulong Yin1,2,3, Bi’e Tan1,2,3, Jiashun Chen1,2,3
To compare and analyze the molecular mechanisms of adipose deposition in subcutaneous fat (SAF)and intramuscular fat (IMF) tissues in Ningxiang pigs,differential gene expression profiles in SAF andIMF tissues of Ningxiang pigs were identified and analysed using RNA-seq technology.Six healthy 250-day-old male Ningxiang pigs with similar body weights (approximately 85 kg) of intraspecific individuals were selected as experimental material and samples of SAF and IMF tissues were collected.Differential genes associated with fat deposition and lipid metabolism were obtained by sequencing two adipose tissue transcriptomes and performing GO (Gene Ontology) functional annotation and KEGG (Kyoto Encyclopedia of Genes and Genomes) pathway enrichment analysis. To verify the reliability of the sequencing results, six differential genes were randomly selected to validate using qRT-PCR. The results showed that we identified 2406 DEGs, with 1422 up-regulated and 984 down-regulated genes in two tissues. GO functional annotation analysis revealed that the differentially expressed genes were mainly involved in lipid metabolism related pathways, such as steroid biosynthesis, unsaturated fatty acid biosynthesis, glycerophospholipid metabolism and autophagy pathway. KEGG pathway enrichment showed that the differentially expressed genes were mainly enriched in the biological processes related to lipid binding, fatty acid metabolism, glycol ester metabolism, lipid biosynthesis and other biological processes related to lipid metabolism. Genes related to lipid metabolism, such as TCAP, NR4A1, ACACA, LPL, ELOVL6, DGAT1, PRKAA1, ATG101, TP53INP2, FDFT1, ACOX1 and SCD were identified by bioinformatic analyses and verified by qRT-PCR. Our results indicated that these genes may play important roles in the regulation of fat deposition and metabolism in the SAF and IMF tissue, providing the further mechanistic investigation of fat deposition in Ningxiang pigs.
Ningxiang pig; intramuscular fat; subcutaneous fat; RNA-seq; differentially expressed gene
2023-05-09;
2023-08-16;
2023-09-18
国家重点研发计划项目(编号:2021YFD1300403),国家自然科学基金项目(编号:32302761,U20A2054),湖南省自然科学基金项目(编号:2022JJ40165),国家生猪产业技术体系建设专项(编号:CARS-35)和湖南省教育厅优秀青年基金项目(编号:22B0206)资助[Supported by the National Key Research and Development Program of China (No. 2021YFD1300403), the National Natural Science Foundation of China (Nos. 32302761, U20A2054), the Youth Science Fund Project of the Natural Science Foundation of Hunan (No. 2022JJ40165), Earmarked Fund for China Agriculture Research System (No. CARS-35), and the Excellent Youth Project of Hunan Provincial Department of Education (No. 22B0206)]
王芳,硕士研究生,专业方向:畜牧学。E-mail: 1264873344@qq.com
陈家顺,讲师,研究方向:动物肉质调控。E-mail: jschen@hunau.edu.cn
谭碧娥,教授,研究方向:猪营养调控研究。E-mail: bietan@hunau.edu.cn
10.16288/j.yczz.23-131
(责任编委: 李明洲)