酿酒酵母中脱氧羟腐胺赖氨酸合酶的结构研究
李珍珍,孟肖肖,乔 治,戴 莉,杨晓娜,滕衍斌
脱氧羟腐胺赖氨酸合酶(deoxyhypusine synthase, DHS)(编号:EC 1.1.1.249)普遍存在于真核生物中,参与真核翻译起始因子-5A (eukaryotic initiation factor -5A,eIF-5A) 的翻译后修饰,在细胞增殖、死亡、肿瘤生长、炎症反应和免疫应答等方面发挥着重要作用[1],其缺失可导致糖尿病、阿尔茨海默病、帕金森病等多种人类常见疾病[2]。DHS参与eIF-5A 翻译后修饰的首步反应,该催化依赖辅因子NAD+。DHS能够催化脱氢亚精胺的丁胺基部分将其转移至底物蛋白eIF-5A N端loop区保守的赖氨酸ε位氨基上,从而生成脱氧羟腐胺赖氨酸[3]。酿酒酵母作为一种重要的真核模式生物,是研究真核生物酶进化和蛋白质相互作用的经典模型,有利于研究羟腐胺赖氨酸化修饰过程[4-6]。然而DHS调控机制仍然不完全清楚,并且由于结构解析的困难,难以得到蛋白质的高分辨率结构,这限制了对DHS功能的深入理解。现以酿酒酵母中DHS(deoxyhypusine synthase, Dys1)为研究对象,通过解析其晶体结构来探究羟腐胺赖氨酸化修饰的分子机制和催化过程,为多种疾病的治疗和相关药物开发提供基础。
1 材料与方法
1.1 材料
1.1.1菌株和质粒 大肠埃希菌 BL21 、大肠埃希菌 Top10菌株, pET-28a质粒(北京诺禾致源科技股份有限公司合成);S288C酿酒酵母基因组模板(中国科技大学生命科学学院提供)。
1.1.2主要试剂 重组质粒构建:高保真Taq酶(上海吐露港生物科技有限公司,货号:21804-02);T4 DNA连接酶,限制性内切酶NdeI、NotI(美国Thermo-Fisher公司,货号:EL0011、ER0585、ER0595);胶回收试剂盒(美国Omega公司,货号:D2500-02);异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-1-thiogalactoside, IPTG)(上海捷瑞生物工程有限公司,货号:RI1758);缓冲液试剂: 三羟甲基氨基甲烷(上海生工生物工程有限公司,货号:T0826)、氯化钠(上海国药集团化学试剂有限公司,货号:10019318);晶体优化试剂:聚乙二醇(Polyethylene Glycol,PEG)8000、乙二醇、N-(2-羟乙基)哌嗪-N′-2-乙烷磺酸(N-2-hydroxyethylpiperazine-N-ethane-sulphonicacid,Hepes)(上海阿拉丁有限公司,货号:P274350、E117900、H109407);晶体初筛试剂盒:Crystal Screen Ⅰ、Crystal Screen Ⅱ(美国Hampton公司,货号:HR2-110、HR2-112)。
1.1.3主要仪器 蛋白纯化仪系统(型号:KTA Pure 25M,美国GE公司);SuperdexTM200层析柱(型号:HiLoadTM16/600,美国GE公司);镍离子金属螯合(Ni2+-NTA)亲和层析柱(型号:L00250-100,南京金斯瑞生物科技有限公司)紫外分光光度仪(型号:UV-1200,上海美谱达仪器有限公司);PCR仪(型号:GE9612T-S,杭州柏恒科技有限公司);高速冷冻离心机(型号:J-26S XPI,美国Beckman公司);超声波细胞粉碎机(型号:JY92-IIN,宁波新芝生物科技股份有限公司);体视显微镜(型号:EZ4W,德国Leica公司)。
1.2 方法
1.2.1DYS1重组质粒的构建 以酿酒酵母的基因组DNA为模板进行DYS1基因的PCR扩增。PCR 反应程序如下:30个循环(94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,72 ℃ 10 min)。将扩增的DYS1基因产物经过限制性内切酶酶切、连接酶连接插入至载体pET-28a,将构建好的重组质粒进行双酶切(NdeI、NotI)2.5 h后,将酶切产物进行琼脂糖凝胶电泳验证。送至合肥有康生物有限公司测序确认其序列正确。
1.2.2Dys1目的蛋白的诱导表达及裂解液的制备 将重组质粒转化至大肠埃希菌BL21感受态细胞中,培养重组菌株至在600 nm波长处的吸光度值为0.6,加入终浓度为0.2 mmol/L的诱导剂 IPTG,在160 r/min、16 ℃条件下继续培养20 h。离心收集表达完成的大肠埃希菌(6 000 r/min;6 min),使用20 ml 缓冲液(20 mol/L Tris pH 8.0、200 mmol/L NaCl)重悬。超声破碎(功率30%,开1 s关5 s)15 min后离心(16 000 r/min、30 min),取上清液用于后续纯化。
1.2.3亲和层析法、分子筛层析法纯化Dys1蛋白 将上清液上样至Ni2+- NTA亲和层析柱。上样前使用10倍柱体积含20 mmol/L Tris pH 8.0、 200 mmol/L NaCl 的缓冲液平衡层析柱,使用5 ml含250 mmol/L咪唑、20 mmol/L Tris pH 8.0、200 mmol/L NaCl 的洗脱液洗脱目标蛋白。将洗脱液上样至SuperdexTM200层析柱进行分子筛纯化。根据280 nm吸收峰收集目标蛋白质。
1.2.4晶体生长 将纯化后的蛋白质浓缩至10 mg/ml,使用试剂盒Crystal Screen Ⅰ、Crystal Screen Ⅱ初筛蛋白质晶体。生长条件为:下槽中100 μl初筛试剂,上槽中混合1 μl蛋白质和1 μl下槽液。出现晶体后进行晶体优化。
1.2.5X-射线衍射法收集晶体的衍射数据 捞取单个晶体,加入防冻液(晶体生长的条件中加20%的甘油)保存到液氮中,于上海同步辐射光源(SSRF)BL18U1蛋白质微晶体结构衍射工作线站进行X-射线衍射。在-173 ℃、0.978 Å的波长条件下收集了一套分辨率为2.8 Å的衍射数据。收集的衍射数据使用HKL2000软件进行处理。
1.2.6分子置换法解析晶体结构 以人源(H.spains)DHS结构(PDB ID:1DHS)为模型,利用分子置换法解析结构。使用CCP4i[7]中程序MOLREP[8]找到初始相位。初始模型通过CCP4i中的REFMAC5[9]进行10轮修正,再使用COOT[10]进行人工修正。修正好的模型使用PROCHECK[11]和MOLPROBITY[12]程序进行检查。结构图均使用PyMol软件(http://pymol.sourceforge.net/)生成。
2 结果
2.1DYS1重组质粒PCR测序结果 重组质粒酶切后的质粒呈现两条DNA带,下端的DNA带分子量与DYS1全长序列的分子量一致(图1A)。构建的重组质粒测定的序列与DYS1的全长基因序列相同(图1B)。

图1 DYS1-pET-28a重组质粒电泳图及测序结果图
2.2 Dys1蛋白质的纯化与结晶Dys1分子量约为43 ku,通过分子筛实验发现Dys1出峰位置对应的分子量约为130 ku,推测Dys1在溶液中以四聚体的形式存在。SDS -PAGE分析结果显示,在分子筛纯化后可见一条显著目的条带,Dys1蛋白质的纯度达到 95% 以上(图2A)。将纯化后的Dys1蛋白质浓缩至10 mg/ml,进行晶体的初步筛选。蛋白晶体通过Crystal Screen试剂盒的初步筛选和优化实验,最终在6% PEG 8000、8%乙二醇、0.1 mol/L Hepes pH 6.5的条件下获得表面光滑、形状规则的菱形蛋白质晶体。观察发现,蛋白质晶体生长一周后达到最大体积(图2B)。

图2 Dys1蛋白质纯化的SDS-PAGE结果与单一晶体图
2.3 Dys1整体结构本研究通过分子置换的方法解析了Dys1的晶体结构,其分辨率为2.8 Å。最终的数据收集和结构修正参数见表1。晶体结构中,Dys1包含两对紧密结合的二聚体(A1B1和A2B2),两个亚基A1与B1、A2与B2形成的相互作用面积为2 830 Å2,A1与A2、B1与B2形成相互作用面积为2 470 Å2。在A1与B1、A2与B2的界面上分布有两个对称的活性位点(图3A)。Dys1的单体结构包含13条α-螺旋和9条β-折叠股。α6到α7之间、α9到α10之间分别形成一段长loop区。β3、α5、β4共同形成βαβ模体。6条平行的β-折叠股(β1~2,β6~9)和4条α-螺旋(α2、α4、α13、α11)形成罗斯曼折叠,该折叠位于单体中心,结合1个NAD+分子(图3B)。
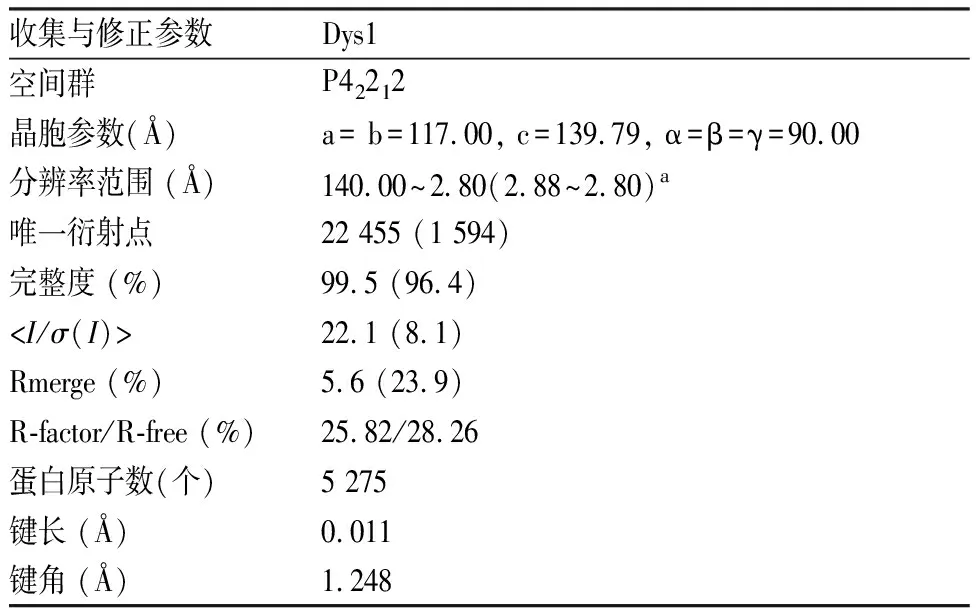
表1 Dys1蛋白晶体结构的参数
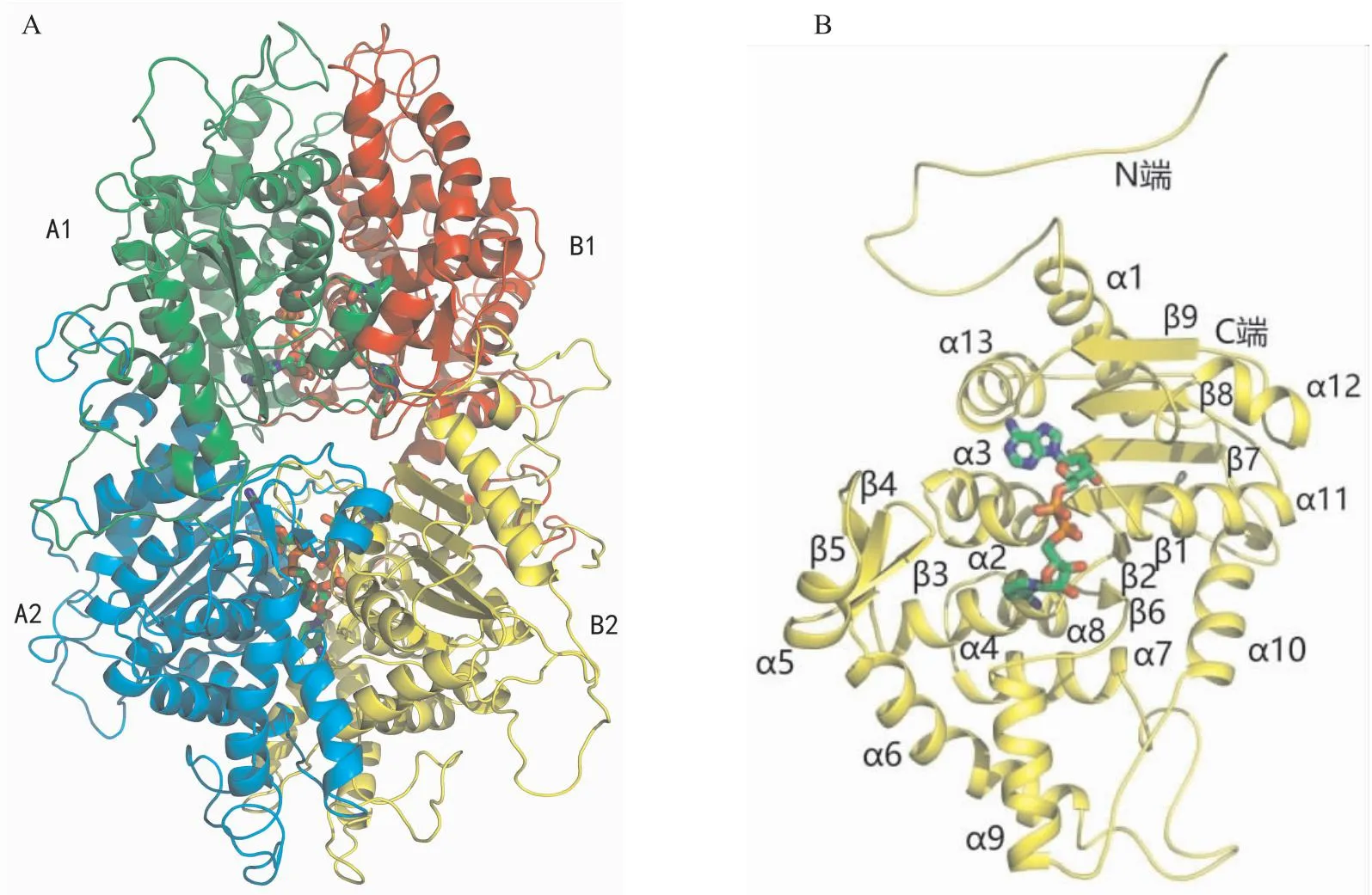
图3 Dys1蛋白的整体三维结构图及单体结构图
2.4 辅因子NAD+结合位点Dys1的催化依赖于辅因子NAD+。反应由NAD+的烟酰胺上的C4原子发起,使亚精胺的C5原子上的氢离子转移至NAD+的烟酰胺处,从而使底物亚精胺脱氢生成脱氢亚精胺。在结构中,NAD+结合于一条深约17 Å的口袋内(图4A)。NAD+主要通过氢键相互作用稳定Dys1的结构。其中腺嘌呤环与残基Thr 329、Asp 334、Asp 363、Val 364形成氢键;磷酸基团与残基Ser 108、Ser 134、Ala 338形成氢键;呋喃糖环与残基Ala 135、Gly 136、Gly 304形成氢键(图4B)。氢键相互作用有利于NAD+的结合,并稳定Dys1的构象以辅助催化反应。
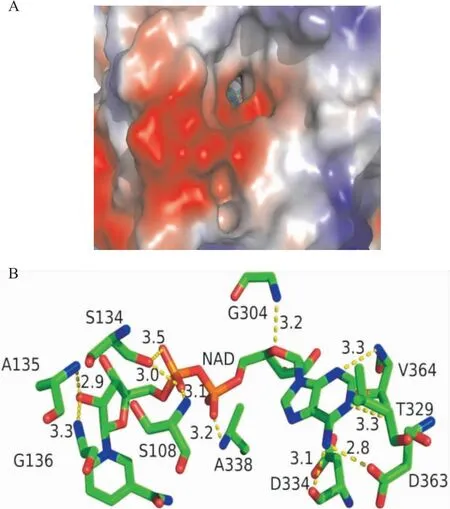
图4 活性位点口袋表面电势图及NAD+与周围残基结合位点图
2.5 底物亚精胺结合位点底物亚精胺结合位点由His 309、Asp 262、Ser 259、Ser 108、Glu 139、Asn 109、Tyr 179、Ile 169、Glu 344、Trp 348、Ala 340、Lys 350、Leu 316,13个氨基酸残基构成(图5A)。其中酸性氨基酸Asp 262、Glu 139分布于结合位点入口处,可以促进碱性底物亚精胺以及eIF-5A N端loop区保守赖氨酸的进入。底物结合位点呈“L”型,在空间上该位点紧靠辅因子NAD+(图5B),有利于发生亚精胺的脱氢反应,生成脱氢亚精胺。通过结构分析及此前催化机制推测Dys1与其他物种DHS机制类似,Lys 350的ε-氨基攻击脱氢亚精胺C5原子与N4原子之间的碳氮双键,使其断裂,脱氢亚精胺断裂后形成的丁胺基部分转移至底物蛋白eIF-5A N端loop区保守的赖氨酸ε-氨基上,形成最终产物脱氧羟腐胺赖氨酸。

图5 亚精胺口袋残基结合位点图及口袋表面电势图
2.6 Dys1的结构比对目前已有4种不同来源的DHS晶体结构,包括热带病锥虫病的致病菌布氏锥虫(Trypanosomatid.Brucei,TbDHS)极端嗜热球古菌(PyrococcushorikoshiiOT3,PhoDHS)以及人源的DHS(Human)hDHS等。其中TbDHS为异四聚体。通过三维结构比对发现,Dys1的整体结构与PhoDHS和hDHS相似(图6A),值得注意的是Dys1 N端缺少一段“球链基序”。Dys1的晶体生长在适宜的离子强度和较中性的pH 6.5条件中,该条件下N端“球链基序”以柔性方式展开,使活性位点暴露,方便底物进入进而完成催化。此外,Dys1在α6和α13螺旋处与PhoDHS、hDHS的结构有明显差异。Dys1的α6和α13处螺旋长度短,在其后有一段loop环区。Dys1中NAD+分子的三维结构整体保守,只在烟酰胺环处存在差异(图6B)。Dys1中构成亚精胺活性口袋的氨基酸在结构上高度保守(图7),这与一级序列比对的结果一致。根据一级序列比对显示Glu 195到Thr 221之间和Thr 375后的氨基酸残基并不保守,使α6和α13处螺旋后的loop环区具有一定的柔性。烟酰胺环相互作用方式存在的差异可能是因为其与周围残基无氢键相互作用。一级序列比对表明构成NAD+活性口袋的氨基酸残基(His 309、Trp 348、Lys 350、Ser 108、Gly 136、Gly 304、Asp 334、Ala 135、Thr 329、Asp 363)高度保守,其余残基Ser 134、Ala 338、Val 364不保守(图8)。
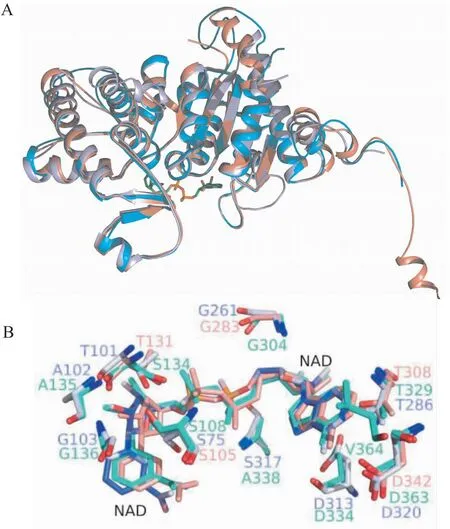
图6 Dys1、hDHS和PhoDHS的整体结构与NAD+位点比对图
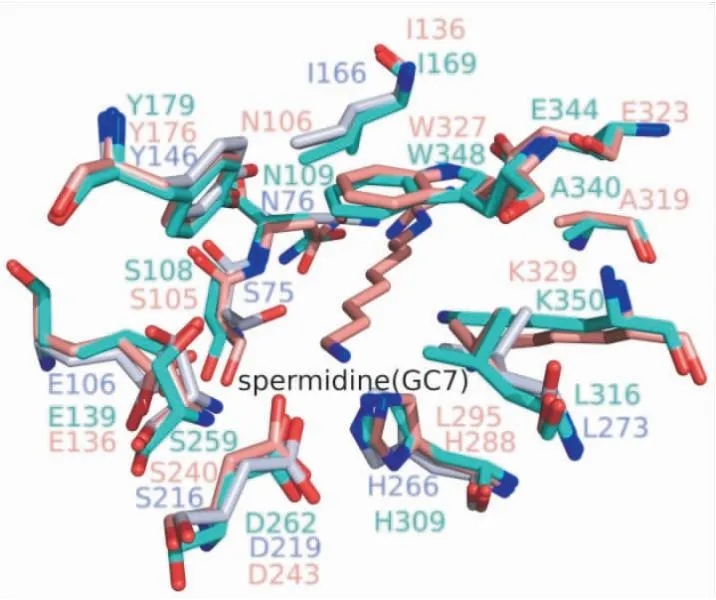
图7 Dys1、hDHS 和PhoDHS的亚精胺底物口袋位点比对图
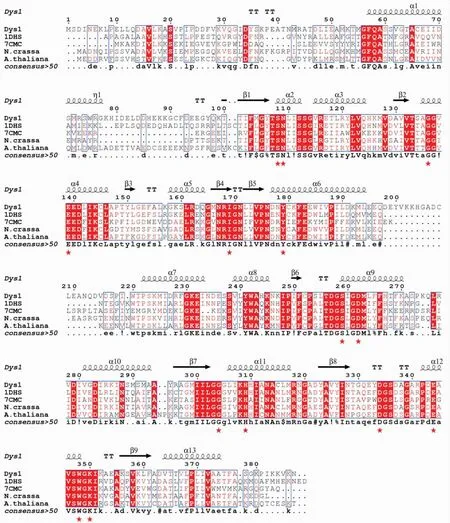
图8 Dys1一级序列比较图
3 讨论
蛋白质的翻译后修饰在多种细胞过程中发挥着重要作用,常作为一种调节机制调整环境变化时的细胞反应。其中羟腐胺赖氨酸化修饰对eIF-5A行使功能起到不可或缺的作用。DHS是催化羟腐胺赖氨酸化修饰的关键酶,研究[13]表明,当eIF-5A修饰位点的赖氨酸突变后,因无法进行羟腐胺赖氨酸化修饰,导致eIF-5A突变株酵母死亡,并且该修饰位点的突变也与多种人类颅面神经发育畸形等疾病相关[14]。
本研究解析了酿酒酵母中Dys1高分辨率结构,分析了Dys1的辅因子NAD+的作用位点,并将Dys1与不同来源的DHS的整体结构、NAD+结合位置以及底物亚精胺结合口袋进行对比,发现Dys1的总体结构保守,辅因子NAD+与酶的结合主要通过氢键相互作用稳定NAD+辅因子,底物亚精胺结合口袋高度保守。结合文献报道[15],Dys1催化酿酒酵母eIF-5A的过程是短暂的,对eIF-5A N端结构域赖氨酸进行第一步修饰,完成后eIF-5A就会离开Dys1,并且在相互作用的过程中Dys1和eIF-5A的三维结构不会发生明显变化。
本研究为设计有效的DHS抑制剂奠定了结构基础,DHS的抑制剂可用于控制如HIV-1病毒复制等高增殖性疾病。未来还将继续致力于DHS抑制剂的开发,基于Dys1的结构,通过虚拟筛选方法得到潜在的抑制剂小分子,利用体外实验验证小分子抑制剂与DHS亲和力,设计细胞实验和体内实验验证抑制效果,最终优化得到理想抑制剂,为后续相关药物开发奠定基石。

