甲基-β-环糊精通过限制脂质代谢抑制横纹肌肉瘤细胞的增殖、迁移和侵袭
胡亚飞,阚 晨,汪思应
横纹肌肉瘤(rhabdomyosarcoma,RMS)是儿童中最常见的软组织肉瘤。RMS总发病率约为4.5/100万[1]。近年来,随着手术、化疗技术的提高以及新型抗癌药物的出现,RMS的治疗水平显著提升,但仍有复发和预后不良的情况出现[2-3]。有研究表明[4],脂质代谢重编程参与多种肿瘤发生发展的进程,但其在肉瘤中的作用尚不清楚。从脂质代谢重编程的角度来探究肉瘤发生发展的机理为肉瘤治疗提供新的方向。课题组前期结果表明与正常肌肉组织相比,肉瘤组织中脂质合成相关基因高表达。基于此,该研究采用脂质抑制剂甲基-β-环糊精(methyl-β-cyclodextrin, mβCD)对人骨骼横纹肌肉瘤细胞进行处理,探究其分子机制。该研究结果可能为人骨骼横纹肌肉瘤治疗提供一个新思路。
1 材料与方法
1.1 材料
1.1.1细胞株与实验动物 人骨骼横纹肌肉瘤细胞系(RD、SJCRH30和A673)购自上海细胞库,短串联重复序列鉴定正确。人骨骼肌细胞系(HSMC)购自湖南丰辉生物科技有限公司。实验动物选用8只 4~5 周龄的 BALB/C雌性裸鼠,体质量 16~20 g(购自江苏集萃药康生物科技股份公司),动物实验经安徽医科大学动物伦理委员会批准(批准号:LLSC 20210807)。饲养条件:SPF 级环境中饲养,环境温度20~24 ℃,湿度40%~70%,通风换气15~20次/h,设置12 h 光照12 h 黑暗交替。
1.1.2主要试剂与仪器 胎牛血清(FBS,货号: S711-001S)购自美国Lonsera公司,DMEM高糖培养基(货号:PM150210)、RPMI-1640培养基(货号:PM150110)购自武汉普诺赛生命科技有限公司,细胞计数盒-8(cell counting kit-8, CCK-8)检测试剂盒(货号:GK10001)购自美国GLPBIO公司,基质胶(Matrige,货号:356234)、细胞培养小室(Transwell小室,货号:353097)购自美国BD公司,结晶紫染色液(货号:G1063)购自北京索莱宝科技有限公司,TRIzol总RNA提取试剂(货号:CW0580)购自江苏康为世纪生物科技有限股份公司, EVO M-MLV反转录预混型示踪试剂盒(货号:AG11734)、SYBR GreenProTagHS 预混型qPCR 试剂盒(货号:AG11476)购自湖南艾科瑞生物工程有限公司,qRT-PCR引物购自上海生物工程有限公司,mβCD(货号:GC32697)购自美国GLPBIO公司,三酰甘油(triglyceride,TG)检测试剂盒(货号:E1013-50)购自北京普利莱公司,细胞培养箱(型号:Galaxy170S)购自德国Eppendorf公司,酶标仪(型号: Varioskan LUX)购自美国赛默飞生物有限公司,实时荧光定量PCR仪(型号:CFX96)购自美国BIO-RAD公司。
1.2 方法
1.2.1GEPIA数据库分析 利用GEPIA数据库分析脂质合成相关基因在正常肌肉组织和肉瘤组织中的表达情况。发现脂质合成相关基因在肉瘤组织中高表达,故后续通过qRT-PCR验证。
1.2.2qRT-PCR检测细胞SREBP1和SQLEmRNA表达 采用TRIzol法提取细胞(HSMC,RD,SJCRH30和A673)总RNA,测定其RNA浓度和纯度后,使用逆转录试剂盒合成cDNA。利用SYBR Green Pro Tag HS 预混型进行 qRT-PCR 检测,反应体系为 20 ul,每组样品设置 3个复孔。扩增程序为:95 ℃预变性30 s ,95 ℃变性5 s,60 ℃退火30 s。共41个循环。目标基因SREBP1引物 F: 5′-CGGAACCATCTTGGCAACAGT-3′,R: 5′-CGCTTCTCAATGGCGTTGT-3′ ;SQLE引物F:5′-GATGATGCAGCTATTTTCGAGGC-3′,R: 5′-CCTGAGCAAGGATATTCACGACA-3′。
1.2.3实验分组与处理 本研究分为3组对照组和实验组,对照组1:正常培养的人骨骼横纹肌肉瘤细胞系RD;实验组1: mβCD(1mmol/L)处理的RD;对照组2:正常培养的人骨骼横纹肌肉瘤细胞系SJCRH30;实验组2: mβCD(1 mmol/L)处理的SJCRH30;对照组3:正常培养的人骨骼横纹肌肉瘤细胞系A673;实验组3: mβCD(1 mmol/L)处理的A673。用于后续平板克隆、软琼脂集落形成、细胞迁移侵袭和TG检测实验。
1.2.4细胞培养 HSMC、RD、A673细胞培养于含10%胎牛血清和1%青-链霉素的 DMEM高糖培养液中,SJCRH30细胞培养于含10%胎牛血清和1%青-链霉素RPMI-1640培养液中。所有细胞均在 37 ℃、5% CO2加湿培养箱中培养,当细胞培养至对数生长期,采用0.25%胰蛋白酶消化方式对细胞进行传代。后续试验细胞均为8~15代。
1.2.5细胞增殖实验 CCK-8试剂盒用于检测细胞的增殖能力。将细胞(RD、SJCRH30、A673)接种于96 孔细胞培养板中,每孔细胞密度为2 000个,培养液为体积100 μl。4 h后使用新鲜培养液将mβCD稀释为5个梯度(0、0.5、1、1.5、2 mmol/L)。弃去 96 孔板内原有培养液,加入含上述浓度的mβCD培养液。培养0 、24 、48 、72 h后,加入10 μl CCK-8溶液, 孵育2 h。其中,0 h检测时间在细胞贴壁后(即培养4~6 h)。用多功能酶标测量仪检测 450 nm处的吸光度值。
1.2.6平板克隆实验 细胞消化离心后,按每孔1 500 个细胞量接种到6孔板内,每组3个复孔。将6孔板置于37 ℃、5% CO2的加湿细胞培养箱内培养10 d左右。时间到后,在孔内加入0.1 % 结晶紫染色液对细胞染色固定,拍照留存。
1.2.7软琼脂集落形成实验 按照1 ∶1的比例将培养液和1.2%的琼脂糖溶液混合均匀铺在6孔板待凝,此过程约30 min。随后将0.7%琼脂糖溶液与含各组细胞(每孔2 000个细胞)的完全培养基混合液加入6孔板中待凝,此过程30 min。之后在每孔内加入适量培养液,防止蒸发。14 d后镜下观察。
1.2.8细胞迁移实验 细胞消化计数,并用无血清培养液重悬,稀释为每孔3×104。在24孔板孔内加入600 μl完全培养液,之后将小室放入孔内,吸取各组无血清细胞悬液加入到小室上层。将24孔板放在37 ℃、5% CO2的加湿细胞培养箱内培养48 h。之后对小室清洗,结晶紫染色,对小室下层细胞进行统计。
1.2.9细胞侵袭实验 按照1 ∶6的比例将基质胶与无血清培养液混合,每个小室200 μl混合液,待凝。此过程大约1 h。细胞消化计数,并用无血清培养液重悬,稀释为每孔3×104。在24孔板孔内加入600 μl完全培养液,之后将小室放入孔内,吸取无血清细胞悬液加入到小室基质胶上层。将24孔板放在37 ℃、5% CO2的细胞培养箱内培养48 h。之后对小室清洗,结晶紫染色。对小室下层细胞进行统计。
1.2.10裸鼠成瘤 将细胞数为5×106,体积为150 μl的SJCRH30细胞悬液分别接种到小鼠腋下。3 d后,对照组小鼠开始隔天腹腔注射150 μl无菌PBS,实验组小鼠隔天腹腔注射150 μl用PBS溶解后的mβCD溶液,药物剂量为400 mg/kg。期间记录小鼠体质量,测量肿瘤体积。
1.2.11脂质组学 将对照组(SJCRH30)和实验组(1 mmol/L mβCD处理)细胞消化离心,按照每组细胞数为1×107装到无菌1.5 ml EP管内,每组取3个样本。将样本在4 ℃离心机离心5 min,转速为 2 000 r/min。弃上清液,收集细胞沉淀于 1.5 ml 离心管中。标记好EP管,将EP管的尖底插入液氮中,淬灭细胞沉淀 1 min,-80 ℃冰箱内保存。收集好样本后由欧易生物公司完成后续检测。
1.2.12TG检测 将细胞消化离心计数,细胞数为1×106。后续按照说明书操作,多功能酶标测量仪在波长550 nm处读取数据,分析结果。
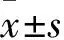
2 结果
2.1 脂质合成相关基因在人骨骼肌细胞和人骨骼横纹肌肉瘤细胞中的表达情况肿瘤基因表达数据库(http://gepia.cancer-pku.cn/)分析结果发现,与正常肌肉组织相比,脂质合成相关基因在肉瘤组织中高表达。见图1A。选取数据库中表达差异最明显的两个基因SREBP1和SQLE在人骨骼肌细胞和人骨骼横纹肌肉瘤细胞中验证。qRT-PCR结果显示:与HSMC相比,人骨骼横纹肌肉瘤细胞(RD、SJCRH30和A673)SREBP1基因和SQLE基因mRNA表达均升高(SREBP1:tRD=26.62,tSJCRH30=93.50,tA673=12.15, 均P<0.001;SQLE:tRD=26.09,tSJCRH30=21.21,tA673=12.09,均P<0.001)。见图1B-C。

图1 数据库结果及SREBP1、SQLE基因在不同细胞的相对表达情况
2.2 mβCD对人骨骼横纹肌肉瘤细胞增殖能力的影响CCK-8实验结果显示,与对照组(0 mmol/L)相比,0.5、1、1.5、2 mmol/L mβCD处理的RD、SJCRH30和A673细胞的增殖能力均下降(0.5 mmol/L:tRD=8.69,tSJCRH30=6.08,tA673=23.05;1 mmol/L:tRD=15.29,tSJCRH30=25.76,tA673=22.98;1.5 mmol/L:tRD=16.86,tSJCRH30=46.04,tA673=31.76;2 mmol/L:tRD=58.67,tSJCRH30=53.46,tA673=35.69,均P<0.01)。见图2。
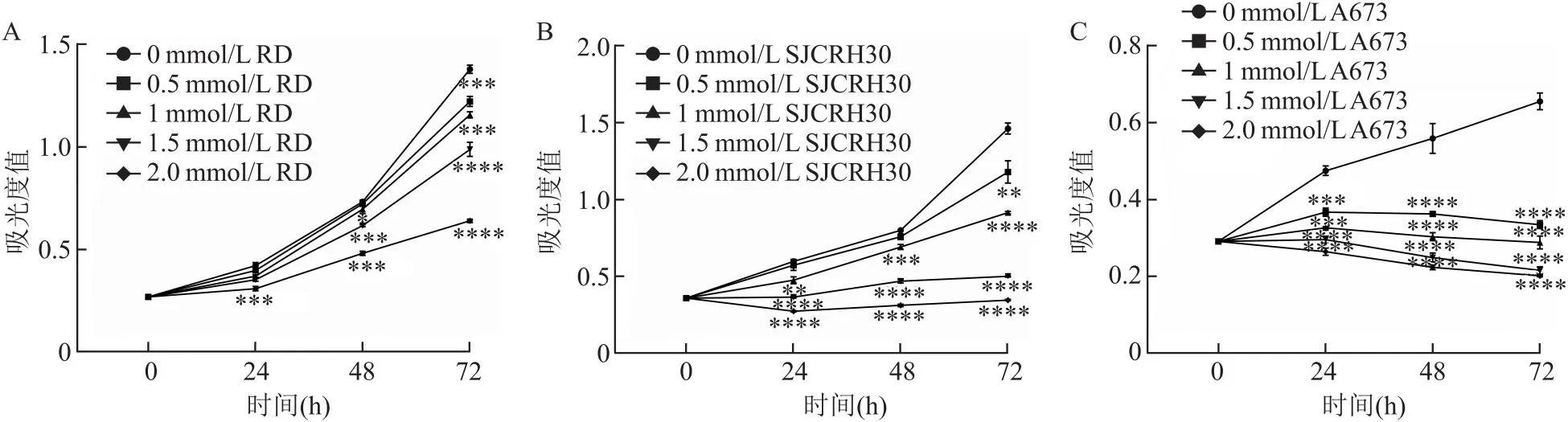
图2 不同浓度mβCD处理后各组细胞的增殖能力
2.3 mβCD对人骨骼横纹肌肉瘤细胞形成克隆能力的影响平板克隆结果显示,与对照组相比,mβCD处理的RD、SJCRH30、A673细胞形成的克隆数目明显减少。(tRD=9.92,tSJCRH30=15.48,tA673=10.36,均P<0.001)。见图3。
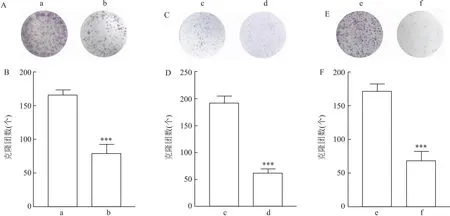
图3 mβCD处理后各组的细胞克隆情况
2.4 mβCD对人骨骼横纹肌肉瘤细胞迁移、侵袭能力的影响细胞迁移实验结果显示,与对照组相比,mβCD处理的RD、SJCRH30和A673细胞迁移数目下降(tRD=12.81,tSJCRH30=15.62,tA673=10.09,均P<0.001)。见图4。此外,与对照组相比,mβCD处理的RD、SJCRH30、A673细胞侵袭数目也明显下降(tRD=7.05,tSJCRH30=4.74,tA673=8.76,均P<0.01)。见图5。
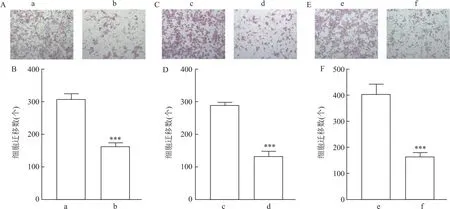
图4 mβCD对人骨骼横纹肌肉瘤细胞迁移能力的影响
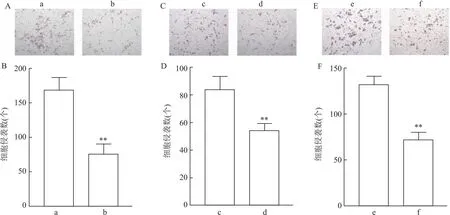
图5 mβCD对人骨骼横纹肌肉瘤细胞侵袭能力的影响
2.5 mβCD对人骨骼横纹肌肉瘤细胞软琼脂集落形成能力的影响肿瘤细胞具有非锚定生长能力。软琼脂集落形成实验结果显示,与对照组相比, mβCD处理的RD、SJCRH30、A673细胞软琼脂集落形成数量减少(tRD=4.00,tSJCRH30=5.00,tA673=4.03,均P<0.05 )。见图6。

图6 mβCD处理后各组细胞的软琼脂集落形成能力
2.6 mβCD对人骨骼横纹肌肉瘤细胞成瘤能力的影响裸鼠成瘤实验结果表明,与对照组相比,mβCD组小鼠重量减轻,但无统计学意义。见图7C。与对照组相比,mβCD组肿瘤体积明显下降(接种后15 d:t=2.76,P<0.05;接种后17 d:t=3.19,P<0.05;接种后19 d:t=4.81,P<0.01;接种后21 d:t=4.93,P<0.001)。见图7A、B、D。同时mβCD组肿瘤重量也降低(t=6.62,P<0.001)。见图7E。以上这些结果均可证实mβCD具有抑制人骨骼横纹肌肉瘤细胞的成瘤能力。

图7 mβCD对人骨骼横纹肌肉瘤细胞成瘤能力的影响
2.7 mβCD对人骨骼横纹肌肉瘤细胞中脂质代谢物的影响主成分分析图、偏最小二乘-判别分析和正交偏最小二乘方-判别分析三种统计分析结果显示,对照组和实验组有差异。见图8A-C。表明人骨骼横纹肌肉瘤细胞在mβCD处理后,脂质代谢物发生变化。此外,在变量权重值(variable important in projection,VIP)>1,t<0.05的筛选条件下,筛选出128个差异代谢物。见图8D。红色原点为实验组中显著上调的代谢产物(P<0.05, VIP>1 且fold chage (FC)>1),共75个。蓝色原点为实验组中显著下调的代谢产物(P<0.05, VIP>1 且FC<1),共53个。灰色原点代表无显著变化的代谢产物。KEGG富集通路分析结果显示,mβCD可抑制人骨骼横纹肌肉瘤细胞中TG的代谢物生成(tTG(16:1/18:1/18:1)=5.85,tTG(16:1/16:1/18:1)=14.71,tTG(16:0/18:1/18:1)=6.41,tTG(16:0/16:1/18:1)=4.00,tTG(16:0/18:1/20:4)=9.78,tTG(18:0/18:1/18:1)=3.02,均P<0.05)。见图9。TG检测试剂盒检测结果显示:与三组人骨骼横纹肌肉瘤细胞相比,mβCD(1 mmol/L)处理组TG含量均降低(tRD=7.78,tSJCRH30=9.34,tA673=2.20,P<0.01)。见图10。提示mβCD很可能通过降低TG含量来减轻人骨骼横纹肌肉瘤细胞的恶性程度。

图8 多元统计分析及火山图
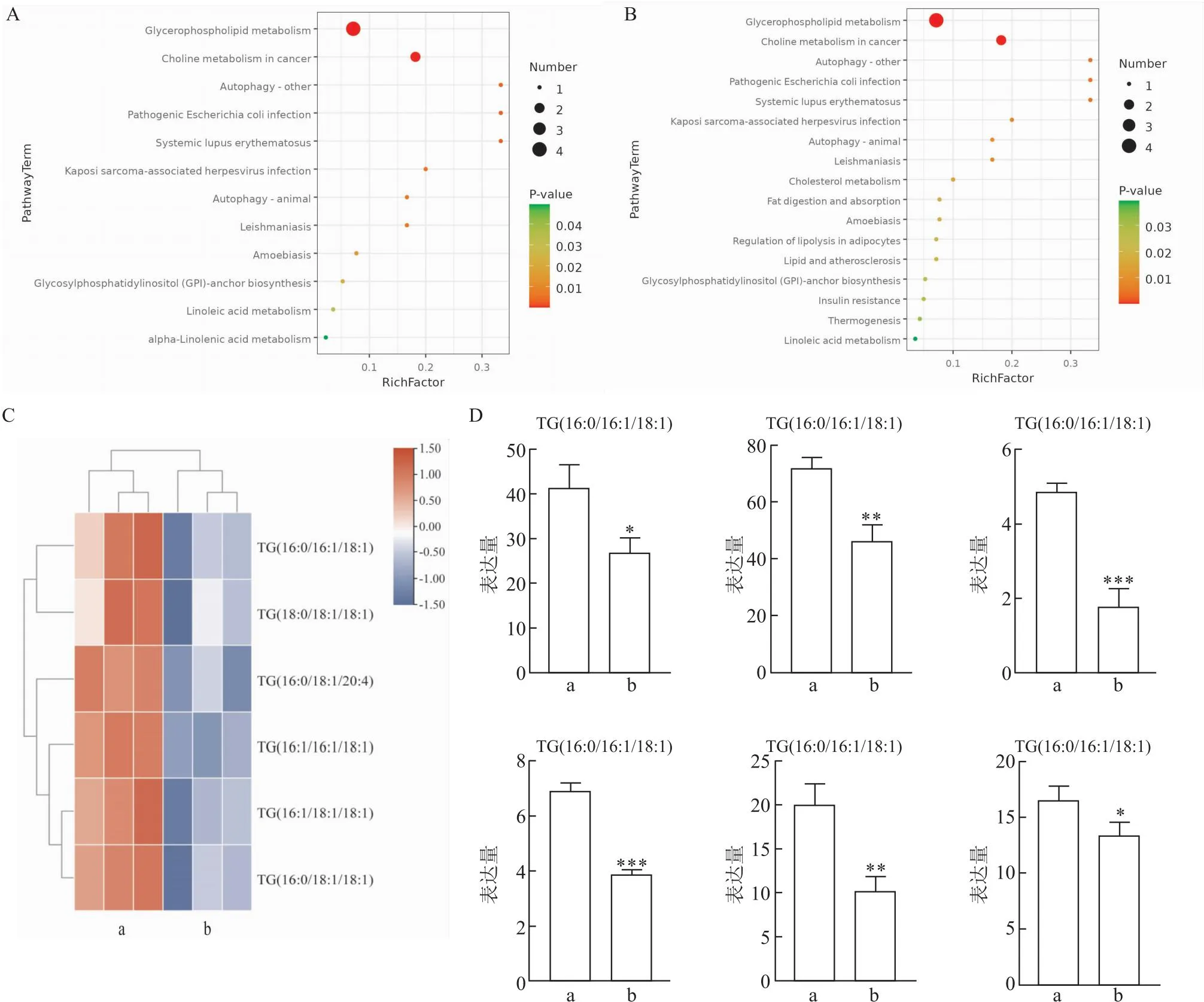
图9 KEGG富集通路分析图
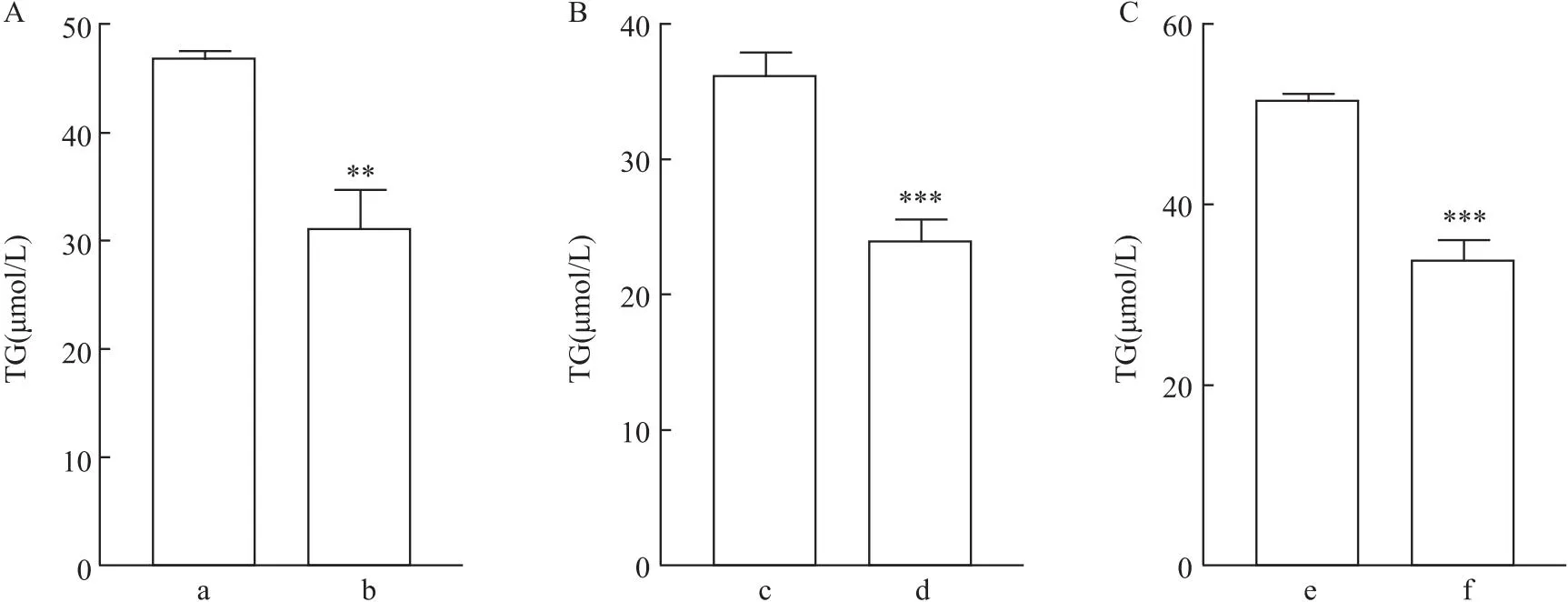
图10 mβCD对人骨骼横纹肌肉瘤细胞TG含量的影响
3 讨论
RMS 是软组织恶性肿瘤的一种,具有高度的侵袭性,主要影响儿童。然而,其治疗和预后的效果并不十分理想[5],探究新的治疗靶点尤为重要。该研究通过探究横纹肌肉瘤细胞中脂质合成相关基因的表达情况,发现其脂质合成较正常细胞上升,mβCD可能通过抑制脂质合成而减轻横纹肌肉瘤恶性程度,为RMS治疗提供新的视角。
肿瘤的发生受多重因素影响,如环境改变和基因突变等[6-7]。近年来发现脂质代谢重编程成为癌症的主要特征之一[8],已被众多研究者关注,但在肉瘤方面的研究仍有很大欠缺。本研究从脂质合成的角度入手,探究脂质代谢重编程在肉瘤的发生发展中的作用。通过查阅数据库发现,相较正常肌肉组织,脂质合成相关基因在肉瘤组织中高表达,并在qRT-PCR中得到验证,结果与数据库相一致。提示在肉瘤中脂质代谢可能也进行重编程。有文献报道mβCD是一种有效的脂质小分子药物抑制剂,它可以将细胞质膜的疏水结构封装在其内部疏水腔中,并连续地从外层质膜中提取胆固醇等相关脂质[9]。持续的胆固醇消耗增加细胞膜张力及其可变性,使细胞容易发生独立于细胞骨架状态的破裂[10]。利用此特性,它可以通过抑制PI3K-Akt-Bad通路的激活,诱导癌细胞凋亡[11]。然而mβCD对于横纹肌肉瘤的影响目前仍然未知。本研究表明mβCD可以抑制人骨骼横纹肌肉瘤细胞的克隆形成、迁移以及侵袭。裸鼠成瘤实验进一步验证mβCD可以抑制人骨骼横纹肌肉瘤的生长。以上结果都表明mβCD可以抑制人骨骼横纹肌肉瘤细胞的恶性程度。本研究脂质组学结果分析显示mβCD处理后可降低人骨骼横纹肌肉瘤细胞中TG含量。TG增高也是肿瘤发展的诱因,也有研究[12]将其作为治疗靶点。同时用TG检测试剂盒对脂质组学的结果进行验证,结果表明mβCD处理后人横纹肌肉瘤细胞TG含量降低。在本研究中虽证明mβCD可以抑制人骨骼横纹肌肉瘤细胞的增殖、迁移和侵袭等恶性生物学行为,且可能是通过降低TG含量发挥的抑制作用,为横纹肌肉瘤的治疗提供了一个新的思路。但本研究仍有不足之处,关于mβCD抑制人骨骼横纹肌肉瘤细胞恶性的分子机制还有待进一步探究,TG合成与人骨骼横纹肌肉瘤细胞恶性程度的相关性需要进一步厘清,调控人骨骼横纹肌肉瘤细胞TG合成的基因需深度挖掘。

