RAB10对胰腺癌细胞生物学功能的影响及临床意义
匡 鹏,张钦泉,程 盛,董 毅,王理承,张思璐,叶家欣,马丹丹,李中虎 ,张智勇,
胰腺癌是一种恶性程度极高的消化系统肿瘤,5年生存率约为10%[1],据美国肿瘤研究机构[2]估计,截止2022年,约49 830例患者死于胰腺癌,在所有恶性肿瘤中占比8.2%。作为预后极差的消化道恶性肿瘤,胰腺癌临床诊治困难,手术干预效果不佳[3]。近些年来一些新型的治疗方法,如免疫抑制、分子靶向、联合放化疗均效果不佳[4-5],早期手术切除仍是目前唯一有效的治疗方法[1]。因此,寻找与胰腺癌有关的基因,基因检测手段的使用对胰腺癌的早期诊断、改善其生存和预后显得尤为重要。RAB10基因位于人染色体 2p23.3[6],国内外研究[7-10]表明RAB10在胶质瘤、骨肉瘤、宫颈癌、肝癌等多种恶性肿瘤的发展中表现出癌基因特征。RAB10在胰腺癌组织中的表达水平可能影响胰腺癌细胞的生物学功能。该研究旨在探讨RAB10在胰腺癌组织中的表达情况,并研究沉默、过表达RAB10对胰腺癌细胞生物学功能的影响以及RAB10的表达水平对胰腺癌患者临床相关预后的影响。
1 材料与方法
1.1 主要试剂和仪器RAB10、GAPDH单克隆抗体及辣根过氧化物酶标记的二抗购自美国Abcam公司(货号:ab237703、ab245357、ab263962)。L15购自上海iCell公司(货号:iCell-0009)。FBS购自美国Gibco公司(货号:10091-148)。EdU细胞增殖检测试剂盒购自上海碧云天生物科技有限公司(货号:C0071S)。凋亡检测试剂盒购自北京Solarbio公司(货号:CA1020)。Transwell小室购自美国Corning公司(货号:3422)。Matrigel胶购自美国BD公司(货号:356234)。BCA 蛋白定量试剂盒购自江苏康为世纪生物科技有限公司(货号:CW0014S)。ECL化学发光检测试剂盒购自苏州UElandy公司(货号:S6009M).荧光显微镜购自日本奥林巴斯公司(型号:CX-1)。流式细胞仪购自美国贝克曼库尔特生命科学公司(型号:CytoFLEX S)。CO2培养箱购自美国Thermo公司(型号:Forma 3111)。人胰腺癌SW1990细胞株购自中国科学院细胞库。
1.2 方法
1.2.1生物信息学分析 ①GEPIA数据库分析RAB10在胰腺癌及正常胰腺组织中的基因表达差异:在GEPIA数据库中条件设置为:“gene:RAB10”、“cancer type:PAAD”,“Match TCGA normal and GTEx data”可获得RAB10在正常胰腺组织与胰腺癌组织中的表达差异。② 不同RAB10mRNA表达水平胰腺癌患者的相关临床数据收集与分析:下载癌基因数据库TCGA中RAB10在胰腺癌中的基因表达量和临床相关性数据,将RAB10mRNA表达量的中位数定为分界线,把胰腺癌患者分为RAB10低表达组和RAB10高表达组,并对临床相关数据进行统计分析。
1.2.2细胞的培养、转染与检测 ① 细胞的培养:将SW1990细胞系培养于DMEM培养基(其中含10%的FBS),放置在37 ℃、5% CO2培养箱中培养24 h,至细胞达到80%~90%融合度;② 细胞转染:将细胞悬液接种于培养板,待接种细胞贴壁后,将过表达RAB10质粒转染至SW1990细胞作为实验组(RAB10-OE),将空质粒转染SW1990细胞作为其对照组(pcDNA3.1);针对RAB10序列合成3条小干扰RNA(siRNA)分别转染SW1990细胞作为实验组(RAB10-siRNA-1、2、3),将随机阴性对照序列siRNA作为其对照组(NC-siRNA)。③ 细胞的检测:使用Q-PCR实验检测沉默效果及过表达效果,挑选干扰效果最好的siRNA进行后续实验。使用BCA、ECL试剂盒按说明书进行Western blot实验,检测蛋白表达情况。
1.2.3EdU细胞增殖实验 在24孔板中铺板,接种转染后的四组细胞并配制20 μmol/L EdU工作液,将上述EdU工作液预热至37 ℃,浓度稀释至10 μmol/L,继续培养细胞,将EdU工作液加入细胞中,待EdU标记完成后加入固定液固定15 min,去除固定液,使用PBS洗涤细胞后加入通透液继续培养15 min,去除通透液,每孔加入0.5 ml Clik反应液,避光培养30 min后洗涤细胞,每孔加入10 μmol/L Hoechst 33342溶液1 ml,培养10 min后洗涤,完成核染色。在荧光显微镜下对细胞进行拍照和处理数据,该实验重复3次。
1.2.4流式细胞实验 调整转染后四组细胞的浓度为5×105~1×106个/ml。吸取上述1 ml细胞,4 ℃、1 000 r/min离心机离心10 min后去除上清液。加入预冷PBS液1 ml,轻摇试管使细胞悬浮,4 ℃、1 000 r/min离心机离心10 min,去除上清液,若存在贴壁细胞,则先用胰酶消化,再加入PBS洗涤处理。将细胞重悬于200 μl Binding Buffer缓冲液中,向上述液中加入10 μl PI 与10 μl Annexin V-FITC,轻晃混匀液体,避光在室温下反应15 min后再加入300 μl Binding Buffer缓冲液。使用流式细胞仪检测,该实验重复3次。使用FlowJo 10处理数据作图。
1.2.5Transwell实验 Transwell小室放置于24孔板中。将无血清的L15与Matrigel胶按8 ∶1稀释至60 μl,置入培养箱中5 h后,待上室胶凝固并吸除残余液体,再加入100 μl的无血清L15培养基,放入培养箱中水化20 min。胰酶消化转染后的四组细胞,把无血清L15重悬制备成细胞悬液,使用血球计数板计数。取上述1×104个实验细胞接种至上室,含有10%FBS的L15培养基接种于下室。放入37 ℃、5% CO2培养箱中进行培养。待24 h后吸干孔板里面的培养基,再使用4%的多聚甲醛固定20 min、结晶紫染色25 min,最后使用PBS清洗3次,在显微镜下拍照。该实验重复3次。
1.2.6划痕实验 接种约5×105个转染后的四组细胞至6孔板;24 h贴壁后用使用移液器枪头对着直尺进行划线,使用PBS冲洗细胞3次,除去划下的细胞,加入L15培养基、FBS血清,置入37 ℃、 5% CO2培养箱中培养。于培养的0 、24、48 h时显微镜下拍照。该实验重复3次。
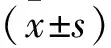
2 结果
2.1 胰腺癌组织及正常胰腺组织中的RAB10mRNA表达情况GEPIA数据库共包含171个正常胰腺组织样本及179个胰腺癌组样本。结果显示胰腺癌组织中RAB10mRNA的表达量明显高于正常胰腺组织(P<0.05)。见图1。
图1 RAB10在胰腺癌组织和正常胰腺组织中的表达比较
2.2细胞转染效果验证Q-PCR实验结果如图2A、B所示,在SW1990细胞中,RAB10mRNA表达在siRNA-1组与siRNA-2组中明显降低(tsiRNA-1=13.494,tsiRNA-2=19.939,均P<0.001;tsiRNA-3=0.78,P=0.48),且siRNA-2组沉默效果更好,故后续实验均选用siRNA-2组;RAB10-OE组RAB10mRNA表达明显高于pcDNA3.1组(t=23.08,P<0.01);Western blot实验结果如图2C所示,与NC-siRNA组比较,RAB10-siRNA1、2、3组蛋白表达量均减少,其中RAB10-siRNA-2减少最明显;与pcDNA3.1组比较,RAB10-OE组蛋白表达量增加。表示均转染成功。

图2 RAB10 mRNA表达和蛋白表达
2.3RAB10对细胞增殖的影响如图3所示,与NC-siRNA组相比,RAB10-siRNA-2组SW1990细胞的增殖能力明显降低(t=32.03 ,P<0.000 1);与pcDNA3.1组相比, RAB10-OE组SW1990细胞的增殖能力明显升高(t=8.02,P=0.001 3)。表明沉默RAB10能够抑制SW1990细胞的增殖,过表达RAB10能够促进SW1990细胞的增殖。

图3 各组细胞的细胞增殖率
2.4RAB10对细胞凋亡的影响如图4所示,与NC-siRNA组相比, RAB10-siRNA-2组SW1990细胞的凋亡细胞数量明显增加(t=35.73,P<0.01);与pcDNA3.1组相比,RAB10-OE组SW1990细胞的凋亡细胞数量明显减少(t=21.39,P<0.001)。表明沉默RAB10能够增强SW1990细胞的凋亡,过表达RAB10能够抑制SW1990细胞的凋亡。

图4 各组细胞凋亡情况
2.5RAB10对细胞侵袭能力的影响如图5所示,与 NC-siRNA 组相比, RAB10-siRNA-2组SW1990细胞的侵袭能力明显降低(t=11.01,P=0.000 4);与pcDNA3.1组相比, RAB10-OE组SW1990细胞的侵袭能力明显增强(t=7.18,P=0.002)。表明沉默RAB10能够抑制SW1990细胞的侵袭能力,过表达RAB10能够增强SW1990细胞的侵袭能力。

图5 各组细胞侵袭能力
2.6RAB10对细胞迁移能力的影响实验结果如图6、表1所示,与NC-siRNA组相比,RAB10-siRNA-2组SW1990细胞的迁移能力明显减弱(48 h:t=33.94,P<0.001);与pcDNA3.1组相比, RAB10-OE组SW1990细胞的迁移能力明显增强(48 h:t=61.46,P<0.001)。表明沉默RAB10抑制SW1990细胞的迁移能力,过表达RAB10增强SW1990细胞的迁移能力。
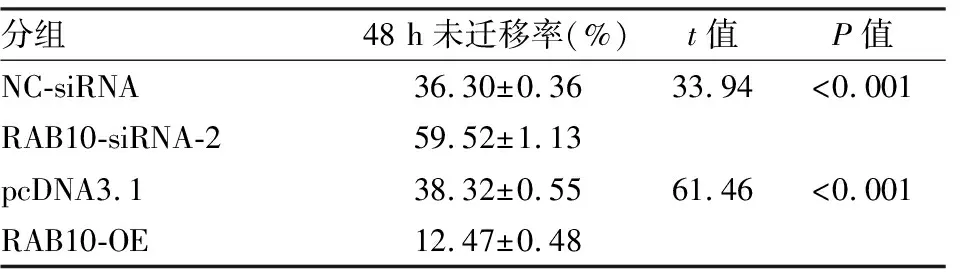
表1 划痕实验未迁移率(n=3)

图6 各组细胞迁移能力 ×40
2.7RAB10mRNA表达水平与胰腺癌患者预后的关系根据癌症基因数据库TCGA中下载的RAB10临床相关数据进行统计学分析,将RAB10mRNA表达量的中位数定为分界线,把胰腺癌患者分为RAB10低表达组和RAB10高表达组。利用Kaplan-Meier法绘制胰腺癌患者生存曲线图。结果如图7所示,RAB10低表达组生存时间明显高于RAB10高表达组(1 059 dvs485 d,χ2=14.420,P<0.001)。Log-rank检验结果显示RAB10低表达组生存时间明显高于RAB10高表达组(P<0.001)。
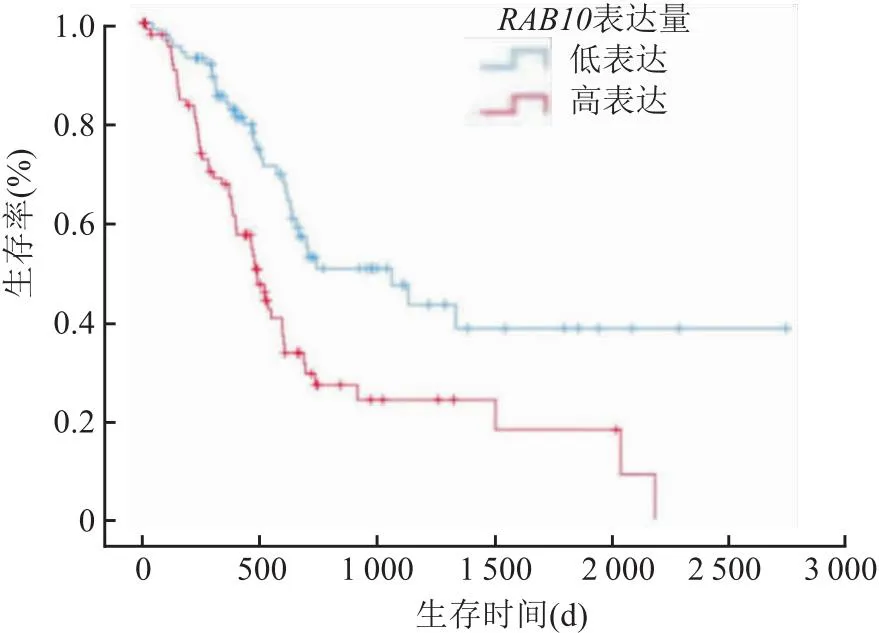
图7 RAB10高、低表达组生存时间与生存率的关系
2.8Cox单因素、多因素回归分析结果下载TCGA
数据库中胰腺癌临床数据,将胰腺癌患者临床病理特征进行Cox回归分析。结果显示,临床分级、T分期、M分期及RAB10mRNA表达水平与胰腺癌患者生存时间明显相关(均P<0.05)。将具有统计学意义的单因素Cox回归分析影响因素纳入多因素Cox回归分析,结果显示,RAB10mRNA的表达水平为影响胰腺癌患者生存时间的唯一独立危险因素(P<0.05)。见表2。
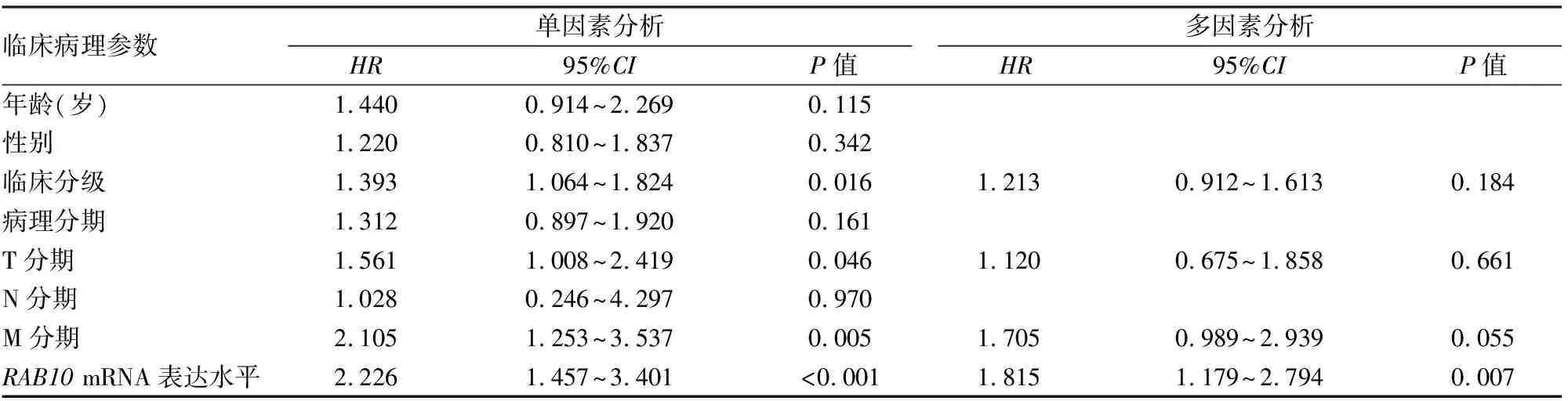
表2 Cox回归分析RAB10mRNA表达水平与胰腺癌患者生存时间的关系
3 讨论
恶性肿瘤具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征,其发生是一个多因子、多步骤的复杂过程。人体中几乎所有的细胞都可能由于突变而发生改变,从而发展成癌症,其中基因突变是重要的影响因素。同时恶性肿瘤的发生是癌细胞不受人体调节机制控制,逐渐侵袭正常组织的渐进过程。上述过程往往受到原癌基因以及抑癌基因的调控。
RAB10是一种蛋白质编码基因,其编码的GTP结合蛋白RAB10属于RAS超家族的小GTP酶。RBA10主要分布于胞吐、胞吞区室,介入调节细胞内囊泡运输,是细胞内膜运输的关键调节因子,参与从运输囊泡的形成到与膜的融合。RAB10在Rabs活性GTP结合形式与非活性GDP结合形式之间循环,能够将直接负责囊泡形成,运动,拴系和融合的不同下游效应子集招募到膜中[11]并参与信号转导、细胞凋亡[12],影响细胞增殖和肿瘤进展。这种调控因子的作用使得RAB10具有潜在的研究价值。
本研究通过生信分析显示RAB10mRNA的表达水平与胰腺癌患者的生存时间相关,RAB10高表达患者的生存时间明显降低,在单因素Cox回归分析中显示RAB10mRNA表达水平与胰腺癌患者临床分级、T分期、M分期相关,多因素Cox回归分析显示出RAB10mRNA表达水平是胰腺癌患者预后的独立危险因素。Wang et al研究[9]表明RAB10低表达的肝癌患者生存时间明显高于高表达患者, Cox回归分析显示RAB10高表达是肝癌患者根治术后总生存期的独立危险因素。Dai et al研究[7]表明RAB10在骨肉瘤细胞中高表达也与患者生存率降低有关, Cox分析显示RAB10的高表达与骨肉瘤肺转移以及 TNM 分期呈正相关。国内外文献与本研究显示RAB10的表达水平与肿瘤患者的生存期相关。
本研究通过体外细胞实验显示RAB10可以促进胰腺癌细胞的增殖、侵袭、迁移,并诱导其凋亡。Jiang et al研究[13]表明,在骨肉瘤细胞中沉默RAB10能够明显抑制肿瘤细胞的生长和迁移。Dai et al[7]发现RAB10在骨肉瘤细胞在骨肉瘤组织中的蛋白表达远高于非肿瘤性骨组织。Zhang et al[10]发现RAB10在脑胶质瘤细胞中表现出明显的促进增殖和侵袭能力。本研究的结果显示,RAB10在胰腺癌中高表达,并且能够促进胰腺癌细胞的增值、侵袭和迁移能力。因此,RAB10可能与癌细胞的恶性功能相关。
总之,本研究使用癌症基因数据库及细胞功能实验说明了RAB10可能具有促进胰腺癌细胞恶性功能行为的作用。未来将继续收集胰腺癌患者临床相关数据进行数据分析,并在公共数据库数据中验证,进一步研究RAB10在胰腺癌细胞中可能的调控通路。

