宫颈癌组织GSTO1的表达与宫颈癌预后的相关性分析及其N-糖基化对宫颈癌恶性生物学行为的影响
于盼盼 ,杨 萍,孙倩玉,高玮睿, 赵邹宇,孙崇凤
宫颈癌是恶性肿瘤之一,严重威胁全球妇女健康[1],每年超过30万人死于宫颈癌[2]。目前,宫颈癌筛查、接种HPV疫苗等可明显降低宫颈癌患者的发病率,但其转移、复发仍是宫颈癌患者的重要死因[3]。糖基化是蛋白质翻译后修饰中最常见的类型之一,主要包括N-糖基化和O-糖基化[4]。研究[5]显示,蛋白质糖基化与宫颈癌的发生发展有关。谷胱甘肽S-转移酶Omega-1(glutathione S-transferase omega-1,GSTO1)是一种谷胱甘肽转移酶,对细胞代谢及凋亡具有调节作用[6]。临床研究[7]显示,GSTO1基因多态性与HPV感染易感性和宫颈癌的发生有明显的相关性。数据库预测GSTO1蛋白存在多个潜在的N-糖基化修饰位点。该研究旨在探索宫颈癌组织肿瘤细胞中GSTO1的表达水平与宫颈癌患者临床病理特征和预后的相关性及其 N-糖基化对宫颈癌细胞增殖、侵袭、转移和上皮间质转化(epithelial-mesenchymal transition,EMT)的影响。
1 材料与方法
1.1 材料
1.1.1临床病理资料 选择2010年11月—2019年12月石河子大学第一附属医院妇科诊断和手术治疗的82例Ⅰ-Ⅱ期(FIGO分期,2018)宫颈癌患者作为研究对象,另收集相近时间段内33例因子宫良性疾病行全子宫切除术患者作为对照。82例宫颈癌患者中,年龄<50岁42例,年龄≥50岁40例;Ⅰ期48例,Ⅱ期34例;鳞癌65例,腺癌17例;高中分化72例,低分化10例;肿瘤直径<2 cm 32例,肿瘤直径≥2 cm 50例;间质浸润深度(deep stromal invision,DSI)<1/2者42例,≥1/2者40例;有淋巴脉管间隙浸润(lymph vascular space invasion,LVSI)21例,无LVSI 61例;有淋巴结转移(lymph node metastasis,LNM)12例,无LNM 70例。对患者行术后随访,记录患者总生存时间(overall survival, OS)。OS是指手术日至死亡日或末次随访日期的时间。该研究经由石河子大学第一附属医院伦理委员会审查并批准(批号:KJ2020-065-01),所有患者均知情同意后纳入本研究。
1.1.2主要材料与仪器 宫颈癌细胞株HeLa(货号:XF0314)购于上海复祥生物科技有限公司;GSTO1 N-糖基化定点突变慢病毒(货号:220519DZ)购自上海吉玛公司;GSTO1抗体(货号:201986)以及E-钙黏蛋白抗体(货号:40772)、N-钙黏蛋白抗体(货号:76011)和波形蛋白抗体(货号:72547)购自英国Abcam公司;DMEM培养基(货号:C11995500BT)、胎牛血清(货号:10099141)购自德国Gibco公司;胰蛋白消化酶(货号:SH30042.01B)购自美国海克隆公司;细胞迁移侵袭Transwell小室(货号:3422)、Matrigel基质胶(货号:354234)购自美国康宁公司;EdU细胞增殖检测试剂盒(货号:K1075)和TBS粉末(货号:AR0144)购自安徽白鲨生物科技公司;嘌呤霉素(货号:107R0440)、Tween-20(货号:85113)和二甲基亚砜(DMSO;货号:D8370)购自北京索莱宝公司;衣霉素(货号:B7417)购自美国伯乐公司;兔种属来源二抗(货号:ZB-2305)和鼠种属来源二抗(货号:ZB-2305)购自北京中杉金桥公司;电泳仪(型号:165-8001)和转膜仪(型号:170-3935)购自美国伯乐公司;倒置显微镜(型号:IX73P2F)购自日本奥林巴斯公司;化学发光成像仪(型号:5200)购自上海Chemiscope公司。
1.2 方法
1.2.1生物信息学分析 利用生物信息学数据库GENT2(http://gent2.appex.kr/gent2/)分析GSTO1 mRNA表达情况。根据NetNGlyc 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/)预测GSTO1潜在的N-糖基化修饰的氨基酸序列。
1.2.2苏木精-伊红染色与免疫组化 石蜡切片经过脱蜡、水化处理,苏木精浸染5 min后分化6 s,然后蓝化5 min,最后用伊红浸洗1 min,水洗不变色后烘干封片。石蜡切片经脱蜡、水化后处理,8 min高温高压抗原热修复,置于过氧化物中避光10 min,滴加GSTO1一抗(1 ∶100)4 ℃冰箱过夜,然后滴加二抗(1 ∶500)室温孵育30 min,DBA显色后再用苏木精复染,最后用中性树胶封片。GSTO1蛋白在宫颈癌组织肿瘤细胞的胞浆中着色,免疫组化染色的结果由3位年资较高的病理科医师进行评分,根据强度分数和百分比分数的乘积计算肿瘤细胞染色强度评分分级,评分0~6分者属于低表达或不表达,评分7~16分属于高表达[8]。
1.2.3细胞转染 本实验按照慢病毒转染说明书所示步骤进行。将宫颈癌细胞HeLa铺入6孔板中,待细胞融合度至50%~60% 时加入含有GSTO1 55位N-糖基化突变载体基因序列(N55Q组)、135位N-糖基化突变载体基因序列(N135Q组)和190位N-糖基化突变载体基因序列(N190Q组)以及GSTO1野生型载体基因序列(WT组)和空载体基因序列(Vector组),去除原有培养基,按每孔1 ml加入不完全培养基。大概12~16 h更换为完全培养基,待细胞融合度达到80% 左右时更换含嘌呤霉素(1 μg/ml)的完全培养基连续筛选7 d,筛选成功表达GSTO1 N-糖基化55位、135位、190位定点突变以及GSTO1野生型和空载体的细胞用于后续实验。
1.2.4EdU增殖实验 将转染后各组细胞均匀铺入96孔板中(5 000个/孔),24 h后用EdU工作液孵育2 h,然后在3.7%甲醛中固定15 min。在室温下加入含0.5% Triton® X-100的PBS通透液孵育20 min,每孔加入100 μl Click反应液,室温暗处培养30 min,最后每孔加入100 μl的1×Hoechst33342溶液,温室暗处培养30 min。显微镜下拍照,判断细胞增殖能力。
1.2.5划痕愈合实验 将转染后各组细胞均匀接种在6孔板中,待细胞融合度达到80%以上时,用移液枪的枪头垂直于6孔板底部划线,清洗除去脱落细胞,然后用完全培养基继续培养。最后,在0、48 h时用倒置显微镜拍照,比较细胞的迁移能力。
1.2.6Transwell实验 将200 μl 转染后各组细胞悬液(包含2×104个细胞)加入上室,下室加入800 μl含20% 胎牛血清的DMEM培养基,恒温孵育48 h,去除原有培养基,在4%多聚甲醛固定液中将细胞固定15 min,PBS清洗后加入结晶紫染色30 min。最后,在倒置显微镜下随机选取多个不同视野拍照并计数,比较细胞的迁移能力。此外,Transwell实验还用于测定细胞侵袭能力,在上室加入细胞悬液之前,在小室的底部先加入基质胶,其余操作均与细胞迁移实验相同。
1.2.7Western blot实验 将宫颈癌HeLa细胞接种于6孔板中,待细胞融合度达到80%时,分别用衣霉素(浓度0.1 μg/ml)、DMSO处理24 h后提取总蛋白质,进行Western blot实验。衣霉素用DMSO进行稀释,因此以DMSO组作为试剂对照组,以宫颈癌HeLa原株细胞作为空白对照。取出转染后各组长满细胞的6孔板,除去原有培养基,加入细胞裂解液(RIPA ∶PMSF=99 ∶1),提取细胞内总蛋白质。每组蛋白样品取10 μl,行SDS-PAGE检测,电泳结束后蛋白由凝胶传递至PVDF膜,然后与5% 脱脂奶粉一起封闭2 h,最后将PVDF膜分别放入含有GSTO1(1 ∶2 000)、EMT相关抗体E-cadherin(1 ∶3 000)、N-cadherin(1 ∶2 000)和Vimentin(1 ∶2 000)的脱脂奶粉中,在4 ℃下孵育过夜。第二天,取出PVDF膜,用TBST缓冲液浸洗30 min(平均5 min/次),随后置于对应种属的二抗(1 ∶20 000)中,室温下继续孵育2 h。最后,置于化学发光成像仪中,按照流程曝光并保存图片,统计灰度值并比较蛋白表达的差异。本研究中所有Western blot实验,均进行3次重复实验并统计结果。
2 结果
2.1 GSTO1在宫颈癌组织中的表达首先,利用生物信息学数据库GENT2检索 GSTO1在宫颈癌组织和正常宫颈组织中表达的差异,结果显示114例宫颈癌组织样本中GSTO1 mRNA的表达明显高于11例正常宫颈组织(P<0.01)(图1A)。免疫组化结果显示82例宫颈癌患者组织样本中GSTO1高表达组有53例(64.6%),低表达组(阴性和低表达者)有29例(35.4%);33例对照的正常宫颈组织上皮细胞中GSTO1均呈阴性表达,二者比较差异具有统计学意义(χ2=39.562,P<0.001)(图1B-M)。
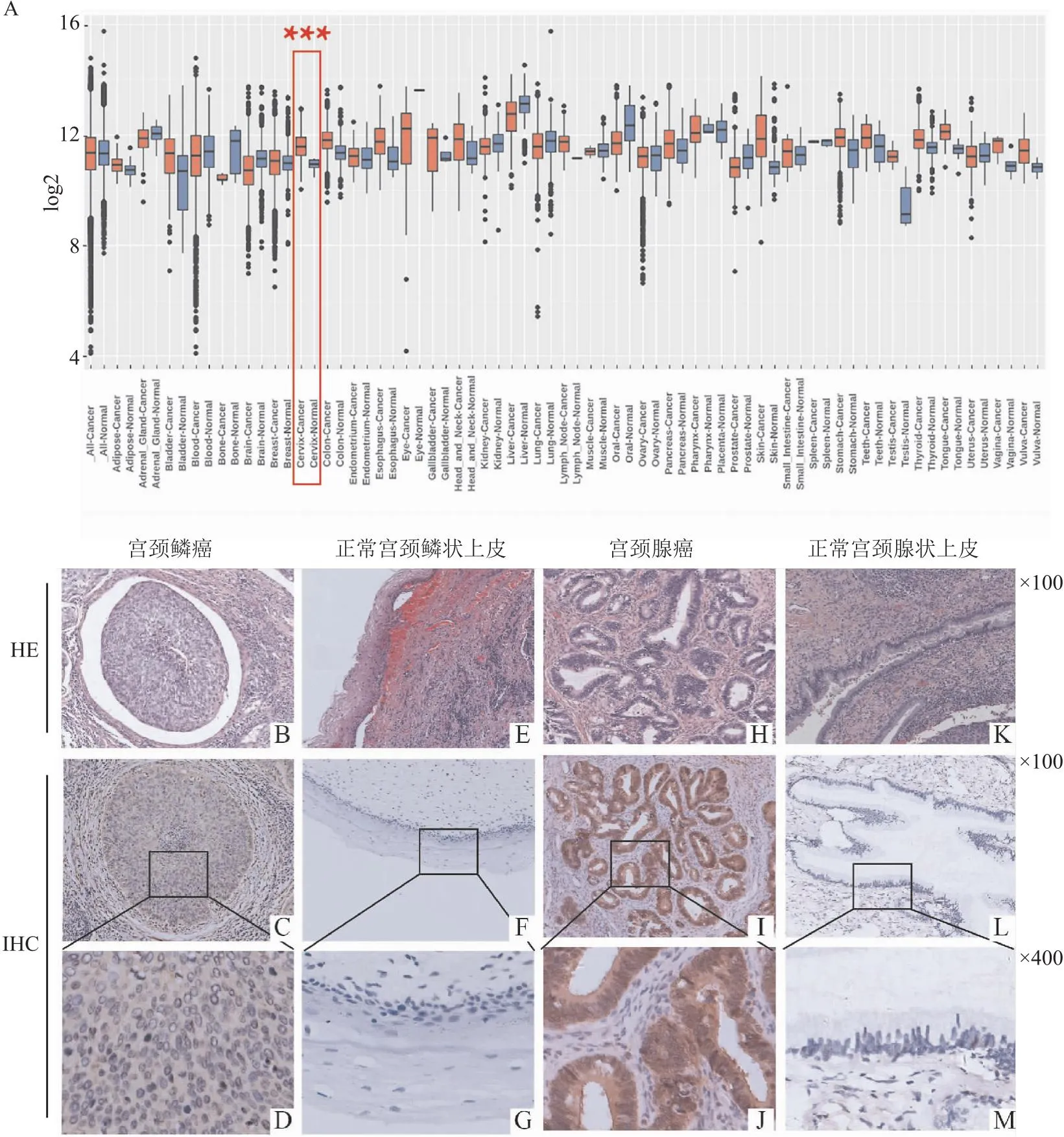
图1 正常宫颈组织和宫颈癌组织中GSTO1的mRNA和蛋白质表达情况
2.2 GSTO1表达与宫颈癌患者临床病理特征的关系DSI≥1/2、有LVSI、有淋巴结转移的宫颈癌患者肿瘤细胞中GSTO1高表达率高于DSI<1/2、无LVSI、无淋巴结转移的宫颈癌患者肿瘤细胞,差异均有统计学意义(P<0.05)。见表1。
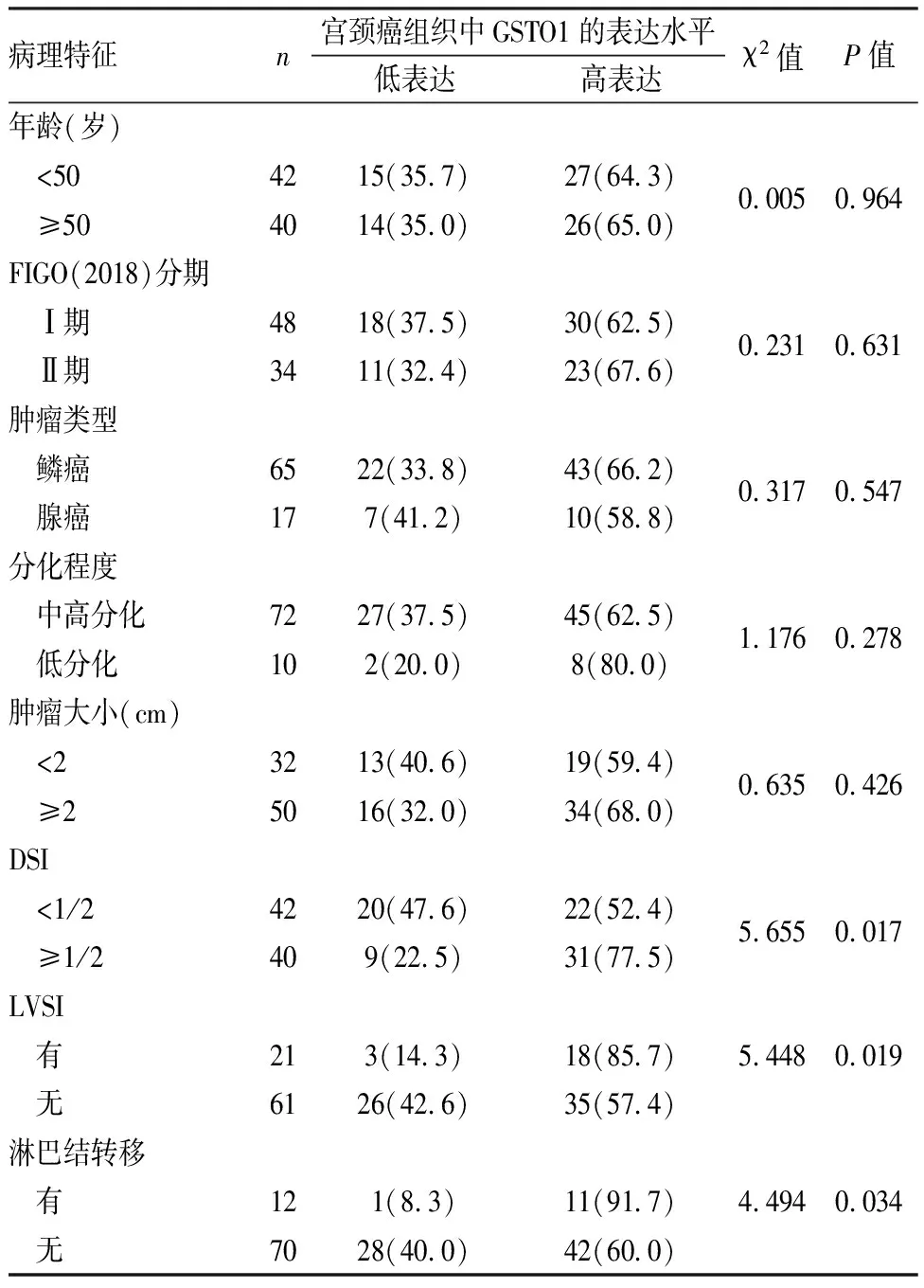
表1 GSTO1在宫颈癌组织肿瘤细胞中的表达与患者临床病理特征的关系[n(%)]
2.3 GSTO1高表达对宫颈癌患者预后的影响随访纳入研究的82例宫颈癌患者,随访截止时间是2022年10月25日,中位随访时间为60个月(9~144个月),其中12例(14.6%)失访,13例(15.8%)复发,12例(14.6%)死亡。Kaplan-Meier生存曲线显示,GSTO1高表达组的5年累计OS率(37.7%, 20/53)低于GSTO1低表达组的OS率(55.2%, 16/29),差异有统计学意义(P=0.029)。见图2A。单因素Cox回归分析结果显示,FIGO分期(HR: 5.678, 95%CI: 1.583~20.366,P=0.008)、间质浸润深度(HR: 3.806, 95%CI: 1.061~13.659,P=0.040)、淋巴结转移(HR: 0.147, 95%CI: 0.051~0.424,P<0.001)和GSTO1表达是影响宫颈癌患者OS(HR: 7.763, 95%CI: 1.013~59.484,P=0.049)的关键因素。见表2。多因素Cox回归分析显示,FIGO分期(HR: 4.125, 95%CI: 1.112~15.308,P=0.034)、DSI(HR: 6.113, 95%CI: 1.329~28.112,P=0.020)和淋巴结转移(HR: 4.749, 95%CI: 0.596~37.835,P=0.001)是影响宫颈癌患者OS的独立危险因素。见表2。
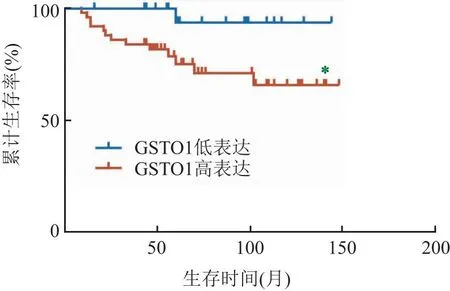
图2 宫颈癌肿瘤细胞中GSTO1不同表达的宫颈癌患者的生存曲线
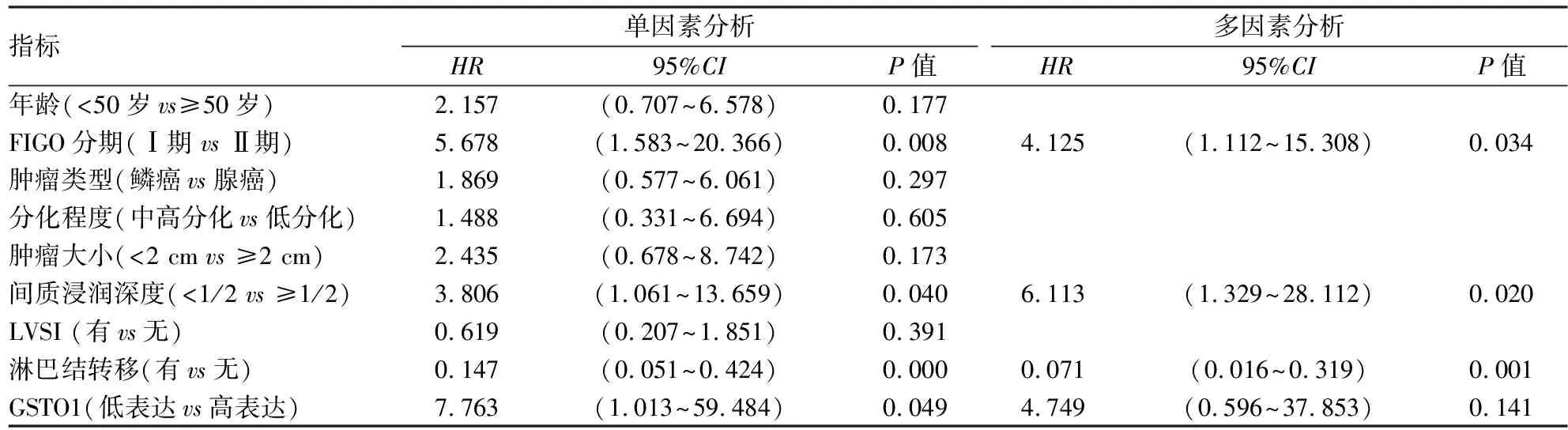
表2 宫颈癌患者OS的单变量和多变量Cox回归分析结果
2.4 宫颈癌HeLa细胞中GSTO1 N-糖基化定点突变对GSTO1表达量的影响根据NetNGlyc 1.0 Server数据库预测GSTO1潜在的N-糖基化修饰的氨基酸序列,其中N55(P=0.67)、N135(P=0.62)、N190(P=0.69)位N-糖基化修饰的阳性率较高(图3C)。用N-糖基化抑制剂衣霉素处理宫颈癌HeLa细胞,Western blot检测结果发现衣霉素(0.01 μg/ml)能够抑制癌细胞中GSTO1的蛋白表达(t=5.203,P<0.05)(图3A-B)。构建GSTO1 N-糖基化定点突变载体(图3D),通过慢病毒转染获得稳定表达GSTO1 N-糖基化定点突变的宫颈癌HeLa细胞,Western blot检测其GSTO1的蛋白表达量,结果显示N-糖基化定点突变组GSTO1的蛋白表达量明显降低(tN55Q=4.272,tN135Q=4.325,tN190Q=5.713,均P<0.05)(图3E-F)。
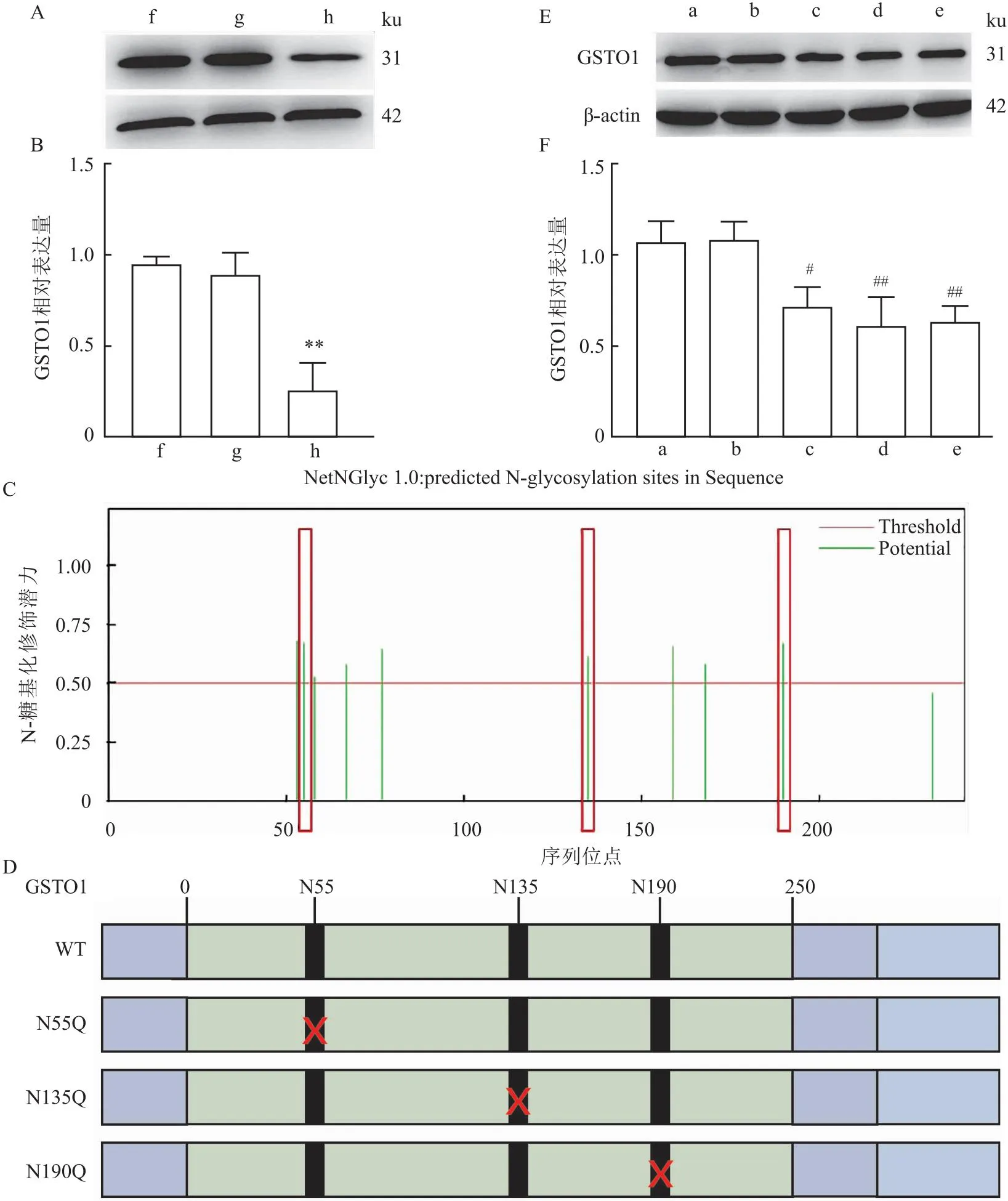
图3 GSTO1 N-糖基化定点突变对GSTO1表达量的影响
2.5 GSTO1 N-糖基化定点突变对宫颈癌HeLa细胞的增殖、迁移和侵袭能力的影响EdU增殖实验结果表明,与Vector组相比,N55Q、N135Q、N190Q三个突变组的细胞增殖能力下降(tN55Q=5.20,tN135Q=4.77,tN190Q=6.51,均P<0.001)(图4A-B)。Transwell侵袭和迁移实验结果显示,与野生型相比,GSTO1 N-糖基化定点突变对HeLa细胞迁移(tN55Q=8.89,tN135Q=10.68,tN190Q=17.55,均P<0.001)和侵袭(tN55Q=14.80,tN135Q=5.644,tN190Q=9.810,均P<0.001)能力具有抑制作用(图4C-E)。同时,划痕愈合实验结果显示,与野生型相比,突变组细胞迁移愈合能力降低(tN55Q=8.22,tN135Q=5.36,tN190Q=11.66,均P<0.001)(图4F-G)。

图4 GSTO1 N-糖基化定点突变对宫颈癌细胞增殖、迁移和侵袭能力的影响
2.6 GSTO1 N-糖基化定点突变对宫颈癌HeLa细胞的EMT转化的影响HeLa细胞中转染GSTO1 N-糖基化定点突变的慢病毒,Western blot检测EMT标志因子E-钙黏蛋白、N-钙黏蛋白和波形蛋白的表达发现,与野生型相比,GSTO1 N-糖基化定点突变均明显增强E-钙黏蛋白(tN55Q=163.70,tN135Q=61.22,tN190Q=153.40,均P<0.001)的表达,同时均明显抑制N-钙黏蛋白(tN55Q=2.49,tN135Q=8.87,tN190Q=10.24,均P<0.05)和波形蛋白(tN55Q=2.05,tN135Q=4.32,tN190Q=4.81,均P<0.05)的表达。见图5A-B。

图5 GSTO1 N-糖基化定点突变后EMT标志因子的蛋白表达及灰度值统计分析柱状图
3 讨论
在世界范围内,宫颈癌位居女性恶性肿瘤第4位[9],尽管宫颈癌的诊疗策略有所改善,但是宫颈癌的病死率仍在逐年增加,肿瘤侵袭与转移对宫颈癌的治疗具有阻碍作用。
GSTO1是GST家族中Omega类的成员之一,具有独特的半胱氨酸位点和多种还原酶活性[10]。GSTO1在结直肠癌[11]、非小细胞肺癌[12]、皮肤恶性黑色素瘤[10]等恶性肿瘤中高表达。其中研究[11]表明敲除结直肠癌肿瘤细胞的GSTO1可以提高其顺铂化疗效果,可能成为结直肠癌化学治疗的靶点。在非小细胞肺癌中,GSTO1可激活JAK/STAT3信号通路,促进癌细胞的增殖、侵袭、转移并抑制其凋亡[12]。此外,GSTO1可通过EMT促进皮肤黑色素瘤肿瘤细胞的侵袭转移[10]。本研究结果表明,与正常组织相比,GSTO1在宫颈癌组织肿瘤细胞中表达较高,其高表达与宫颈癌患者的DSI、LVSI和淋巴结转移等临床病理特征显著相关,且FIGO分期、DSI、淋巴结转移和GSTO1高表达是影响宫颈癌患者预后的关键因素。因此,GSTO1可能是一个潜在的靶点,可用于预测宫颈癌预后以及恶性程度,为肿瘤的诊疗带来了新思路。
蛋白质糖基化在恶性肿瘤等疾病中具有重要的意义,糖基化通过多种复杂的信号通路决定肿瘤性质。肿瘤细胞的凋亡、迁移、血管生成和肿瘤细胞外基质的黏附等均与糖基化有关[13]。本研究证实GSTO1的3个N-糖化修饰位点,即Asn55、Asn135、Asn190,并且发现突变其中任意一个糖基化位点均会导致GSTO1的表达水平降低,提示N-糖基化对于维持其表达水平密切相关。最新研究[14]报道,SGK196在乳腺癌细胞中主要发生N-糖基化修饰,且SGK196 N-糖基化通过PI3K/AKT/GSK3β信号通路发挥调控功能,在乳腺癌的侵袭和转移中发挥抑制作用。本研究通过EdU增殖实验、划痕愈合实验和Transwell实验表明,GSTO1 N-糖基化定点突变对宫颈癌细胞的增殖及侵袭迁移能力具有明显的抑制作用。以上均提示N糖基化修饰可参与不同肿瘤的增殖和转移。
EMT是肿瘤转移过程中的重要机制之一。在肿瘤侵袭转移中,EMT可以促进肿瘤细胞转变成为具有间充质特征的细胞,从而赋予肿瘤细胞更强的侵袭和转移能力。通过调控EMT的分子机制可以有效地抑制肿瘤细胞的侵袭转移,从而达到治疗肿瘤的效果。E-钙黏蛋白、N-钙黏蛋白和波形蛋白是EMT过程中的三个关键分子,它们分别代表了上皮细胞和间充质细胞的特征,在调控细胞形态和功能转变方面具有重要作用,对于EMT的发生和发展有着重要的意义[15]。本研究通过Western blot实验发现,去除GSTO1 N-糖基化修饰,可以增加E-钙黏蛋白的表达,抑制N-钙黏蛋白和波形蛋白的表达,表明GSTO1 N-糖基化定点突变可抑制宫颈癌细胞的EMT转化。
本研究揭示了GSTO1在宫颈癌组织肿瘤细胞中高表达及其与患者的不良预后相关。此外,GSTO1 N-糖基化参与宫颈癌的增殖和转移并且可能影响癌细胞中EMT的转化,这对于探讨宫颈癌侵袭转移发生的机制,寻求宫颈癌防治新策略,具有重要指导意义。但目前本研究尚未明确GSTO1 N-糖基化在宫颈癌侵袭转移过程中作用的特定分子机制,因此,未来需要进一步探究。

