阿司匹林诱发GSDME依赖性细胞焦亡对结肠癌细胞增殖的影响
司马学琴,苏延停,李成武
结肠癌是临床常见的恶性肿瘤之一,国外的一项流行病学研究[1]结果显示,其发病率为所有恶性肿瘤的前三位,且近年来发病率与病死率呈上升趋势,但目前对于结肠癌的发病机制仍不清楚。近期研究[2]显示其发生机制可能与结肠肿瘤组织中肿瘤干细胞的无限增殖和异常分化能力有关。由于肿瘤分子生物学近些年的快速发展,分子靶向治疗成为临床肿瘤治疗研究的热点,已经有越来越多的靶向治疗药物应用于临床[3]。阿司匹林对结肠肿瘤的预防作用已被逐渐证实,但其具体作用机制尚未阐明[4]。细胞焦亡是一种依赖于白介素-1β(interleukin-1β,IL-1β)转化半胱氨酸蛋白酶-1(cysteinyl aspartate and specific proteinase 1,Caspase-1)、多种炎症因子为诱因的细胞死亡形式[5],研究[6]表明辛伐他汀通过触发焦孔素E(Gasdermin E,GSDME)介导的细胞焦亡引起胃癌细胞死亡,但目前尚无关于阿司匹林能否通过诱发GSDME依赖性细胞焦亡从而影响结肠癌细胞增殖的研究。因此本研究通过分子生物学技术分析阿司匹林对结肠癌细胞增殖的影响及这一过程与GSDME依赖性细胞焦亡的相关性,为结肠癌的分子靶向治疗提供一定的理论依据。
1 材料与方法
1.1 主要材料与试剂阿司匹林(货号:A2093)购自美国sigma公司,人结肠癌Caco-2细胞购自上海中科院细胞库;MTT分析试剂盒(货号:ab211091)购自Abcam(上海)贸易有限公司;乳酸脱氢酶(Lactate dehydrogenase,LDH)释放检测试剂盒(货号:C0016)购自上海碧云天生物技术有限公司;IL-1β、白介素-18(interleukin-18,IL-18)酶联免疫吸附试验检测试剂盒(货号:EK101BHS、EK118)购自北京中杉金桥公司;一抗NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)(货号:bs-41293R)、Caspase-1(货号:bs-20616R)及山羊抗兔IgG二抗(货号:bs-40295G)购自北京博奥森生物技术有限公司;一抗GSDME-N(货号:ab215191)购自Abcam(上海)贸易有限公司;内参β-actin抗体(货号:bb-2101)购自上海贝博生物科技有限公司;GSDME siRNA购自北京华泰亿康生物科技有限公司;胎牛血清(货号:12483020)及DMEM培养基(货号:11965092)购自美国Gibco公司,蛋白免疫印迹试验(Western blot)相关试剂和胰蛋白酶-EDTA混合液(货号:C0201)购自上海碧云天生物技术有限公司;LipofectaminTM2000(货号:11668030)转染试剂购自美国赛默飞世尔科技公司。
1.2 主要仪器恒温培养箱(型号:HHCP-160S)购自沃尔福(上海)实业有限公司;倒置显微镜(型号:CKX41)购自日本OLYMPUS公司;高速离心机购自上海医用分析仪器厂(型号:TGI-16);实时荧光定量PCR仪(型号:CFX Connect)、电泳仪(型号:1658033)与转膜仪(型号:Trans-Blot Turbo)购自美国伯乐公司;全自动凝胶成像分析系统(型号:GeneGenius)购自美国SYGENE公司。
1.3 方法
1.3.1细胞培养 在培养皿中用含10%胎牛血清的DMEM培养基培养Caco-2细胞,置于CO2含量为5%的37 ℃恒温培养箱中培养,饱和湿度。传代条件:培养2~3 d,细胞密度>80%。用胰蛋白酶-EDTA混合液消化传代后培养。细胞处于对数生长期时进行实验。
1.3.2MTT法检测细胞增殖活性 取对数生长期的细胞,以每孔约5×103个细胞的密度接种到96孔细胞培养板上进行培养,待细胞贴壁后,倒去原培养基,分别加含有不同浓度的阿司匹林(1.0、2.5、5.0、10.0、15.0、20.0 mmol/L)的培养基继续培养,同时加入等量原培养基作为空白对照组,每组设3个复孔,继续培养48 h后取出细胞培养板,每孔中避光加入20 μl的MTT粉剂溶液,置于培养箱中培养4 h后取出,用PBS溶液轻轻洗涤,加入20 μl的DMSO溶液,使用酶标仪在570 nm波长下测量吸光度值,生长抑制率=(1-实验组吸光度值/对照组吸光度值)×100%。根据实验结果,选择细胞生长抑制率达平台期的浓度用作后续实验。
1.3.3转染 当15 mmol/L阿司匹林处理好的Caco-2细胞培养密度达到50%后进行siRNA沉默GSDME(siRNA-GSDME)操作,按LipofectamineTM2000转染试剂说明书进行转染,转染后继续培养细胞48 h后进行实验。
1.3.4显微镜下观察细胞形态 取处于对数生长期的细胞,接种到6孔板中,并立即放在培养箱中,待细胞贴壁后,用15 mmol/L阿司匹林处理后继续培养48 h,后期沉默GSDME基因,在显微镜下观察各组细胞形态。
1.3.5LDH释放实验 收集15 mmol/L阿司匹林处理好的细胞和对照组细胞,1 000 r/min离心5 min,吸取各孔中的上清液,按步骤依照试剂盒说明书测定LDH释放量。
1.3.6Western blot检测蛋白表达水平 收集15 mmol/L阿司匹林处理好的细胞和对照组细胞,加入RIPA 裂解液,置于冰上裂解30 min,在高速离心机4 ℃条件下以12 000 r/min离心10 min,吸取上清液提取总蛋白,用BCA法测定各组细胞蛋白浓度,各组加入缓冲液后放入100 ℃沸水中水煮变性后备用。按每孔30 μg蛋白上样,凝胶电泳并湿转法转膜到PVDF膜上,5%脱脂牛奶室温封闭2 h,分别加入NLRP3(1 ∶1 000)、Caspase-1(1 ∶1 000)、GSDME-N(1 ∶1 000)及β-actin(1 ∶500)抗体,4 ℃孵育10 h,加入山羊抗兔二抗(1 ∶5 000)室温孵育1 h后,用TBST溶液洗膜3次,涂上发光显影液用显影仪拍照,用ImageJ软件分析相应灰度值。
1.3.7ELISA法检测细胞上清液中IL-1β和IL-18的含量 将收集到的处理后的Caco-2细胞悬液以1 000 r/min离心5 min后,收集15 mmol/L阿司匹林细胞和对照组细胞上清液,依照ELISA试剂盒说明书按步骤测定IL-1β和IL-18的含量。
2 结果
2.1 不同浓度阿司匹林对Caco-2细胞增殖活性的影响给予不同浓度的阿司匹林分别处理Caco-2细胞48 h,采用MTT法检测增殖抑制率,结果显示:48 h不同浓度组细胞增殖抑制率分别为(5.80±0.68)、(11.22±0.93)、(21.14±1.26)、(35.52±1.54)、(50.34±0.69)、(50.66±1.83)。与1.0 mmol/L组相比,2.5 mmol/L组细胞增殖抑制率增加(t=7.627,P<0.05);与2.5 mmol/L组相比,5.0 mmol/L组细胞增殖抑制率增加(t=7.310,P<0.05);与5.0 mmol/L组相比,10.0 mmol/L组细胞增殖抑制率增加(t=9.975,P<0.01);与10.0 mmol/L组相比,15.0 mmol/L组细胞增殖抑制率增加(t=10.215,P<0.01),提示阿司匹林表现出一定剂量依赖性抑制Caco-2细胞的增殖。当浓度超过15.0 mmol/L后其浓度效应达到平台期,与15.0 mmol/L组相比,20.0 mmol/L组对细胞增殖抑制无差异(t=1.061,P>0.05)。见图1。
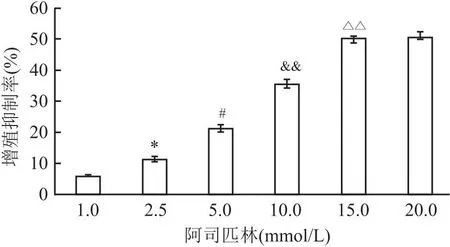
图1 不同浓度阿司匹林对Caco-2细胞增殖抑制作用的比较
2.2 阿司匹林对Caco-2细胞焦亡的影响用浓度为15 mmol/L的阿司匹林的培养基培育Caco-2细胞48 h,在显微镜下观察细胞的形态变化,并应用LDH 释放检测试剂盒检测细胞上清液中LDH含量。结果如图2A所示,与对照组相比,阿司匹林组细胞数目减少,并且能够明显观察到细胞膜出现肿胀甚至破裂现象和细胞膜内容物流出等典型的细胞焦亡形态学特征。如图2B所示, 应用阿司匹林后细胞上清中LDH 的含量增加(t=6.738,P<0.05)。
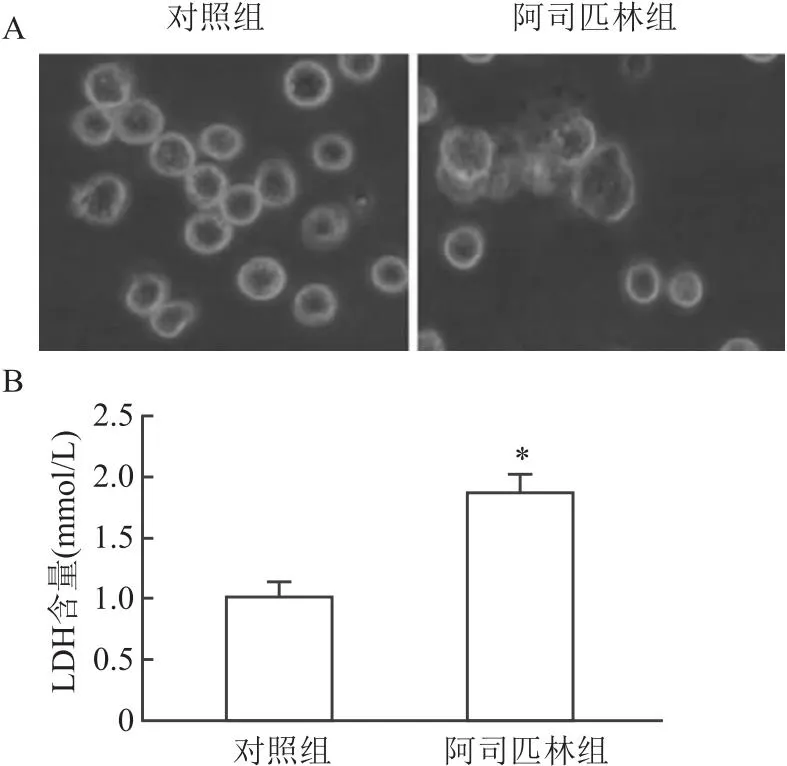
图2 阿司匹林对Caco-2细胞形态和细胞上清中LDH含量的影响
2.3 阿司匹林对Caco-2细胞中焦亡相关因子表达的影响Western blot结果显示如图3所示,与对照组相比,阿司匹林组能明显提升Caco-2细胞中焦亡相关基因NLRP3、Caspase-1、GSDME-N蛋白表达水平(tNLRP3=6.479,tCaspase-1=6.293,tGSDME-N=5.704,均P<0.05)。
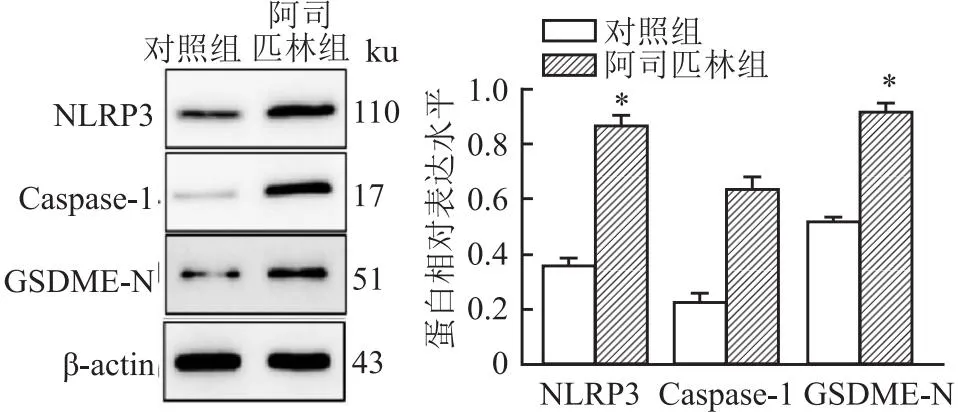
图3 阿司匹林对Caco-2细胞焦亡相关蛋白表达的影响与对照组比较:*P<0.05
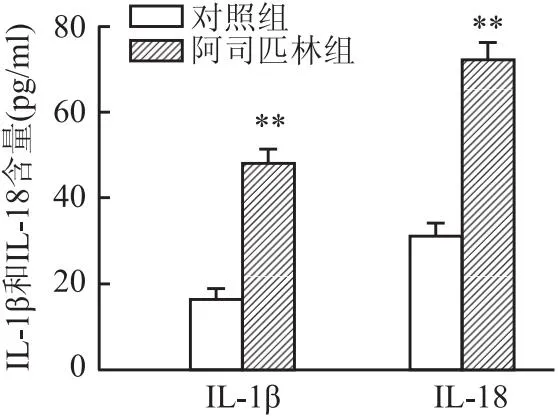
图4 阿司匹林对Caco-2细胞上清中IL-1β、IL-18含量的影响与对照组比较:**P<0.01
2.4 阿司匹林对Caco-2细胞上清中IL-1β与IL-18的影响ELISA结果如图5所示,与对照组相比,阿司匹林能够明显提升Caco-2细胞中焦亡相关因子IL-1β与IL-18的水平(tIL-1β=11.357,tIL-18=12.953,均P<0.01)。
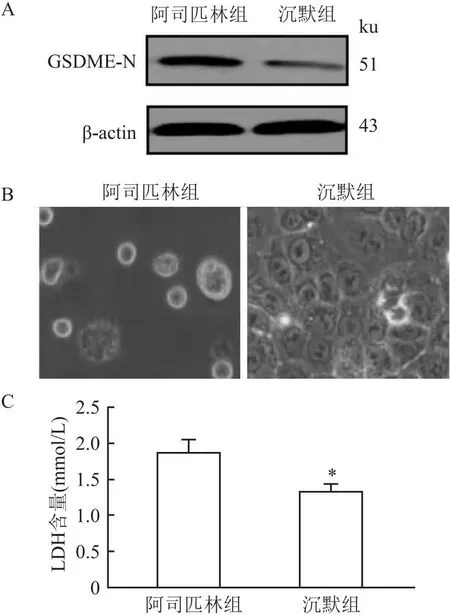
图5 沉默GSDME对Caco-2细胞焦亡的影响
2.5 沉默GSDME对Caco-2细胞焦亡的影响使用siRNA-GSDME沉默Caco-2细胞(阿司匹林处理浓度为15 mmol/L)中的GSDME,Western blot结果显示, GSDME的关键剪切片段GSDME-N处于低表达状态,提示GSDME沉默成功(图5A);沉默组较15 mmol/L阿司匹林组细胞增加,细胞膜较为完整,细胞破裂少见,细胞上清中LDH 的含量明显降低(t=6.258,P<0.05)。见图5B、C。
2.6 沉默GSDME后对Caco-2细胞上清中IL-1β与IL-18的影响ELISA结果显示,与阿司匹林组相比,沉默GSDME明显抑制焦亡相关因子IL-1β与IL-18的水平(tIL-1β=9.953、tIL-18=11.026,均P<0.01)。见图6。
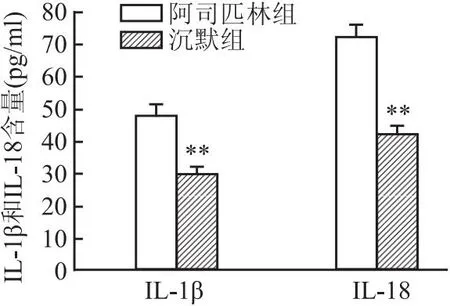
图6 沉默GSDME对IL-1β、IL-18含量的影响与阿司匹林组比较:**P<0.01
3 讨论
结肠癌作为我国常见的恶性肿瘤,严重影响患者的健康,早期诊断与治疗是改善结肠癌患者预后的关键。近些年来,由于传统治疗方式的局限性以及人们对恶性肿瘤分子生物学研究的深入,分子靶向治疗已成为新的研究方向。阿司匹林是一种临床常用的非甾体抗炎药,除了抗风湿及预防心脑血管疾病意外,研究[7]表明,长期低剂量使用阿司匹林能够降低结肠癌的发病率,因此被临床推荐应用于抗结肠癌的预防治疗中。现代药理学研究证实阿司匹林具有抗炎与抗肿瘤免疫作用,但机制尚未完全明确,可能与炎症反应可以刺激肿瘤细胞的发生与转移有关[8]。本研究通过给予含有不同浓度阿司匹林的培养基培养干预结肠癌Caco-2细胞,结果显示阿司匹林对于Caco-2细胞增殖活性的抑制具有时间与浓度依赖性,说明阿司匹林能够抑制其增殖,但机制尚未明确。
细胞程序性死亡包括细胞凋亡、坏死及焦亡等[9]。与凋亡及坏死不同,细胞焦亡是由半胱氨酸天冬酶Caspase家族介导的细胞程序性死亡,当细胞受到外源刺激时,细胞内形成NLRP3炎症小体,从而活化Caspase-1,切割Gasdermin家族的GSDMD与GSDME[10]。当GSDME被切割后会产生GSDME-N片段,研究[11]表明GSDME-N具有在细胞膜上成孔的特性,导致细胞焦亡发生。当细胞焦亡发生时,细胞膜肿胀破裂、细胞核皱缩、包含炎性因子的细胞内容物向胞外释放。Caspase-1的结构中包括3个结构域,其中一个结构域可与炎性体中的衔接蛋白发生相互作用,进而将炎性细胞因子 pro-IL-1β和 pro-IL-18切割裂解成响应免疫细胞中的炎性刺激的活性形式IL-1β和IL-18。当细胞焦亡发生时,细胞内容物中含有大量炎症因子IL-1β和IL-18,并会随着细胞膜破裂而流出[12]。本研究结果显示,使用含有阿司匹林的培养基干预,能明显增加Caco-2细胞中NLRP3、Caspase-1、GSDME等基因的蛋白表达,提高Caco-2细胞上清液中IL-1β及IL-18的含量,说明这一过程中有细胞焦亡发生。此外本研究结果显示,在使用含有阿司匹林的培养基培养Caco-2细胞后细胞上清中LDH水平明显上升,提示细胞膜完整性发生了破坏,进一步说明了细胞焦亡可能参与了阿司匹林对Caco-2细胞的作用过程。
有研究报道称,GSDME在胃癌[13]和乳腺癌[14]中的表达被沉默,表明GSDME可能在癌症进展中发挥抑癌作用。本研究结果显示,在正常Caco-2细胞中GSDME的关键剪切片段GSDME-N蛋白处于低表达状态,而给予使用含有阿司匹林的培养基培养干预后GSDME的蛋白表达量明显上升,同时给予阿司匹林干预后Caco-2细胞数目明显减少,并且能够明显观察到细胞膜出现肿胀甚至破裂,细胞膜内容物流出等典型的细胞焦亡形态学特征。当通过siRNA沉默GSDME后细胞上清液中LDH释放减少,说明细胞膜破裂程度减轻,且细胞形态少见细胞焦亡形态学特征,进一步说明了GSDME是焦亡发生过程中的关键,而阿司匹林或许能通过诱发GSDME依赖性细胞焦亡发挥抗肿瘤细胞增殖的作用。

