SP1在食管鳞癌组织中的表达及其对食管鳞状细胞增殖和凋亡的影响
黄红芳,卢香云,孙梦菲,崔晓宾,2
食管癌是我国最常见的恶性肿瘤之一[1],生存预后较差,仅不到20%的患者生存时间超过5年[2]。虽然食管癌治疗方法多样,但外科手术仍是食管癌治疗最有效的方式[3],然而术后预后效果不佳,存在严重的术后不良反应[4]。研究[5]发现,特异性蛋白(specific protein, SP)是一个重要的转录因子家族,其包括SP1、SP2和SP3。SP1是第一个在哺乳动物中被鉴定和克隆的SP家族蛋白,SP1作为靶基因表达的调节剂可与功能蛋白特别是转录因子相互作用参与调控多种生物过程。SP1还参与癌基因、抑癌基因的表达,影响细胞生长、凋亡、分化等多种细胞基本功能,在多种肿瘤中高表达,并且与患者的不良预后有关[6]。然而,SP1在食管鳞癌发生发展中的作用尚不明确,有待进一步研究。该研究旨在探讨转录因子SP1在食管鳞癌中的表达及其对食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)细胞生物学功能的影响,分析其与ESCC患者生存预后的关系,从而为ESCC患者的临床预后提供实验依据。
1 材料与方法
1.1 材料
1.1.1病例资料 该研究收集了喀什第一人民医院、乌鲁木齐市自治区人民医院、石河子大学医学院第一附属医院3所医院2015年—2016年间的食管鳞癌石蜡包埋组织标本121例。由石河子大学医学院第一附属医院病理科两位专家审查确诊为食管鳞状细胞癌,依照第8版食管癌分期标准对组织样本进行TNM分期,所有患者均已签署知情同意书(伦理学批号:shzu2015CG09),通过电话等联系方式随访至2022年5月。
1.1.2细胞系、试剂与仪器 食管鳞癌细胞系(Eca109货号:iCell-h056、EC9706货号:YS105C)购自中国科学院北京细胞库;无血清1640培养基(货号:IMC-202)购自厦门逸漠生物科技有限公司;兔抗人SP1单克隆抗体购自英国艾博抗贸易有限公司(货号:ab231778);EDTA修复液(货号:abs9247)购自北京爱必信生物科技有限公司;SP siRNA(小干扰RNA)购自上海吉玛公司sense sequence:CCAGCA-ACAUGGGAAUUAUdTdT anti-sense sequence:AUA-AUUCCCAUGUUGCUGGdTdT;BSA封闭液(货号:SW3015)购自北京索莱宝科技有限公司;LiP 2000转染试剂(货号:18324012)购自上海invitrogen生命技术公司;CCK-8试剂盒(货号:C0042)、凋亡试剂盒(货号:70-AP101-100)分别购自日本同仁和联科生物。高压锅(型号:7970A)购自上海仪涛生物仪器有限公司;CO2细胞培养箱(型号:I-5110-230V)、差速离心机(型号:Sorvall ST40)均购自美国赛默飞世尔科技公司;光学显微镜(型号:CX23 双目)购自日本Olympus公司;转膜仪(型号:DYC-Mini4)、电泳仪(型号:1658033)均购自美国伯乐生命医学产品有限公司;流式细胞仪(型号:FACSCanto Ⅱ)购自美国BD公司。
1.2 方法
1.2.1免疫组化法染色及结果判定 利用免疫组织化学实验法对收集的组织蜡块进行切片、烘干后依次进行脱蜡、脱二甲苯、脱酒精,随后将切片放进盛满EDTA修复液的塑料盒内置于高压锅行高温高压修复,并在室温条件下进行冷却降温,BSA封闭液37 ℃下封闭反应30 min,去除废液后4 ℃孵育一抗(1 ∶1 200)过夜,第二天在37 ℃恒温箱中复温完成后用PBS冲洗滴加二抗(1 ∶1 000)恒温箱孵育2 h,再次冲洗后进行显色、复染和酸酒精的分化,最后树胶封片后于光学显微镜下观察结果,取相应组织做阳性对照,用PBS溶液代替一抗做阴性对照。SP1主要定位于细胞核,核染棕黄色为阳性。根据阳性细胞所占百分比计分:<5%计0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,76%~100%记4分。根据阳性细胞着色强度计分:无着色计0分,黄色计1分,棕黄色计2分,棕色计3分。两个判定标准相乘≤8分为低表达,>8分为高表达。结果由两名以上经验丰富的病理学医师评定,意见不一致时由上级医师做最终评定计分并录入统计学软件。
1.2.2细胞转染 细胞计数完成后,将Eca109和EC9706细胞分为si-Control组和si-SP1组(Western blot实验设置3组转染浓度:100、120、140 nmol/ml)并均匀接种于6孔中,待细胞密度达70%~80%时进行转染,将转染试剂(5 μl liP 2000)、SP1 siRNA(14 μl、sense sequence:CCAGCAACAUGGGAAUUAUdTdT anti-sense sequence:AUAAUUCCCAUGUUGCUGGdTdT)分别加入125 μl的无血清1640培养基中混匀,活化20 min后移至孔板内。
1.2.3Western blot实验 将转染好的细胞进行蛋白的提取:将配好的裂解液(PMSF:RIPA裂解液=1:100)覆盖孔板,于4 ℃冰箱孵育30 min,用细胞刮板将孔板内的细胞刮下,移至EP管中,置于差速离心机(12 000 r/min)内离心15 min后取出,计算体积并煮沸,按照制胶-电泳-上样-转膜-封闭-孵育一抗(1 ∶1 000)8 h-孵育二抗(1 ∶10 000)2 h-洗膜步骤依次操作,最后于避光室内滴加化学发光试剂进行显色。
1.2.4克隆实验 通过CCK-8细胞增殖实验检测两组食管鳞癌细胞系的集落形成能力,将转染后的细胞(400~500个)均匀接种到12孔培养板中培养10~14 d,间隔3 d进行换液,观察细胞生长情况。待克隆集落形成后,移除废液,PBS清洗,孔板内加入多聚甲醛固定30~40 min,染色完成后拍照,利用ImageJ软件进行计数。
1.2.5CCK-8细胞增殖实验 通过CCK-8细胞增殖实验检测两组食管鳞癌细胞系的增殖能力。将转染好的si-Control组,si-SP1组和空白对照组(仅培养基)消化离心接种至96孔板内,并于每个时间点(0、24、48、72、96 h)铺一个96孔板,每组设置5个复孔,分别于0、1、2、4、5 d后于避光条件下在各孔内依次加入10 ul CCK-8试剂,作用2 h后,上机(避光)检测450 nm波长处吸光度值。
1.2.6流式细胞术 利用流式细胞术检测两组食管鳞癌细胞系的凋亡能力,于12孔板内进行转染(计数后每孔细胞数约1×104);待转染48 h后,把5 μl的 PI及10 μl的 FITC加于处理好的细胞中(空白组不加),避光5 min,在每个流式管中加入2 ml PBS及处理好的细胞,上机检测,记录结果。
1.3 统计学处理应用SPSS 25.0统计软件处理数据;计数资料采用绝对数(%)表示,计数资料组间比较采用χ2检验;正态分布计量资料组间比较采用独立样本t检验,不服从正态分布计量资料组间比较采用非参数检验;绘制SP1表达与食管鳞癌关系的Kaplan-Meier生存曲线图, log-rank检验用作生存曲线的比较;Cox回归分析评定相关指标能否作为独立预后因子。P<0.05为差异有统计学意义。
2 结果
2.1 SP1在食管鳞癌及癌旁正常组织中的表达情况免疫组化结果显示食管鳞癌癌旁正常组织(图1A、B)、食管鳞癌组织中SP1均定位于细胞核(图1C、D)。食管鳞癌组织和癌旁正常组织中SP1蛋白表达阳性率分别为26.4%和1.4%。癌组织中SP1的蛋白表达阳性率高于癌旁正常组织(χ2=20.568,P<0.001)。

表1 SP1在食管鳞癌与癌旁正常组织中的表达
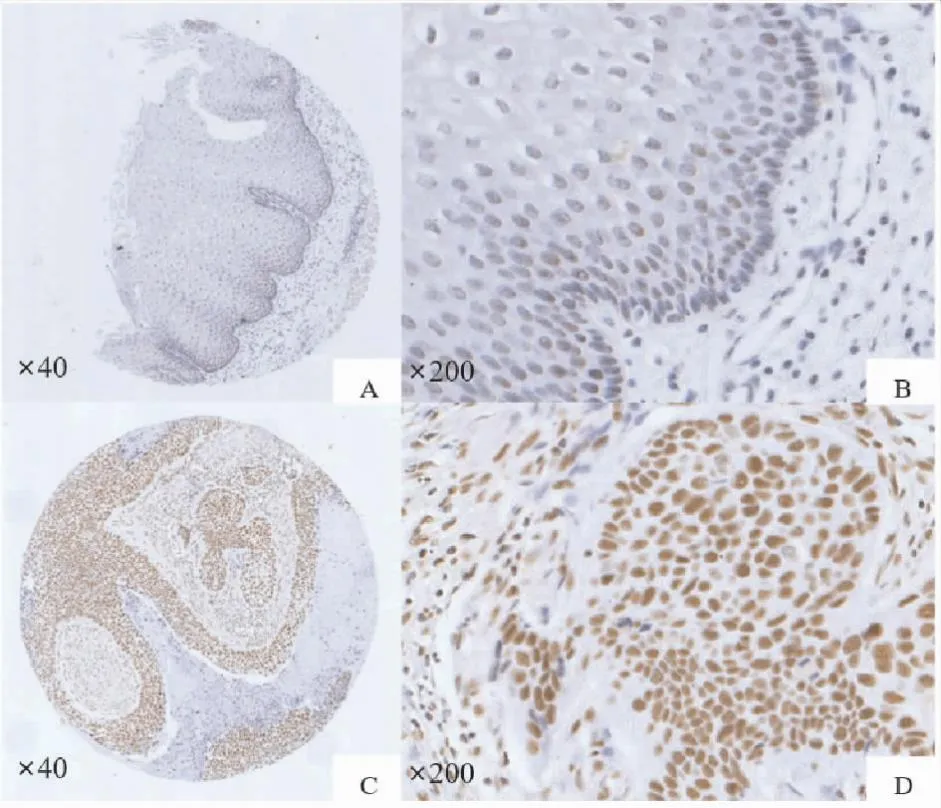
图1 食管鳞癌癌旁正常组织与食管鳞癌组织中SP1蛋白的表达情况
2.2 食管鳞癌组织中SP1蛋白表达与临床病理特征之间的关系食管鳞癌组织中,SP1蛋白在女性、中低分化、浸润深度T3~T4级的高表达率高于食管鳞癌癌旁正常组织(均P<0.05),差异具有统计学意义。见表2。
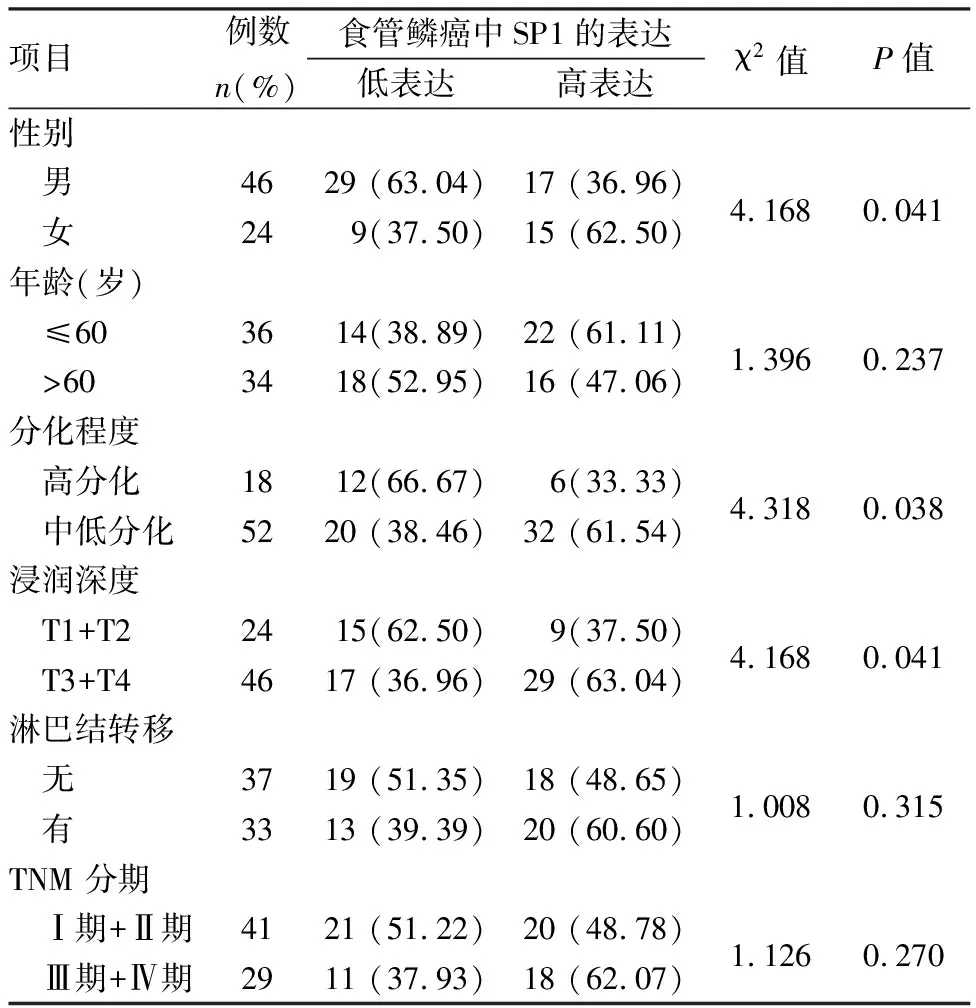
表2 食管鳞癌患者不同临床病理特征中SP1蛋白表达的比较
2.3 SP1蛋白表达与食管鳞癌患者生存预后的关系通过生存曲线结果图可以发现,食管鳞癌患者中SP1蛋白高表达的患者生存时间低于SP1低表达的患者(P=0.048)。见图2。单因素Cox回归分析显示,淋巴结转移(P=0.004)和TNM分期(Ⅲ+Ⅳ)(均P<0.01)是影响食管鳞癌患者生存时间的危险因素,多因素Cox回归显示TNM分期(Ⅲ+Ⅳ)是影响患者生存期的独立危险因素(P<0.001)。见表3。
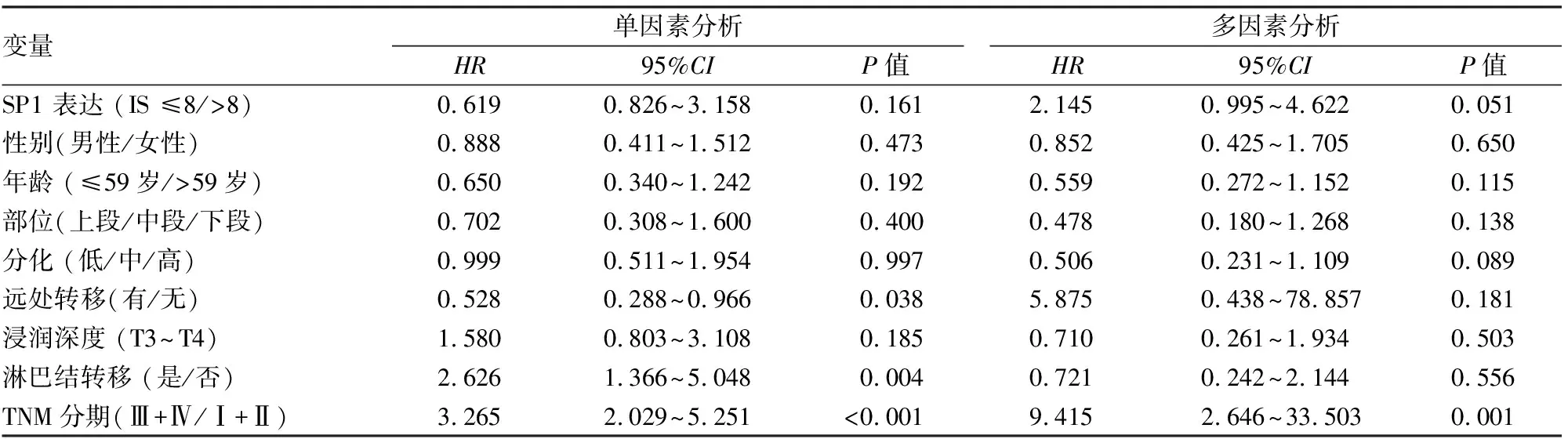
表3 食管鳞癌患者生存预后独立危险因素单、多因素Cox回归分析

图2 SP1蛋白的表达情况与食管鳞癌患者预后关系的生存曲线图
2.4 沉默SP1后食管鳞癌细胞的SP1蛋白表达情况为摸索SP1 siRNA的最佳的作用浓度,我们选取食管鳞癌Eca109细胞系进行Western blot实验,以检测不同SP1 siRNA浓度(100、120、140 nmol/ml)作用下SP1的表达水平。结果显示,与对照组相比,转染浓度在140 nmol/ml、作用48 h的Western blot 条带最浅,沉默效果最佳(图3)。

图3 不同SP1 siRNA浓度转染Eca109细胞系后SP1蛋白的表达
2.5 沉默SP1对食管鳞癌细胞增殖的影响CCK-8细胞增殖实验结果显示,沉默SP1后,食管鳞癌Eca109细胞系培养至48 h时,si-SP1组与si-Control组的细胞增殖能力开始出现明显差异(t=5.377,P<0.001);而对于食管鳞癌EC9706细胞系,在沉默SP1后培养至24 h时,增殖能力就已出现明显差异(t=2.340,P=0.047);随着培养时间的延长,待细胞培养至96 h时,食管鳞癌Eca109细胞系(t=8.722,P<0.001)和EC9706细胞系(t=8.635,P<0.001)中si-SP1组的细胞增长能力均低于si-Control组(图4)。平板克隆实验结果同样提示,食管鳞癌Eca109细胞系中,si-SP1组的集落形成能力明显低于si-Control组(t=6.332,P<0.001),在食管鳞癌EC9706细胞系中,si-SP1组的集落形成能力低于si-Control组(t=7.690,P<0.001,图5)。以上实验结果表明沉默SP1可以抑制食管鳞癌细胞的增殖。

图4 沉默SP1后食管鳞癌细胞(Eca109、EC9706)的增殖能力
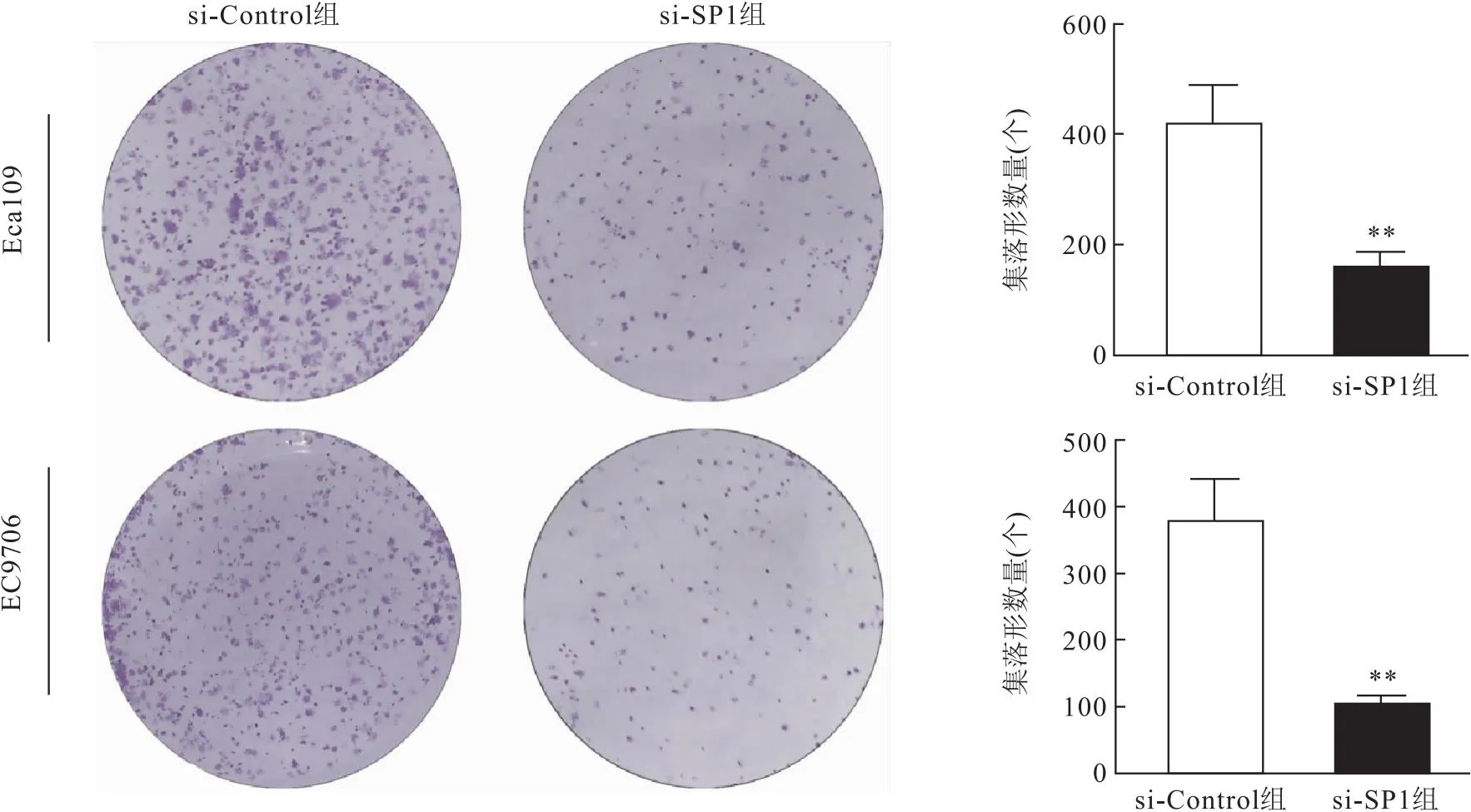
图5 沉默SP1后食管鳞癌细胞(Eca109、EC9706)的集落形成能力
2.6 沉默SP1对食管鳞癌细胞凋亡的影响在食管鳞癌Eca109细胞系中,si-SP1组凋亡指数(16.38±4.01)高于si-Control组凋亡指数(6.72±2.68),差异具有统计学意义(t=3.69,P<0.05);在食管鳞癌EC9706细胞系中,si-SP1组凋亡指数(11.77±3.31)高于si-Control组凋亡指数(5.80±2.18),差异具有统计学意义(t=4.91,P<0.001)。提示沉默SP1蛋白可以促进食管鳞癌细胞的凋亡。见图6。
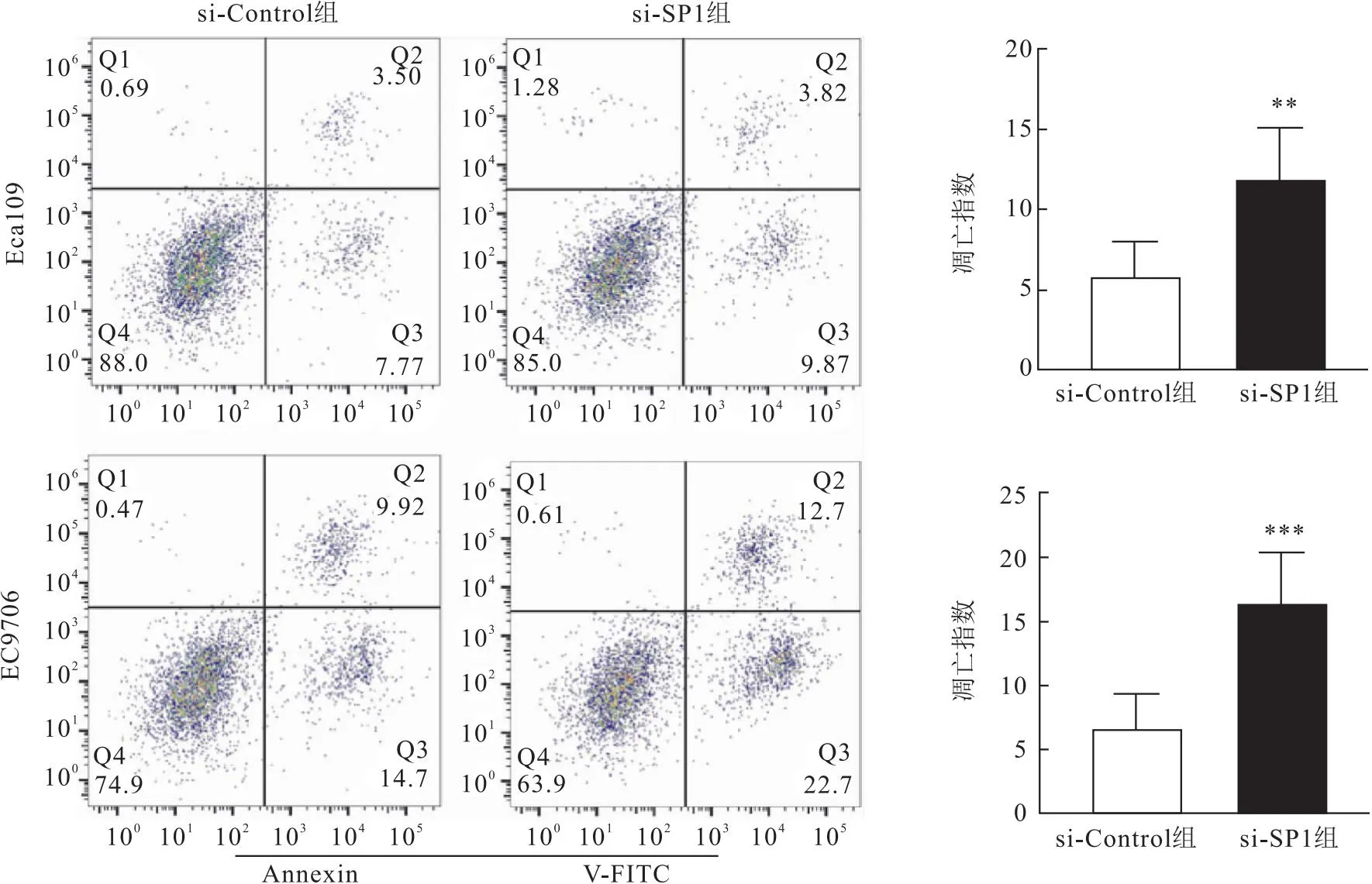
图6 沉默SP1后食管鳞癌细胞(Eca109、EC9706)的凋亡能力
3 讨论
食管鳞状细胞癌在肿瘤中具有较高的发生率,生存预后较差,缺乏有效的治疗方案[7]。食管癌的发生发展机制较为复杂,与多种影响因素相关[8],探索食管鳞癌发生发展的机制以寻求食管鳞癌新型治疗手段已成为当前研究的目标。截止目前,SP1蛋白在食管鳞癌组织中的表达及其对食管鳞癌细胞增殖、凋亡的生物学行为影响的研究较少。在本研究中,免疫组化发现SP1在食管鳞癌组织中的表达高于癌旁正常组织,且主要表达在食管鳞癌组织的细胞核内。SP1蛋白在女性、低中分化及浸润深度T3~T4级的食管鳞癌组织中表达率更高,Cox单因素回归分析提示有远处转移、淋巴结转移和TNM分期是影响食管鳞癌患者生存时间的危险因素,TNM分期是影响患者生存期的独立危险因素。
SP家族转录因子在多种细胞过程中起着至关重要的作用,SP1、SP3和SP4调控多种癌症相关的基因,这些基因参与细胞周期、细胞增殖、细胞分化和凋亡[9]。有研究[10]表明,转录增强因子1可以通过激活SP1促进结直肠癌细胞增殖。此外,SP1还可以与RasGRP1启动子结合,促进其转录,进而诱导肝细胞的增殖[11]。另有研究[12]证明,甘草查尔酮A通过下调SP1的表达诱导口腔鳞癌细胞的凋亡。本研究利用SP1 siRNA转染食管鳞癌Eca109和EC9706细胞系,通过CCK-8细胞增殖试验、克隆实验发现si-SP1组的细胞增殖能力及集落形成能力明显低于si-Control组,si-SP1组的细胞凋亡指数明显高于si-Control组。本研究在Eca109和EC9706两株食管鳞癌细胞系中验证了SP1蛋白对食管鳞癌细胞增殖及凋亡,补充了SP1蛋白在食管鳞癌发生发展过程中关系的相关研究。有研究[13]表明在食管鳞癌中长链非编码RNA FGD5-AS1作为microRNA-383上的竞争内源性RNA,可通过增加SP1的表达来增强食管鳞状细胞癌的恶性特征,这与本研究的结果一致。这些研究提示,SP1具有促进食管鳞癌发生发展的作用。
综上所述,本研究表明SP1在食管鳞癌组织中高表达,并且沉默SP1能够抑制食管鳞癌细胞的增殖和凋亡,SP1可能成为食管鳞癌潜在的分子治疗靶点。但是SP1在食管鳞癌组织中高表达的分子机制尚未明确,未来将通过细胞学实验和动物实验进一步探究SP1在食管鳞状细胞癌中表达的发生机制,更深层次探索SP1在食管鳞癌进展中的作用。

