miR-125b对肝脏血管新生调控作用的实验研究
王佳慧,郑 洋,汪 磊,黄艳青,段雪琳,刘艳芳,赵铁建,梁天坚
肝纤维化(hepatic fibrosis, HF)是肝脏对慢性损伤的应答反应,以细胞外基质(extracellular matrix, ECM)大量沉积为特征[1]。当肝脏受到损伤,肝窦内皮细胞(hepatic sinusoid endothelial cell, HSEC)表型会改变,导致分化抗原簇31(cluster of differentiation 31,CD31)、血管性血友病因子(von Willebrand factor, vWF)以及层粘连蛋白(laminin, LN)和Ⅳ型胶原(type IV collagen, Collagen IV)表达增多,从而介导肝窦毛细血管化发生[2]。肝窦毛细血管化可导致肝细胞损伤和肝星状细胞(hepatic stellate cell, HSC)活化[3]。活化的HSC可导致大量ECM生成促进肝纤维化的发生发展,进一步表明肝窦毛细血管化是肝纤维化发生的重要病理事件。
miR-125b通过调控HSC的凋亡,减少ECM的沉积发挥抗肝纤维化作用[4]。血管内皮生长因子(vascular endothelial growth factor, VEGF)可通过调节一氧化氮(nitric oxide, NO)介导血管新生[5]。miR-125b作为VEGF的上游分子,可以影响其下游信号传导[6]。目前围绕血管新生防治肝纤维化的药物研究,因为缺少明确靶点而进展缓慢。该研究旨在探究miR-125b对肝脏血管新生的作用,为肝纤维化提供新的作用靶点。
1 材料与方法
1.1 材料与仪器人肝窦内皮细胞(HHSEC)(美国ScienCellTM公司,货号:5000),Lip2000(上海赛默飞,货号:12566014),miR-125b相关片段(上海吉玛制药技术有限公司),TRIzol(美国Ambion公司,货号:15596-026),VEGF抗体(货号:ab52917),CD31抗体(货号:ab222783),vWF抗体(货号:ab174290),Collagen IV抗体(货号:ab6586),LN抗体(货号:ab154848),双荧光素酶报告基因检测试剂盒(货号:ab228530)购自Abcam公司,无血清培养基(上海赛默飞,货号:12753018),PBS(北京索莱宝科技有限公司,货号:P1003),DAF-FMDA(上海碧云天公司,货号:S0019),多聚甲醛(国药集团,货号:80096618),Matrigel(北京索莱宝科技有限公司,货号:354277),NLRP3野生型(wild type,wt)/突变型(mutant,mut)的荧光素酶报告基因质粒载体(上海Genepharm公司),Easy Pure miRNA Kit(北京全式金生物技术有限公司,货号:ER601-01-V2),ELISA试剂(上海酶联生物科技有限公司,货号:ml064281;ml060878;ml023069;ml062947;ml028571)。RT-PCR仪(美国赛默飞,型号:ABI QuantStudio6),扫描电镜(日本HITACHI,型号:SU-8010),倒置显微镜(日本OLYMPUS,型号:IX51),培养箱(上海赛默飞,型号:311)、临界点干燥器(美国 tousimis 公司,型号:Autosamdri-931)。
1.2 方法
1.2.1细胞培养 用含5%FBS的ECM培养基进行HHSEC细胞培养,置于5% CO2的37 ℃培养箱中培养,待细胞长至单层后用于实验。
1.2.2细胞转染以及分组处理 取生长至单层的HHSEC细胞将其分为空白组、过表达组(mimics组)、过表达对照组(mimics NC组)、抑制组(inhibitor组)、抑制对照组(inhibitor NC组),随后进行转染。将细胞接种于24孔板上,第2天当细胞密度达到约30%时,进行miRNA-125b mimics和阴性对照转染。用无血清培养基将miRNA-125b mimics和阴性对照配成miRNA-DMEM,终浓度为20 nmol/L,轻轻震荡摇匀后在室温下孵育5 min,同样配制浓度为5 μl/ml的Lipofec-tamineTM2000试剂,轻轻震荡摇匀后在室温下孵育5 min,随后将配制好的miRNA-125b mimics和阴性对照分别与Lipofec-tamineTM2000混匀后在室温下孵育20 s,使之形成mimics-Lipo2000混合物,将100 μl mimics-Lipo2000混合物加入到24板孔中,置于37 ℃、5%CO2的培养箱中培养4~6 h,更换新鲜培养液,继续培养24 h,以供后续实验使用。miRNA-125b inhibitor和阴性对照转染方法与mimics相同,空白组全程使用ECM培养基进行培养,培养条件与其它四组相同。各组细胞用100 μg/L廋素活化,培养48 h,用于各项后续实验。
1.2.3qRT-PCR检测miR-125b和U6、VEGF、CD31、vWF、CollagenⅣ、LN和β-actinmRNA表达 将各组细胞按上述处理后,借助TRIzol试剂和Easy Pure miRNA Kit提取RNA,用mRNA逆转录试剂盒得到cDNA,进行PCR扩增反应,反应条件:预变性95 ℃ 10 min,变性95 ℃ 15 s,退火/延伸60 ℃ 1 min,共40个循环。用miRNA逆转录试剂盒操作完成高效加尾和合成第一链cDNA,然后以cDNA为模板,进行扩增,反应条件为:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 35 s,40个循环。通过各目的基因片段的扩增曲线确定Ct值;以β-actin、U6为内参基因,采用2-ΔΔCt法分析目标基因mRNA的相对表达量;用qRT-PCR检测相应分子的表达,miR-125b、U6、VEGF、CD31、vWF、CollagenⅣ、LN和β-actin上下游引物及长度见表1。实验重复3次。

表1 引物序列表
1.2.4ELISA检测VEGF、CD31、vWF、CollagenⅣ、LN蛋白表达 将各组细胞按上述处理后,以5×103/ml细胞密度接种至96孔板中,以离心半径15 cm、1 000 r/min离心20 min,取上清液检测。按试剂盒说明书操作,在酶标仪450 nm波长下测量吸光度值,计算细胞上清液中VEGF、CD31、vWF、Collagen Ⅳ及LN的含量。实验重复3次。定量的ELISA实验检测蛋白表达更能反映miR-125b的靶向作用。
1.2.5荧光探针检测NO的表达 将各组细胞按上述处理后,接入12孔板爬片,于37 ℃、5%CO2培养箱中培养48 h,去除细胞培养液,加入1 ml稀释好的DAF-FMDA,37 ℃细胞培养箱内孵育20 min,用PBS洗涤细胞3次,以去除未进入细胞内的DAF-FMDA,将爬好细胞的玻片浸入4%的多聚甲醛溶液中室温固定25 min,随后用PBS洗涤3次,每次5 min,滴加DAPI避光孵育5 min,PBST 5 min×4次洗去多余的DAPI,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像,实验重复3次。
1.2.6扫描电镜观察肝窦内皮细胞的结构 各组孵育的细胞爬片,2.5%的戊二醛固定2 h,0.1 mol/L磷酸缓冲液冲洗3次,1%鞣酸处理1 h,1%四氧化锇后固定1 h,磷酸盐缓冲液再次冲洗,梯度乙醇溶液脱水,之后用临界点干燥器对细胞标本进行临界点干燥,扫描电镜观察样品,每组选取随机选取3个视野。
1.2.7血管形成实验检测血管新生数量 4 ℃融化Matrigel胶,按每100 μl均匀加至96孔细胞培养板底部,37 ℃孵育60 min,在40 min时取HHSEC,按照5×104/ml密度,接种于96孔细胞培养板,各组经过1.2.2项转染处理后,在倒置显微镜下观察管腔形成情况,每组选取随机选取3个视野。
1.2.8双荧光素酶报告基因实验验证miR-125b与VEGF的靶向关系 按照双荧光素酶报告基因检测试剂盒说明书,将VEGF野生型(wild type, wt)/突变型载体(mutant, mut)和短链非编码RNA-125b 模拟物(miR-125b mimic)转染入HHSEC细胞中,培养48 h后,3 500 r/min离心2 min, 小心吸取培养液弃去。PBS洗涤细胞后,再加入细胞裂解液,在室温下震荡 5~10 min,收集并在3 000 r/min条件下离心5 min,取上清液进行检测,实验重复3次。
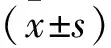
2 结果
2.1 转染后miR-125b的表达情况细胞转染结束后,用qRT-PCR检测转染各组miR-125b的表达量,结果如图1所示。转染miR-125b mimics及inhibitor后,过表达组miR-125b的表达明显高于空白对照组(F=4.617,P=0.001),同时明显高于mimics NC组(F=3.321,P=0.002),而 inhibitor 组则没有检测到miR-125b表达,表明inhibitor对miR-125b表达具有较好的抑制作用。
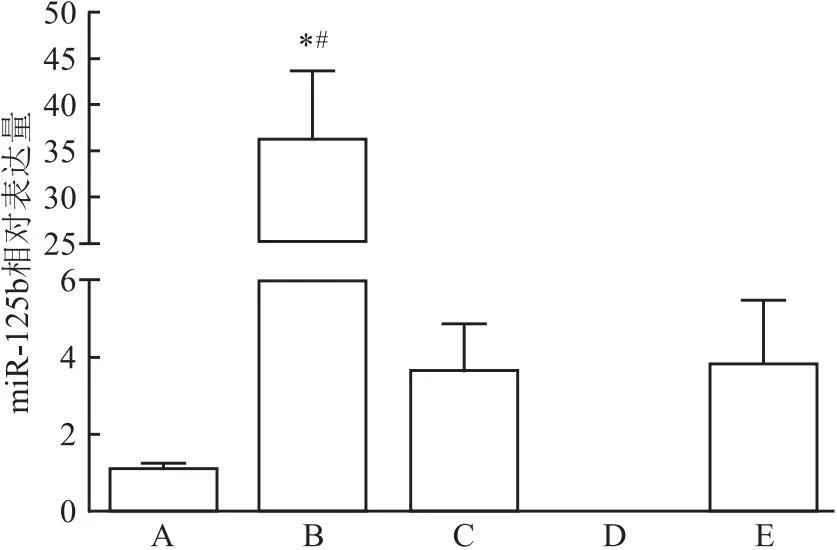
图1 转染后各组miR-125b表达情况
2.2 miR-125b对VEGF、CD31、vWF、CollagenⅣ、LNmRNA表达的作用与阴性对照组相比,miR-125b mimics转染后VEGF、CD31、vWF、CollagenⅣ、LNmRNA表达明显下降(均P<0.05);而miR-125binhibitor 转染后VEGF、CD31、vWF、CollagenⅣ、LNmRNA表达明显增加(均P<0.05)。见表2。
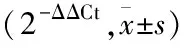
表2 miR-125b模拟物和抑制物对VEGF、CD31、vWF、CollagenⅣ、LN mRNA表达的比较
2.3 miR-125b对VEGF、CD31、vWF、CollagenⅣ、LN蛋白表达的作用ELISA检测发现与阴性对照组相比,miR-125b mimics转染后VEGF、CD31、vWF、Collagen Ⅳ、LN蛋白表达明显降低(均P<0.05);而miR-125b inhibitor 转染后VEGF、CD31、vWF、Collagen Ⅳ、LN蛋白表达明显增加(均P<0.05)。见表3。
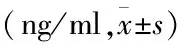
表3 miR-125b模拟物和抑制物对VEGF、CD31、vWF、Collagen Ⅳ、LN蛋白表达的比较
2.4 miR-125b对NO表达的作用与阴性对照组相比,miR-125b mimics转染后NO平均荧光强度表达下降(t=5.176,P=0.007);而miR-125b inhibitor转染后NO平均荧光强度表达增加(t=3.752,P=0.020)。见图2。
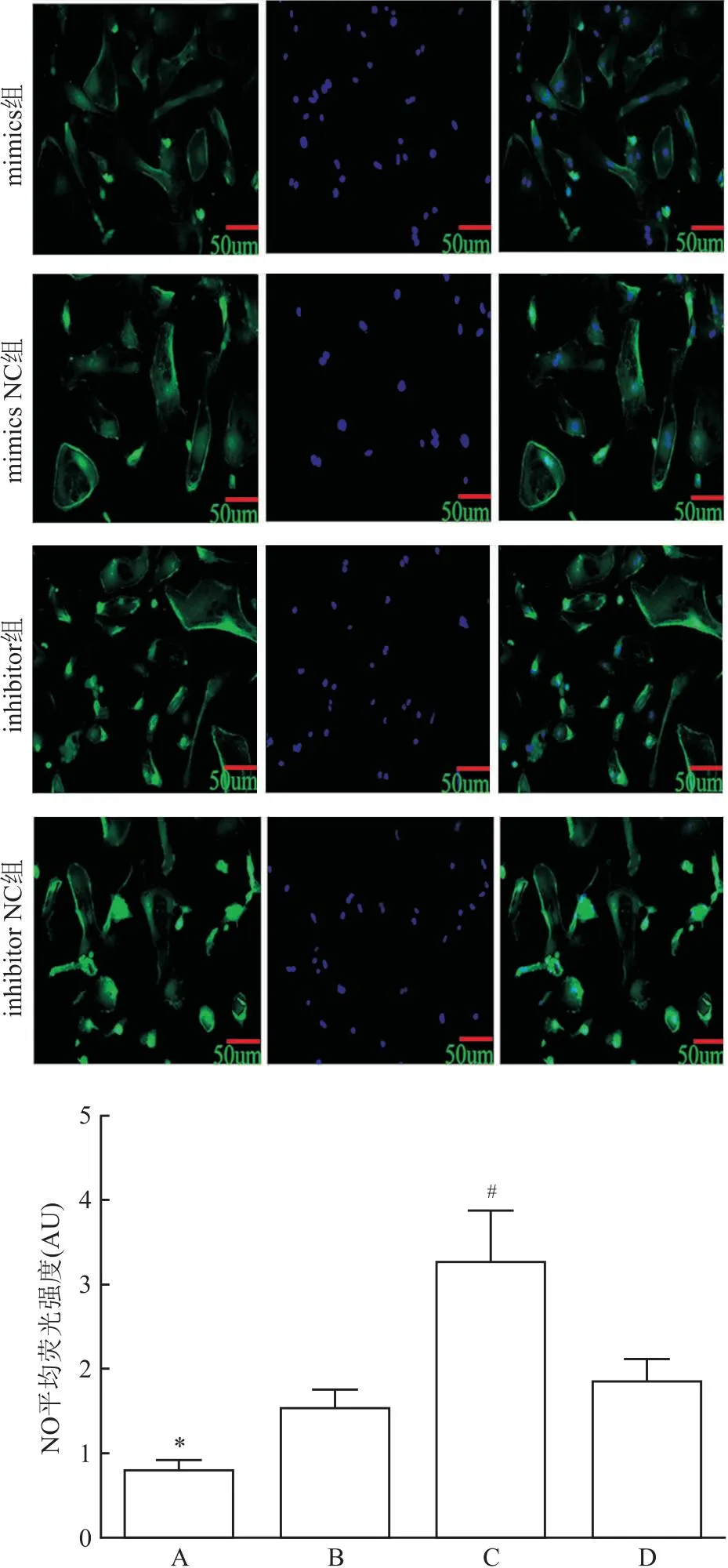
图2 miR-125b模拟物和抑制物对肝窦内皮细胞NO表达的影响
2.5 miR-125b对肝窦内皮细胞表面窗孔数量的作用与阴性对照组相比,miR-125b mimics转染后肝窦内皮细胞表面窗孔的数增加(t=6.897,P=0.002);而miR-125b inhibitor 转染后肝窦内皮细胞表面窗孔的数量下降(t=3.001,P=0.046)。见图3。
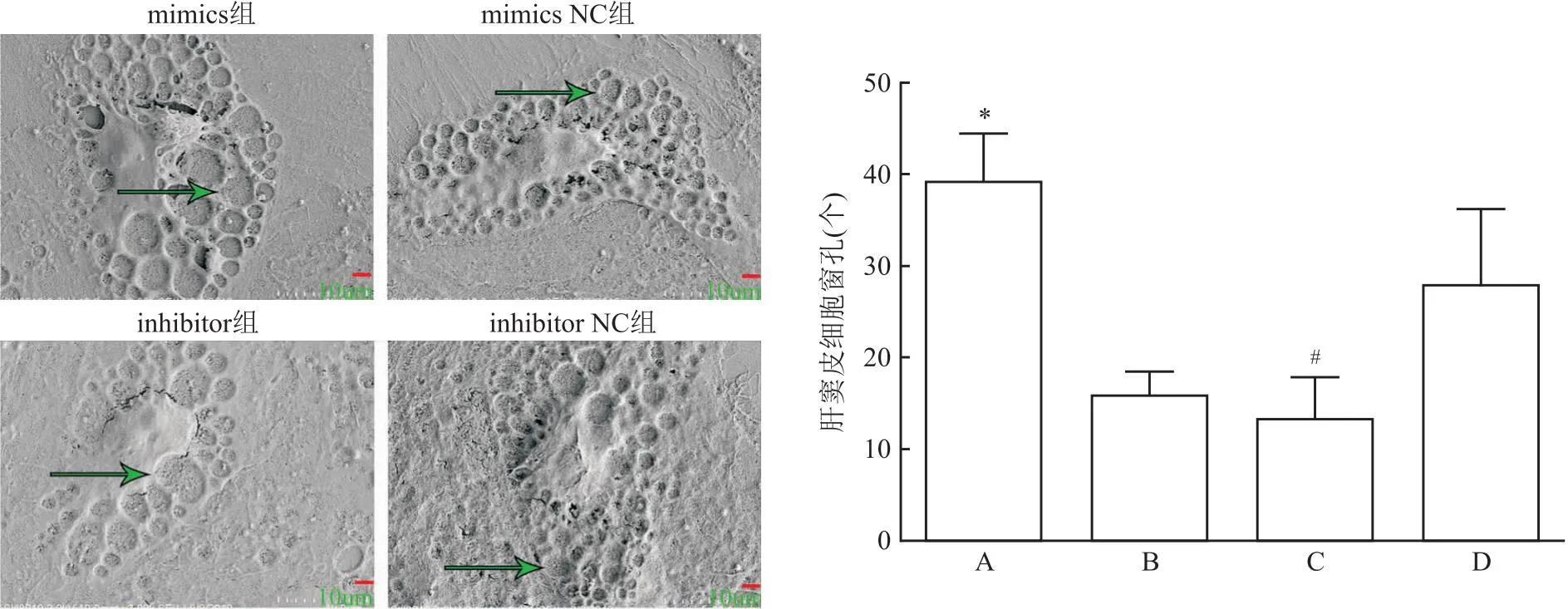
图3 miR-125b模拟物和抑制物对肝窦内皮细胞窗孔数量的影响
2.6 miR-125b对血管新生的作用与阴性对照组相比,miR-125b mimics转染后血管新生的数量下降(t=3.223,P=0.032);而miR-125b inhibitor 转染后血管新生的数量增加(t=3.874,P=0.018)。见图4。

图4 miR-125b模拟物和抑制物对血管新生数量的影响
2.7 miR-125b对VEGF的靶向作用相比于NC mimics组,VEGF-wt和miR-125b mimics共转染明显降低VEGF的3′UTR区荧光酶活性(t=7.148,P=0.002),相比于NC mimics组,VEGF-mut和miR-125b mimics共转染荧光酶活性差异不显著(t=1.981,P=0.119)。表明miR-125b mimics通过直接靶向作用于VEGF的3′UTR区域,抑制肝窦内皮细胞中VEGF的表达。见图5。

图5 双荧光素酶报告基因检测相对荧光强度
3 讨论
HF是慢性肝病的中间病理过程,因此探究HF的分子机制具有重要意义[7]。刘聪 等[8]认为肝脏血管新生与肝纤维化的关系密切,实验证明肝纤维化中病理性血管新生以肝窦毛细血管化为特点,并且发现其早于肝纤维化的形成。有研究[9]表明抑制肝窦毛细血管化的形成,可以抑制肝纤维化。同时发现失窗孔化的HSEC 即肝窦毛细血管化的发生会加重HSC活化[10]。
本研究成功构建miR-125b高表达和低表达的细胞模型。后续的qRT-PCR检测发现,miR-125b mimics可以抑制VEGF、CD31、vWF、CollagenⅣ和LN的mRNA表达,miR-125b inhibitor可以增加VEGF、CD31、vWF、CollagenⅣ和LN的mRNA表达。ELISA检测发现,miR-125b mimics可以抑制VEGF、CD31、vWF、Collagen Ⅳ和LN的蛋白表达,miR-125b inhibitor可以增加VEGF、CD31、vWF、Collagen Ⅳ和LN的蛋白表达。本研究双荧光素酶报告基因实验发现,miR-125b可以结合VEGF mRNA的3′UTR区域,调控其表达,表明miR-125b可以通过靶向VEGF,从而影响内皮细胞标志物CD31和vWF以及连续性基底膜标志物Collagen Ⅳ和LN的表达。本研究荧光探针实验检测发现,miR-125b mimics可以抑制NO的表达,miR-125b inhibitor可以增加NO的表达。研究[11]表明NO可以通过血管舒张来调节血管生成因子,从而调节血管生成。血管新生与肝纤维化相促相伴,是肝纤维化重要的早期病变。本研究血管新生实验也发现,miR-125b mimics可以抑制血管新生,miR-125b inhibitor可以促进血管新生。表明miR-125b调控NO表达,可能是其介导血管新生的关键策略。本研究发现miR-125b mimics可以增加肝窦内皮细胞窗孔的数量,miR-125b inhibitor可以减少肝窦内皮细胞窗孔的数量。研究[12]显示肝细胞损伤可导致肝脏缺氧,使肝窦内皮细胞线粒体功能衰竭,细胞骨架塌陷,导致其失窗孔化发生。并且失窗孔化也促进了肝窦连续基底膜的形成,破坏了肝细胞和肝血窦之间营养物质的交换[13]。有研究[14]表明以血管生成与重构为靶点进行药物干预,可能成为抑制或逆转肝纤维化的有效策略。

