NADH通过SIRT1/Nrf2通路缓解小鼠抗结核药物性肝损伤及凋亡
李金凤,崔梦祥,龙奕妃,孟春燕,任 琦,冯福民
抗结核药物性肝损伤(antituberculosis drug-induced liver injury,ADLI)是抗结核药物最严重且最常见的副反应,严重的ADLI会导致肝功能衰竭甚至死亡,但其发生发展机制尚未完全阐明。沉默信息调节蛋白1(silence informationregulator 1, SIRT1)是一类烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)依赖性的Ⅲ型组蛋白去乙酰化酶,其引起的组蛋白乙酰化的异常与ADLI的发生发展密不可分[1]。有研究[2]显示组蛋白乙酰化水平的改变可通过调控细胞凋亡参与ADLI进程。SIRT1可调控核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)的稳定性与表达[3]。在正常情况下,Nrf2能与细胞质中的Kelch样ECH关联蛋白1(Kelch like ECH associated protein 1, Keap1)结合,导致Nrf2的活动暂时受到抑制。而SIRT1可触发Nrf2与Keap1分离,Nrf2转位进入细胞核,同时改变细胞内正常的生理状态[4]。因此本研究推测SIRT1/Nrf2信号通路在ADLI进展中可能发挥重要作用。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)能够与NAD+相互转换,参与细胞氧化还原状态的调节,其外源给药可以预防鱼藤酮诱导的细胞损伤并调节凋亡相关基因的表达[5]。因此,本研究拟应用一线抗结核药物异烟肼、利福平、吡嗪酰胺构建ADLI小鼠模型,利用NADH进行干预,旨在探讨NADH通过调节SIRT1/Nrf2通路,改变凋亡信号从而调控小鼠ADLI的作用机制。
1 材料与方法
1.1 材料与仪器异烟肼(货号:84-85-3)、利福平(货号:13292-46-1)、吡嗪酰胺(货号:98-96-4)购于日本TCI公司;TRIzol试剂盒(货号:RP1001)购于北京百泰克生物技术有限公司;qRT-PCR试剂盒(货号:MF303-05)购于北京聚合美生物科技有限公司;反转录试剂盒(货号:AG11705)购于湖南艾科瑞生物工程有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)(货号:C009-2-1)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)(货号:C010-2-1)、乳酸脱氢酶(lactatedehydrogenase,LDH)试剂盒(货号:A020-2-2)购于南京建成生物工程研究所;SIRT1抗体(货号:13161-1-AP)、Nrf2抗体(货号:16396-1-AP)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)抗体(货号:26593-1-AP)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)抗体(货号:60267-1-AP)、caspase-3抗体(货号:19677-1-AP)、β-actin抗体(货号:8115-1-RR)、HRP标记羊抗兔二抗(货号:PR30011)均购于武汉三鹰生物技术有限公司;NADH(货号:ST358)、BCA蛋白定量试剂盒(货号:P0012)购于上海碧云天生物技术有限公司;SDS-PAGE凝胶配制试剂盒(货号:ZD304)购于北京庄盟国际生物科技有限公司。电泳仪(型号:DYY-8)、全波长酶标仪(型号:SpectraMax Plus 384型)购于上海美谷分子仪器有限公司;快速湿转仪(型号:L00686C)购于南京金斯瑞生物科技有限公司;荧光定量PCR仪(型号:StepOnePlus)购于美国Applied Biosystems公司;光学显微镜(型号:CX43)购于日本奥林巴斯株式会社;Alpha凝胶成像系统(型号:Alpha Imager HP型)购于美国AlphaInotech公司。
1.2 ADLI小鼠模型和NADH干预组模型制备24只6周龄SPF级雄性小鼠,饲养于华北理工大学实验动物中心屏障实验室(实验动物许可证号:SYXK冀2020-007),体质量20~30 g,饲养温度18~25 ℃,相对湿度40%~60%。适应性饲养1周后,随机分为4组,每组6只。其中, ADLI组用90 mg/(kg·d)异烟肼+135 mg/(kg·d)利福平+315 mg/(kg·d)吡嗪酰胺灌胃处理(剂量按照临床成人正常用药剂量的9倍计算所得);对照组用ADLI组相同体积生理盐水灌胃;NADH组在对照组的基础上应用NADH 30 mg/kg灌胃处理;NADH干预组在ADLI组的基础上应用NADH 30 mg/kg灌胃处理。每d灌胃1次,连续灌胃7 d,末次灌胃后处死小鼠并收集血清和肝组织,-80 ℃保存。
1.3 HE染色法检测肝组织形态小鼠肝组织标本收集后经固定→透明→包埋→切片等步骤制作病理切片,HE染色后,在光学显微镜下观察小鼠肝组织的病理形态学改变。
1.4 qRT-PCR法检测SIRT1、Nrf2、Bcl-2、Bax、caspase-3mRNA表达情况按照Trizol试剂盒说明书提取小鼠肝组织中的总RNA,按照反转录试剂盒说明书将其反转录为cDNA。构建PCR反应体系,共20 μl,其中Mix 10 μl,无酶水6 μl,cDNA 2 μl,上下游引物共2 μl;反应条件为95 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,40个循环。以GADPH作为内参。具体引物序列如下表1所示。

表1 引物序列表
1.5 Western blot法检测蛋白表达情况取1.2中提及的不同处理组的小鼠肝组织,提取总蛋白,应用BCA蛋白定量试剂盒对各组细胞提取的蛋白进行定量。经上样→SDS-PAGE电泳→转膜→封闭→一抗孵育→二抗孵育→洗膜→显色等步骤观察蛋白表达情况,其中一抗浓度为1 ∶1 000,4 ℃条件下孵育过夜;羊抗兔二抗浓度为1 ∶10 000,室温条件下孵育2 h。应用ImageJ软件分析蛋白灰度值。
1.6 微板法检测肝损伤指标的表达情况按照ALT、AST、LDH试剂盒要求,将双蒸水、丙酮酸标准液、待测样本、基质缓冲液、辅酶Ⅰ混合,37 ℃温育15 min,加入2,4-二硝基苯肼后,再次混合,37 ℃温育15 min,最后加入NaOH溶液混匀,于450 nm波长处检测吸光度值。
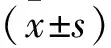
2 结果
2.1 NADH对SIRT1/Nrf2通路表达水平的影响与对照组相比,ADLI组小鼠SIRT1和Nrf2蛋白和mRNA表达均降低(t=5.18、6.21、8.09、6.29,均P<0.05);与ADLI组相比,NADH干预后SIRT1、Nrf2蛋白和mRNA表达均升高(t=4.17、8.00、6.14、4.49,均P<0.05),SIRT1/Nrf2信号通路被激活,表明NADH可逆转抗结核药物引起的各指标的低表达。见图1。
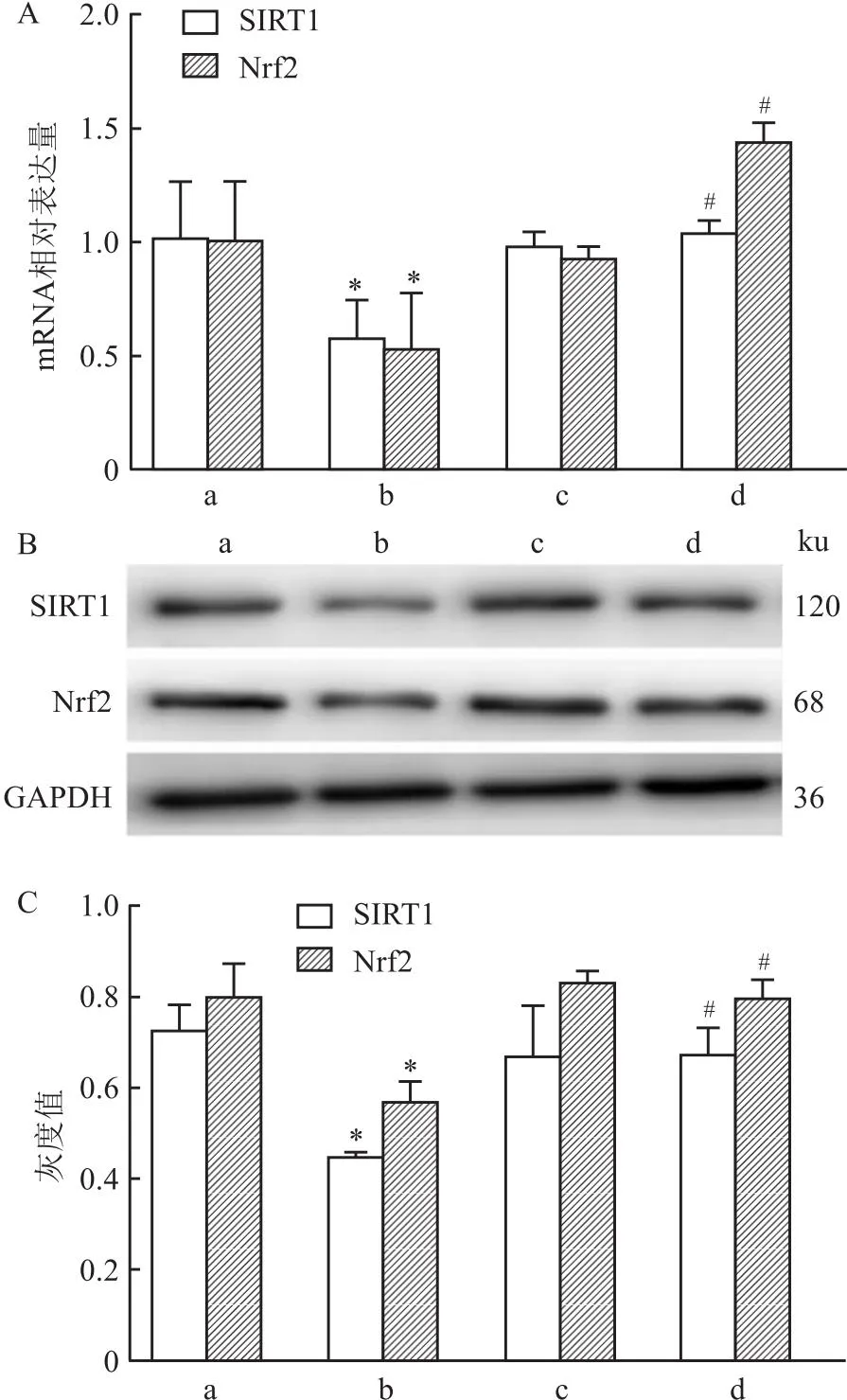
图1 SIRT1/Nrf2通路相关指标mRNA和蛋白检测结果(n=3)
2.2 NADH对小鼠肝组织形态学的影响HE染色结果显示,与对照组相比,ADLI组小鼠肝组织结构紊乱,细胞明显肿胀、边界不清;而NADH干预后,肝组织结构较清晰,细胞呈多边形。见图2。
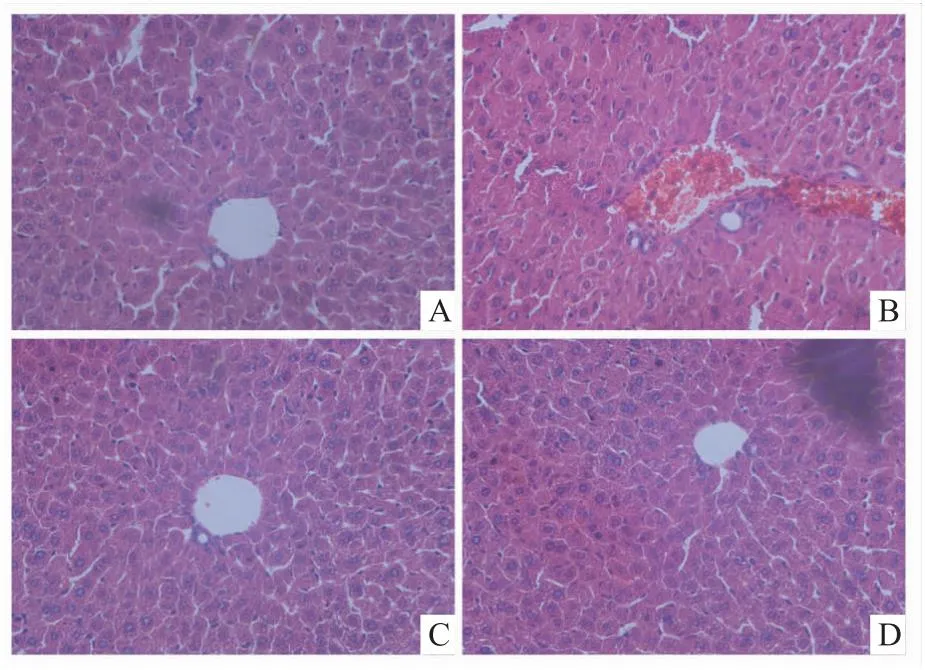
图2 小鼠HE染色肝组织形态图(×40)
2.3 NADH对小鼠体质量和肝指数的影响与对照组相比,ADLI组小鼠肝指数升高、体质量降低(t=8.51、4.38,均P<0.05);NADH干预后,ADLI组小鼠肝指数明显降低、体质量升高(t=6.10、3.49,均P<0.05)。见图3。

图3 各组小鼠体质量及肝指数比较(n=3)
2.4 NADH对小鼠血清中凋亡指标的影响与对照组相比,ADLI组抗凋亡因子Bcl-2的蛋白及mRNA表达降低(t=5.20、4.89,均P<0.05),凋亡指标Bax、caspase-3的蛋白、mRNA表达水平均升高(t=8.16、8.85、3.89、8.03,均P<0.05);而NADH干预后,Bcl-2的蛋白、mRNA表达升高(t=6.16、5.01,均P<0.05),凋亡指标Bax、caspase-3的蛋白及mRNA表达水平均降低(t=9.39、6.10、3.81、7.29,均P<0.05),逆转了抗结核药物引起的指标变化。见图4。
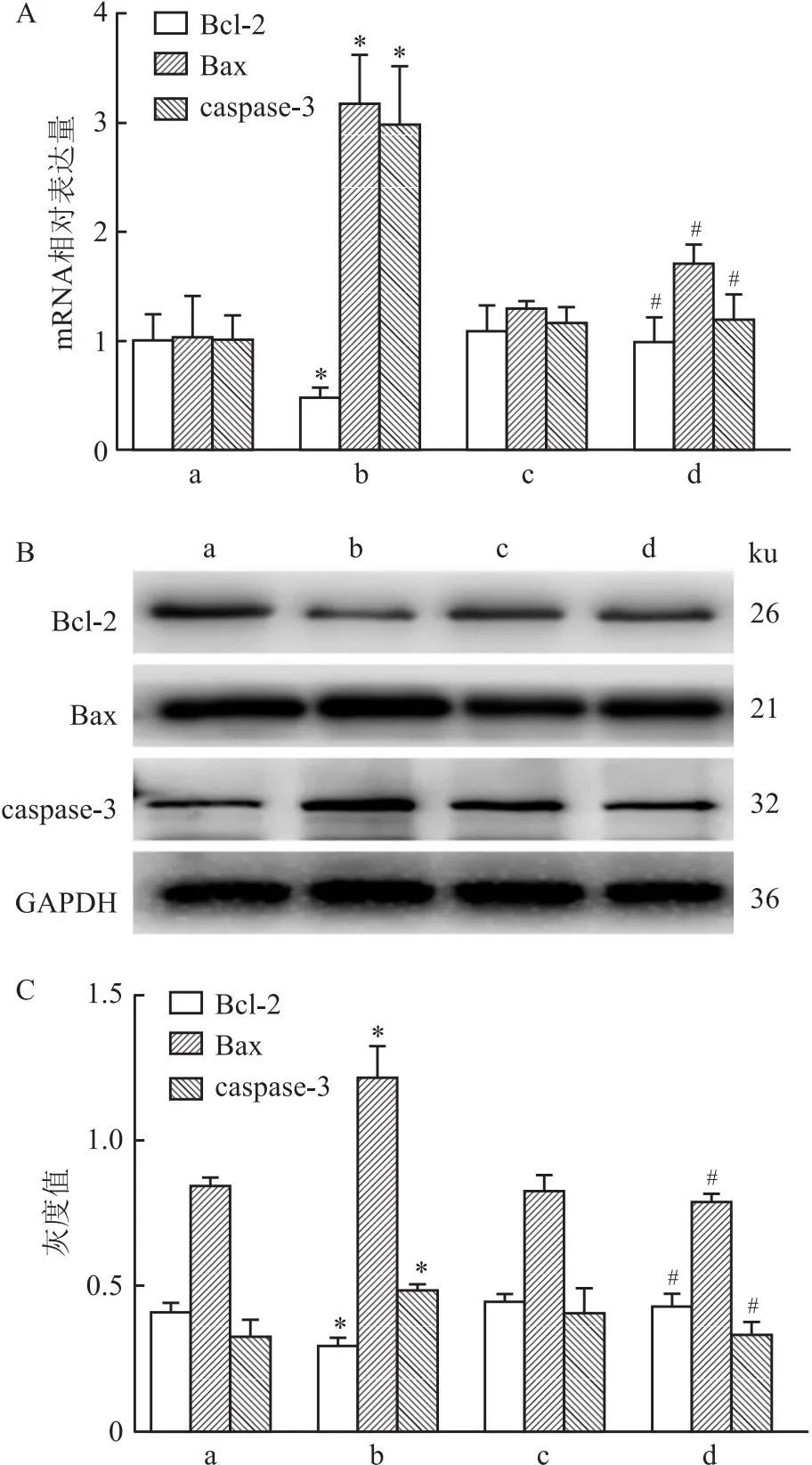
图4 凋亡相关指标mRNA及蛋白检测结果(n=3)
2.5 NADH对小鼠血清中肝损伤指标的影响结果显示,与对照组相比,ADLI组小鼠ALT、AST、LDH活性增强(t=6.29、10.81、8.51,均P<0.05);而NADH干预后ALT、AST、LDH活性降低(t=3.64、9.63、4.80,均P<0.05)。见图5。
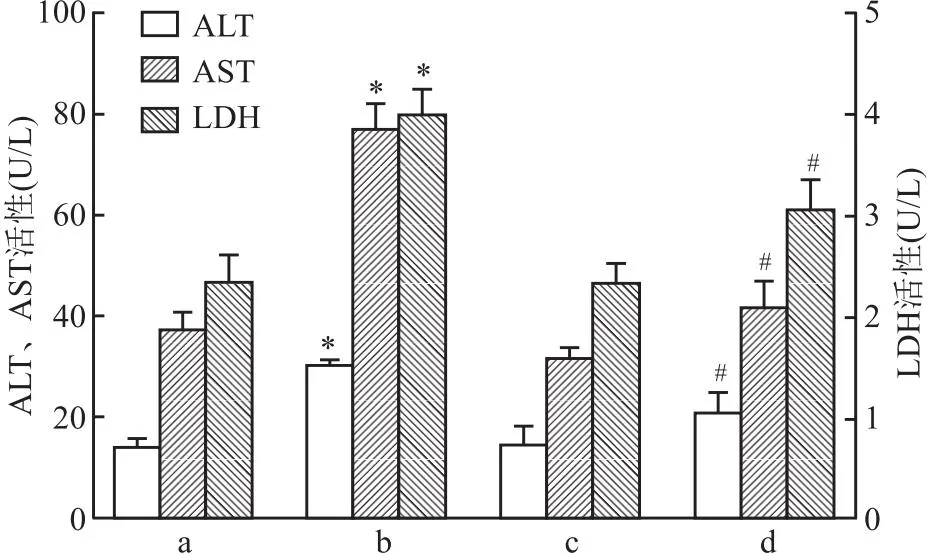
图5 各组血清中肝损伤指标活性比较(n=3)
3 讨论
抗结核药物性肝损伤是异烟肼、利福平、乙醇丁胺和吡嗪酰胺等一线抗结核药物长期联合应用导致的最严重的副反应,其机制至今尚未完全阐明。本研究应用抗结核药物构建小鼠ADLI模型,并给予NADH处理,探讨NADH通过SIRT1/Nrf2信号通路在ADLI发展中的调控机制。结果表明,NADH处理后,SIRT1/Nrf2信号通路被激活,小鼠肝细胞形态趋于正常,肝脏损伤得到缓解,凋亡水平下降,证实NADH可激活SIRT1/Nrf2信号通路,并改变凋亡指标蛋白和mRNA表达情况,缓解ADLI。
有研究[6-7]证实,抗结核药物在肝脏代谢产生的活性代谢产物会诱导炎症反应和细胞凋亡,但其具体机制尚未完全阐明。本研究在ADLI模型中发现抗结核药物能够引起肝细胞肿胀、边界不清等现象,ALT、AST、LDH等肝损伤指标表达上调,凋亡相关因子Bcl-2蛋白、mRNA表达降低,Bax、caspase-3蛋白和mRNA表达升高,与前期研究[8]结果一致。
此外,ADLI的发生被认为与组蛋白修饰密不可分,SIRT1是组蛋白去乙酰化酶Sirtuins家族的主要成员,已被证实可以发挥去乙酰化功能,缓解抗结核药物引起的细胞损伤[2]。SIRT1还可以去除Nrf2基因的乙酰化修饰,并通过生成抗氧化酶促进其功能的发挥[9],因此,SIRT1/Nrf2信号通路在肾脏损伤[10]、肝损伤[11]等疾病中具有重要的调节功能,被认为是调节基因表达、缓解氧化损伤的关键信号通路。本研究显示ADLI小鼠模型的SIRT1/Nrf2通路受到抑制,SIRT1和Nrf2的mRNA和蛋白表达水平均明显降低,而在应用NADH后,该通路被激活,二者活性明显增强。有研究[12]表明,在对乙酰氨基酚诱导的人正常肝细胞损伤中应用SIRT1的特异性激动剂,不仅会激活SIRT1的表达,使其活性增强,还可显著促进Nrf2的表达,最终逆转对乙酰氨基酚诱导的小鼠肝损伤。SIRT1/Nrf2通路还可在乙醇诱导的肝纤维化中抑制炎性因子的表达,从而改善酒精性肝纤维化[13]。这与本研究结果相一致,可见在ADLI的发生发展过程中,SIRT1/Nrf2通路也可发挥抗炎作用。
SIRT1 作为NAD+依赖性的去乙酰化酶,降低NAD+含量能够明显抑制SIRT1蛋白的表达和活性[14-15]。因此,本研究在ADLI小鼠模型中应用NADH,SIRT1和Nrf2的水平均升高,可见NADH增加了小鼠体内NAD+的含量,为SIRT1提供底物,激活了SIRT1/Nrf2信号通路。除此之外,NADH的作用机制与改善线粒体功能、增加抗凋亡蛋白、降低促凋亡蛋白的表达有关。本研究显示NADH改变了小鼠肝组织中凋亡相关指标Bcl-2、Bax、caspase-3的表达,引起了凋亡信号的变化;同时ALT、AST、LDH等肝损伤指标活性均降低,ADLI小鼠炎症反应得到缓解。
本研究通过在ADLI小鼠中应用NADH,证明了NADH可改变SIRT1/Nrf2信号通路中SIRT1、Nrf2蛋白和mRNA的表达,缓解ADLI小鼠的炎症反应和细胞凋亡,为ADLI的治疗提供新的方向。但本研究尚有不足之处。首先,本研究仅以小鼠为研究对象,在体内水平进行研究,研究结果不能外推。其次,仅观察了SIRT1/Nrf2信号通路中SIRT1、Nrf2蛋白和mRNA的表达情况,并未研究二者之间的相互作用机制,具有一定的局限性。未来应从人群、体外等水平进一步探讨NADH对ADLI的保护作用,并深入研究SIRT1对Nrf2的具体调控机制,为阐明ADLI的发生机制提供理论依据。

