姜黄素可能通过上调Prdx6蛋白表达抑制软骨细胞铁死亡
陈 凡,周富丽,陈 勇,付万进,周仁鹏,胡 伟,鲁 超
骨关节炎(osteoarthritis,OA)是一种以软骨损伤为主的常见关节疾病,其特征是关节软骨细胞外基质(extracellular matrix, ECM)降解、关节软骨退化和骨赘的形成[1-2]。铁死亡是一种铁离子依赖的,以脂质活性氧(reactive oxygen species, ROS)累积,线粒体皱缩为主要标志的新型程序性细胞死亡方式,许多抑制或缓解脂质过氧化的药物均可抑制铁死亡[3],从而能够有效干预疾病的发展,因此成为当前研究的热点。姜黄素(curcumin,Cur)具有抗氧化、抗菌以及与非甾体类抗炎药物类似的抗炎活性,已经广泛应用于OA的治疗中[4]。Cur的抗氧化作用与多种信号通路有关[5],研究报道[6]Cur在调控过氧化物酶6(peroxiredoxin6,Prdx6)表达在抑制内质网应激和线粒体凋亡中发挥重要作用,但其在软骨细胞铁死亡中的作用及机制目前尚不清楚。Prdx6作为过氧化物还原酶家族的一员,是发挥抗氧化应激与维持细胞磷脂平衡的关键蛋白[7]。因此,本研究旨在探讨Cur调控Prdx6蛋白表达在抑制软骨细胞铁死亡过程中的作用及可能的机制,为OA的防治提供新的靶点与策略。
1 材料与方法
1.1 材料
1.1.1细胞株及实验动物 C28/I2人正常软骨细胞系,由ATCC公司提供;SD大鼠20只,雄性,体质量160~180 g,鼠龄6~8周,由济南朋悦实验动物繁育有限公司提供,合格证号:SCXK(鲁)20190003。于温度(22±3)℃,湿度40%~70%条件下12 h光照12 h黑暗交替饲养。
1.1.2人膝关节软骨组织样本 2019年—2021年临床收集正常人(5例)和OA患者(5例)置换下来的膝关节软骨组织标本,排除因有膝关节感染性疾病、类风湿性关节炎等其他疾病进行膝关节置换的软骨标本。本研究通过安徽理工大学生物医学研究伦理委员会审核(伦理批号:2021020)。
1.1.3药品和试剂 Cur(美国Sigma-Aldrich公司,货号:08511);Erastin(美国Selleck生物科技有限公司,货号:S7242);胎牛血清(fetal bovine serum,FBS)(美国Invitrogen生命技术有限公司,货号:C0235);DMEM 高糖培养基(以色列BI生物科技公司,货号:06-1055-57-1ACS);乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(瑞士Hoffmann-La Roche有限责任公司,货号:11644793001);噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)(上海碧云天生物技术有限公司,货号:ST1537);BODIPY 581/591 C11荧光探针(美国Invitrogen生命技术有限公司,货号:D3861);总谷胱甘肽(glutathione,GSH)检测试剂盒(上海碧云天生物技术有限公司,货号:S0052);抗SLC7A11抗体(英国abcam公司,货号:ab307601);抗GPX4抗体(英国abcam公司,货号:ab125066);抗Prdx6抗体(江苏亲科生物研究中心有限公司,货号:DF6765);抗β-actin抗体(北京中杉金桥生物技术有限公司,货号:TA-09);抗ACSL4抗体(美国Santa Cruze公司,货号:sc-365230);抗FTH抗体(美国Santa Cruze公司,货号:sc-376594)。
1.1.4仪器 电泳仪(型号:EPS 600,上海天能电子有限公司);CO2培养箱(型号:371Steri-Cycle,美国Thermo Fisher科技公司);酶标仪(型号:800TS,美国ThermoFisher科技公司);流式细胞仪(型号:CytoFLEX,美国Thermo Fisher科技公司);倒置荧光显微镜(型号:AxioVert.A1,德国Carl Zeiss股份公司);超低温冰箱(型号:DW-86L626,青岛海尔股份有限公司);化学发光分析仪(型号:FINEDO X6,上海天能电子有限公司);离心机(型号:No. 5417R,德国Eppendorf股份公司)。
1.2 方法
1.2.1膝关节软骨组织染色
1.2.1.1OA大鼠模型的建立及组织切片 20只SD大鼠随机分为2组:正常大鼠组、OA大鼠模型组。采用左膝前交叉韧带切除术+内侧半月板摘除术建立左膝 OA 模型。取材后膝关节组织样本经4%多聚甲醛固定,10%EDTA溶液脱钙后进行组织浸蜡、包埋、切片。人膝关节软骨组织切片同大鼠。
1.2.1.2Safranin O/Fast Green染色 大鼠膝关节切片脱蜡水化后,按常规方法进行Safranin O/Fast Green染色,倒置荧光显微镜拍照保存。
1.2.1.3HE染色 大鼠膝关节切片脱蜡水化后,按常规方法进行HE染色,倒置荧光显微镜拍照保存。
1.2.1.4免疫组织化学染色 大鼠和人软骨组织切片脱蜡水化后孵育Prdx6和GPX4蛋白一抗(1 ∶50)过夜,37 ℃孵育二抗(1 ∶150) 30 min,DBA显色3 min,苏木精溶液复染2 min,脱水封片后显微镜下观察。
1.2.2C28/I2软骨细胞系培养和传代 C28/I2软骨细胞系用含有10%胎牛血清和1%双抗的DMEM培养基,在含有5% CO2,温度为37 ℃的条件下培养,观察细胞贴壁情况至达到对数增长期,用0.25%胰酶进行消化传代分组,分为:Control组、Erastin组、Cur组、Erastin+Cur组。
1.2.3MTT法检测细胞活力 按1.2.2项中分组情况,在96孔板中用2.5 μmol/L Erastin和不同浓度Cur(0、0.312、0.625、1.25、2.5、5、10、20和40 μmol/L)分别处理Erastin组、Cur组和Erastin+Cur组的C28/I2软骨细胞系8 h,显微镜下观察细胞死亡数量至50%时,每孔加入MTT检测液,孵育4 h后加入二甲基亚砜溶解,酶标仪选定波长490 nm和570 nm,测定吸光度值计算细胞活力,确定最宜Cur加药浓度为20 μmol/L。
1.2.4LDH法检测细胞毒性 按1.2.2项中分组情况,在24孔板中用2.5 μmol/L Erastin和20 μmol/L Cur处理Erastin组、Cur组和Erastin+ Cur组C28/I2软骨细胞系8 h,依据罗氏LDH试剂盒使用说明书,使用酶标仪测定波长在492 nm和620 nm处的吸光度,确定LDH的释放值。
1.2.5流式细胞术检测脂质ROS 按1.2.2项中分组情况,在6孔板中用2.5 μmol/L Erastin和20 μmol/L Cur处理Erastin组、Cur组和Erastin+Cur组C28/I2软骨细胞系8 h。用2 μmol/L BODIPY 581/591C11探针染色30 min,胰酶消化并于1 500 r/min,4 ℃离心5 min收集细胞沉淀,通过流式细胞仪进行分析,数据用FlowJo软件分析。
1.2.6总GSH试剂盒检测GSH含量 按1.2.2项中分组情况,在6孔板中用2.5 μmol/L Erastin和20 μmol/L Cur处理Erastin组、Cur组和Erastin+Cur组C28/I2软骨细胞系8 h。胰酶消化并1 500 r/min,4 ℃,离心5 min收集细胞沉淀,实验按碧云天生物的试剂盒使用说明进行。
1.2.7Western blot检测ACSL4、SLC7A11、Prdx6、FTH、GPX4蛋白表达 按1.2.2项中分组情况,在6孔板中用2.5 μmol/L Erastin和20 μmol/L Cur处理Erastin组、Cur组和Erastin+Cur组C28/I2软骨细胞系8 h。用RIPA蛋白裂解液提取软骨细胞总蛋白,根据不同的蛋白分子量在合适的SDS-PAGE凝胶中进行电泳(分离胶80 V 30 min,浓缩胶120 V 60 min)。再转移到聚偏二氟乙烯(PVDF)膜上用5%脱脂牛奶封闭,置于抗ACSL4(1 ∶500)、抗SLC7A11(1 ∶1 000)、抗FTH(1 ∶500)、抗GPX4(1 ∶500)、抗Prdx6(1 ∶1 000)一抗孵育过夜,用辣根过氧化物酶(HRP)标记的山羊抗兔/鼠IgG二抗(1 ∶500)孵育1h,配制ECL混合显影液平铺在膜表面,化学发光分析仪中显影。使用ImageJ软件对Western blot条带进行量化。
1.2.8Cur分子与Prdx6蛋白的分子对接 利用分子对接技术Biovia Discovery Studio2016评价Cur分子与Prdx6蛋白的对接,并展示Cur分子与Prdx6蛋白相互作用的二维结构。
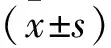
2 结果
2.1 OA大鼠关节软骨病理染色和Western blot法检测结果正常大鼠和OA大鼠Safranin O/Fast Green病理染色结果显示,正常大鼠关节软骨表面完整、平滑,软骨细胞排列正常、数量正常、核染正常,软骨基质着色鲜红;OA大鼠模型关节面糜烂、缺损、变形,软骨结构消失,软骨层进行性丧失或者损坏,软骨细胞数量减少、排列紊乱、有簇集现象,软骨基质着色变浅。HE病理染色结果显示正常大鼠膝关节软骨表面光滑连续、无损伤,而OA大鼠模型关节软骨的形态学出现明显的改变,关节软骨表面不连续,软骨基质损伤、断裂,软骨组织被侵蚀,关节表面轮廓发生典型的病理改变(图1A)。免疫组织化学染色观察Prdx6和铁死亡标志物GPX4蛋白在OA大鼠模型中的表达,结果显示OA大鼠模型关节软骨中Prdx6和GPX4蛋白黄染变淡(图1B)。以上结果说明OA发病进程中存在铁死亡。
2.2 Prdx6和铁死亡标志物GPX4蛋白在OA患者关节软骨中的表达情况Western blot检测结果显示与正常人相比,OA患者中Prdx6(t=3.38,P<0.01)和GPX4(t=3.66,P<0.01)蛋白表达明显降低(图2A、B)。免疫组织化学染色观察Prdx6和铁死亡标志物GPX4蛋白在OA患者中的表达,结果显示OA患者关节软骨中Prdx6和GPX4蛋白黄染变淡(图2B)。以上结果进一步表明OA发病进程中存在铁死亡,且Prdx6蛋白表达的降低可能与铁死亡有关。

图2 OA患者软骨组织中Prdx6和GPX4的表达情况(n=5)
2.3 Cur对Erastin诱导的C28/I2软骨细胞系铁死亡细胞活力和细胞毒性的影响Erastin和不同浓度Cur处理C28/I2软骨细胞系8 h,通过MTT法检测细胞活力,结果显示,与Erastin组比较,Cur能浓度依赖性抑制Erastin诱导的关节软骨细胞活力的降低,提高细胞活力,且在Cur浓度为20 μmol/L时保护效果显著(t=9.00,P<0.01)(图3A)。LDH法检测细胞毒性,结果显示(图3B)Erastin组关节软骨细胞中LDH释放增加(t=6.78,P<0.01),表明Erastin增加了关节软骨细胞的毒性,而用20 μmol/L Cur处理后可以明显降低软骨细胞LDH的释放(t=6.55,P<0.01),表明Cur可以降低Erastin所致的软骨细胞毒性。
图3 Cur对Erastin诱导的软骨细胞铁死亡细胞活力(n=6)和细胞毒性(n=4)的影响
2.4 Cur对Erastin诱导的C28/I2软骨细胞系铁死亡脂质ROS产生和GSH含量的影响流式细胞术量化比较FITC-A+脂质过氧化细胞最大百分比,结果显示(图4A、B)Erastin处理后软骨细胞脂质ROS明显增加(t=9.64,P<0.01),而Cur处理后能明显降低脂质ROS的水平(t=4.76,P<0.01)。GSH结果显示(图4C)Erastin处理后软骨细胞内GSH含量明显降低(t=115.20,P<0.01),而Cur处理后软骨细胞内GSH含量明显提高(t=98.66,P<0.01)。
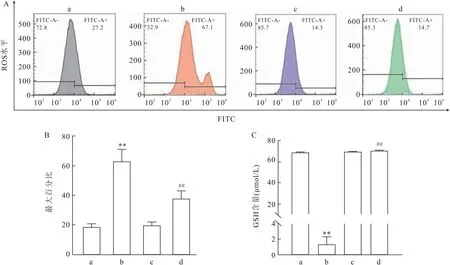
图4 Cur对Erastin诱导的软骨细胞脂质ROS水平和GSH含量的影响(n=3)
2.5 Cur对Erastin诱导的C28/I2软骨细胞系Prdx6和铁死亡相关蛋白表达的影响Western blot检测结果显示在Erastin诱导的软骨细胞铁死亡过程中,Cur处理可以降低软骨细胞ACSL4(t=11.87,P<0.01)蛋白表达,上调SLC7A11(t=5.19,P<0.01)、Prdx6(t=3.77,P<0.05)、FTH(t=4.11,P<0.05)、GPX4(t=8.06,P<0.01)蛋白表达。说明Cur可能通过上调Prdx6蛋白表达抑制C28/I2软骨细胞系铁死亡。见图5。

图5 Cur对Erastin诱导的软骨细胞铁死亡Prdx6和铁死亡蛋白表达的影响(n=3)
2.6 Cur分子与Prdx6蛋白的分子对接情况通过分子对接技术探究Cur分子与Prdx6蛋白的结合情况,结果显示Cur分子可以与Prdx6蛋白结合,二者之间存在相互作用力:范德华力;Cur分子与Prdx6蛋白163位VAL缬氨酸残基有Pi-Sigma键结合,与LYS144、LEU167、ALA171氨基酸残基有Pi-Alkyl键结合。见图6。

图6 Cur分子与Prdx6蛋白分子对接图
3 讨论
OA因其病因和发病机制的复杂性,目前临床上针对OA的预防和根治尚无有效的治疗药物和治疗方法,因此OA发生发展的分子机制亟待深入探究。软骨细胞作为关节软骨中唯一的细胞类型,参与软骨基质的合成[8]。生理情况下,软骨细胞的分化与死亡及软骨基质的合成和分解维持动态平衡。而在OA的发病进程中,这种平衡被打破,关节组织部位大量的炎症、氧化应激等因素诱发软骨细胞过度死亡,进而引起关节功能的丧失。OA发病进程中存在凋亡、自噬、坏死等类型的细胞死亡方式,然而靶向抑制这些类型的细胞死亡并不能有效抑制软骨损伤,提示OA病程中可能存在其他类型的细胞死亡方式。因此,对软骨细胞死亡方式及其调控机制的研究将有助于OA的防治。
本研究表明OA患者和OA大鼠发病进程存在铁死亡,Prdx6蛋白表达的降低可能与铁死亡有关。研究[9]报道Cur通过抑制NF - κB信号通路抑制软骨细胞凋亡从而发挥软骨保护作用,且Cur在一些癌细胞铁死亡中也发挥作用,但其在软骨细胞铁死亡中的作用未见报道。临床研究[10]表明OA患者血清中脂质ROS较正常人明显增加,并伴有GSH水平的降低。本研究表明Cur处理减少了脂质ROS的产生,提高了软骨细胞内GSH含量。铁死亡的发生依赖于脂质ROS的累积及其介导的脂质过氧化反应[11],因此通过调控细胞内ROS的水平及其下游信号级联效应,能够干预细胞铁死亡的发生。
此外,本研究结果显示Cur处理后ACSL4蛋白表达降低,Prdx6、SLC7A11、FTH、GPX4蛋白表达增加。GPX4能够利用GSH将过氧化的脂质还原为无毒性的脂醇,抑制ACSL4可减少多不饱和脂肪酸整合到磷脂上,且SLC7A11作为组成System xc-的两个亚基之一,可以促进胱氨酸合成GSH[12]进而抑制软骨细胞铁死亡。Prdx6作为一种过氧化还原蛋白,它不仅结构独特,而且具有谷胱甘肽过氧化物酶活性和钙非依赖性磷脂酶活性,其活性调控受到亚细胞定位、底物结合及翻译后修饰等因素影响。通过不同活性功能参与多种疾病的发生与发展,在肿瘤、炎性疾病及缺血性脑卒中等疾病中具有重要作用。研究[13]结果显示在肿瘤细胞铁死亡过程中,Prdx6能够发挥清除脂质ROS的功能,是一个新的肿瘤细胞铁死亡的负性调控因子。本研究结果显示Cur和Prdx6之间存在较强的相互作用,结合Cur对软骨细胞铁死亡的抑制作用,表明Cur可能通过上调铁死亡过程中Prdx6蛋白表达抑制软骨细胞铁死亡。
综上所述,本研究表明Cur可能通过上调铁死亡过程中Prdx6蛋白的表达,促进Prdx6清除脂质ROS,进而抑制Erastin诱导的软骨细胞铁死亡。后续还需以Prdx6为靶点探讨其在Cur抑制软骨细胞铁死亡发生发展中的作用及其可能的分子机制,为OA的防治提供新思路。

