咽喉反流性疾病发病机制与治疗的研究进展
王太保,杨 丹,梁冰雨,王 琴 综述 廖晨钟,张 晨 审校
咽喉反流性疾病(laryngopharyngeal reflux disease, LPRD)是指胃肠内容物反流到食管上括约肌(upper esophageal sphincter, UES)以上部位引起一系列症状和体征的总称。严重的LPRD是咽喉部恶性肿瘤的危险因素,并与慢性渗出性中耳炎、慢性鼻窦炎、过敏性鼻炎、哮喘、特发性肺纤维化等疾病相关[1]。不同病理生理机制导致LPRD的临床症状和治疗效果可能存在区别。该文对LPRD现有发病机制及致病因素进行综述,介绍现有治疗方法的优缺点,为未来治疗LPRD提供新方向。
1 发病机制
LPRD是一种多因素综合征,发病因素可归纳为两大类:① 反流理论:抗反流屏障结构破坏和黏膜保护屏障损伤。② 反射理论:食管酸刺激引起迷走神经反射致咽喉黏膜损伤。此外,LPRD发生还与幽门螺杆菌、患者自身的年龄、性别、体型、阻塞性睡眠呼吸暂停低通气综合征等因素有关(图1)。
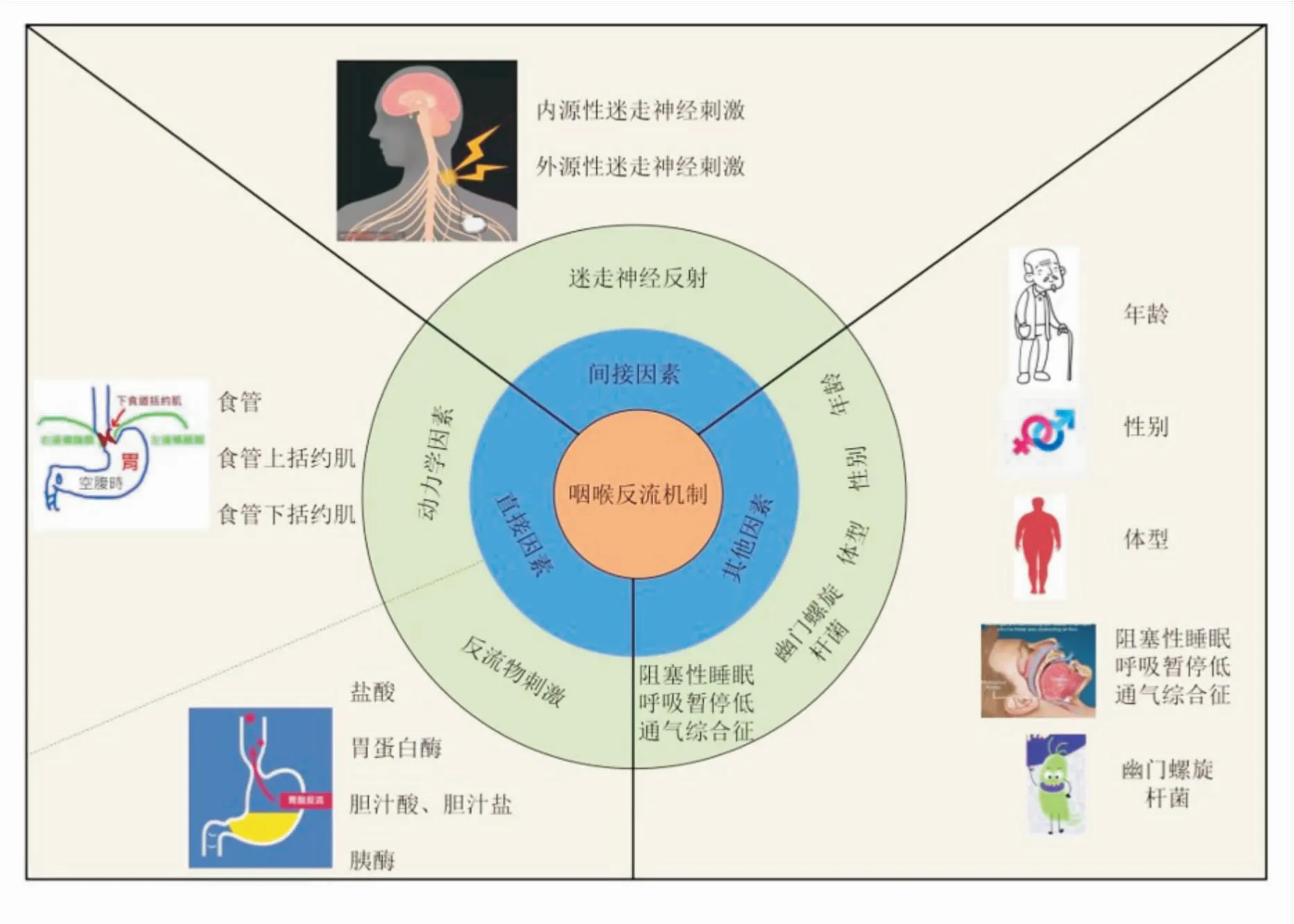
图1 LPRD主要的发病机制
1.1 反流理论胃肠内容物(包括盐酸、胃蛋白酶、胆汁酸、胆汁盐、胰酶及胃肠道细菌)反流损伤咽喉部黏膜导致抗反流屏障的结构和功能异常,从而导致LPRD的发生。
1.1.1反流发生的动力学机制 UES、食管下括约肌(lower esophageal sphincter, LES)、膈脚、膈食管韧带、食管与胃底间的锐角(His角)和胃食管阀瓣是构成抗反流屏障的主要结构,其破坏是LPRD发生的解剖学基础。食管-UES收缩反射是抗反流的保护机制,然而,食管酸刺激会造成该收缩反射敏感性降低及食管清除功能障碍[2],此时反流物更易于进入咽喉部并导致炎症反应,进一步减弱抗反流能力[3],两者形成恶性循环。LES功能障碍导致LPRD发生的机制有[4]:① 暂时性LES松弛学说:LES松弛频率增加或每次松弛时反流频率的增加会导致异常反流。② LES低压学说:LES收缩导致压力增加可防止反流发生,而当LES压力降低和(或)胃内压力增高时会发生反流。研究[4]认为LES低压在LPRD发病过程中发挥中枢调节作用。③ 食管裂孔疝(hiatal hernia, HH)学说:HH导致患者LES水平的高压带压力降低,降低了LES松弛发生的阈值,诱发暂时性LES松弛,也可造成食管蠕动、清除功能、反酸频率及酸暴露时间异常,增加发病机会。
1.1.2反流物引起咽喉部黏膜损伤的机制 盐酸和胃蛋白酶反流是导致LPRD的最主要因素,它们能够直接引起咽喉部上皮细胞损伤、纤毛功能紊乱、炎症反应及局部赘生物形成[5]。盐酸损伤咽喉部黏膜的机制包括:① 碳酸酐酶Ⅲ可催化生成碳酸氢根离子以调节咽喉部pH值,并减少胃蛋白酶原的激活。反流物的浸润能够导致碳酸酐酶Ⅲ的表达降低,削弱其调节能力,导致咽喉部黏膜损伤。② 盐酸反流降低钙黏蛋白E表达,造成细胞间的黏附连接和极性破坏以及胃蛋白酶和胃酸扩散,损伤咽部细胞。胃蛋白酶作为另一个导致LPRD的重要因素,不存在于正常人的咽喉部,而LPRD患者的咽喉部却能检测到胃蛋白酶,这些胃蛋白酶是导致细胞损伤的关键。并且研究[5]表明胃蛋白酶存在时,喉部黏膜对盐酸的抵抗力降低,此时盐酸与胃蛋白酶表现出对黏膜的协同损伤效果。
近年来也有研究[5]显示胆汁盐和胰酶也能损伤咽喉黏膜。胆汁反流通过内皮细胞转化途径诱导产生转化生长因子-β1,降低钙黏蛋白E水平,导致咽喉部细胞间黏附连接和极性破坏,影响正常屏障功能。胰酶能调节蛋白酶激活受体-2和瞬时感受器电位离子通道引起LES功能异常、刺激炎症因子的分泌、损害食管屏障,导致LPRD发病。
多种反流物质协同作用会导致更严重的LPRD症状[6],反流物的反复浸润引起咽喉部及周围组织的活性氧增加从而导致慢性炎症;当胃酸与胆汁酸、胃蛋白酶同时反流时,反流物对声门下组织表现出更强的协同损伤。
1.2 反射理论迷走神经功能异常可以导致胃蠕动、LES、UES等功能障碍,引起LPRD。反流物可刺激迷走神经反射引起气管和支气管的收缩,增加咳嗽敏感性和一过性食管括约肌松弛频率。研究[7]表明LPRD病程越长,迷走神经功能越差,提示迷走神经功能障碍参与了疾病的发展,迷走神经功能的恢复在治疗过程中起着重要作用。
2 LPRD的治疗
治疗LPRD可缓解其症状、提高生活质量和降低并发症的发生。常用的治疗方式、作用机制、适用范围及存在的问题见表1。
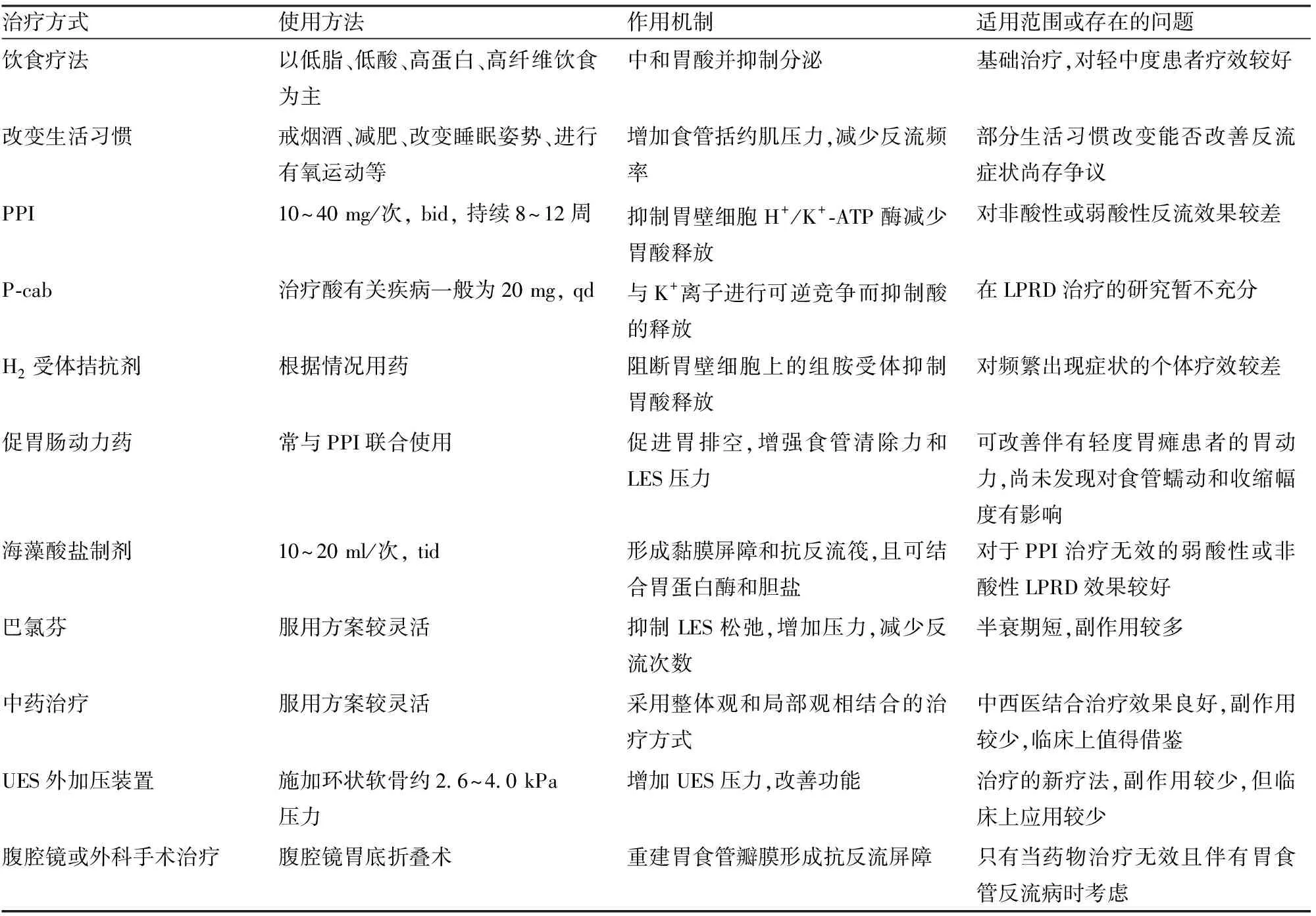
表1 LPRD治疗方式
2.1 一般治疗改变饮食习惯和生活方式是治疗的第一步,是轻中度患者低成本、高效益的治疗手段。
2.1.1饮食疗法 饮食疗法主要以高蛋白、高纤维、低脂、碱性食物为主,可缓解多数轻中度LPRD患者的症状,疗效可媲美质子泵抑制剂(proton pump inhibitors, PPI),可显著改善患者的反流症状指数评分(reflux symptom index, RSI)和反流体征评分(reflux finding score, RFS)[8]。然而,目前缺乏饮食调整与LPRD治疗关系的研究,因此需要更多的研究以确定二者关系。
2.1.2改变生活习惯 不良的生活习惯可导致LPRD发生。研究[9]表明肥胖者表现出更高的RSI可能是由于肥胖导致LES压力降低造成胃食管交界处结构和功能破坏。有氧运动有助于减轻反流症状,然而剧烈运动会造成胃食管交界处损伤、胃肠血流量减少和胃食管蠕动功能改变,增加反流机会。睡眠不足、焦虑、抑郁等精神因素可通过改变饮食习惯从而加重LPRD症状,且二者可形成恶性循环[10]。因此,改变不良生活习惯能从一定程度上降低发病概率。
2.2 药物治疗
2.2.1PPI和钾竞争性酸阻断剂(P-cab) PPI是目前治疗LPRD的首选药物,PPI可通过抑制胃壁细胞的H+/K+-ATP酶来减少胃酸的分泌,降低反流物酸性,抑制胃蛋白酶原激活,从而缓解咳嗽、声嘶、异物感等症状[11]。高剂量PPI疗法能大幅度降低酸暴露量和时间,因此治疗指南推荐使用高剂量PPI疗法。
目前对于PPI的治疗方案尚存在争议。一项PPI与安慰剂对照试验的meta分析[12]指出PPI治疗效果仅稍优于安慰剂,其原因可能是:① 研究对象中包括非酸性反流者; ② LPRD诊断和疗效评估指标缺乏特异性和统一性,并且长期服用PPI有严重的副作用(表2),可导致继发性胃泌素增高从而造成症状复发或恶化。
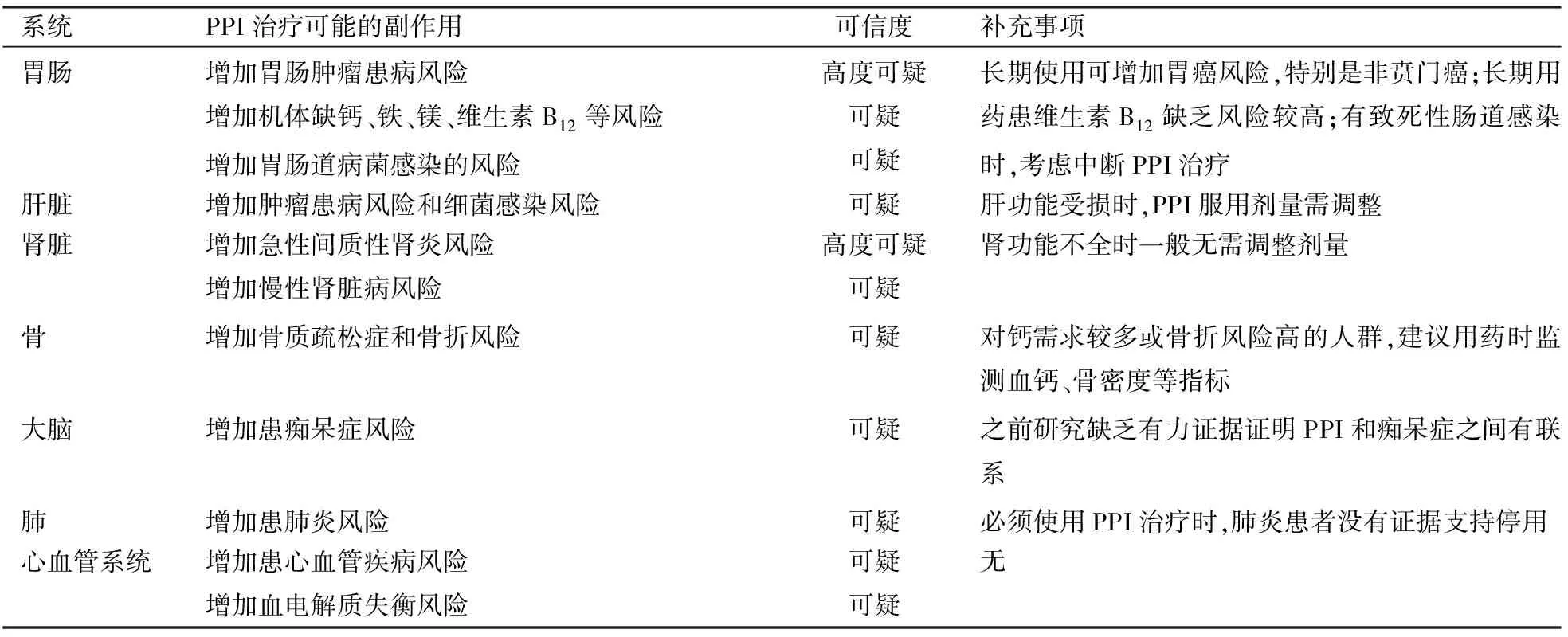
表2 长期服用PPI的副作用
由于PPI治疗的副作用,近年来效果更好、副作用更小的抑酸剂P-cab得到了快速发展。其通过可逆性、竞争性抑制K+与H+/K+-ATP酶的结合,阻滞K+与H+交换,从而抑制胃酸分泌。较PPI有吸收更快,抑酸更强;半衰期更长,抑酸时间更长,服药次数更少;稳定性更高,食物对其影响更小;安全性更高,副作用更少等优势[13]。目前P-cab对胃十二指肠溃疡、糜烂性食管炎等酸相关疾病的疗效优于PPI[14]。但P-cab对LPRD的作用仍需进一步探究。
2.2.2H2受体拮抗剂 H2受体拮抗剂通过阻断胃壁细胞上的组胺受体,抑制胃酸释放,减少暂时性LES松弛次数并增加其张力,可有效缓解咽喉症状、促进咽喉破损黏膜修复。研究[15]表明H2受体拮抗剂雷尼替丁联合PPI使用表现出良好的疗效和治疗安全性,但其抑酸效果较弱,作用时间较短,属于治疗的二线用药。
2.2.3胃肠动力药 食管蠕动异常可导致LPRD的发生和症状加重[3]。常见的促胃肠动力药如莫沙必利可通过促进胃肠运动、增加LES张力和增强食管清除能力治疗LPRD,与PPI联合使用疗效较好[16]。
2.2.4海藻酸盐及其他胃黏膜保护剂 海藻酸盐制剂主要由海藻酸盐和活性成分碳酸盐组成,其能够通过以下机制发挥黏膜保护作用:当海藻酸盐制剂与胃酸接触时,海藻酸盐制剂中的碳酸盐成分能够中和胃酸,将其分解为二氧化碳,其中的金属阳离子可促进相邻海藻酸盐分子中的α-L-古洛糖醛酸残基交联,形成低密度泡沫凝胶状抗反阀漂浮于胃酸表面,阻碍胃内容物反流[17]。其副作用极少,生物相容性好;起效快、维持时间较长;对胃蛋白酶和胆盐反流为主的LPRD疗效好,且对胃蛋白酶诱导的咽喉肿瘤的生长有抑制作用。研究[17]显示单独使用海藻酸盐的疗效并不次于PPI,可作为PPI的代替疗法。除海藻酸盐外,其他的胃黏膜保护剂,如铝碳酸镁也有良好的疗效和较高的安全性,可有效改善咽喉部炎症[18]。
2.2.5巴氯芬的治疗 巴氯芬可通过抑制LES松弛减少反流次数和时间。在一项对32名接受PPI治疗但仍有症状的受试者的研究[19]中发现,服用巴氯芬后,53%患者症状明显缓解。但由于其半衰期短,需多次服药,且为亲脂性药物,可透过血脑屏障致中枢神经系统功能异常,一旦出现神经系统症状应立即停药。
2.2.6中药治疗 与西医的对症治疗相比,中医采用整体观和局部观相结合的方式,在治疗中具有优势。中医治疗主要包括情绪疏导、辨证治疗和中医外治法,同时也需结合饮食调整[20]。中西医联合治疗疗效显著,能够避免只使用西药产生的依赖性,实现优势互补[21],如PPI联合贝母瓜蒌散[22]等中医疗法能有效缓解症状、缩短治疗时间、降低不良反应发生率。
2.3 UES外加压治疗在环状软骨外使用加压装置可增加UES压力并改善UES功能,减少反流的发生。研究[23]表明接受PPI治疗后再接受此装置治疗4周,55%患者RSI明显降低,且此疗法副作用小,在3个月的随访中,只有4.57%因不适停止使用。另一项研究[24]显示,有治疗效果者往往具有较低的体质量指数、较高的唾液胃蛋白酶、较小的HH,且同时联合PPI治疗效果可能更佳。UES外加压治疗拓宽了LPRD治疗策略,未来需要收集更多临床数据进行研究从而更好地服务于临床治疗。
2.4 手术治疗药物无效或难治性LPRD可以考虑手术治疗。腹腔镜Nissen胃底折叠术(laparoscopic Nissen fundoplication, LNF)和腹腔镜Toupet胃底折叠术(laparoscopic toupet fundoplication, LTF)是最常见的抗反流手术,一般以LNF作为首选,其原理是通过增加LES高压带压力,减少反流的发生。研究[25]显示,10%~30%药物治疗效果较差的患者手术治疗成功率为48%~94%。一项研究[26]对176名符合手术治疗的患者进行手术,其RSI从平均术前值19.2降低到7.8(2周)、6.1(8周)和10.9(1年),且术前RSI最高的对手术的效果最好。手术最有可能改善胃灼热、声嘶和吞咽困难等症状,研究[26]显示经LNF术后声嘶改善66%、消退42%;咳嗽改善74%、消退41%;喘息改善69%、消退42%。此外,手术能够显著减少术后反流次数和时间,多数患者术后能够停止药物治疗,从而减轻由于长期服用药物导致的不良反应。虽然手术治疗效果较好,但症状完全缓解很少见[27],且会造成吞咽困难(29%)和腹胀(14%)等其他并发症[28],因此,手术治疗需谨慎。
2.5 其他疗法除上述方法,治疗方法还包括使用疼痛调节剂、语言练习、声音练习、呼吸练习、膈脚的康复治疗、声道卫生管理等。
3 开发有效的胃蛋白酶抑制剂是治疗LPRD的新方向
鉴于胃蛋白酶在LPRD中的关键作用,有学者[29]提出胃蛋白酶可能是潜在的治疗靶点,胃蛋白抑制剂的作用机制包括:① 使胃蛋白酶失活并抑制其在酸性条件下的重新激活;② 通过受体拮抗剂阻止受体介导胃蛋白酶进入细胞内。然而市场上此类抑制剂的水溶性和药代动力学特性较差,需要进一步研究胃蛋白酶在LPRD中的作用,开发有效的抑制剂以及解决现有药物的不足[29]。
4 总结与展望
LPRD发病机制的研究对于其治疗有重要意义,不同的发病机制采用相对应的治疗方案,可能获得最佳治疗效果。LPRD的发病机制主要包括反流理论(反流物刺激)和反射理论(迷走神经反射),并且幽门螺杆菌感染、肥胖、年龄、性别等其他因素亦可导致其发生,未来有待进一步深入探索发病机制之间的联系。此外,医疗工作者在开发新型临床疗法时也应当注意对传统疗法的研究和发展,探索出更科学合理的疗法。目前,针对胃蛋白酶的治疗可能是未来治疗LPRD较好的突破口。实现治疗的突破需要包括耳鼻喉科、呼吸科、消化科等多学科在内的共同合作。

