m6A甲基化修饰在肾细胞癌中的研究进展
徐丽秀,倪伟建,王 伟,侯冰冰 综述 郝宗耀,温家根 审校
肾癌在我国泌尿生殖系统肿瘤中占第2位,仅次于膀胱癌,每年全球新增病例超过40万例,发病率仍在逐年上升[1]。肾细胞癌(renal cell carcinoma,RCC)是肾癌中最常见的恶性肿瘤,约占90%左右。由于肾癌早期无明显临床症状,通过肾脏彩超、CT和核磁共振才可诊断,因此肾癌发现时往往已出现远端转移[2]。早期RCC以手术治疗为主,约30%~50%的患者手术切除原发肿瘤后出现远端转移,晚期和转移性RCC则以药物治疗为主,但传统化疗和放疗效果不佳,预后较差[3],因此亟须探索新的治疗方法。
近年来,以m6A甲基化修饰为主的表观遗传学研究已成为生物医学领域的研究热点,尤其在肿瘤方面。研究显示,m6A甲基化修饰与RCC间存在密切联系[4]。为探讨m6A甲基化修饰在RCC中的治疗潜力,该文回顾了m6A甲基化修饰相关调控因子与RCC疾病进程的关系,并总结了这些调控因子在RCC中的作用及机制,旨在为后续的研究提供基础和方向。
1 m6A甲基化修饰概述
m6A甲基化(N6-methyladenosine,m6A)修饰是在mRNA中腺苷酸的第6位氮原子上发生的甲基化[5],是真核细胞RNA中最常见、最丰富且影响较大的修饰类型[6]。m6A甲基化修饰过程参与了RNA加工、核输出、翻译调控和衰变等过程[7],并与肿瘤、心脑血管疾病、中枢神经系统疾病、代谢性疾病等多种疾病的发生发展密切相关[8]。m6A RNA的甲基化修饰过程与DNA甲基化过程类似,是动态、可逆的,由m6A甲基转移酶复合物、去甲基转移酶和阅读蛋白协同完成(图1)。
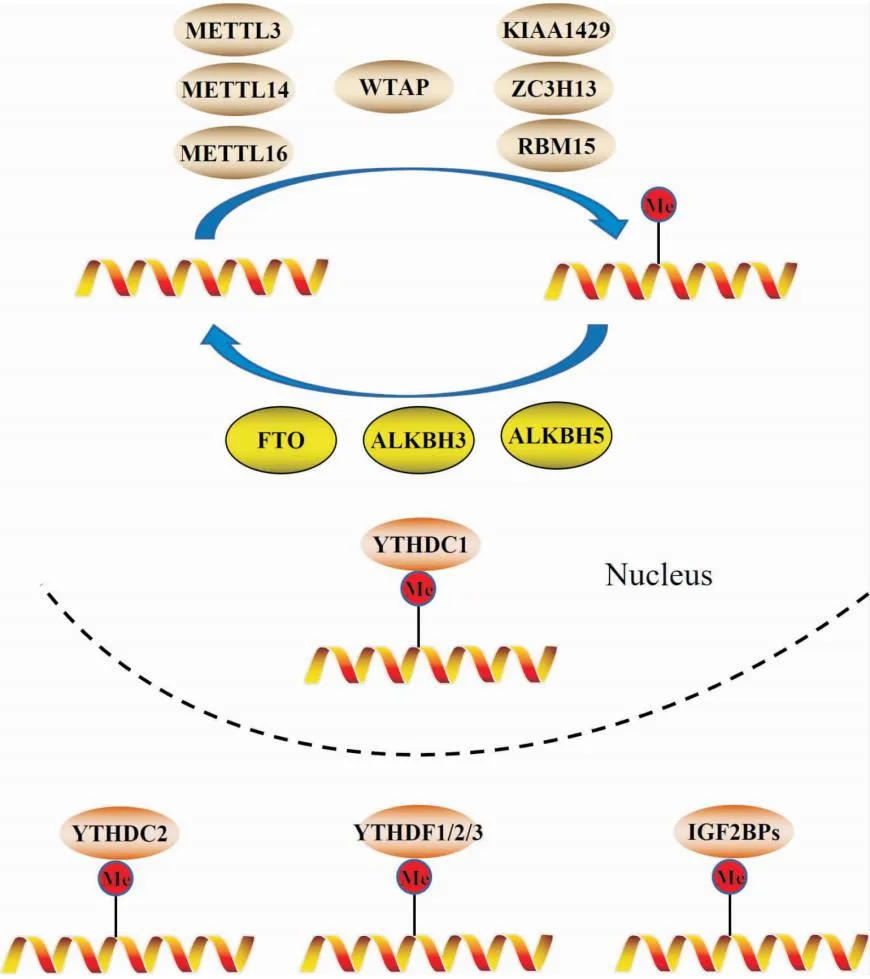
图1 m6A甲基化修饰的分子机制
1.1 甲基转移酶m6A甲基化由甲基转移酶复合物催化,使S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)的甲基转移至受体腺嘌呤第6位氮原子上[9]。甲基转移酶复合物的核心成分是甲基转移酶样3蛋白(methyltransferase-like 3,METTL3),其结构中的甲基转移酶结构域是与SAM结合的必需结构[10];另一个核心成分是甲基转移酶样14蛋白(methyltransferase-like 14,METTL14),其与METTL3以1 ∶1复合,METTL3作为催化核心,而METTL14作为RNA底物结合的结构支撑;作为辅助因子的肾母细胞瘤1-相关蛋白(wilm tumor 1 associated protein,WTAP),由于缺乏甲基化结构域,本身对m6A修饰无催化作用,与METTL3-METTL14形成三元复合物能够影响m6A甲基转移酶的富集能力[11]。其他的甲基转移酶还包括:METTL3同源物METTL5、METTL16、METTL24、病毒样m6A甲基转移酶相关蛋白(KIAA1429)、锌指CCCH结构域蛋白13、RNA结合基序蛋白15(RNA-binding motif protein 15,RBM15)及其副产物RBM15B[12]。
1.2 去甲基转移酶m6A去甲基转移酶可去除m6A甲基化,与m6A甲基化形成动态可逆过程。目前已被鉴定的去甲基转移酶主要有脂肪和肥胖相关蛋白(fat mass and obesity-associated protein,FTO)和ALKB同系物1/3/5(ALKB homolog 1/3/5,ALKBH1/3/5),二者同属于α-酮戊二酸依赖的双加氧酶家族,但参与的生物学过程有所不同,FTO主要影响RNA的剪切和稳定性,而ALKBH5主要影响RNA的代谢、组装及核输出[13]。
1.3 阅读蛋白阅读蛋白是能特异性识别并结合至靶RNA的一类蛋白,包括含YTH结构域蛋白(YTHDC)和YTH结构域家族蛋白(YTHDF)亚型,如YTHDC1、YTHDC2、YTHDF1、YTHDF2和YTHDF3。YTHDC1是m6A修饰中唯一定位于细胞核内的YTH家族甲基结合蛋白,影响RNA的核定位、剪切和核输出[14];YTHDC2通过直接与m6A修饰位点结合促进翻译[15];YTHDF1通过与翻译起始因子结合,提高发生m6A修饰的RNA翻译效率;YTHDF2则主要影响m6A修饰的RNA衰变;而YTHDF3作为辅助因子,既可与YTHDF1协同促进RNA翻译,亦可与YTHDF2协同促进衰变[16]。另一类阅读蛋白是IGF2BPs家族,主要参与RNA的核定位、输出和翻译,并在生长发育及代谢方面发挥作用[17]。
2 m6A甲基化与RCC的关系
基于癌症基因组图谱(the cancer genome atlas,TCGA)和基因综合表达数据库的分析显示[18],多个参与m6A甲基化修饰的调控因子在RCC组织和正常组织中差异表达,并在RCC的病理分期和预后预测中具有重要价值,如表1所示。
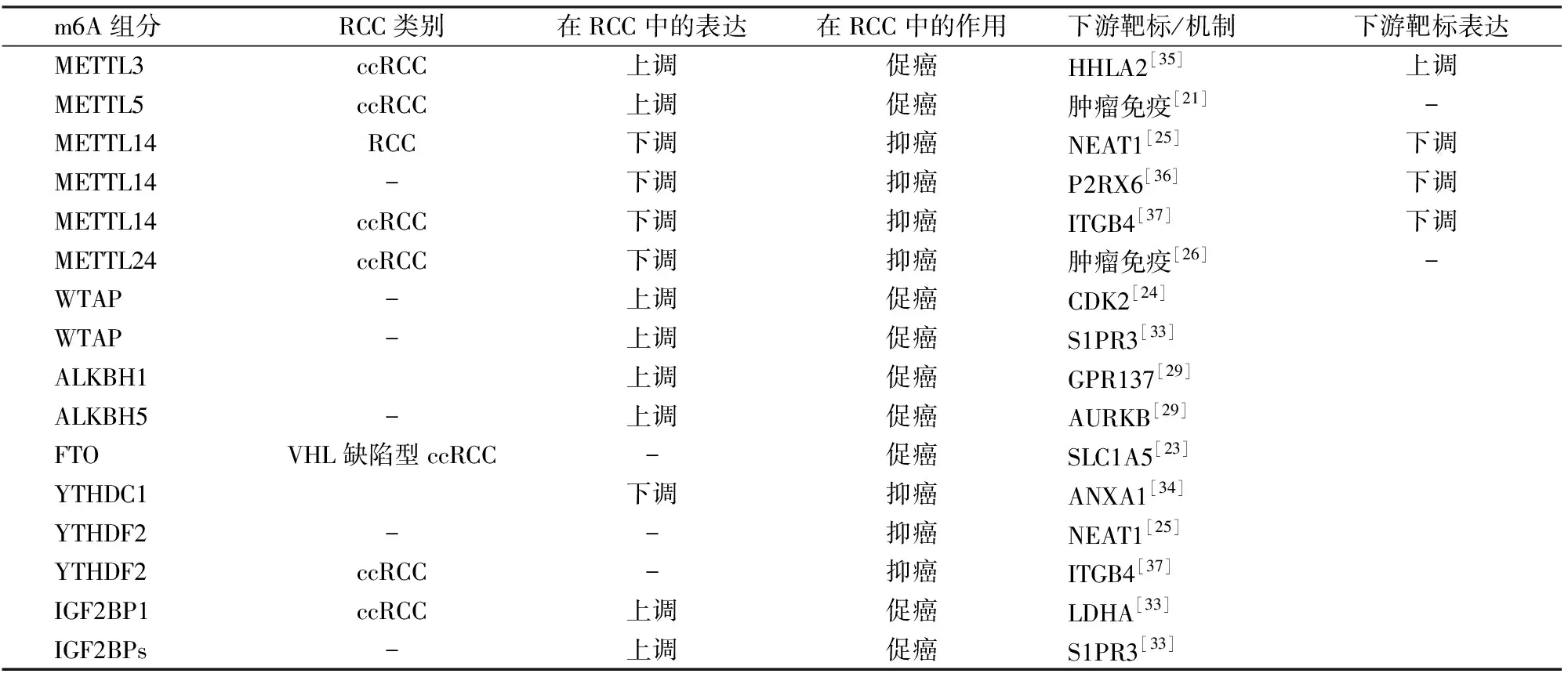
表1 m6A修饰在RCC中的作用及分子机制
2.1 甲基转移酶与RCC的关系Wang et al[19]研究发现包括WTAP等在内的m6A甲基化调节因子与ccRCC进展和预后相关,并发现METTL3和METTL14是ccRCC的独立预后预测因子。研究显示,METTL3[20]、METTL5[21]和WTAP[22]在肾癌患者的肿瘤组织中表达上调,表达量与肿瘤大小和TNM分期呈正相关,晚期患者的METTL3[23]、METTL5和WTAP[24]的表达水平更高,生存率更低,提示其在RCC中的致癌作用。
经TCGA数据库和临床样本分析显示,METTL14在RCC组织[25]、METTL24在ccRCC[26]组织中的表达下调,表达水平与肿瘤大小、病理分级和转移率呈负相关。Zhang et al[27]揭示转移性RCC组织样本中METTL14表达明显低于原发RCC组织,提示METTL14与RCC转移之间的关系。Cai et al[28]发现METTL24表达水平与癌症患者预后相关,可作为肾癌的潜在预后生物标志物。
2.2 去甲基转移酶与RCC的关系研究表明ALKBH1[29]和ALKBH5[30]在RCC组织中,FTO和ALKBH5在ccRCC组织[31]中的表达上调。ALKBH1表达量与RCC的恶性特征相关[29];ALKBH5高表达组患者的肿瘤更大、TNM分期更高、预后更差[30];FTO和ALKBH5的表达水平与RCC患者预后相关[31],敲低FTO和ALKBH5可抑制ccRCC细胞中的上皮-间质转化和细胞周期进展,促进RCC细胞的迁移和增殖。
2.3 阅读蛋白与RCC的关系m6A阅读蛋白YTHDC1、YTHDC2、YTHDF1、YTHDF2和IGF2BPs等在RCC组织和正常肾组织间存在差异表达[32]。Ying et al[33]发现,IGF2BPs在RCC中高表达,且IGF2BPs表达量越高患者预后越差。Li et al[34]发现,YTHDC1在ccRCC中表达下调,表达量越低的ccRCC患者预后越差,且YTHDC1过表达可抑制ccRCC在体内外的增殖、侵袭和转移,表明YTHDC1在ccRCC中发挥抑癌作用。研究[25]显示,METTL14通过募集阅读蛋白YTHDF2,抑制促癌基因表达从而抑制RCC的生长和转移。
3 m6A甲基化在RCC中的作用机制
m6A甲基化的调控因子可通过调控原癌基因表达、调节细胞代谢、调节肿瘤免疫多种机制在RCC中起到促癌或抑癌作用。
3.1 调控原癌基因表达METTL3可通过促进原癌基因人HERV-HLTR关联蛋白2(human HERV-HLTR-associating protein 2,HHLA2)的mRNA稳定性,上调HHLA2表达从而促进癌细胞增殖和迁移[35]。ALKBH1通过促进原癌基因G蛋白偶联受体137[29]和极光激酶B(aurora kinase B,AURKB)[30]的mRNA稳定性并上调其表达,上调的AURKB蛋白能够促进RCC细胞在体内外的增殖。WTAP通过直接结合周期蛋白依赖性激酶1(cyclin-dependent kinases 1,CDK1)的转录物,增强其mRNA稳定性,上调CDK2表达[24],CDK2的异常表达可使细胞越过G1/S极限,缩短细胞周期,促进细胞恶性增殖。Ying et al[33]揭示了WTAP通过促进致癌基因鞘氨醇1磷酸酯受体3(recombinant sphingosine 1 phosphate receptor 3,S1PR3)mRNA的稳定性,激活PI3K/AKT通路从而促进RCC细胞的增殖和迁移。
Gong et al[36]研究发现,METTL14可通过介导P2RX6的前体mRNA剪切,下调其表达从而抑制RCC发展。METTL14依赖于YTHDF2的RNA降解作用,加速核富集转录本1(nuclear enriched abundant transcript 1,NEAT1)[25]和整合素β4(integrin beta 4,ITGB4)[37]的mRNA降解,下调原癌基因表达从而抑制RCC细胞增殖和迁移。类似地,Li et al[34]的研究结果显示,敲低YTHDC1可增加原癌基因膜联蛋白A1(annexin A1,ANXA1)的mRNA稳定性,而过表达的YTHDC1通过下调ANXA1表达,抑制MAPK信号通路的激活,从而抑制ccRCC进展。
3.2 调节细胞代谢Shim et al[38]研究发现,癌细胞代谢产物右旋羟戊二酸(R-2-hydroxyglutarate,R-2HG)在ccRCC细胞中高浓度累积,可与包括FTO和ALKBH5在内的多种m6A修饰酶的活性位点结合[39],提示m6A甲基化修饰与细胞代谢之间存在联系。Shi et al[23]发现METTL3可通过ATP结合盒(ATP-binding cassette,ABC)转运蛋白D1(ABCD1)调节细胞代谢促进RCC进展,METTL3选择性靶向ABCD1,提高β氧化和线粒体功能从而促进肾细胞癌肿瘤球体形成和细胞迁移。VHL基因(von hippel-Lindau)缺乏或突变是ccRCC的常见特征[40],VHL失活导致缺氧诱导因子(HIFs)激活,这对ccRCC的细胞代谢重编程具有重要价值,而代谢重编码可促进肾癌细胞迅速增殖[41]。Xiao et al[42]发现,VHL缺失或突变的ccRCC肿瘤中FTO表达增加,FTO通过促进溶质载体家族1成员5(solute carrier 1 family member 5,SLC1A5)表达,促进VHL缺陷型ccRCC细胞的代谢重编程和存活。Ying et al[33]揭示IGF2BP1通过直接结合乳酸脱氢酶A(lactate dehydrogenase A,LDHA),促进LDHA的mRNA稳定性上调其表达,促进ccRCC的有氧糖酵解过程从而促进癌细胞增殖。Zhang et al[27]研究发现,敲除METTL14可上调溴区结构域转录因子(bromodomain PHD-finger transcription factor, BPTF)蛋白的表达,BPTF可通过糖酵解重编码和代谢重塑,显著提高RCC细胞糖酵解活性和迁移能力和RCC细胞的迁移速度。
3.3 调节肿瘤免疫Wei et al[21]揭示了METTL5在肾癌免疫调节中的作用。METTL5的表达与包括NKT细胞、CD8+T细胞、CD4+T细胞和巨噬细胞在内的多种免疫细胞的浸润率呈负相关,恶性肿瘤中浸润的CD8+T细胞和CD4+T细胞可抑制肿瘤[43]。并且,METTL5对高免疫浸润和低免疫浸润患者的生存期有不同影响,表明METTL5可能通过调节多种免疫细胞浸润,在RCC中发挥致癌作用。相反,Jiang et al[26]研究发现,METTL24与免疫细胞的表达呈正相关,同时,METTL24的表达对不同免疫浸润水平的ccRCC患者的总生存率影响不同,提示METTL24可能通过调节免疫微环境发挥抑癌作用。
4 m6A甲基化修饰相关调控因子抑制剂的临床应用
目前,以手术和放化疗为主的综合方案是治疗RCC的主要手段,但患者复发和转移率较高,预后较差。基于m6A甲基化修饰与肿瘤的密切联系,从分子层面研究RCC的发生发展,有利于寻找有效治疗靶点,探索新的治疗策略。多种m6A甲基化修饰调控因子能够促进RCC的发生发展,因此靶向抑制这类因子可能为RCC的治疗提供新思路。
剑桥大学Tony Kouzarides[44]的研究团队使用METTL3特异性小分子抑制剂抑制其活性,在体外抑制急性髓系白血病(acute myelocytic leukemia,AML)癌细胞的生长和增殖,抑制小鼠体内癌细胞的增殖并延长了小鼠寿命。同样,过表达的METTL3也会促进RCC进展[20],因此,靶向抑制METTL3的药物或许能够提高RCC患者的生存率。目前,多种FTO抑制剂的抑瘤作用已被证明,FTO抑制剂MA2能有效抑制胶质母细胞瘤的发生[45], FTO选择性抑制剂MO-I-500能显著抑制三阴性乳腺癌细胞的增殖和存活[46],FTO抑制剂或能为RCC的治疗带来新方法。前期研究显示[47],用METTL3抑制剂Cpd-564可预防肾损伤和炎症。因此,m6A相关调控因子可成为RCC靶向治疗研究中的重要方向。虽然这些抑制剂在人体中的安全性和有效性仍缺乏有效证据,但为提高RCC患者生活质量、延长寿命提供了希望。由于METTL5[21]、WTAP和IGF2BP1[33]在RCC中发挥致癌作用,特异性抑制其活性或许是RCC治疗的新思路。
5 总结与展望
现有研究结果表明,多种m6A甲基化修饰相关的调控因子在RCC中扮演重要角色。比如,m6A甲基转移酶METTL3、METTL5和WTAP在RCC中发挥原癌基因的作用,METTL14抑制肾癌细胞在体内外的增殖和迁移;去甲基转移酶ALKBH1、ALKBH5和FTO促进RCC进展;YTHDF2及IGF2BPs在内的多种阅读蛋白与RCC的发生发展及不良预后相关。本文综述了m6A修饰相关酶在RCC发生发展中的作用和机制,目前研究显示,m6A甲基化修饰通过调控下游靶标基因的表达发挥作用,或进一步调控相关信号通路影响肿瘤细胞的增殖和迁移,或调控肿瘤能量代谢影响肿瘤细胞的恶性增殖,或通过免疫调节在RCC中发挥作用。然而,m6A甲基化修饰在RCC中的作用机制仍存在其他可能,未来需要通过更多的机制性研究来证明。
目前多项研究发现m6A甲基化修饰相关调控因子抑制剂能够抑制AML、胶质母细胞瘤、三阴性乳腺癌细胞等多种癌细胞的增殖。然而,迄今为止,尚无针对m6A调控因子的靶向小分子抑制剂和抗体药物成功应用于临床。基于m6A甲基化修饰在RCC发生发展过程中的重要作用,其相关的调控因子可成为RCC疾病治疗的潜在重要靶点。目前,急需开发有效的治疗药物,为RCC的治疗提供新的思路和方法。

