低氧条件下SIRT3调控ROS介导的氧化应激反应对肺癌细胞凋亡的影响
黄 波,丁 洁,郭红荣,王红娟,徐建群,郑 泉
肺癌是全球最常见的癌症之一,发病率和病死率高[1]。低氧是肿瘤快速生长中过量氧消耗和血管供应不足所导致的重要肿瘤微环境特征[2]。低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)的表达是低氧的标志,HIF-1α可通过调节肿瘤细胞的血管生成和细胞周期进程等促进肿瘤进展[3]。去乙酰化酶3(sirtuin 3, SIRT3)被证实在非小细胞肺癌(non-small cell lung cancer, NSCLC)组织中高表达,与NSCLC的发生发展相关[4]。有文献[5]报道SIRT3可通过抑制线粒体活性氧(reactive oxygen species, ROS)的生成抑制HIF-1α和肿瘤生长,但在低氧条件下SIRT3是否可以通过调节ROS的生成从而影响肺癌细胞中的氧化应激和HIF-1α表达,目前尚未见报道。因此,该研究旨在探讨低氧条件下SIRT3通过ROS对肺癌细胞中的氧化应激反应和HIF-1α表达的影响及其机制,为肺癌的靶向治疗提供参考依据。
1 材料与方法
1.1 主要材料人非小细胞肺癌A549细胞购于中国科学院上海细胞库。ROS抑制剂N-乙酰半胱胺酸(n-acetylcysteine, NAC)(货号:HY-B0215)购于美国MCE公司,F12K培养基(货号:21127-022)购于美国Gibco公司,BCA蛋白浓度测定试剂盒、RIPA细胞裂解液、MTT(货号:PC0020、R0010、M1025)购于北京索莱宝科技有限公司,一抗SIRT3、HIF-1α、GAPDH和HRP标记的山羊抗兔IgG二抗(货号:PAB35180、PAB37598、PAB36269、SAB43714)购于武汉贝茵莱生物科技有限公司,SYBR FAST qPCR Master Mix(货号:KM4101)购于美国KAPA Biosystems公司,TRIzol(货号:15596026)购于美国ambion公司,逆转录试剂盒(货号:6210A)购于日本TAKARA公司,DMSO(货号:D2650)购于美国SIGMA公司,AnnexinV-PE/7 AAD凋亡检测试剂盒(货号:559763)购于美国BD公司,ROS检测试剂盒(含ROS荧光探针2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate, DCFH-DA)(货号:S0033)购于上海碧云天生物技术有限公司,丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(super oxide dimutese, SOD)、谷胱甘肽(glutathione, GSH)测定试剂盒(货号:A003-1-2、A001-3-2、A006-2-1)购于南京建成生物工程研究所。311型CO2恒温培养箱购自美国Thermo公司,AMR-100酶标仪购自杭州奥盛仪器有限公司,NovoCyte流式细胞仪购自美国ACEA公司,CFX-Connect 96荧光定量PCR仪、mini protean 3 cell电泳仪购自美国Bio-Rad公司。
1.2 方法
1.2.1细胞培养及低氧细胞模型的构建 A549细胞用含10%胎牛血清的F12K培养基培置于37 ℃、5%CO2的培养箱中培养。细胞融合度达到80%以上时,胰酶消化细胞,按1 ∶2的比例传代培养。取对数生长期的细胞接种至6孔板中,5×105个细胞/孔,每孔2 ml,置于37 ℃、5%CO2培养箱中培养24 h。将细胞暴露于低氧(5%~8%O2)条件下培养0、12、24、48 h,RT-PCR和Western blot检测低氧条件下不同培养时间细胞中HIF-1α和SIRT3 mRNA和蛋白的表达,由此确定最佳低氧诱导时间。
1.2.2构建SIRT3过表达慢病毒载体和稳转株 根据SIRT3的序列构建过表达慢病毒载体,转染至肺癌细胞中,并筛选获得稳转株,以未转染的细胞和转染空载的细胞为对照,RT-PCR检测细胞中SIRT3 mRNA的表达,验证转染效率,显示慢病毒转染和稳转株构建成功。
1.2.3细胞分组及处理 将A549细胞分成5组:对照组、低氧组、低氧+ROS抑制剂NAC组、低氧+SIRT3过表达(SIRT3 overexpression, SIRT3-OE)组和低氧+SIRT3-OE+NAC组。对照组细胞正常培养;低氧组细胞暴露于低氧条件下培养24 h;低氧+NAC组先用20 mmol/L的NAC诱导24 h[6],再暴露于低氧条件下培养24 h;低氧+SIRT3-OE组将SIRT3过表达慢病毒细胞稳转株在低氧条件下培养24 h;低氧+SIRT3-OE+NAC组将SIRT3过表达慢病毒细胞稳转株用20 mmol/L的NAC诱导24 h,于低氧条件下培养24 h。处理完成后,取出细胞培养板,加入MTT溶液,培养4 h后吸去上清液,加入DMSO溶解液,摇床低速振荡10 min,结晶物充分溶解后酶标仪检测490 nm处的吸光度值,以检测细胞增殖情况。
1.2.4流式细胞术检测细胞凋亡 收集细胞,加入预冷的PBS洗涤,PBS重悬细胞,加入10 μl Annexin V-FITC和7 AAD,混匀,4 ℃避光孵育30 min,加入PBS,上流式细胞仪检测。
1.2.5RT-PCR和Western blot法检测细胞中HIF-1α和SIRT3 mRNA和蛋白的表达 收集细胞,TRIzol法提取细胞总RNA,逆转录合成cDNA,进行PCR扩增,引物序列表见表1。以GAPDH为内参,2-△△Ct法计算目的基因的相对表达量。提取细胞总蛋白,BCA法进行蛋白质定量,上样电泳,湿转至PVDF膜,5%脱脂奶粉封闭,加入一抗稀释液(1 ∶1 000)室温孵育1 h,洗膜3次,加入二抗稀释液(1 ∶20 000)室温孵育1 h,洗膜3次,ECL显影,TANON GIS软件读取条带灰度值,目的蛋白与内参蛋白的比值即为目的蛋白的相对表达量。

表1 引物序列表
1.2.6流式细胞术检测细胞中ROS含量 用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。收集1.2.3项各组细胞悬浮于稀释好的DCFH-DA中,置于37 ℃、5%CO2的培养箱中孵育20 min,待DCFH-DA和细胞充分接触后用无血清细胞培养液洗涤细胞,PBS重悬,上流式细胞仪检测。
1.2.7生化试剂盒检测细胞中MDA、SOD和GSH的含量 收集1.2.3项各组细胞上清液,严格按照试剂盒说明书步骤检测MDA、SOD和GSH的含量。
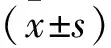
2 结果
2.1 低氧暴露不同时间对A549细胞中HIF-1α和SIRT3 mRNA和蛋白表达的影响与0 h相比,低氧暴露12 h细胞中HIF-1α mRNA水平变化差异无统计学意义(t=-1.78,P>0.05),HIF-1α蛋白水平升高(t=-5.36,P<0.01),SIRT3 mRNA和蛋白水平均降低(tmRNA=-6.38,t蛋白=5.81, 均P<0.01);低氧暴露24 h和48 h细胞中HIF-1α mRNA和蛋白水平均升高(tmRNA(24 h)=-6.92,tmRNA(48 h)=-12.47,t蛋白(24 h)=-7.51,t蛋白(48 h)=-11.11, 均P<0.01),SIRT3 mRNA和蛋白水平均降低(tmRNA(24 h)=10.95,tmRNA(48 h)=13.76,t蛋白(24 h)=11.95,t蛋白(48 h)=17.63, 均P<0.01)。见图1。因此最终确定最佳低氧诱导时间为24 h。
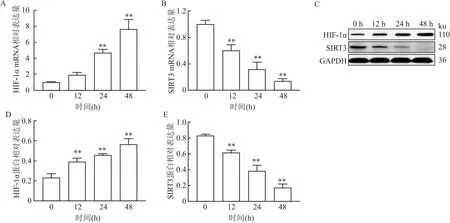
图1 低氧暴露不同时间细胞中HIF-1α和SIRT3 mRNA和蛋白表达水平的比较
2.2 低氧条件下过表达SIRT3对A549细胞增殖的影响与对照组(0.90±0.02)相比,低氧组(1.26±0.02)细胞增殖能力升高(t=-16.28,P<0.01);与低氧组比较,低氧+NAC组(0.88±0.03)和低氧+SIRT3-OE组(0.97±0.01)细胞增殖能力均降低(t低氧+NAC组=16.92,t低氧+SIRT3-OE组=13.21, 均P<0.01);与低氧+NAC组相比,低氧+SIRT3-OE+NAC组(0.74±0.04)细胞增殖能力降低(t=6.46,P<0.01)。见图2。
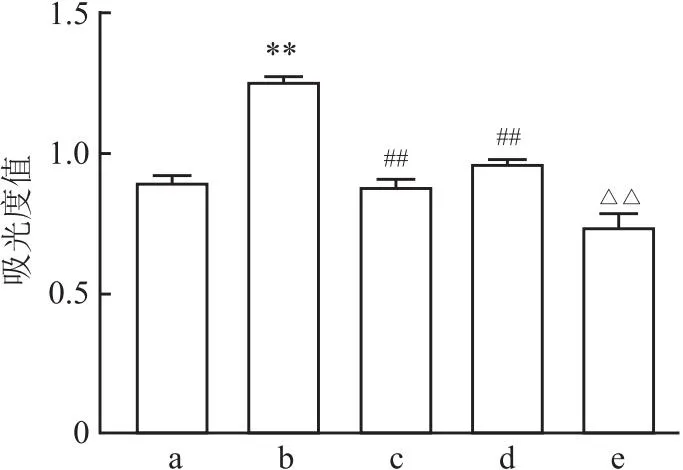
图2 各组细胞增殖能力的比较
2.3 低氧条件下过表达SIRT3对A549细胞凋亡的影响与对照组(8.59%±0.51%)相比,低氧组(3.98%±0.33%)细胞凋亡率降低(t=3.45,P<0.05);与低氧组比较,低氧+NAC组(15.50%±1.04%)和低氧+SIRT3-OE组(16.55%±0.43%)细胞凋亡率均升高(t低氧+NAC组=-8.62,t低氧+SIRT3-OE组=-9.41, 均P<0.01);与低氧+NAC组相比,低氧+SIRT3-OE+NAC组(25.90%±3.43%)细胞凋亡率升高(t=-7.78,P<0.01)。见图3。
图3 各组细胞凋亡率的比较
2.4 低氧条件下过表达SIRT3对A549细胞中HIF-1α表达的影响与对照组相比,低氧组细胞中HIF-1α mRNA和蛋白表达水平升高(tmRNA=-14.32,t蛋白=-20.21, 均P<0.01),SIRT3 mRNA和蛋白表达水平降低(tmRNA=22.89,t蛋白=16.41, 均P<0.01);与低氧组相比,低氧+NAC组和低氧+SIRT3-OE组细胞中HIF-1α mRNA和蛋白表达水平降低(tmRNA(低氧+NAC组)=-7.21,tmRNA(低氧+SIRT3-OE组)=8.44,t蛋白(低氧+NAC组)=5.60,t蛋白(低氧+SIRT3-OE组)=9.00, 均P<0.01),SIRT3 mRNA和蛋白表达水平升高(tmRNA(低氧+NAC组)=-4.49,tmRNA(低氧+SIRT3-OE组)=-5.34,t蛋白(低氧+NAC组)=-6.21,t蛋白(低氧+SIRT3-OE组)=-9.08, 均P<0.01);与低氧+NAC组相比,低氧+SIRT3-OE+NAC组细胞中HIF-1α mRNA和蛋白表达水平降低(tmRNA=5.70,t蛋白=7.65, 均P<0.01),SIRT3 mRNA和蛋白表达水平升高(tmRNA=-8.20,t蛋白=-8.57, 均P<0.01)。见图4。
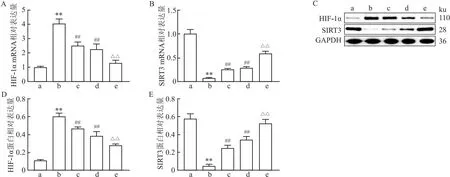
图4 各组细胞中HIF-1α和SIRT3的mRNA和蛋白表达水平的比较
2.5 低氧条件下过表达SIRT3对A549细胞中ROS含量的影响与对照组(5.80%±1.85%)相比,低氧组(47.43%±4.01%)细胞中ROS含量升高(t=-18.67,P<0.01);与低氧组相比,低氧+NAC组(35.77%±2.58%)和低氧+SIRT3-OE组(29.67%±1.57%)细胞中ROS含量均降低(t低氧+NAC组=5.23,t低氧+SIRT3-OE组=7.96, 均P<0.01);与低氧+NAC组相比,低氧+SIRT3-OE+NAC组(19.80%±2.95%)细胞中ROS含量降低(t=7.16,P<0.01)。见图5。

图5 各组细胞中ROS含量的比较
2.6 低氧条件下过表达SIRT3对A549细胞中MDA、SOD和GSH含量的影响与对照组相比,低氧组细胞中MDA含量升高(t=-18.44,P<0.01),SOD和GSH含量降低(tSOD=14.79,tGSH=20.94, 均P<0.01);与低氧组相比,低氧+NAC组和低氧+SIRT3-OE组细胞中MDA含量降低(t低氧+NAC组=7.62,t低氧+SIRT3-OE组=11.74, 均P<0.01),SOD(t低氧+NAC组=-6.44,t低氧+SIRT3-OE组=-8.65, 均P<0.01)和GSH含量升高(t低氧+NAC组=-7.19,t低氧+SIRT3-OE组=-12.76, 均P<0.01);与低氧+NAC组相比,低氧+SIRT3-OE+NAC组细胞中MDA含量降低(t=9.37,P<0.01),SOD和GSH含量升高(tSOD=-5.80,tGSH=-10.14, 均P<0.01)。见图6。
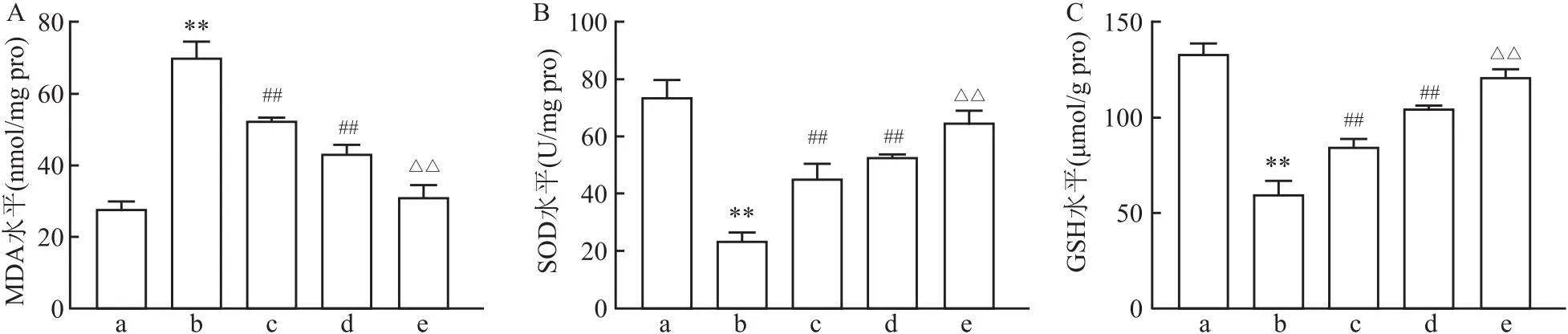
图6 各组细胞中MDA、SOD和GSH含量的比较
3 讨论
研究[7]表明,SIRT3在NSCLC中具有抑癌作用。本研究结果显示,低氧条件下过表达SIRT3能够促进肿瘤细胞凋亡,并抑制肿瘤细胞增殖,提示SIRT3具有肿瘤抑制作用,与前人研究结果一致[7-8]。肿瘤微环境在维持NSCLC的发生和发展中具有重要作用。炎症细胞浸润、血管、可溶性因子和低氧状态等构成了NSCLC中的肿瘤微环境,其中低氧是肺癌肿瘤最常见的微环境特征,能够影响癌细胞的转移和代谢[2]。肿瘤细胞对低氧的适应主要受HIF的调节,HIF可随着细胞氧水平的降低而增加[9]。低氧时HIF-1α水平的升高,可以调节细胞代谢,诱导存活分子的产生、促进新生血管的形成,使肿瘤细胞在低氧条件下存活和转移,从而促进肿瘤生长、侵袭和转移[3]。研究[10]表明,HIF-1α的表达受SIRT3介导的去乙酰化调控。本研究结果显示,低氧条件下过表达SIRT3能够抑制HIF-1α的表达,与前期研究[11]结果一致,提示低氧条件下SIRT3能够通过抑制HIF-1α的表达来抑制肿瘤进展。
研究[12]发现,SIRT3在调节线粒体功能和ROS产生中也发挥重要作用。ROS是一种非常重要的生物活性物质,可通过诱导脂质过氧化或破坏细胞内蛋白质和核酸诱导细胞坏死或凋亡,被认为是治疗癌症的重要药物[13]。在癌细胞中,ROS信号传导在细胞的存活、转录、蛋白质翻译以及肿瘤的形成和发展中起着重要作用。高水平的ROS有助于癌细胞增殖、DNA改变、凋亡、转移和血管生成[14]。本研究结果显示,低氧条件下过表达SIRT3能够抑制ROS的增加,表明SIRT3对ROS具有抑制作用。此外还检测了低氧条件下过表达SIRT3对A549细胞中氧化应激相关指标MDA、SOD和GSH的影响,其中MDA是脂质过氧化氢的最终产物,是ROS的指示物;SOD是一种将O2-催化还原为过氧化氢的酶;GSH可以催化过氧化氢和其他过氧化物的还原,具有抗氧化作用[15]。结果显示,过表达SIRT3能够降低MDA水平,升高SOD和GSH水平。为明确低氧条件下SIRT3调控ROS的机制,用ROS抑制剂NAC处理A549细胞,结果显示,与NAC单独处理相比,NAC联合过表达SIRT3后细胞ROS水平降低,MDA水平降低,SOD和GSH水平升高,表明SIRT3能够通过抑制ROS来抑制氧化应激反应,NAC联合过表达SIRT3细胞中HIF-1α的表达降低,细胞凋亡率升高。

