针刺对偏头痛大鼠三叉神经节和三叉神经脊束尾核A1R/ERK1/2/CGRP通路的影响
林淑芳,王 舰,陈 白,饶 婷,姚娟娟,曹丽萍,江一静△
(1.福建中医药大学附属康复医院,福建 福州 350003;2.福建省康复技术重点实验室,福建 福州 350003)
偏头痛是一种反复发作且高度致残的慢性神经障碍性疾病,每年的患病率达15%[1-2],是部分心血管疾病的重要危险因素[3],长期反复发作使患者生活质量受到严重影响[4]。在偏头痛的辨证分型中,肝阳上亢证最为常见[5]。针刺在偏头痛的治疗中应用广泛,临床疗效确切[6]。目前已有机构正进行针刺治疗偏头痛相关循证指南的研制,致力于推动针刺治疗偏头痛在国内外安全、规范地应用和推广[7]。课题组前期已证实针刺太冲穴可改善偏头痛临床症状[8],但机制不明。在偏头痛发生发展机制中,以神经源性炎性反应为主要特征的三叉神经血管反射学说是国内外学者研究探讨的焦点[9]。三叉神经节(Trigeminal ganglion,TG)分布着三叉神经血管系统的一级神经元,三叉神经脊束尾核(Spinal trigeminal nucleus caudalis,TNC)分布着该系统的二级神经元。降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)是引起神经源性炎症反应的重要血管活性物质,广泛表达于TG和TNC中,是偏头痛病理生理过程的重要参与者[10]。研究发现,腺苷A1受体(Adenosine A1 receptor, A1R)激活后能抑制偏头痛大鼠三叉神经血管系统中神经源性炎性反应及痛觉敏化,显著降低CGRP表达[11-12],并且观察到激活的A1R能通过细胞外信号调节激酶1/2(Extracellular signal regulated kinase 1/2,ERK1/2)进行信号传导[13],阻断ERK1/2信号通路疼痛信号转导,实现镇痛作用。因此,本研究以肝阳上亢偏头痛大鼠为研究对象,通过观察大鼠TG、TNC中 A1R、ERK1/2和CGRP表达,探讨针刺太冲穴治疗偏头痛的可能机制。
1 材料与方法
1.1 实验动物及分组
66只健康雄性SD大鼠,体质量180~220 g,由福建中医药大学动物实验中心提供[许可证号:SYXK(闽)2020-0002],在福建中医药大学实验动物中心动物房(SPF级)喂养,自由摄食、饮水。动物房温度恒定于22 ℃,湿度恒定于50%,光暗周期为12 h。整个实验过程中以《关于善待实验动物的指导性意见》[14]作为处理动物的参考,经福建中医药大学伦理委员会批准同意(FJTCM IACUC:2022054),遵循实验动物伦理学原则。
适应性喂养1周,66只大鼠随机分为空白对照组10只、模型组56只,其中50只模型组大鼠顺利建模(附子汤灌胃结合颈肩部皮下注射硝酸甘油建立肝阳上亢偏头痛模型),将成模的大鼠随机分为模型组、太冲组、非穴组、太冲+DPCPX组和太冲+EGF组,每组10只。
1.2 主要仪器和试剂
1.2.1 仪器 华佗牌无菌针灸针(0.25 mm×13 mm,200135,苏州医疗用品厂有限公司);恒温水浴锅(HWS24,上海一恒科技有限公司);光学显微镜(DM750,德国LEICA公司);蛋白成像系统(ChemiDoc XRS+,美国Bio-Rad伯乐);研磨机(JXFTPRP-48,上海净信实业发展有限公司);超微量紫外可见分光光度计(ND-100c,杭州米欧仪器有限公司);高速冷冻离心机(5810R,德国Eppendorf公司);激光共聚焦显微镜(TCS-SP8 SR,德国LEICA公司);荧光定量PCR仪(ABI7500,美国ABI公司);琼脂糖水平电泳仪(DYCP-31DN,北京六一生物科技有限公司)。
1.2.2 试剂 硝酸甘油注射液(1210901,广州白云山明兴制药有限公司);8-环戊基-1,3二丙基黄嘌呤(DPCPX)、表皮生长因子(EGF)(美国Sigma-Aldrich公司);CGRP、A1R、ERK1、ERK2及GAPDH引物(上海博尚生物工程技术有限公司);Western blot试剂盒(E-IR-R304B,武汉伊莱瑞生物科技股份有限公司);兔抗大鼠CGRP抗体、兔抗大鼠A1R抗体、兔抗大鼠p-A1R抗体、兔抗ERK1/2抗体、辣根酶标记的山羊抗兔IgG抗体、鼠抗p-ERK1/2抗体和GAPDH单克隆抗体(北京乐博生物科技有限公司);逆转录试剂盒(R123-01,南京诺唯赞生物科技股份有限公司);总RNA提取试剂盒(RN0101,北京艾德莱生物科技有限公司);QPCR试剂盒(S2024LT,Singabio公司)。
1.3 偏头痛大鼠模型制备
本研究以附子汤灌胃[15]加注射硝酸甘油方法[16]复制肝阳上亢型偏头痛模型。将20 g制附子浸泡30 min,煎煮2次后将药液混合,浓缩为含生药0.1 g/mL的附子浓缩液,以20 mL/kg/d的剂量连续灌胃21 d,当大鼠出现眼结膜颜色变红,抓尾时尖叫、惊跳甚至咬人等易激惹表现时提示肝阳上亢证模型复制成功;再用0.9% NaCL将硝酸甘油注射液稀释成浓度为2 mg/mL溶液,以10 mg/kg算出每只SD大鼠所需注射的剂量,用5 mL注射器抽取相对应剂量溶液,在大鼠右肩颈部皮下缓缓注射,1次/d,共5 d;给药后5 min内,SD大鼠出现双耳发红,爬笼以及挠头次数增加等烦躁不安的症状,为偏头痛模型制备成功[17]。
1.4 干预方法
造模成功且第1次行为学观察后进行针刺干预,具体方法如下。
1.4.1 空白对照组 常规饲养,仅抓取,不予治疗。
1.4.2 模型组 常规饲养,仅抓取,不予治疗。
1.4.3 太冲组 针刺双侧太冲穴[18],用0.25 mm×13 mm的一次性无菌针灸针直刺2~3 mm,捻转泻法1 min,每10 min行针1次,留针30 min。
1.4.4 非穴组 针刺双侧胁下固定非穴点(双侧髂嵴直上10 mm处),约30°斜刺2~3 mm,行针手法同太冲组。
1.4.5 太冲+DPCPX组 注射硝酸甘油后随即腹腔注射DPCPX[19](0.125 mL/100 g,A1R拮抗剂);针刺双侧太冲穴,操作同太冲组。
1.4.6 太冲+EGF组 注射硝酸甘油后随即腹腔注射EGF[20](50 μg/Kg,ERK1/2激动剂);针刺双侧太冲穴,操作同太冲组。
1.5 观察指标及检测方法
1.5.1 行为学 观察大鼠耳红持续时间、挠头和爬笼次数[21]:记录给药后大鼠耳红症状出现及消失的时间,并计算整个耳红过程的持续时间(耳红持续时间=耳红症状消失的时间-耳红症状出现的时间);单位时间内挠头和爬笼次数:在针刺前1 h、针刺后1 h和针刺后2 h共3个时间段内(以每1 h作为1个时间段),观察记录每个单位时间段内大鼠挠头(以前肢挠头作为挠头行为标志,以连续挠头达5次及以上作为挠头出现的标志)和爬笼(以前肢抓笼作为爬笼行为标志)的次数,针刺治疗期间不记次。
1.5.2 荧光定量PCR法检测大鼠TG、TNC中A1R、ERK1、ERK2及CGRP mRNA表达 行为学观察后,腹腔注射0.3%戊巴比妥钠(10 mL/kg)麻醉,断头处死大鼠,迅速分离取出TG和TNC,置冰盒内放-80 ℃冰箱暂存。取出TG或TNC,在液氮中研磨后取适量组织,用Trizol法提取总RNA;按逆转录试剂盒的说明,配置逆转录反应体系30 μL(42 ℃,孵育2 min),合成cDNA;设置扩增条件(95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40次)进行q-PCR扩增;电泳后用凝胶图像处理系统采集分析数据,参考大鼠A1R、ERK1、ERK2及CGRP的mRNA序列,内参基因为相应种属的GAPDH;目标基因和内参基因均运用Primer Premier5.0进行设计,用2-△△Ct计算各样品的相对表达量,PCR引物详细信息见表1。

表1 PCR引物序列
1.5.3 Western blot法检测大鼠TG、TNC中A1R、p-A1R、ERK1/2、p-ERK1/2及CGRP蛋白表达 在-80 ℃冰箱中取出并称取TG或TNC组织块,在液氮中研磨后取适量组织加入1 mL蛋白裂解液,以60 Hz,30 s,振动3次进行粉碎,在4 ℃条件下,12 000 r/min的转速离心15 min,收集上清液;参照试剂盒测定蛋白浓度;配胶(现配现用),蛋白电泳顺序为(30V10 min-80 V30 min-120 V40~50 min);转移到PVDF膜,封闭过夜,加一抗(兔抗大鼠CGRP抗体1∶500、兔抗大鼠A1R抗体1∶500、兔抗大鼠p-A1R抗体1∶500、兔抗ERK1/2抗体1∶500、鼠抗p-ERK1/2抗体1∶500及GAPDH单克隆抗体1∶1 000),4 ℃温度环境下孵育过夜;第2天清洗PBST3次,每次5 min,再加辣根酶标记的山羊抗兔IgG抗体(1∶1 000)孵育,PBST清洗(5 min×3次)后经化学发光,显影后用蛋白成像系统拍照分析,测定各个条带光密度值,以目的条带光密度值与内参GAPDH光密度值的比值来量化A1R、p-A1R、ERK1/2、p-ERK1/2及CGRP mRNA的表达。
1.6 统计学处理

2 结果
2.1 各组大鼠造模后行为学观察
空白对照组不出现耳红,其余各组均在注射硝酸甘油后3~4 min出现耳红,持续3 h左右后消失;与模型组比较,太冲组大鼠耳红持续时间明显减少,差异具有统计学意义(P<0.05);与太冲组比较,非穴组、太冲+DPCPX组和太冲+EGF组大鼠耳红持续时间明显增加,差异具有统计学意义(P<0.05)。见表2。

表2 各组大鼠造模后耳红持续时间的比较
空白对照组在各时间段内仅有少数几次挠头、爬笼。在针刺前1 h,与空白对照组比较,其余组大鼠挠头、爬笼次数均频繁,差异具有统计学意义(P<0.05);与模型组比较,太冲组、非穴组、太冲+DPCPX组和太冲+EGF组差异无统计学意义(P>0.05)。针刺后1 h、2 h,与模型组相比较,太冲组大鼠挠头、爬笼次数均明显减少,差异具有统计学意义(P<0.05);与太冲组比较,非穴组、太冲+DPCPX组和太冲+EGF组挠头、爬笼次数均明显增多,差异具有统计学意义(P<0.05)。见表3。

表3 各组大鼠针刺前后各时间段挠头和爬笼次数的比较
2.2 各组大鼠TG、TNC中A1R、ERK1、ERK2及CGRP的mRNA表达水平比较
与空白对照组比较,模型组大鼠TG、TNC中ERK1、ERK2及CGRP的mRNA表达均增加,差异具有统计学意义(P<0.05),A1R mRNA表达均减少,差异具有统计学意义(P<0.05);与模型组比较,太冲组大鼠TG、TNC中ERK1、ERK2及CGRP的mRNA表达均减少,差异具有统计学意义(P<0.05),A1R mRNA表达均增加,差异具有统计学意义(P<0.05);与太冲组比较,非穴组、太冲+DPCPX组及太冲+EGF组大鼠TG、TNC中ERK1、ERK2及CGRP的mRNA表达均增加,差异具有统计学意义(P<0.05),A1R mRNA表达均减少,差异具有统计学意义(P<0.05)。见表4、5及图1。

图1 大鼠RNA琼脂糖凝胶电泳图

表4 各组大鼠TG中A1R、ERK1、ERK2及CGRP mRNA相对表达量比较

表5 各组大鼠TNC中A1R、ERK1、ERK2及CGRP mRNA相对表达量比较
2.3 各组大鼠TG、TNC中A1R、p-A1R、ERK1/2、p-ERK1/2及CGRP蛋白表达比较
与空白对照组比较,模型组大鼠TG、TNC中ERK1/2、p-ERK1/2及CGRP蛋白表达均增加,差异具有统计学意义(P<0.05),A1R、p-A1R蛋白表达均减少,差异具有统计学意义(P<0.05);与模型组比较,太冲组大鼠TG、TNC中ERK1/2、p-ERK1/2及CGRP蛋白表达均减少,差异具有统计学意义(P<0.05),A1R、p-A1R蛋白表达均增加,差异具有统计学意义(P<0.05);与太冲组比较,非穴组、太冲+DPCPX组及太冲+EGF组大鼠TG、TNC中ERK1/2、p-ERK1/2、CGRP蛋白表达均增加,差异具有统计学意义(P<0.05),A1R、p-A1R蛋白表达均减少,差异具有统计学意义(P<0.05)。见表6、7及图2、3。
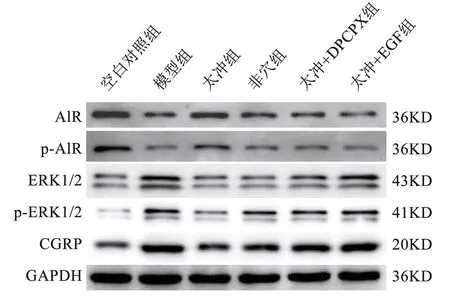
图2 各组大鼠TG中A1R、p-A1R、ERK1/2、p-ERK1/2及CGRP蛋白表达

图3 各组大鼠TNC中A1R、p-A1R、ERK1/2、p-ERK1/2及蛋白表达

表6 各组大鼠TG中A1R、p-A1R、ERK1/2、p-ERK1/2及CGRP蛋白相对表达量

表7 各组大鼠TNC中A1R、p-A1R、ERK1/2、p-ERK1/2及CGRP蛋白相对表达量
3 讨论
在偏头痛的发病机制研究中,三叉神经血管学说受到普遍关注,该学说认为神经源性炎性反应是偏头痛发病的关键[9,22],TG和TNC是三叉神经血管上行疼痛通路中参与神经源性反应的重要组成部分,二者均可表达与偏头痛发病和慢性化相关的炎性介质,如CGRP、ERK、5-HT及PACAP等,TG中参与了偏头痛的周围敏化过程,TNC中参与偏头痛的中枢敏化过程,二者与偏头痛的发生、疼痛传递及敏化相关[23]。本研究同时检测这两个部位,说明了相同的介质在不同部位共同参与偏头痛过程。偏头痛属中医“少阳头痛”范畴,在偏头痛的辨证分型中,肝阳上亢证最常见[5]。根据人体经络中肝胆表里络属的关系及“病在上者下取之”的治疗原则,对于肝阳上亢型偏头痛,多责之于肝,临床上取肝经的输穴太冲清泄肝胆,疏通少阳经气[5,24]。研究报道[25],太冲作为偏头痛最常用的远端取穴的原因之一在于针刺太冲迅速显著地调节脑血流量。有学者通过复杂网络拓扑结构分析发现太冲是针灸治疗偏头痛的核心节点腧穴之一[26]。前期临床观察证实针刺双侧太冲可明显改善偏头痛临床症状,提高生活质量[8]。针刺治疗无毒副作用、创伤小且取穴精简。因此,本研究以神经源性炎性反应为切入点,探讨针刺双侧太冲治疗偏头痛的可能机制。
CGRP的释放是引起偏头痛神经源性炎性反应产生疼痛的重要环节。研究发现,偏头痛大鼠TG和TNC中CGRP释放明显增多[27];近期研究也证实偏头痛大鼠TNC中的CGRP mRNA水平明显升高,针刺治疗后CGRP mRNA表达降低,偏头痛缓解[28],本研究结果再次证实偏头痛大鼠TG和TNC中CGRP mRNA及蛋白高表达,而针刺双侧太冲后,TG和TNC中CGRP mRNA及蛋白均明显下调,说明针刺双侧太冲通过降低CGRP的释放缓解偏头痛。
ERK1/2在ERK亚族中表达最多,广泛存在于中枢神经系统中,在疼痛信号转导通路的研究中备受关注[29]。ERK信号转导通路参与偏头痛的发生,偏头痛模型大鼠TG中ERK1/2表达增加[30]。本研究发现偏头痛大鼠TG和TNC中ERK1、ERK2 mRNA及ERK1/2、p-ERK1/2蛋白表达升高,说明偏头痛的发生与ERK1/2、磷酸化ERK1/2 转录水平及蛋白表达升高有关;针刺双侧太冲后,TG和TNC中ERK1、ERK2 mRNA及ERK1/2、p-ERK1/2蛋白表达降低,说明针刺双侧太冲可下调TG和TNC中ERK1/2信号转导通路中疼痛信号的传导缓解偏头痛。研究发现外周血中ERK1/2表达量与CGRP含量呈正相关[31];下调ERK1/2基因和的表达和磷酸化可抑制CGRP等疼痛相关因子的释放[32]。本研究显示,与太冲组比较,注射ERK1/2激动剂组大鼠的TG和TNC中CGRP转录水平和蛋白表达升高,说明ERK1/2激动剂EGF具有拮抗针刺双侧太冲的抗偏头痛作用,针刺太冲可通过下调ERK1/2的信号传导,抑制CGRP释放。
A1R是腺苷受体的重要一员,在神经系统中分布最多。A1R在炎性反应及痛觉信息的传递和调控过程中发挥重要作用。偏头痛模型中TG和TNC的A1R表达量低于正常大鼠,并且A1R的表达与CGRP水平呈负相关[33-34];本研究显示偏头痛大鼠TG和TNC中A1R mRNA及A1R、p-A1R蛋白低表达,针刺双侧太冲可上调TG和TNC中A1R mRNA及A1R、p-A1R蛋白。激活的A1R可降低三叉神经血管系统的激活程度,减少CGRP的释放,抑制神经源性炎性反应和痛觉敏化[35],且激活的A1R能抑制ERK1/2磷酸化,通过ERK1/2信号通路阻断疼痛信号转导[36]。本研究发现,与太冲组比较,运用A1R拮抗剂DPCPX后,偏头痛大鼠TG和TNC中CGRP、ERK1/2及p-ERK1/2的基因和蛋白均偏高,A1R拮抗剂DPCPX可抑制针刺双侧太冲对偏头痛的治疗作用,可见激活的A1R可通过抑制ERK1/2磷酸化,即阻断ERK1/2对疼痛信号的传递而减少CGRP释放,缓解偏头痛。
本研究发现非穴组对TG和TNC中A1R、ERK和CGRP的mRNA和蛋白的调控结果更接近太冲组,虽然两组间的疗效有显著差异,但也说明针刺大鼠双侧胁下非穴对偏头痛也有一定的疗效。考虑一方面可能与非穴点未避开胁下的足少阳胆经经线有关,本研究仅对非穴纵坐标进行定位,位于双侧髂嵴直上10 mm处,有学者认为还应补充横坐标后正中线旁开20 mm[37];另一方面,有学者[38]认为体表非穴也有一定的治疗效应,针尖刺激体表的任何一个位点都可能产生多重叠加的治疗效应。
综上所述,针刺双侧太冲通过激活A1R,抑制ERK1/2磷酸化,阻断ERK1/2信号通路疼痛信号向下转导,进而抑制CGRP的释放,达到治疗偏头痛的目的;调控A1R/ERK1/2/CGRP信号通路是针刺双侧太冲治疗肝阳上亢型偏头痛的可能机制之一。

