电针血清外泌体促进缺氧诱导的人脐静脉血管内皮细胞血管新生的研究
彭拥军,徐疏影,吕鹤群,冯瑶婷
(南京中医药大学附属医院,江苏 南京 210029)
脑卒中是全球范围内致残率、致死率最高的疾病之一,且随着社会老龄化的发展,脑卒中的发病率在逐年增加。迄今为止,脑缺血唯一公认的有效疗法即为超早期溶栓,但由于时间窗受限,应用的人群极为有限[1]。近年来,有研究表明,尽早促进缺血灶的血管新生,增加新的侧支循环,恢复血流,可控制可逆性损伤的神经元进一步加重,同时也为神经结构的可塑性创造良好的微环境,有利于神经功能的恢复[2]。近年来研究发现,缺血缺氧可使微小核糖核酸(miRNAs)的表达谱发生改变[3]。有研究者对miRNA与血管新生的关系做了相关研究,发现miRNAs与血管生成密切相关,miRNA如miR-210 对血管新生具有强大的调控作用,进而影响到缺血性疾病的转归。而近年来,有报道显示miRNAs主要来源于外泌体[4]。
针灸治疗脑缺血在临床已被广泛认可。有研究发现,针灸可促进脑缺血后的血管新生[5-6],但具体作用机制尚不明确。因此,本研究拟通过建立人脐静脉内皮细胞(HUVEC)缺氧模型,从离体水平探讨外泌体miR-210介导的缺氧诱导因子-1(HIF-1)/血管内皮生长因子(VEGF)/Notch信号通路在电针促进脑缺血后血管新生中的机制。
1 材料
1.1 实验动物
6~8周龄SPF级雄性大鼠,体质量210~230 g,均购自扬州大学。
1.2 伦理审查
本实验方案已通过南京中医药大学附属医院实验动物研究伦理审查通过(伦理号:2021DW-40-01)。
1.3 试剂与仪器
DMEM 培养基(美国Gibco公司);胎牛血清(美国Gibco公司);胰蛋白酶(上海碧云天生物技术有限公司);CD34一抗(美国abcam公司);HIF-1α一抗(美国abcam公司);VEGF一抗(美国abcam公司);Notch 1一抗(美国abcam公司);低频脉冲电针治疗仪(G6805-Ⅱ型,上海医疗电子仪器有限公司)。
2 方法
2.1 电针外泌体的提取
参照Longa线栓法阻塞大鼠右侧大脑中动脉,建立改良的急性局部脑缺血再灌注模型[7]。缺血1 h后实行再灌注。造模成功后5 min进行电针干预,针刺大鼠的“人中(Du26)”和“百会(Du20)”穴,并接电针治疗仪,0.8~1.3 mA,采用疏密波,电针30 min,1次/d,共电针治疗3 d。最后1次电针干预7 h后,采用超速离心法提取大鼠血浆样本中的外泌体,用PBS重悬后-80 ℃冰箱放置保存备用,然后用PKH26试剂标记并提取电针外泌体。
2.2 细胞转染
根据脂质体Lipofectamine 2000说明书所述的实验步骤对miR-210模拟物(miR-210 mimic);miR-210抑制剂(miR-210 inhibitor);HIF-lα抑制剂(HIF-1α shRNA)进行细胞转染。siRNA 序列如下:miR-210 mimic:上游引物 5′-CUGUGCGUGUGACAGCGGCUGA-3′,下游引物5′-AGCCGCUGUCACACGCACAGUU-3′;miR-210 inhibitor:5′-AGCCGCUGUCACACGCACAGUU-3′,HIF-1α shRNA:上游引物:5′-GGAAAUGAGAGAAAUGCUUACUTT-3′,下游引物5′-AGUAAGCAUUUCUCUCAUUUCCTT-3′。
2.3 人脐静脉内皮细胞(HUVEC)缺氧模型建立
将HUVEC接种到细胞培养瓶内,釆用DMEM培养基加10%的新生牛血清,置于37 ℃,含5%CO2的细胞培养箱中常规培养。放入37 ℃、通有混合气体(5%CO2,94%N2,1%O2)的缺氧培养箱中。3 h后更换为正常培养液,并置于37 ℃、5%CO2饱和的常氧培养箱中继续培养24 h。
2.4 分组及干预
2.4.1 对照组 HUVEC置于37 ℃、55%CO2饱和的常氧培养箱中培养,不作任何处理。
2.4.2 模型组 HUVEC缺氧模型。
2.4.3 电针外泌体组 HUVEC缺氧模型与电针外泌体共培养。
2.4.4 miR-210模拟物组 在缺氧的HUVEC细胞中转染miR-210模拟物。
2.4.5 miR-210抑制剂组 在缺氧的HUVEC细胞中转染miR-210抑制剂,并与电针外泌体共培养。
2.4.6 HIF-lα抑制剂组 利用阳离子脂质体法在缺氧后的HUVEC细胞中转染HIF-lα shRNA表达载体,并与电针外泌体共培养。
2.5 流式细胞术观察细胞凋亡
根据实验细胞处理后,收集细胞培养基上清和细沉淀,离心后用PBS洗涤细胞2次,再离心;在50 μL的Binding Buffer中加入5μL 7-AAD染液,收集细胞中加入上述7-AAD染液,再加入 Binding Buffer 与AnnexinV-PE 混匀,1 h内进行流式细胞仪检测。
2.6 CCK-8检测细胞增殖
将HUVECs接种在96孔板中,按照实验分组分别进行处理,放入培养箱继续培养 24 h、36 h和48 h,培养结束后向每孔加入10 μL CCK-8溶液,培养箱内孵育1 h,用酶标仪测定在450 nm处的吸光度值,计算细胞活性。细胞生存率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
2.7 Matrigel基质胶实验观察血管生成能力
将整个培养皿放入培养箱中,放置30 min使胶凝固,在胶凝固的过程中,将各组细胞消化后,用无血清的培养基调整细胞浓度到6×105cell/mL,从培养箱中取出ibidi血管生成载玻片,每孔加入50 μL细胞悬液,放入培养箱培养过夜,24 h内记录细胞管状结构数量。
2.8 Western blot检测相关蛋白表达情况
采用Western blot检测各组细胞CD34、HIF-1α、VEGF和Notch 1蛋白表达量。离心收集各组干预48 h后的细胞,Bradford法测定蛋白质含量,SDS-PAGE凝胶电泳,分别加入一抗、洗涤,二抗、洗涤,进行发光检测,X光片压片、显影及定影。用目的条带与β-tubulin条带的灰度值比值作为蛋白样本表达强度。
2.9 qPCR检测相关mRNA表达情况
SYBR Green染料法实时荧光定量PCR检测:①按照TRIzol法提取细胞中的总RNA和miRNA,RNA的浓度及纯度鉴定,按照试剂盒说明书操作;②逆转录反应RT-PCR;③Real Time PCR反应;④绘制融解曲线;⑤软件操作反应体系和程序。
2.10 统计学处理

3 结果
3.1 各组细胞凋亡情况
细胞经处理后,与对照组比较,模型组的细胞凋亡率显著上升,差异具有统计学意义(P<0.01)。与模型组比较,经细胞外泌体处理与经miR-210模拟物转染的细胞凋亡率显著下降,差异具有统计学意义(P<0.01)。与电针外泌体组比较,单纯经miR-210模拟物转染的细胞凋亡率差异无统计学意义(P>0.05),而经miR-210抑制剂与HIF-lα抑制剂转染的细胞凋亡率显著上升,差异具有统计学意义(P<0.05)。见图1。

注:A.对照组;B.模型组;C.电针外泌体组;D.miR-210模拟物组;E.miR-210抑制剂组;F.HIF-lα抑制剂组。图1 各组细胞凋亡情况
3.2 各组细胞活力比较
经处理后24 h、36 h及48 h后,与对照组比较,模型组的细胞活力均显著下降,差异具有统计学意义(P<0.01)。与模型组比较,电针外泌体组与miR-210模拟物组的细胞活力显著提高,差异具有统计学意义(P<0.01)。与电针外泌体组比较,miR-210模拟物组的细胞活力稍有降低,但差异无统计学意义(P>0.05),而miR-210抑制剂组与HIF-lα抑制剂组的细胞活力均显著下降,差异具有统计学意义(P<0.05)。见表1。

表1 各组细胞活力比较
3.3 各组细胞血管生成能力比较
对照组为正常细胞血管结构,模型组细胞在镜下显示为未密封的多边形结构,且平均管状结构数量显著减少,差异具有统计学意义(P<0.01)。与模型组比较,电针外泌体组与miR-210模拟物组管状结构数量显著增加,差异具有统计学意义(P<0.01)。与电针外泌体组比较,miR-210抑制剂组与HIF-lα抑制剂组的管状结构数量均显著减少,差异具有统计学意义(P<0.01)。见图2、表2。

表2 各组细胞管状结构数量比较

注:A.对照组;B.模型组;C.电针外泌体组;D.miR-210模拟物组;E.miR-210抑制剂组;F.HIF-lα抑制剂组。标尺=100 μm。图2 各种细胞血管生成能力(100×)
3.4 Western blot 检测蛋白含量比较
与对照组比较,模型组CD34、HIF-lα、VEGF及Notch 1蛋白的表达量均显著增加,差异具有统计学意义(P<0.01)。与模型组比较,电针外泌体组与miR-210模拟物组CD34、HIF-lα、VEGF及Notch 1蛋白的表达量均显著,差异具有统计学意义(P<0.01),HIF-lα抑制剂组差异无统计学意义(P>0.05)。与电针外泌体组比较,miR-210抑制剂组与HIF-lα抑制剂组CD34、HIF-lα、VEGF及Notch 1蛋白表达均显著降低,差异具有统计学意义(P<0.01)。见图3、表3。

表3 各组细胞中CD34、HIF-lα、VEGF及Notch 1蛋白表达
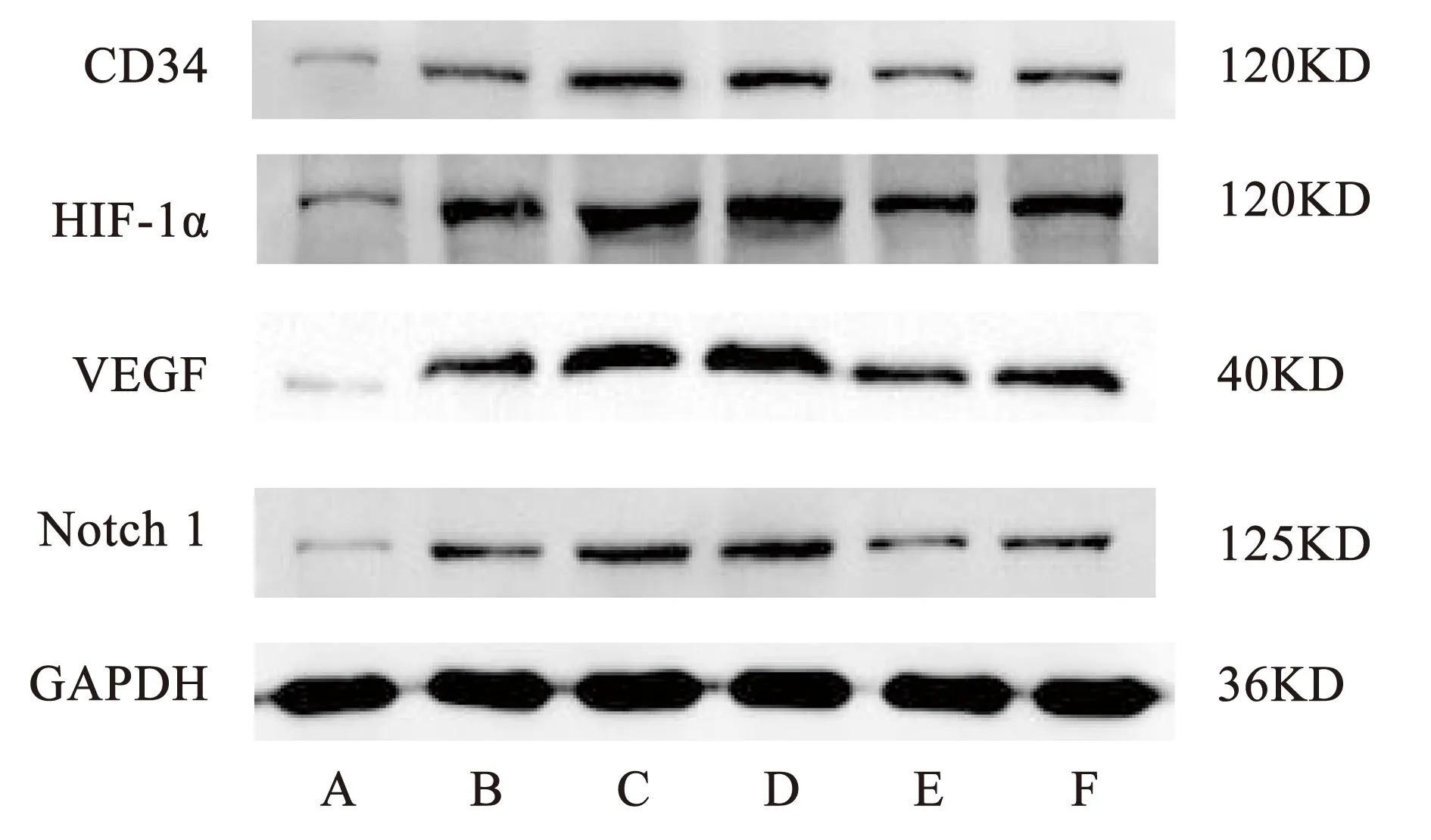
注:A.对照组;B.模型组;C.电针外泌体组;D.miR-210模拟物组;E.miR-210抑制剂组;F.HIF-lα抑制剂组。图3 各组细胞CD34、HIF-lα、VEGF及Notch 1蛋白表达情况
3.5 qPCR检测mRNA表达的比较
与对照组比较,模型组miR-210、CD34、HIF-lα、VEGF及Notch 1 mRNA的表达量均显著增加,差异具有统计学意义(P<0.01)。与模型组比较,电针外泌体组与miR-210模拟物组miR-210、CD34、HIF-lα、VEGF及Notch 1mRNA的表达量均显著,差异具有统计学意义(P<0.01),HIF-lα抑制剂组差异无统计学意义(P>0.05)。与电针外泌体组比较,miR-210抑制剂组与HIF-lα抑制剂组miR-210、CD34、HIF-lα、VEGF及Notch 1 mRNA表达均显著降低,差异具有统计学意义(P<0.01)。见表4。

表4 各组细胞中miR-210、CD34、HIF-lα、VEGF及Notch1 mRNA表达
4 讨论
目前针对缺血性脑卒中的治疗,重组组织型纤溶酶原激活剂(rt-PA)是唯一被FDA认可的溶栓药物,因其使用时间窗窄与副作用在临床使用受限[8]。针灸已被世界卫生组织(WHO)推荐为治疗脑缺血损伤的替代与补充疗法[9]。临床研究发现,针灸可显著提高脑缺血患者的肌力,缓解肌肉僵硬状态,提高患者平衡能力[10-12]。一项循证研究证明,针刺可减少急性缺血动物模型的脑梗死体积,促进神经功能损伤的恢复[13]。有研究显示,针灸可促进脑缺血后细胞增殖,加速细胞迁移,促进神经再生[14]。另一项研究发现,针灸可能促进血管新生、增加侧支循环开放程度以缓解脑缺血损伤[15]。然其具体机制还需进一步探索。
近年来,外泌体在机体中的重要作用被重新发现,是一种具有脂质双层膜结构的微小膜泡,包含细胞特异的蛋白、脂质和核酸,并能作为信号分子在细胞间传递信息。目前,外泌体已成为细胞间信息通讯的常见形式。大部分的细胞可通过外泌体携带miRNAs,以保护miRNAs免受内源性RNA酶的降解。缺血缺氧环境可调控miRNAs的表达[3]。研究发现,miR-210对血管新生具有强大的调控作用,从而影响到脑卒中的转归[16]。研究表明,miR-210过表达使内皮细胞VEGF表达上调,促使内皮细胞迁移进而形成毛细血管管腔样结构[17]。有研究发现,HIF-1可上调缺血缺氧区VEGF的表达,促进新血管生成,当HIF-1抑制剂可显著下调VEGF的表达,因此推测HIF-1是VEGF的上游调控基因,影响下游VEGF的表法[18]。Antonio D等研究发现VEGF可激活Notch信号通路,调节血管内皮细胞的增殖和分裂[19]。综上,VEGF和Notch信号系统都参与血管新生,VEGF位于Notch信号的上游,而缺氧后HIF-1又能够诱导VEGF的表达,因此,HIF-1/VEGF/Notch信号通路可能是脑缺血后调控血管新生的重要通路。
本研究通过建立HUVECs缺氧模型,发现电针外泌体的作用与miR-210模拟物作用相似,均可降低缺氧后的细胞凋亡率,提高细胞活力,促进缺氧缺血后的血管生成能力,同时,电针外泌体可上调CD34、HIF-lα、VEGF及Notch 1的蛋白表达与miR-210、CD34、HIF-lα、VEGF及Notch 1 mRNA的表达情况,而转染miR-210抑制剂与HIF-lα抑制剂后,细胞凋亡率、细胞活力及血管生成能力均被显著抑制,且血管新生因子的表达均被下调。表明电针治疗脑缺血的作用机制可能是通过调节外泌体miR-210的表达,从而促进血管新生以缓解脑缺氧缺血后的神经功能损伤,最终发挥了对脑组织的保护作用。

