CRMP2与Ubc9在电针缓解慢性压迫性损伤模型大鼠神经病理性疼痛中的作用
樊远志,张峻峰,吴耀持
(上海市第六人民医院,上海 200233)
神经病理性疼痛作用机制复杂,当机体检测到有害刺激的存在时,引起突触膜去极化,发生器电位,当器电位足够大时,会触发一个动作电位,该动作电位沿着背根神经节(DRG)传入神经元,神经元投射后将疼痛相关信息传递到脊髓背角的中央末端,从而产生疼痛感[1-3]。既往研究证实了针刺足三里和三阴交两个穴位可有效缓解神经病理性疼痛[4]。近年来多项研究发现,在神经病理性疼痛的发生过程中,机体炎症相关调节蛋白的表达水平会受到激活或抑制,从而参与调节机体炎症反应,达到激发或缓解疼痛的目的。因此,找到神经病理性疼痛相关蛋白,对于神经病理性疼痛的治疗具有一定临床意义[5-6]。坍塌反应调节蛋白2(Collapsin response mediator protein-2,CRMP2)是一种与受体运输和离子通道密切相关的蛋白,主要在脑组织中表达,可与微管蛋白结合,参与神经元的调节和线粒体形态的变化[7]。泛素结合酶9(Ubiquitin-Conjugating Enzyme 9,Ubc9)是泛素结合酶E2家族中的一员,Ubc9可与ubi-quitin样修饰物(SUMO)相结合,从而激活神经细胞内CRMP2的表达,起到诱导镇痛的作用[8]。本研究构建了慢性压迫性损伤(Chronic constriction injury, CCI)大鼠模型,选择了与神经病理性疼痛治疗相关的足三里和三阴交两个穴位,采用电针和CRMP2激活剂对大鼠进行干预治疗,观察大鼠疼痛测试情况,探讨电针和CRMP2相关蛋白的表达水平对CCI大鼠的影响。
1 材料与方法
1.1 实验动物
12周龄SPF级雄性SD大鼠,购自重庆陆军军医大学[动物生产许可:SCXK(渝)2022-0013;动物使用许可:SYXK(渝)2022-0007;动物合格证:20206132],体质量(180~200)g,所有大鼠饲养于室温:20~25 ℃,湿度:40%~60%的SPF级动物房内,动物房内采用光照(12 h/12 h)模拟昼夜交替,本实验所有动物均自由饮水饮食。本研究已通过本院伦理委员会审批通过,并严格执行《实验动物管理条例》。
1.2 仪器与试剂
1.2.1 仪器 伯乐BIO-RADXR凝胶成像系统(购自美国伯乐公司,型号BIO-RADXR);Bio-Rad伯乐实时荧光定量PCR仪(购自美国伯乐公司,型号CFX Opus96/CFX Opus384);韩式电针仪(购自南京济生医疗科技有限公司,型号:HANS100-A)。
1.2.2 试剂 CRMP2激活剂(南京建成生物工程研究所,纯度:99.99%,批号:AD-512);放射免疫沉淀(RIPA)缓冲液、磷酸缓冲盐溶液(PBS)(购自苏州宇恒生物科技有限公司,批号DP3012、DK3364);白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)酶联免疫吸附测定(ELISA)试剂盒(上海优宁维生物有限公司,批号:HL-1126、HL-7524和HL-3329); RT-qPCR试剂盒、蛋白定量试剂盒(南京建成生物有限公司,批号:DK5123、FA7829);CRMP2、Ubc9和β-actin蛋白抗体(美国,abcam公司,批号:AB-7213、AB-7306和AB-1122)。
1.3 CCI大鼠模型制备
各组大鼠适应性喂养1周后,采用10 mg/kg甲苯噻嗪和40 mg/kg氯胺酮肌内注射麻醉大鼠,固定大鼠后分离右侧臀部坐骨神经,在坐骨神经分叉的近心端轻微地做4个结扎,然后缝合伤口,术后7 d检测大鼠手术侧和非手术侧(患健侧)缩足潜伏期差值(PWLD),当PWLD>4 s即表示建模成功[9]。
1.4 实验分组
选取雄性SD大鼠40只,根据随机数字表法将大鼠随机分成假手术组、模型组、电针组与电针+激活剂组,每组10只。电针组每只大鼠每天进行1次电针干预,电针+激活剂组大鼠于每日开始电针治疗前1 h腹腔注射CRMP2激活剂(50 ng/kg),其余各组同时间进行抓取大鼠动作,但不做电针和激活剂注射处理,持续5 d。
1.5 电针干预
找到大鼠后肢膝关节,参照《实验针灸学》[10]大鼠穴位图谱定位到足三里(外侧腓骨小头下约5 mm处)和三阴交上外侧5 mm处穴位,用针灸针(江苏省苏州市医疗用品有限公司生产的华佗牌一次性针灸针,规格为1寸,0.30 mm×25 mm)刺入足三里和三阴交两个穴位,针的端口连接HANS-200E型韩氏电针仪,同时进行电流强度1 mA,频率2 Hz/100 Hz的刺激,持续时间为30 min。30 min取下针灸针,将大鼠放回动物架。
1.6 大鼠痛觉敏感性检测
大鼠痛觉敏感性的测定:在大鼠造模前、造模后1 d和造模后7 d分别使用足底测痛仪检测大鼠患健侧缩足潜伏期(Paw withdrawal latency,PWL),采用热光源对大鼠患侧足底进行照射,记录大鼠出现躲避、舔舐和抬足等动作的时间,每只大鼠测量3次,取均值。同时比较患侧和健康侧的测定时间,计算患健侧缩足潜伏期差值(PWLD),每只大鼠重复测定3次,每次测定间隔5 min。
1.7 血清炎症因子检测
最后一次电针治疗后,当天晚上禁食禁水12 h,第2天采用无水乙醚麻醉大鼠,将大鼠固定于解剖板上,并进行消毒。非抗凝管心脏取血后1 500 r/min,4 ℃条件下离心20 min后取上清,保存于-80 ℃冰箱。室温下解冻-80 ℃冰箱中保存备用的大鼠血清,采用ELISA法检测血清中IL-1β、IL-6和IL-8的水平,根据ELISA试剂盒说明书对血清样本进行处理,采用全自动酶标仪在450 nm波长处检测样本吸光度,根据标准品的吸光度结果得到标准曲线和计算公式,通过公式计算样品中IL-1β、IL-6和IL-8的浓度。
1.8 大鼠脊髓中CRMP2与Ubc9 mRNA测定
大鼠麻醉处死后,取脊髓腰L2~4组织0.1 g,根据RNA提取试剂盒提取总RNA,并利用反转录试剂盒得到cDNA保存至-80 ℃备用。RT-qPCR体系:SYBR Green qPCR SuperMix 16.25 μL,特异性引物2.0 μL,模板cDNA3.25 μL,加入DEPC水,使反应体系为30 μL。扩增条件:94 ℃,12 min;94 ℃,15s;62 ℃,40 s;72 ℃,30 s;共40个循环。设置3个复孔,根据公式(2-ΔΔCT法)计算、分析mRNA表达。引物序列:CRMP2:5′-CATGTGCTGTAGCTAGTCGAT-3′,5′-AACTGTAGTGCTAGTCGATG-3′; Ubc9:5′-CCGATGTCGTGTGTAGTTCAGTTT-3′,5′-TAATCGTTAGTCGTAGTTAGTCGATC-3′;GAPDH:5′-GTCGTAGTGTGTGTCGTAGTC-3′,5′-GTCGATGGCGGCGCGTAC-3′。
1.9 大鼠脊髓中CRMP2与Ubc9 蛋白测定
大鼠麻醉处死后,取脊髓腰L2~4组织0.1 g,放入玻璃研磨器中,加入1 mL RIPA溶液充分研磨,3 000 r/min离心10 min后取上清液,检测蛋白浓度,调节蛋白浓度使其为3 μg/mL,每孔上样量为10 μL后进行电泳,将凝胶上的蛋白转移至硝化纤维素膜,5%脱脂奶粉溶液对硝化纤维素膜封闭2 h后,将特异性抗体CRMP2、Ubc9和β-actin一抗1∶5 000稀释,4 ℃条件下一抗摇晃孵育12 h,孵育后的硝化纤维素膜使用1%吐温20清洗3次,每次5 min,清洗后二抗(1∶500)孵育2 h,孵育后清洗步骤同上,最后使用显影剂后在凝胶成像系统上显影。
1.10 统计学处理

2 结果
2.1 电针干预对大鼠痛觉敏感性的影响
CCI大鼠模型建成后,各组大鼠PWLD均显著升高,差异具有统计学意义(P<0.05);在给予大鼠相应干预后,与假手术组比较,模型组大鼠患健侧PWLD升高,差异具有统计学意义(P<0.05);与模型组比较,电针组和电针+激活剂组大鼠患健侧PWLD降低,差异具有统计学意义(P<0.05);电针+激活剂组干预5 d后PWLD低于电针组,差异具有统计学意义(P<0.05)。见表1。

表1 各组大鼠患健侧PWLD比较
2.2 电针干预对大鼠血清炎症因子的影响
与假手术组比较,模型组大鼠血清IL- 1β、IL-6和IL-8表达水平更高,差异具有统计学意义(P<0.05);与模型组比较,电针组和电针+激活剂组大鼠血清IL- 1β、IL-6和IL-8表达水平更低,差异具有统计学意义(P<0.05);电针+激活剂组血清IL- 1β、IL-6和IL-8表达水平低于电针组,差异具有统计学意义(P<0.05)。见表2。

表2 各组大鼠血清炎症因子比较
2.3 电针干预对大鼠脊髓CRMP2、Ubc9 mRNA表达的影响
与假手术组比较,模型组大鼠脊髓CRMP2、Ubc9 mRNA表达水平更低,差异具有统计学意义(P<0.05);与模型组比较,电针组和电针+激活剂组大鼠脊髓CRMP2、Ubc9 mRNA表达水平更高,差异具有统计学意义(P<0.05);电针+激活剂组大鼠脊髓CRMP2、Ubc9 mRNA表达水平高于电针组,差异具有统计学意义(P<0.05)。见表3、图1。

注:A/B.CRMP2 mRNA检测溶解曲线/峰值图;C/D.Ubc9 mRNA检测溶解曲线/峰值图。图1 各组大鼠脊髓CRMP2、Ubc9 mRNA检测溶解曲线/峰值图

表3 各组大鼠脊髓CRMP2、Ubc9 mRNA表达水平比较
2.4 电针干预对大鼠脊髓CRMP2、Ubc9蛋白表达的影响
与假手术组比较,模型组大鼠脊髓CRMP2、Ubc9蛋白水平更低,差异具有统计学意义(P<0.05);与模型组比较,电针组和电针+激活剂组大鼠脊髓CRMP2、Ubc9蛋白水平更高,差异具有统计学意义(P<0.05);电针+激活剂组大鼠脊髓CRMP2、Ubc9蛋白水平高于电针组,差异具有统计学意义(P<0.05)。见表4、图2。
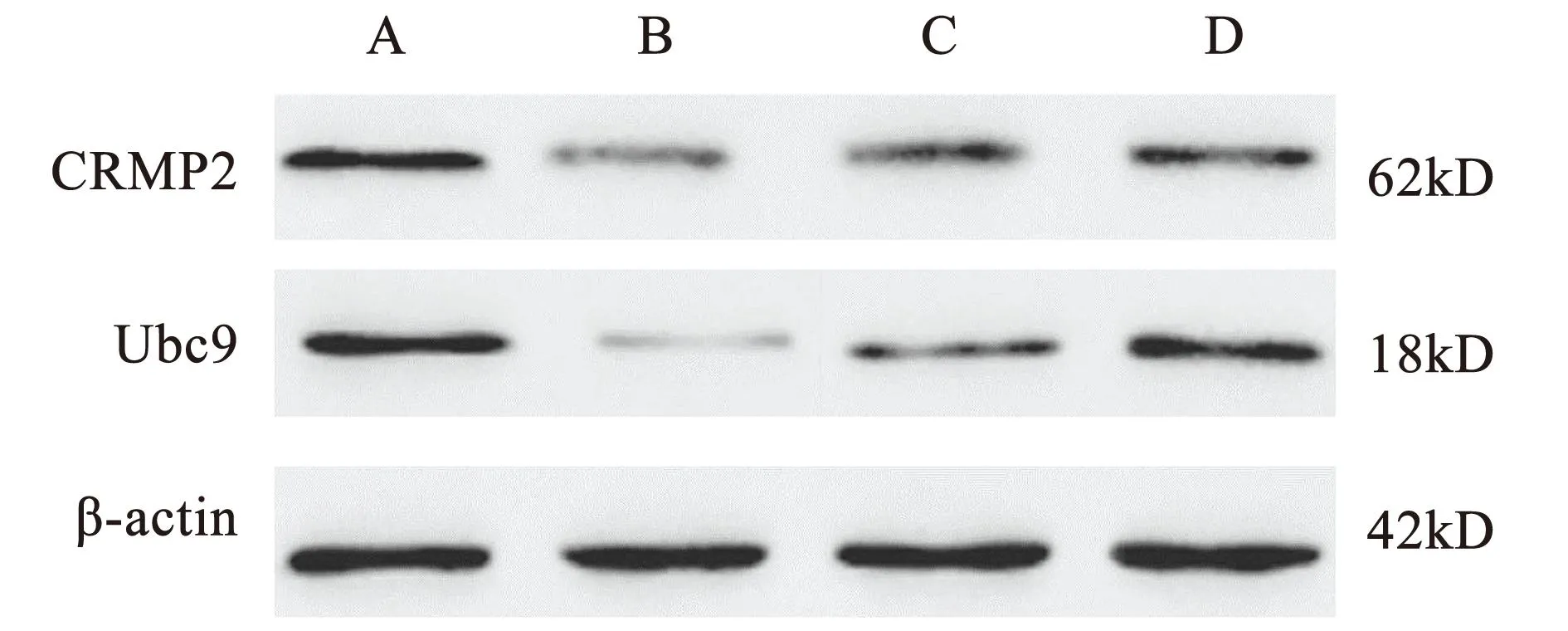
注:A.假手术组;B.模型组;C.电针组;D.电针+激活剂组。图2 各组大鼠脊髓CRMP2、Ubc9蛋白表达情况

表4 各组大鼠脊髓CRMP2、Ubc9蛋白表达水平比较
3 讨论
神经病理性疼痛是一种慢性神经系统性疾病,临床表现为异常性疼痛、自发性疼痛和痛觉过敏等,在临床上神经病理性疼痛的发病率约为3.3%~17.9%[11]。机体发生神经病理性疼痛的因素有很多,其中主要包含物理伤害、自身免疫性疾病和机体感染等,目前临床上对于神经病理性疼痛还没有有效的根治措施,因此对患者的生活质量造成了严重的困扰[12]。既往已有大量研究证实了电针刺激在神经性疼痛的治疗中具有较好的效果,电针可通过刺激足三里和三阴交两个穴位来抑制CCI小鼠背根神经节外核苷酸酶PAP的降解以缓解神经性疼痛[13]。因此,探讨电针治疗对CCI模型大鼠神经性疼痛的缓解作用,对于临床上该类疾病的治疗具有重要意义。本研究对CCI模型大鼠进行电针干预治疗,大鼠痛觉敏感性测定结果显示各组间PWLD存在显著差异,提示电针对于CCI大鼠具有一定的治疗作用,可有效降低PWLD时间,降低疼痛引起的损伤,从而具有缓解大鼠神经病理性疼痛的功效,提示电针有成为临床上神经性疼痛相关疾病治疗方法的潜质。
从免疫性角度而言,神经性病理疼痛是一种异常的中枢刺激信号,必然会引起中枢神经系统免疫功能的紊乱,随着炎症在各种疾病中的生物学作用越来越受到重视,有研究发现在绝大多数疾病发展过程中均伴随着炎症反应的进行[14]。免疫系统功能的紊乱常常伴随着相关蛋白表达水平的异常改变,如CRMP2和Ubc9蛋白,因此通过检测相关蛋白的表达在一定程度上可以反映机体免疫系统受损伤程度。神经病理性疼痛的发生常常伴随着炎症反应的发生,神经病理性疼痛的病灶中往往存在多种炎症细胞(如肥大细胞、嗜酸性粒细胞、淋巴细胞与巨噬细胞等)的浸润,且其炎性细胞浸润数与神经病理性疼痛的严重程度有关[15]。大量炎性细胞的浸润可导致平滑肌肥大,从而加剧结构细胞的破坏,最终导致病灶部位结构改变,进而加剧疾病对机体造成的损伤[16]。炎症反应被认为在众多疾病的发病机制中有着至关重要的作用,疾病发生后可引起机体炎症因子水平的急剧上升[17]。既往研究发现CRMP2、Ubc9蛋白与机体免疫系统平衡密切相关,当机体免疫系统发生紊乱时,可导致CRMP2和Ubc9蛋白的表达异常,从而引起免疫系统的稳态失衡[18]。有研究发现,当神经病理性疼痛发生时,炎症相关因子IL-1β、IL-6和IL-8均急剧上升,且随着炎症水平的加重而增加,而高表达的炎性因子将进一步加剧疼痛的发生,因此抑制炎症反应成为了神经病理性疼痛治疗的有效方式之一[19]。CRMP2和Ubc9作为炎症抑制蛋白,可抑制细胞促炎因子的表达,从而达到缓解机体炎症的目的[20]。因此,本研究检测了大鼠IL-1β、IL-6和IL-8水平,以反映机体炎症反应程度。研究结果显示,当大鼠CCI发生时,其血清内IL-1β、IL-6和IL-8水平均显著升高,表明炎症反应发生。当采用电针治疗后,IL-1β、IL-6和IL-8水平显著降低,且大鼠疼痛得以缓解,提示电针刺激可能会抑制炎症反应,从而达到镇痛的效果,其机制可能是疼痛引起了CRMP2和Ubc9的表达抑制,从而免疫系统紊乱导致炎症因子分泌增加,机体炎症反应发生,而电针刺激后激活机体免疫防护机制,激活相关蛋白基因CRMP2和Ubc9的转录及翻译水平,而高表达的CRMP2和Ubc9可有效抑制机体炎症反应的发生,缓解疼痛反应。因此,电针治疗可能是通过激活CRMP2和Ubc9来起到降低炎症反应及缓解疼痛的作用,从而达到治疗神经性疼痛的效果,提示CRMP2和Ubc9可能是电针治疗的有效靶分子。
CRMP2和Ubc9的主要表达部位为大脑神经细胞内,大量研究结果显示CRMP2和Ubc9的表达水平与大脑的神经系统损伤密切相关[21]。既往研究发现,在神经病理性疾病中,Ubc9被激活,与下游信号因子结合后形成泛素化结合酶聚体,泛素化结合酶聚体可促进CRMP2的表达,抑制神经递质的释放,从而达到镇痛的功效[22]。有研究发现CRMP2和Ubc9的异常改变可引起机体免疫平衡紊乱,从而影响炎症反应的发生发展[23]。既往研究显示,激活CRMP2可调节神经细胞突触间的信号分子,从而影响突触信号传导,对疼痛的传导起到一定的缓解作用[24]。CRMP2的高表达同时可抑制炎症反应的发生,体内动物实验结果显示,对严重感染的大鼠使用CRMP2激活剂,发现较普通大鼠感染症状显著减轻,同时检测血清炎症因子指标发现较模型大鼠明显下降,因此推测CRMP2具有炎症抑制作用[25]。本研究在电针刺激的同时,对一组大鼠腹腔注射了CRMP2激活剂以提高CRMP2的表达,结果发现电针可有效提高脊髓中CRMP2的表达,从而达到镇痛的效果,而电针联合CRMP2激活剂可进一步提高CRMP2的表达,且结合大鼠痛觉敏感性和血清炎症因子检测结果发现,CRMP2的高表达与镇痛效果密切相关,且高表达的CRMP2炎症反应抑制效果更明显,进一步提示了CRMP2可能通过抑制炎症反应以达到镇痛的效果,同时也进一步表明电针治疗的分子机制可能是通过激活CRMP2的表达,抑制炎症反应,以达到缓解神经性疼痛的作用。因此,电针治疗可能会成为临床神经性疼痛治疗的新方向。
综上所述,电针可有效缓解CCI模型大鼠神经病理性疼痛,其作用机制可能是电针刺激穴位后促进神经细胞内CRMP2、Ubc9表达水平,从而抑制CCI发生后产生的机体炎症反应,以达到镇痛和治疗的效果。

