不同磷胁迫处理转OsPHR2 小麦的转录组学分析
李 艳 方宇辉 王永霞 彭超军 华 夏 齐学礼 胡 琳 许为钢
河南省作物分子育种研究院 / 河南省麦类种质资源创新与改良重点实验室 / 神农种业实验室, 河南郑州 450002
磷是植物细胞的重要组成成分, 主要存在于DNA、RNA、磷脂、腺嘌呤核苷酸(ATP、ADP 及AMP)的结构中[1-3]。磷在植物体内参与糖酵解、脂质代谢、碳水化合物代谢、氧化还原反应等多个代谢过程[4-5]。磷肥施入土壤, 作物当季磷肥利用率较低, 大部分容易被含有金属元素的土壤矿物及有机物质吸附固定, 从而降低了土壤中磷肥的有效性。土壤有效磷偏低是全球普遍存在的问题, 施用磷肥对农作物生产起到极其重要的作用, 但大量磷肥施入土壤后作物当季利用率仅为10%~20%[6], 土壤中的磷素和施入土壤的磷80%被固定, 变为难于被植物吸收的难溶态和有机态[7], 同时对环境亦产生负面影响, 如水生系统的富营养化和生物多样性的丧失[8-9]。磷胁迫信号在植物中有特异的调控途径[10]。植物在长期的进化过程中形成了各种适应磷胁迫的机制[11-13], 包括根构型的改变、生理代谢适应等。另外通过上调表达高亲和磷转运子, 改变植物体内磷参与的代谢活动[14-15], 以此提高对可溶性磷的吸收利用效率以及对固定态磷的吸收能力。不同作物和同一作物不同基因型对磷的吸收和利用效率上存在着明显的遗传差异[16-18]。小麦是世界和我国主要的粮食作物之一, 为世界约40%人口的主粮, 发掘利用磷高效吸收利用基因, 研究磷高效基因在小麦中的作用机制, 对高产养分高效小麦新品种培育和小麦生产可持续发展具有重要意义。
植物挖掘自身潜力、充分活化和利用潜在磷,是自身进行磷饥饿拯救的重要机制, 这些机制本质是磷饥饿诱导的一系列基因的协同表达[7]。磷饥饿条件下, 植物通过调控一系列缺磷诱导表达基因来增加磷的吸收利用效率[19]。通过对拟南芥不同磷处理浓度不同时间点的特异基因的表达分析, 结果表明分别有612 个和254 个磷响应基因被协同诱导和抑制, 这些基因参与各种代谢途径, 如转录调控、信号转导、离子运输等[20]。小麦磷饥饿诱导的蛋白质被定位于质外体, 磷胁迫下小麦根尖糖酵解酶含量显著增加[21], 总干重降低、根冠比增加[22]。利用基因芯片分析Atphr1和Atphr1/Atphl1突变体, 结果表明绝大部分的缺磷响应基因受到AtPHR1和AtPHL1的调控, 这些基因涉及到磷的吸收转运、磷脂代谢、信号转导等[23]。AtPHR1在植物中具有功能的保守性,它在水稻中的同源基因OsPHR2是水稻调控缺磷胁迫响应的中心转录调控因子。AtPHR1/OsPHR2过表达能有效提高植株的磷吸收水平, 同时激活下游一系列PSI基因的表达。低磷胁迫下,OsPHR2过表达可改变植株根构型, 增强磷吸收能力[24]。OsPHR2在水稻中的作用机制研究已较深入, 但关于其在小麦中的研究报道甚少。前期研究已将OsPHR2导入普通小麦, 获得了磷吸收利用效率显著提高的转基因小麦纯系, 并对转OsPHR2小麦进行了根表型、磷吸收特性和产量性状分析, 结果表明长至一叶一心的幼苗在营养液中缺磷处理10 d 转基因小麦的最大根长、根系总长度、根冠比和根系体积均显著高于受体对照; 田间低磷处理下, 苗期、拔节期、抽穗期、灌浆期和成熟期转基因小麦植株地上部磷积累量亦均显著高于对照, 2 个转OsPHR2小麦株系产量平均较受体对照增产 6.29%[25]。但目前关于OsPHR2提高小麦磷吸收利用效率的分子机制还不清楚。本研究以转OsPHR2小麦纯系为材料, 利用RNA-seq 对低磷胁迫处理不同时间点的差异表达基因进行分析, 揭示OsPHR2提高小麦磷吸收利用效率的分子机制, 为小麦磷高效遗传改良研究提供理论依据。
1 材料与方法
1.1 试验材料与处理方法
磷吸收利用效率显著提高的转OsPHR2小麦纯合株系OsT5-28[25]和受体郑麦0856 均由河南省作物分子育种研究院小麦分子育种团队提供。
利用水培试验, 水培至四叶一心时进行低磷胁迫处理(低磷营养液中磷的浓度为正常处理营养液浓度的1/30, 其他成分不变), 设置3 次生物学重复,分别在低磷胁迫(0、6、24 和72 h) 4 个时间点, 对转OsPHR2小麦株系OsT5-28 和对照郑麦0856 的根部和叶片取样, 置于–70℃冰箱保存。
1.2 文库构建与质检
采用TRIzol 法提取小麦根部和叶片的RNA, 并进行 RNA 纯度和完整性等检测。利用试剂盒(Illumina 的NEBNext Ultra RNA Library Prep Kit)构建文库。通过Oligo(dT)磁珠富集带有polyA 尾的mRNA, 以片段化的mRNA 为模版, 随机寡核苷酸为引物, 在M-MuLV 逆转录酶体系中合成cDNA 第一条链, 在DNA polymerase I 体系下, 以dNTPs 为原料合成cDNA 第二条链。纯化后的双链cDNA 经过末端修复、加A 尾并连接测序接头, 用AMPure XP beads 筛选200 bp 左右的cDNA 进行PCR 扩增,纯化PCR 产物, 最终获得文库。
文库构建完成后, 先使用Qubit2.0 Fluorometer进行初步定量, 稀释文库至1.5 ng µL–1, 随后使用Agilent 2100 bioanalyzer 对文库的insert size 进行检测, insert size 符合预期后, 利用qRT-PCR 对文库有效浓度进行准确定量(文库有效浓度高于2 nmol L–1),以确保文库质量。库检合格后进行Illumina 测序, 并产生150 bp 配对末端读数, 测序仪通过捕获荧光信号, 最终获得待测片段的序列信息。
1.3 统计分析
首先对原始数据进行过滤, 确保数据分析的质量及可靠性。使用HISAT2 v2.0.5 构建参考基因组的索引, 并将配对末端过滤后的数据与参考基因组比对。采用StringTie 进行新基因预测。
利用 featureCounts 计算映射到每个基因的读数。根据基因的长度计算每个基因的FPKM, 并计算映射到该基因的读数。利用DESeq2 R 软件(1.16.1)进行两个比较组合之间的差异表达分析(每组3 次生物学重复)。使用Benjamini 和Hochberg 方法调整P值, 通过DESeq2 发现调整的P值<0.01 的基因被分配为差异表达的基因, 校正后的P值以及|log2(Fold Change)|>1 作为显著差异表达的阈值。利用clusterProfiler R 软件实现差异表达基因的GO 富集和KEGG 分析。
1.4 数据质控分析
利用RNA-Seq 技术, 对转基因株系OsT5-28 和对照郑麦0856 进行转录组测序分析。低磷胁迫处理0、6、24 和72 h 转基因系OsT5-28 叶片样品分别命名为L_0 h_T、L_6 h_T、L_24 h_T 和L_72 h_T, 其根系样品分别命名为R_0 h_T、R_6 h_T、R_24 h_T和R_72 h_T; 低磷胁迫处理0、6、24 和72 h, 对照郑麦0856 叶片样品分别命名为L_0 h_C、L_6 h_C、L_24 h_C 和L_72 h_C, 其根系样品分别命名为R_0 h_C、R_6 h_C、R_24 h_C 和R_72 h_C。
利用双末端测序法, 使用Illumina 高通量测序平台(HiSeq2000)对所有合格RNA 样品进行测序和特异性文库构建。去除带接头的reads、含N (无法确定碱基信息) reads、低质量reads 后, 各样品的Clean reads 在6.79~10.53 G 之间, 平均Clean reads为8.38 G, 均在6 G 以上。各样品的Error rate 在0.02%~0.03%之间, GC 含量在50.84%~57.03%之间,Q20 和Q30 值均在90%以上。通过对所有样本的基因表达值进行主成分分析, 结果显示组间样本较分散, 组内除了L_0 h_C1 和R_0 h_C3 较分散之外, 其余样本3 个重复之间均较好地聚在一起(图1)。说明所有样品质量均满足转录组数据分析要求, 可进行可靠性分析。
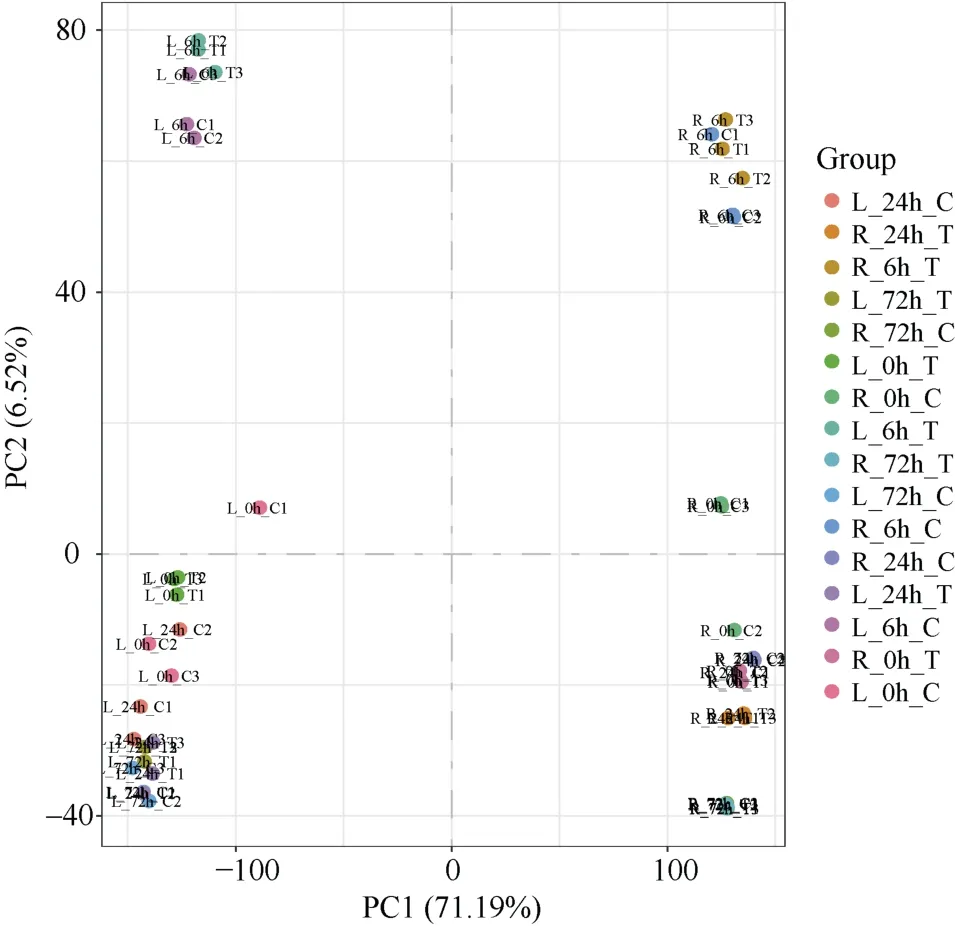
图1 不同磷处理小麦RNA-Seq 数据的主成分分析Fig.1 Principal component analysis of RNA-Seq data from wheat under different phosphorus treatments
1.5 qRT-PCR 分析
随机挑取根部5 个DEG 和叶片5 个DEG, 分别在3 个处理0、6 和24 h 的表达模式进行qRT-PCR验证。以Actin作为内参, 基因特异引物见表1。利用MonScript RTIII All-in-One Mix with dsDNase (莫纳生物科技有限公司)对构建文库的RNA 反转录成cDNA, 利用MonAmp ChemoHS qPCR Mix (莫纳生物科技有限公司)进行qRT-PCR 分析。反应体系为20 µmol L–1, 反应条件为95℃ 10 min; 95℃ 10 s,63℃ 30 s, 38 个循环, 95℃ 15 s, 60℃ 1 min。采用2–ΔΔCt法计算基因的相对表达量。利用Pearson’s correlation coefficient (PCC)计算2 组数据的相关系数。

表1 qRT-PCR 引物信息Table 1 Information of qRT-PCR primers
2 结果与分析
2.1 差异基因表达分析
2.1.1 根部差异基因表达分析 不同处理时间之间相比, 低磷胁迫处理0 h, 转基因系OsT5-28 和对照郑麦0856 的根部差异表达基因(differentially expression gene, DEG)数量最多, 共有6891 个DEG, 其中2147 个上调表达和4744 个下调表达, 上调表达基因占31.16%。低磷胁迫后, DEG 数量随处理时间的延长呈先降低后增加的趋势。低磷胁迫处理6、24 和72 h 的DEG 数量分别比0 h 下降了63.79%、91.64%和 86.68%, 6、24 和 72 h 上调基因占比分别为64.73%、67.01%和50.00%。胁迫处理6 h 的DEG数量大于24 h 和72 h, 胁迫6 h 的DEG 共有2495 个,其中1615 个上调表达和880 个下调表达, 上调表达基因占比大于0 h (图2-A)。韦恩图分析显示, 磷胁迫处理0、6、24 和72 h 转基因系OsT5-28 及对照郑麦0856 根部共有22 个共同表达的差异基因(图2-B)。
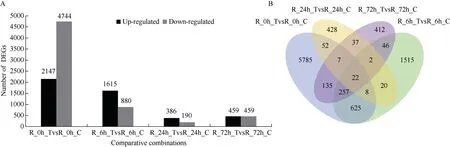
图2 转基因小麦与对照不同比较组合根部差异表达基因分析Fig.2 DEGs in roots between transgenic wheat and control in different comparative combinations
分析受体对照根部低磷胁迫6 h 与0 h 比较的DEG, 结果显示受体对照低磷胁迫6 h 后有13,370个DEG, 其中5864 个上调表达和7506 个下调表达,上调表达基因占43.86% (图3)。
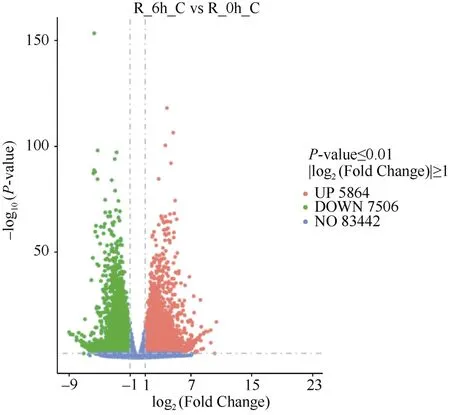
图3 受体对照低磷胁迫6 h 与0 h 的根部差异表达基因分析Fig.3 DEGs in roots between 6 hours and 0 hour under low phosphorus in control
2.1.2 叶片差异基因表达分析 不同处理时间之间相比, 低磷胁迫处理72 h, 转基因系OsT5-28 和对照郑麦0856 的DEG 数量最多, 共有2071 个DEG, 其中1519 个上调表达和552 个下调表达, 上调表达基因占73.35%。低磷胁迫处理0、6 和24 h 的DEG 数量分别比72 h 低76.20%、77.21%和83.44%, 0、6 和24 h 上调基因占比分别为33.06%、38.77%和16.62%。胁迫处理0 h 的DEG 数量大于6 h 和24 h, 0 h 的DEG 共有493 个, 其中163 个上调表达和330 个下调表达, 上调表达基因占比小于72 h (图4-A)。韦恩图分析显示, 磷胁迫处理0、6、24 和72 h 转基因系OsT5-28 及对照郑麦0856 叶片有9 个共同表达的差异基因(图4-B)。
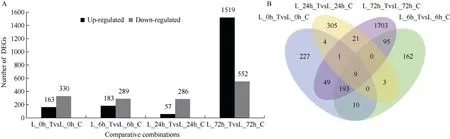
图4 转基因小麦与对照不同比较组合叶片差异表达基因分析Fig.4 DEGs in leaves between transgenic wheat and control in different comparative combinations
分析受体对照叶片低磷胁迫72 h 与0 h 比较的DEG, 结果显示对照低磷胁迫72 h 后有2501 个DEG,其中392 个上调表达和2109 个下调表达, 上调表达基因占15.67% (图5)。
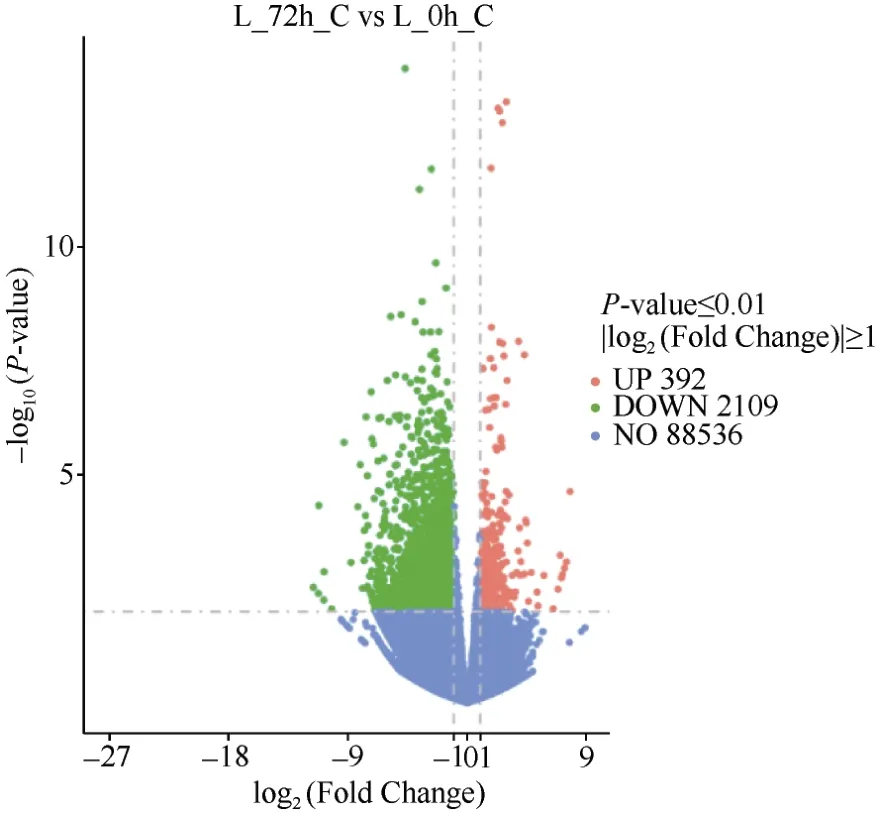
图5 受体对照低磷胁迫72 h 与0 h 的叶片差异表达基因分析Fig.5 DEGs in leaves between 72 hours and 0 hour under low phosphorus in control
综合以上结果, 转基因株系与对照根部DEG 数量在低磷胁迫处理0 h 最多, 叶片DEG 数量在低磷胁迫处理72 h 最多。叶片对磷素的响应比根部滞后。
2.2 部分DEG 表达模式的qRT-PCR 验证
为了验证转录组测序结果的可靠性, 挑取根部5 个DEG 和叶片5 个DEG, 分别在0、6 和24 h 的表达模式进行qRT-PCR 验证。结果显示, 这10 个DEG 在3 个处理的qRT-PCR 表达趋势与转录组测序结果均基本一致(图6), 相关系数平均为r=0.9069, 具有很好的相关性, 表明转录组测序结果准确、可靠。
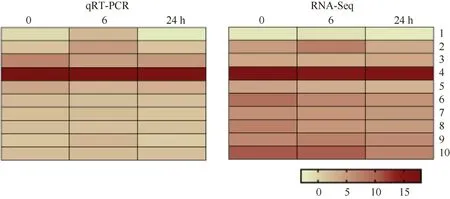
图6 不同磷处理根部和叶片部分DEG 表达模式验证Fig.6 qRT-PCR verification of selected DEGs in root and leaf under different phosphorus treatments
2.3 根部DEG 功能富集分析
2.3.1 GO 分析 通过对不同处理下转基因株系与对照根部DEG 进行GO 富集分析。将注释成功的基因按照GO 分为3 类, 即: 生物学过程(biological process), 细胞组分(cellular component)和分子功能(molecular function) (图7)。

图7 转基因小麦与对照不同比较组合根部差异基因的GO 富集分析Fig.7 GO enrichment of root DEGs between transgenic wheat and control in different comparative combinations
低磷胁迫0 h, DEG 主要富集在单细胞碳水化合物代谢、有机酸生物合成、三羧酸生物合成、对化学物质响应等50 个生物学过程; DEG 主要富集在胞外区、细胞外部封装结构、细胞壁、质外体等4 个细胞组分; DEG 主要富集在细胞骨架蛋白结合、作用于CH-OH 的氧化还原酶活性、黄素腺嘌呤二核苷酸结合、养分储存器活性等32 个分子功能。低磷胁迫0、6 和72 h, DEG 均富集在了养分储存器活性这一分子功能上。低磷胁迫0 h 转基因小麦与对照根部DEG 富集的生物学过程和分子功能均明显多于胁迫6、24 和72 h。
低磷胁迫6 h, DEG 主要富集在铵转运、无机阴离子转运、对生物刺激响应和蔗糖代谢等4 个生物学过程; DEG 主要富集在有关养分贮存器活性、多糖结合、葡糖转移酶活性、ATP 酶活性等16 个分子功能。低磷胁迫24 h, DEG 主要富集在细胞氧化还原稳态、细胞内稳态、稳态过程和生物质量调节等4 个生物学过程; DEG 主要富集在二硫化物氧化还原酶活性、电子载体活性、作用于供体硫基的氧化还原酶活性等4 个分子功能。低磷胁迫6 h 和24 h没有DEG 富集在细胞组分。低磷胁迫72 h, 没有DEG 富集在生物学过程, DEG 主要富集在胞外区、细胞外部封装结构、细胞壁、质外体等4 个细胞组分; DEG 主要富集在养分储存器活性1 个分子功能。
通过对受体对照低磷胁迫6 h 与0 h 根部DEG进行GO 富集分析结果显示(图8), DEG 主要富集在防御反应、金属离子转运等5 个生物学过程, 胞外区、质外体和膜的锚固部件3 个细胞组分, 以及养分贮存器活性、水解酶活性和吡哆醛磷酸结合等21个分子功能。

图8 受体对照低磷胁迫6 h 与0 h 根部差异基因的GO 富集分析Fig.8 GO enrichment of root DEGs between 6 hours and 0 hour under low phosphorus in control
2.3.2 KEGG 分析 KEGG 富集分析发现(表2),低磷胁迫0 h, 转基因小麦和对照根部DEG 主要富集在苯丙素生物合成、植物激素信号转导、甘油磷脂代谢、α-亚麻酸代谢4 个过程。低磷胁迫处理6 h,DEG 主要富集在苯丙素生物合成和谷胱甘肽代谢。OsPHR2参与调控转基因小麦根部苯丙素的生物合成, 从而促进转基因小麦对磷素的吸收转运。另外,低磷胁迫处理6 h DEG 还富集在谷胱甘肽代谢途径,且上调的 DEG 数量大于下调, 说明低磷胁迫后OsPHR2参与了谷胱甘肽代谢途径, 该途径响应低磷胁迫。低磷胁迫24 h 和72 h 没有DEG 富集代谢途径。通过对受体对照低磷胁迫6 h 与0 h 根部DEG进行KEGG 富集分析结果显示(图9), DEG 主要富集在苯丙素生物合成和植物病原体互作2 个过程, 且下调DEG 多于上调。
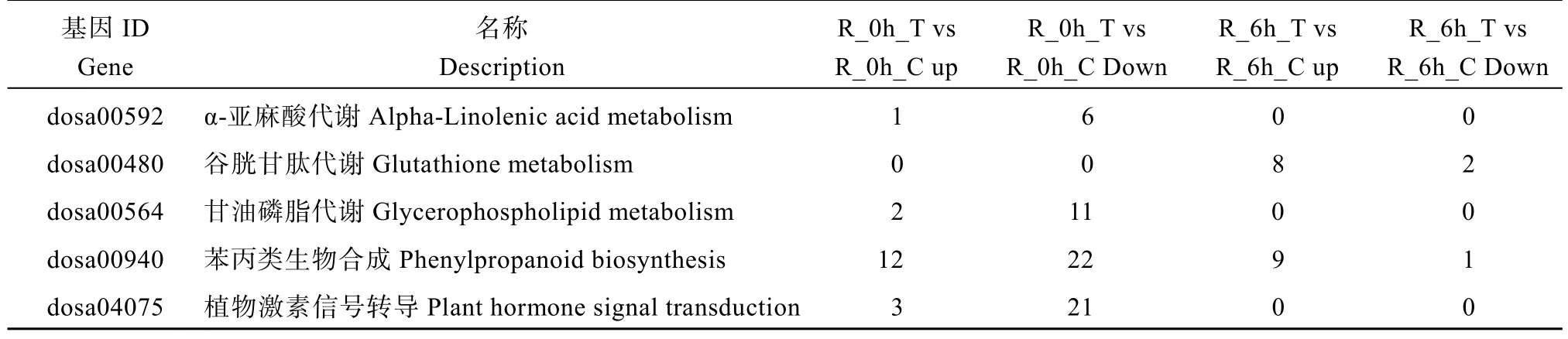
表2 不同比较组合根部差异基因的KEGG 富集分析Table 2 KEGG enrichment of root DEGs in different comparative combinations
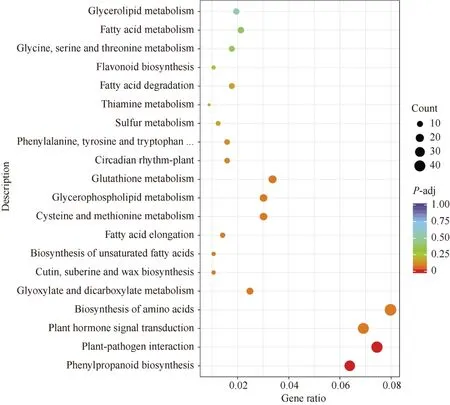
图9 受体对照低磷胁迫处理6 h 与0 h 根部差异基因的KEGG 富集分析Fig.9 KEGG enrichment of root DEGs between 6 hours and 0 hour under low phosphorus in control
2.4 叶片DEG 功能富集分析
2.4.1 GO 分析 通过对不同处理下转基因株系与对照叶片DEG 进行GO 富集分析。将注释成功的基因按照GO 分为3 类, 即: 生物学过程、分子功能和细胞组分(图10)。
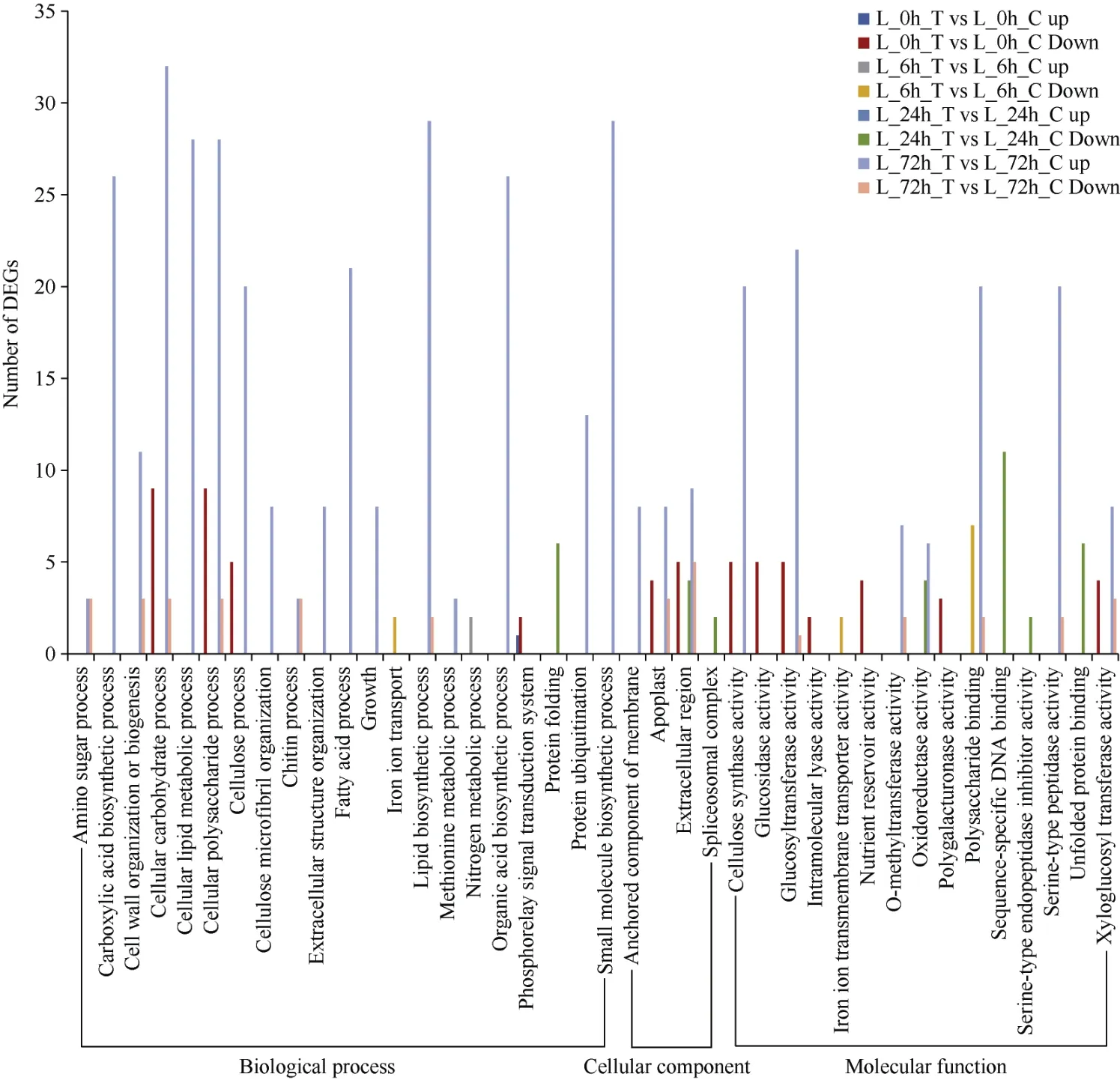
图10 转基因小麦与对照不同比较组合叶片差异基因的GO 富集分析Fig.10 GO enrichment of leaf DEGs between transgenic wheat and control in different comparative combinations
低磷胁迫72 h, 转基因小麦和对照叶片DEG 数量最多, 且上调的DEG 数量显著大于下调, DEG 主要富集在碳水化合物合成和代谢、有机酸、脂质和小分子生物合成等51 个生物学过程; DEG 主要富集在膜锚固构件、质外体、外部封装结构等5 个细胞组分; DEG 主要富集在与糖基转移酶活性、纤维素合酶活性、丝氨酸型肽酶活性等有关的11 个分子功能。
低磷胁迫0 h, DEG 主要富集在细胞碳水化合物合成、葡聚糖生物合成和代谢、磷光体信号转导系统等15 个生物学过程, 且下调DEG 数目远远多于上调; DEG 主要富集在细胞壁、胞外区、质外体等4个细胞组分; DEG 主要富集在纤维素合酶、UDP-糖基转移酶、养分储存器活性等13 个分子功能, 富集细胞组分和分子功能的DEG 均为下调。低磷胁迫6 h,DEG 主要富集在铁离子跨膜转运、氮代谢等6 个生物学过程; DEG 主要富集在与多糖结合、离子跨膜转运蛋白活性、模式结合等有关的3 个分子功能, 没有DEG 富集在细胞组分。低磷胁迫24 h, DEG 主要富集在蛋白质折叠1 个生物学过程; DEG 主要富集在细胞外区、剪接体复合体2 个细胞组分; DEG 主要富集在与未折叠蛋白结合、特异性DNA 结合、氧化还原酶活性等有关的6 个分子功能, 该处理DEG 均为下调。
通过对受体对照低磷胁迫72 h 与0 h 叶片DEG进行GO 富集分析, 结果显示DEG 主要富集在胺生物合成代谢过程、多糖代谢过程、激素代谢过程等17 个生物学过程, 胞外区、质外体、细胞壁和外部封装结构4 个细胞组分, 以及磷脂结合、磷酸二酯水解酶活性和丝氨酸型肽酶活性等30 个分子功能,大部分DEG 为下调(图11)。
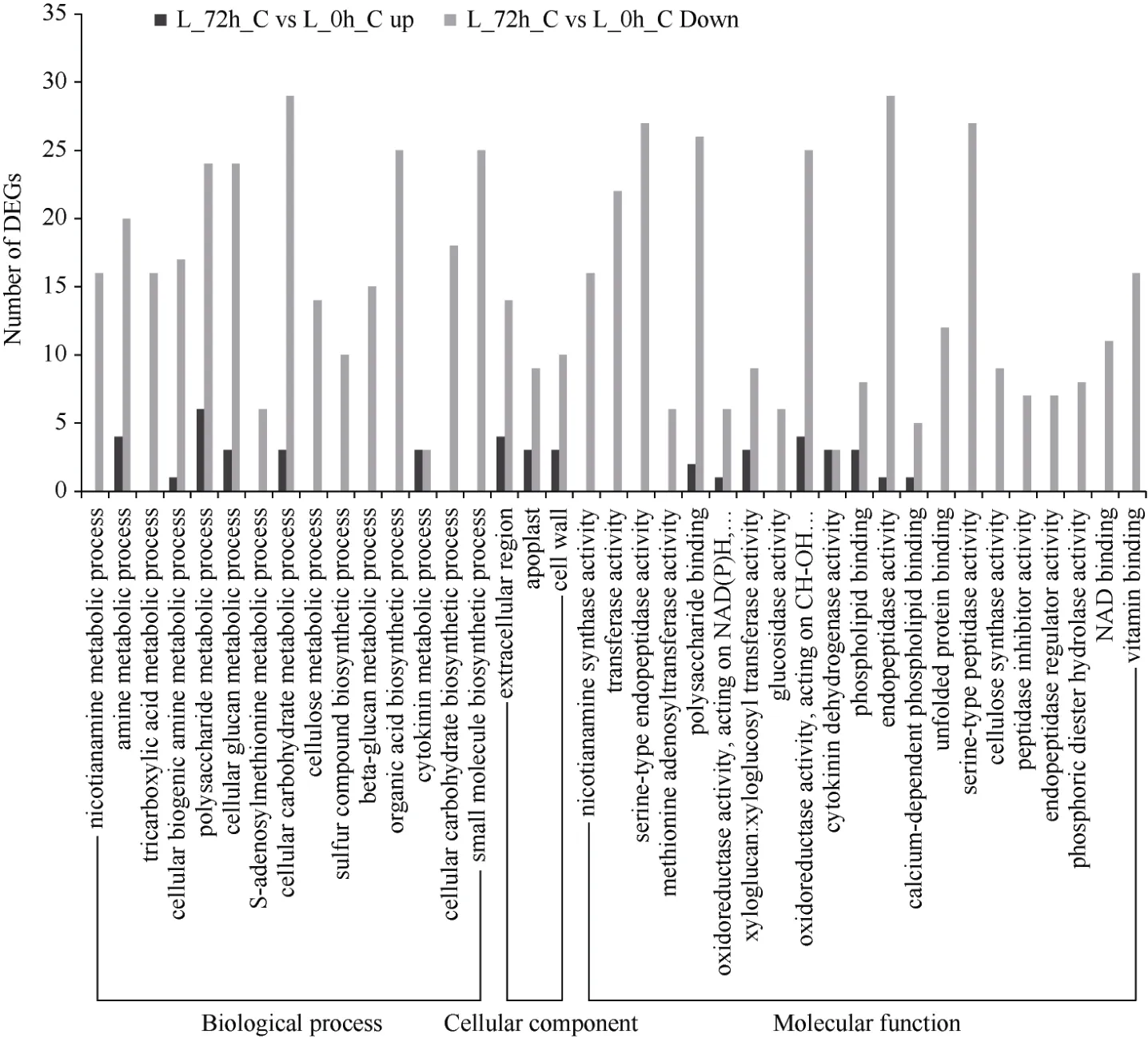
图11 受体对照低磷胁迫72 h 与0 h 叶片差异基因的GO 富集分析Fig.11 GO enrichment of leaf DEGs between 72 hours and 0 hour under low phosphorus in control
2.4.2 KEGG 分析 KEGG 富集分析发现(表3),低磷胁迫72 h 差异基因富集在苯丙素生物合成、苯丙氨酸代谢、类黄酮生物合成等5 个代谢途径, DEG全部为上调。低磷胁迫6 h 和24 h 的DEG 未富集到相关途径。低磷胁迫处理0 h (R_0 h_T vs.R_0 h_C), DEG 主要富集在光合作用-天线蛋白1 个途径,DEG 为下调。KEGG 富集分析结果表明, 低磷胁迫72 h,OsPHR2通过上调叶片苯丙素生物合成等代谢途径基因响应低磷胁迫, 提高转基因小麦的耐低磷特性。

表3 不同比较组叶片差异基因的KEGG 富集分析Table 3 KEGG enrichment of leaf DEGs in different comparative combinations
通过对受体对照低磷胁迫72 h 与0 h 叶片DEG进行KEGG 富集分析结果显示(图12), DEG 主要富集在植物病原体互作1 个过程, 且下调DEG 多于上调。
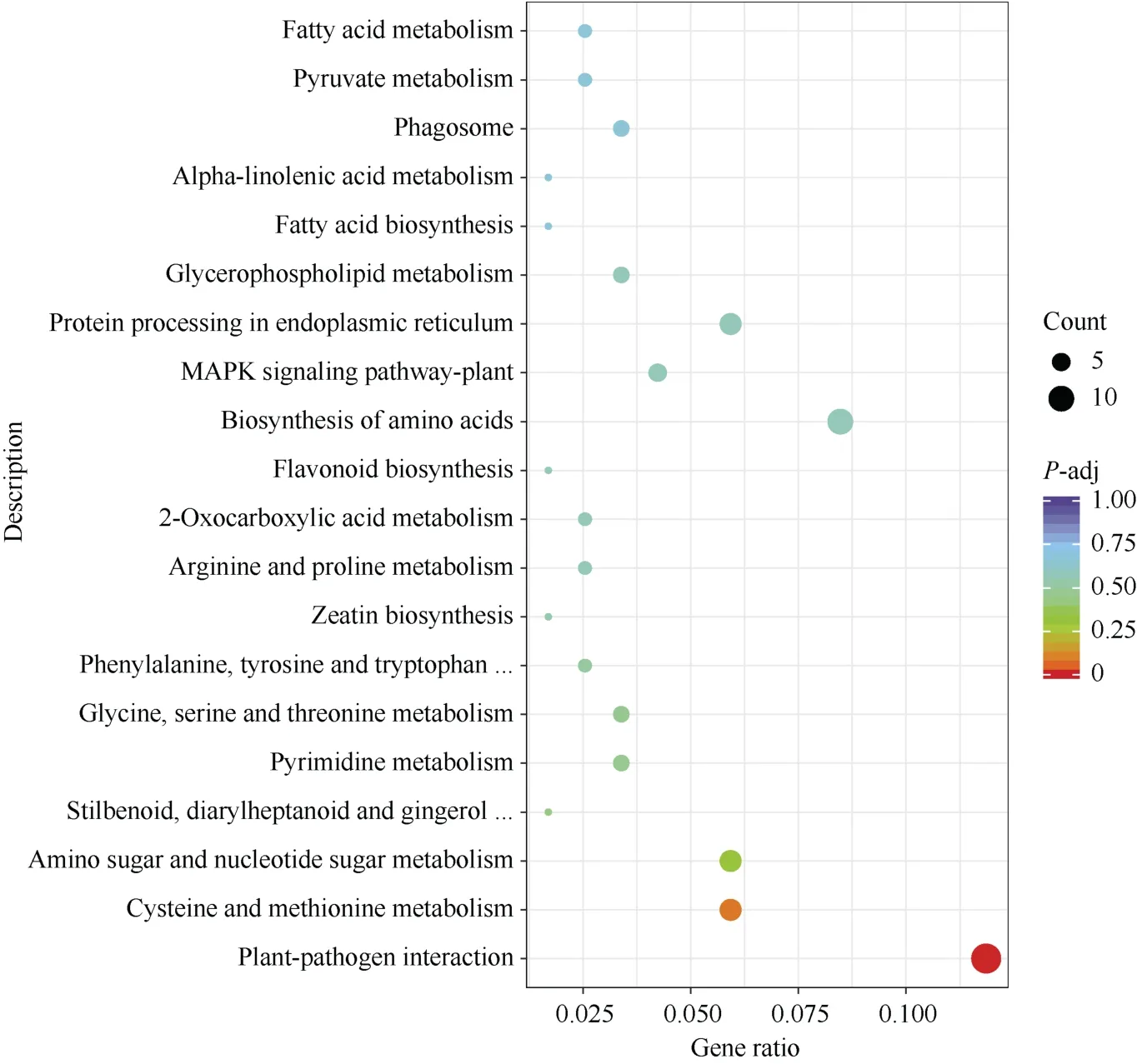
图12 受体对照低磷胁迫处理72 h 与0 h 叶片差异基因的KEGG 富集分析Fig.12 KEGG enrichment of leaf DEGs between 72 hours and 0 hour under low phosphorus in control
2.5 关键差异表达基因分析
为进一步解析转OsPHR2小麦耐低磷胁迫的分子机制, 对低磷胁迫后转基因株系OsT5-28 和对照的根部和叶片关键DEG 进行了深入分析。植物过氧化物酶是一类含血红素辅基的酶, 逆境条件下过氧化物酶(POD)是酶促防御系统的关键酶, 可以清除植物细胞中的活性氧(ROS)。谷胱甘肽在植物体内存在自我氧化还原平衡调剂机制, 谷胱甘肽-S-转移酶在清除生物和非生物胁迫产生的氧化损伤中起重要的作用。P-环核苷三磷酸水解酶能够影响植物根中ROS含量, 对维持植物根中ROS 稳态具有重要作用[26]。因此这些基因的上调表达可以提高植物的抗逆性。当植株受到氮磷养分缺乏等逆境胁迫时, 活性氧的种类增多以提高植物抗逆性[27-28]。在本研究中, 与对照相比, 转基因系OsT5-28 根部血红素过氧化物酶基因(TraesCS6A02G052800)、谷胱甘肽S-转移酶基因(TraesCS6A02G059600)、P-环核苷三磷酸水解酶基因(TraesCS6B02G464400)、非血红素双加氧酶N端结构域蛋白基因(TraesCS7A02G141100)等在低磷胁迫前后均上调表达, 其中非血红素双加氧酶N 端结构域蛋白基因(TraesCS7A02G141100)在低磷胁迫6 h 表达量最高, 其余3 个基因在低磷胁迫72 h表达量最高。正常处理下OsPHR2提高了转基因小麦根部抗逆相关基因的表达, 低磷胁迫下这些基因的表达量更加增强, 进而提高了转基因小麦的耐低磷特性。
苯丙素类化合物与植物生长调节和抵御病害侵袭有关, 在植物生长发育和环境互作中起重要作用。有研究表明, 苯丙素类生物合成和谷胱甘肽代谢途径在低氮促进的小麦种子根生长调控中起关键作用[29]。本研究结果显示, 转基因系OsT5-28 和对照根部在低磷胁迫0 h 和胁迫6 h 均有DEG 富集在苯丙素生物合成代谢途径。低磷胁迫0 h 和6 h 分别有12 个和9 个基因显著上调表达, 有3 个共同基因上调, 其中2 个血红素过氧化物酶基因(TraesCS4D02G342500和TraesCS7D02G464600)在低磷胁迫6 h 表达量最高。受体对照低磷胁迫6 h 与0 h 根部DEG 主要富集在苯丙素生物合成和植物病原体互作, 其中有5 个苯丙素生物合成途径的DEG (TraesCS1D02G310100、TraesCS6B02G258600、TraesCS5B02G405300、TraesCS6D02G351500、TraesCS7A02G424100)在低磷胁迫6 h 显著下调, 而在转OsPHR2小麦低磷胁迫6 h 后相比受体对照显著上调。转基因系OsT5-28 和对照叶片在低磷胁迫72 h 有DEG 富集在苯丙素生物合成和苯丙氨酸代谢途径, 分别有11 个和5 个基因显著上调表达。以上结果表明, 低磷胁迫后OsPHR2调控转基因小麦根部和叶片苯丙类代谢途径相关基因表达, 进而增强其耐低磷特性。
磷酸丙糖转运体是叶绿体内膜上的重要结构,担负着内膜的主要运输功能, 负责将磷酸丙糖从叶绿体运出到细胞质, 同时将无机磷酸等量运入叶绿体[30-31]。本研究中, 转基因系OsT5-28 叶片的磷酸丙糖转运体家族基因(novel.11254)和叶绿体转移酶基因(TraesCS5D02G120200)在低磷胁迫前后均上调表达, 其中磷酸丙糖转运体基因在转基因系叶片低磷胁迫6 h 表达量最高, 叶绿体转移酶基因在胁迫72 h 表达量最高。低磷胁迫下,OsPHR2过表达提高了转基因小麦中磷酸丙糖转运体家族基因的表达,从而促进了细胞质中碳水化合物的合成和无机磷的利用, 增强了对磷素的吸收。
3 讨论
3.1 根部和叶片相关基因对低磷的响应存在差异
AtPHR1是高等植物中唯一已知的磷信号调控体系的核心转录因子, 它调控一系列基因在低磷胁迫下特异表达, 从而启动下游部分应对磷饥饿的适应性反应, 这些反应主要是植物在低磷胁迫下增加对磷的吸收和利用[32-33]。水稻低磷胁迫转录因子OsPHR2是AtPHR1的同源基因, 参与下游磷饥饿响应基因的表达调控, 其自身的表达与磷水平无关[24]。前期研究结果表明从拔节到灌浆期OsPHR2在转基因小麦株系OsT5-28 根中表达量最高, 其次为叶片,而苗期OsPHR2主要在叶片中表达[25]。本研究中, 转基因小麦与对照根部DEG 在低磷胁迫0 h 最多, 表明正常条件下OsPHR2在小麦中过量表达模拟了部分磷饥饿信号, 调控了一系列磷饥饿响应基因的表达, 低磷胁迫后对照植株对低磷响应, 从而导致DEG 数量下降。转基因小麦与对照叶片DEG 数量在低磷胁迫72 h 最多, 说明叶片对低磷的响应较根系滞后。低磷胁迫72 h 叶片DEG 数量显著大于根部, 这可能与低磷胁迫下苗期OsPHR2在转基因小麦叶片中表达量高于根部有关。
3.2 活性氧清除酶参与低磷胁迫响应
当植物生长发育过程中处于逆境胁迫时, 植物体内ROS 水平会迅速升高, 从而使DNA 受损程度增加。植物中过氧化物酶、超氧化物歧化酶等ROS清除酶和谷胱甘肽等抗氧化剂一起协同维持植物细胞具有高效ROS 清除机制。ROS 能诱导植株防御基因的表达从而应对自身创伤[34]。拟南芥水杨酸基于(NahG)沉默后可减弱植株对ROS 的诱导产生, 从而增强植株对盐胁迫的耐受性[35]。谷胱甘肽转移酶是植物抗氧化酶清除系统中的关键酶, 在植物应对逆境胁迫时发挥重要作用[36-37]。还原型谷胱甘肽(GSH)可以将体内ROS 还原成H2O, 从而实现对ROS 的清楚[38]。本研究结果显示, 低磷胁迫6 h 转OsPHR2小麦株系OsT5-28 和对照根部DEG 主要富集在谷胱甘肽代谢途径, 该途径有8 个基因显著上调表达,其中谷胱甘肽S-转移酶基因在低磷胁迫72 h 表达量最高。结果表明低磷胁迫下OsPHR2过表达诱导了谷胱甘肽代谢途径相关基因的表达, 这些基因的上调表达增强了转基因小麦的耐低磷特性。
3.3 OsPHR2 过表达对小麦糖代谢相关基因的影响
低磷胁迫条件下, 植物形成了一系列耐低磷胁迫的适应机制, 包括淀粉合成、糖类代谢及根系有机物分泌合成等生理生化反应的改变, 同时相关基因表达也发生一系列变化, 以提高植物对磷素的吸收利用[39-43]。碳水化合物是植物进行各种生命活动的重要能源物质, 植物光合作用的主要产物是碳水化合物, 蔗糖、葡萄糖、果糖和淀粉等均为非结构性碳水化合物[44]。低磷胁迫条件下, 糖和淀粉在根和叶部积累[45], 根尖糖酵解酶含量显著增加[21]。本研究结果显示, 低磷胁迫前后, 转基因系OsT5-28和对照DEG 均主要富集在糖代谢过程。低磷胁迫0 h, 在转基因系根部氨基糖代谢途径中有7 个基因显著上调表达, 低磷胁迫6 h, 有6 个基因显著上调,均为糖酵解酶基因。受体对照低磷胁迫6 h 根部有2 个纤维素合成酶基因(TraesCS2A02G210300、TraesCS2A02G210400)显著下调表达, 转OsPHR2小麦低磷胁迫6 h 后相比受体对照这2 个基因显著上调表达。低磷胁迫72 h, 在转基因小麦叶片细胞碳水化合物代谢过程有32 个基因显著上调表达, 包括纤维素合成酶基因、葡聚糖酶结构域基因和糖水解酶基因等。受体对照低磷胁迫72 h 叶片有7 个碳水化合物生物合成过程基因(TraesCS3D02G289600、TraesCSU02G142500、TraesCS2A02G102600、TraesCS2B02G119700、TraesCS2D02G102100、TraesCS6B02G104600、TraesCS6A02G077800)显著下调表达, 转OsPHR2小麦低磷胁迫72 h 后相比受体对照这7 个基因显著上调表达。低磷胁迫下, 转基因小麦根部和叶片糖代谢相关基因的显著上调表达, 提高了糖类在根和叶片的积累, 从而增强了转基因小麦的耐低磷特性。OsPHR2过表达诱导了小麦糖代谢途径相关基因的表达。
4 结论
不同磷处理下转基因小麦与对照转录组分析结果显示, 叶片对磷素的响应比根部稍滞后。低磷胁迫前,OsPHR2过表达可以提高转基因小麦根部碳水化合物代谢和有机酸合成等相关基因表达。低磷胁迫后,OsPHR2可以通过调控根部生物刺激响应、蔗糖代谢、氧化还原酶活性和谷胱甘肽代谢等基因,以及叶片碳水化合物代谢、有机酸合成、转移酶活性和纤维素合酶活性等相关基因表达, 从而提高转基因小麦耐低磷特性。研究结果可为小麦磷高效利用遗传育种研究提供理论参考。

