渗透胁迫下玉米自然反义转录本cis-NATZmNAC48 启动子的功能分析
毛 燕 郑名敏 牟成香 谢吴兵 唐 琦
1 成都师范学院, 四川成都 611130; 2 四川农业大学玉米研究所, 四川成都 611130
渗透胁迫是由于外界水分亏缺和细胞失水过多,进而使细胞水势降低, 最终导致植物生长受影响的过程。包括干旱、高温和高盐等非生物胁迫。非生物胁迫是全球农作物减产的主要原因之一, 可直接导致作物的产量降低50%以上, 造成巨大经济损失[3]。因此, 研究植物对渗透胁迫的响应机制对于后续作物改良育种具有重要的意义。
自然反义转录本(Natural Antisense Transcripts,NATs)是生物体内产生的一种内源性RNA, 可与其对应的互补RNA 通过碱基配对, 形成自然正义-反义转录物配对的双链RNA[4]。在植物生长发育和逆境响应等过程中发挥着重要的作用。在盐胁迫下,拟南芥胁迫相关基因Δ1-pyrroline-5-carboxylate dehydrogenase (P5CDH)与其自然反义转录SRO5形成24 nt 的siRNA 并指导P5CDH初始剪切, 为后形成的21 nt siRNA 建立一个相位, 进一步降解P5CDH,进而调控拟南芥的耐盐性[5]。Zhao 等[6]研究发现低温下,MADSAFFECTINGFLOWERING4(MAF4)被其反义转录本MAS激活, 抑制拟南芥过早开花。“高产”和“早熟”在水稻产量中是2 个矛盾的因素, 阻碍着水稻产量的进一步提高。水稻开花促进因子OsSOC1的自然反义转录本 Early floweringcompletely dominant (Ef-cd)在不影响作物产量的情况下可将水稻成熟时间提前7~20 d[7]。AsDOG1是Delay of Germination 1 (DOG1)的自然反义转录本,在种子成熟过程中以顺式的调控方式抑制DOG1基因的表达, 防止种子进入休眠[8]。此外, Yatusevich等[9]研究发现抑制asDOG1的表达可增加拟南芥的耐旱性。
启动子作为基因表达的关键调控区域, 其在基因转录调控中发挥关键作用。因此, 通过分析渗透胁迫下玉米自然反义转录本启动子表达特性, 有助于了解NATs 的调控机制。关于NATs 启动子的研究,仅在少量文献中有报道, 其主要目的在于探索自然反义转录本的表达模式[10-11]。前期研究表明,cis-NATZmNAC48是位于玉米ZmNAC48基因位点的自然反义转录本, 缺乏蛋白编码潜能, 其可能通过双链RNA 依赖机制负调控玉米ZmNAC48基因表达进而影响玉米气孔开闭, 调控植物耐旱性[12]。为了进一步探索cis-NATZmNAC48在渗透胁迫的功能, 本研究通对cis-NATZmNAC48启动子序列分析, 初步了解cis-NATZmNAC48启动子序列各调控元件及功能。通过获得Procis-NATZmNAC48: GUS 和ProZmNAC48: GUS 转基因材料, 以确定cis-NATZmNAC48启动子活性是否受渗透胁迫的影响。通过分析渗透胁迫下cis-NATZmNAC48启动子甲基化情况, 进一步明确cis-NATZmNAC48在渗透胁迫下的表达机制。
1 材料与方法
1.1 试验材料
供试材料玉米耐旱自交系AC7643 和干旱敏感自交系AC7729/TZSRW 由四川农业大学玉米研究所提供。拟南芥哥伦比亚0 型(COL)由本实验室保存。
1.2 玉米干旱试验
在人工气候中, 将AC7643 和AC7729/TZSRW玉米种子催芽后, 将其移入装有蛭石的发芽盘上,放入培养室中生长, 用蒸馏水灌溉。待其长到二叶一心后, 使用营养液进行水培, 每3 d 换1 次营养液(营养液配方参照《无土栽培原理与技术》), 每天通3 h 的氧气。长日照(16 h 光/8 h 黑暗)下生长, 待其长到五叶一心后, 随机选择部分幼苗采用 20%PEG-6000 处理, 其他幼苗仍然在正常的营养液中生长作为对照。分别取处理和对照6 h 材料的根, 用液氮速冻后放于–80℃冰箱保存, 用于DNA 提取, 该部分DNA 用作甲基化分析; 其中用20% PEG-6000处理后的AC7729/TZSRW 根系中提取的DNA 作为PCR 模板用于启动子区域片段的扩增。
1.3 cis-NATZmNAC48 和ZmNAC48 启动子生物信息分析
以cis-NATZmNAC48cDNA序列、ZmNAC48蛋白质编码序列在EnsemblPlants网站(http://plants.ensembl.org/index.html)上检索玉米B73参考基因组, 获取cis-NATZmNAC48和ZmNAC48上游启动子序列。将获取基因上游启动子序列, 利用生物信息网站PlantCARE(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[1]和New PLACE (https://www.dna.affrc.go.jp/PLACE/?action=newplace)[2]预测启动子调控元件。
1.4 DNA 提取及启动子克隆
用GENEOU Plant DNA Isolation kit (LabGENE)试剂盒提取玉米AC7643 和AC7729/TZSRW 根系DNA。利用Primer 5.0设计引物PNA-1F/1R和PNS-1F/1R (表1), 用于cis-NATZmNAC48和ZmNAC48启动子克隆。以提取的AC7729/TZSRW根系DNA为模板, 采用Phanta Max Super-Fidelity DNA Polymerase (Vazyme,江苏南京)进行PCR扩增。扩增产物与pEASY-Blunt (北京全式金生物技术股份有限公司)载体链接, 转化T1感受态细胞(北京全式金生物技术股份有限公司), 菌液检测、测序, 最终获得序列正确的单克隆。
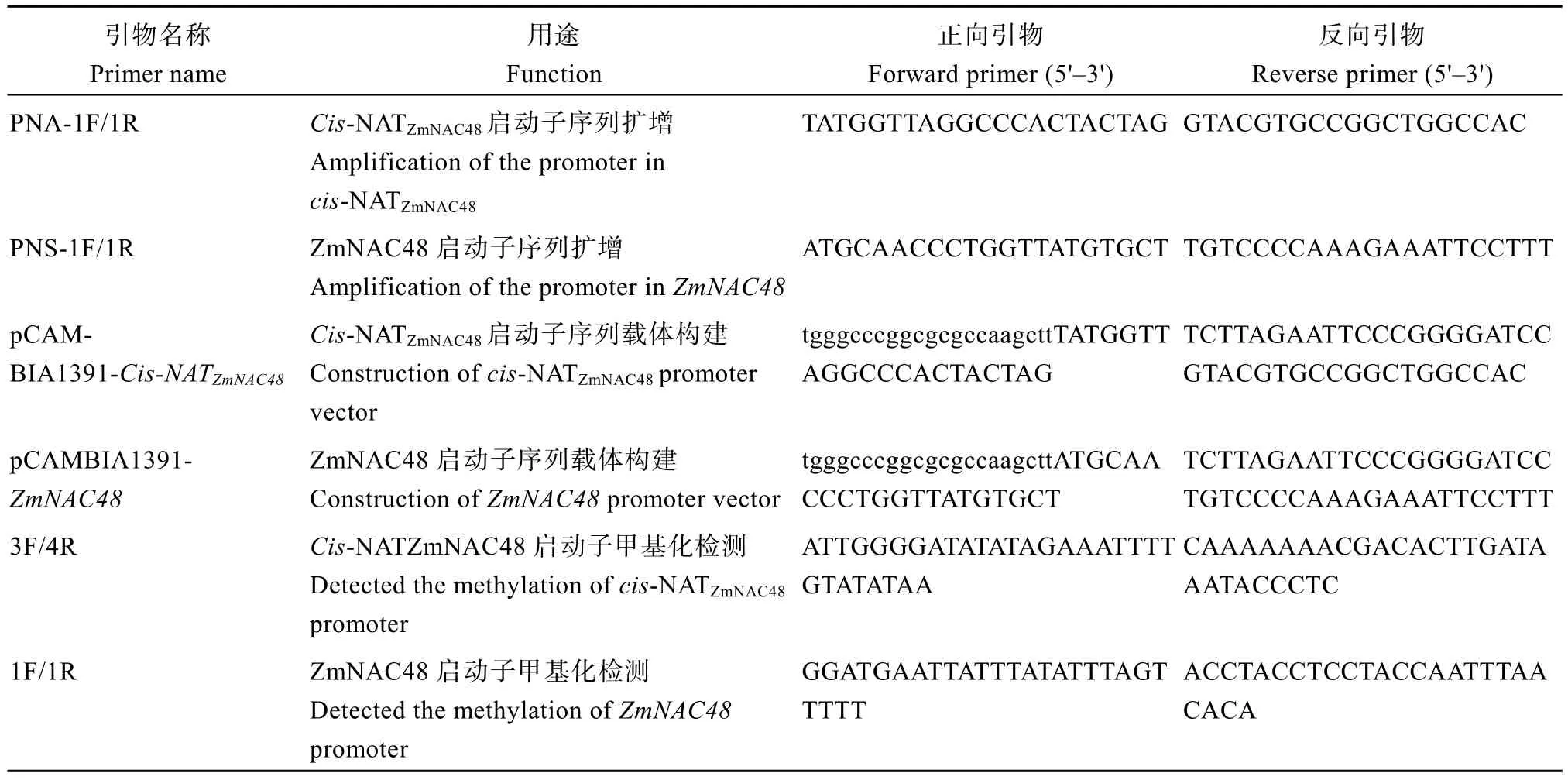
表1 本研究所用引物Table 1 Primers used in this study
1.5 启动子载体构建
将扩增的cis-NATZmNAC48(1284 bp)和ZmNAC48(1246 bp)启动子序列构建到载体pCAMBIA1391 (采用双酶切,Hind III 和BamH I)。运用试剂盒ClonExpress Multis one step cloning kit (Vazyme, 江苏南京)将线性的载体pCAMBIA1391和加上同源序列的目的序列进行连接反应。反应结束后, 进行大肠杆菌感受态转化(菌株Trans1-T1), 测序, 获得Procis-NATZmNAC48:GUS和ProZmNAC48:GUS载体。质粒提取采用Plasmid mid kit D6904 (Omega, 美国)试剂盒。
1.6 Procis-NATZmNAC48:GUS 和ProZmNAC48:GUS 拟南芥材料获得
将构建的 Procis-NATZmNAC48:GUS 和 ProZmNAC48:GUS 载体转化到农杆菌菌株EHA105 中(北京博迈德基因技术有限公司), 通过花序侵染法转化拟南芥[13]。获得T0代种子用75%酒精清洗10 min, 再用清水清洗2~3 次后播种到含50 mg mL–1卡那霉素1/2 MS 培养基, 阳性植株移栽至土壤中, 取T1代叶片提取 DNA, 检测目的基因, 直到筛选出纯合植株。
1.6 转基因拟南芥GUS 染色
将21 d 大小的ProZmNAC48: GUS 和Procis-NATZmNAC48:GUS 转基因拟南芥放入新鲜GUS 染色液[0.1 mol L–1磷酸缓冲液(pH 7.0), 50 mmol L–1K3Fe (CN)6, 50 mol L–1K4Fe (CN)6, 0.5 mol L–1Na2EDTA, 1% Triton,20 mmol L–1X-Gluc]中于37℃恒温避光过夜, 用无水乙醇脱色, 直至组织色素被去除, 在普通显微镜下观察染色情况。
1.7 转基因拟南芥GUS 酶活性测定
将转基因拟南芥的种子和野生型材料的种子用75%酒精清洗10 min 后, 用清水清洗2~3 次后播种到1/2 MS 固体培养基(不含任何抗生素)上, 4℃生长2 d, 移到长日照条件下生长5 d 后, 将拟南芥移到新的1/2 MS 固体培养基上, 继续长日照培养7 d 后,将转基因拟南芥和野生型材料幼苗移出分别放置在1/2 MS 液体培养基和含20% PEG-6000 的1/2 MS 液体培养基继续培养 6 h 后取样, 一部分样品用于RNA 提取, 测定GUS基因表达量; 另一部分样品用于测定GUS 酶活性, GUS 酶活性测定采用GUS 荧光分析的方法[11], 共进行3 次生物学重复。
1.8 BSP (Bisulfite sequencing PCR)技术
用试剂盒EZ DNA Methylation-gold kit (ZYMO RESEARCH)处理所提取的DNA。处理后的DNA 双链中的“C”转化为“U”, 通过PCR 将“U”转化为“T”。利用在线引物设计网站MethPrimer 设计引物(表1),以处理后的DNA 作为模板克隆目的序列。所得到的目的序列连接到T 载体上, 挑取至少20 个单克隆,送样测序。测序结果正确的序列利用网站Kismeth(http://katahdin.mssm.edu/kismeth/revpage.pl#) 进行比对分析[14]。
2 结果与分析
2.1 玉米cis-NATZmNAC48及其正义基因ZmNAC48启动子序列分析
以cis-NATZmNAC48序列和ZmNAC48蛋白质编码序列检索玉米B73 参考基因组, 获取基因上游启动子序列。利用生物信息网站 PlantCARE 和 New PLACE 预测启动子调控元件发现(表2 和表3),cis-NATZmNAC48(2000 bp)和ZmNAC48(1500 bp)启动子序列中除具有CAAT-box, TATA-box 等基本元件外,cis-NATZmNAC48启动子序列中还包含ACE, G-box等的光响应元件, TGA-element 生长素响应元件以及ABRE 脱落酸响应元件, 同时也包含WRKY 转录因子结合序列W-box;ZmNAC48启动子区域中包含GA-motif 光响应元件, 厌氧相关元件ARE, 玉米醇溶蛋白代谢调节相关元件O2-site, 组织特异表达调控元件 NON-box, 以及转录因子 MYB 结合位点MBS, Myb-binding sites。
2.2 玉米cis-NATZmNAC48及其正义基因ZmNAC48启动子序列克隆及载体构建
为了探究自然反义转录本cis-NATZmNAC48及其正义基因ZmNAC48启动子在渗透胁迫响应中的功能, 以B73 基因组获得的上游启动子作为参考序列,设计特异引物, 以玉米AC7729/TZSRWB 自交系根系DNA 为模板进行PCR 扩增, 最后经测序显示扩增获得的cis-NATZmNAC48启动子序列大小为1284 bp,ZmNAC48启动子序列大小为1246 bp。将获得的启动子序列构建到含有GUS 基因的表达载体上, 并转化拟南芥, 获得由cis-NATZmNAC48启动子驱动的Procis-NATZmNAC48:GUS 转基因株系和ZmNAC48启动子驱动的ProZmNAC48:GUS 转基因株系。
2.3 玉米cis-NATZmNAC48 和ZmNAC48 启动子表达模式分析
为了探究cis-NATZmNAC48和ZmNAC48的表达模式, 我们将生长至21 d 大小的拟南芥进行GUS染色, 经GUS 染色分析发现Procis-NATZmNAC48:GUS和ProZmNAC48:GUS 转基因拟南芥根、茎、叶中均有GUS 表达(图1-A)。
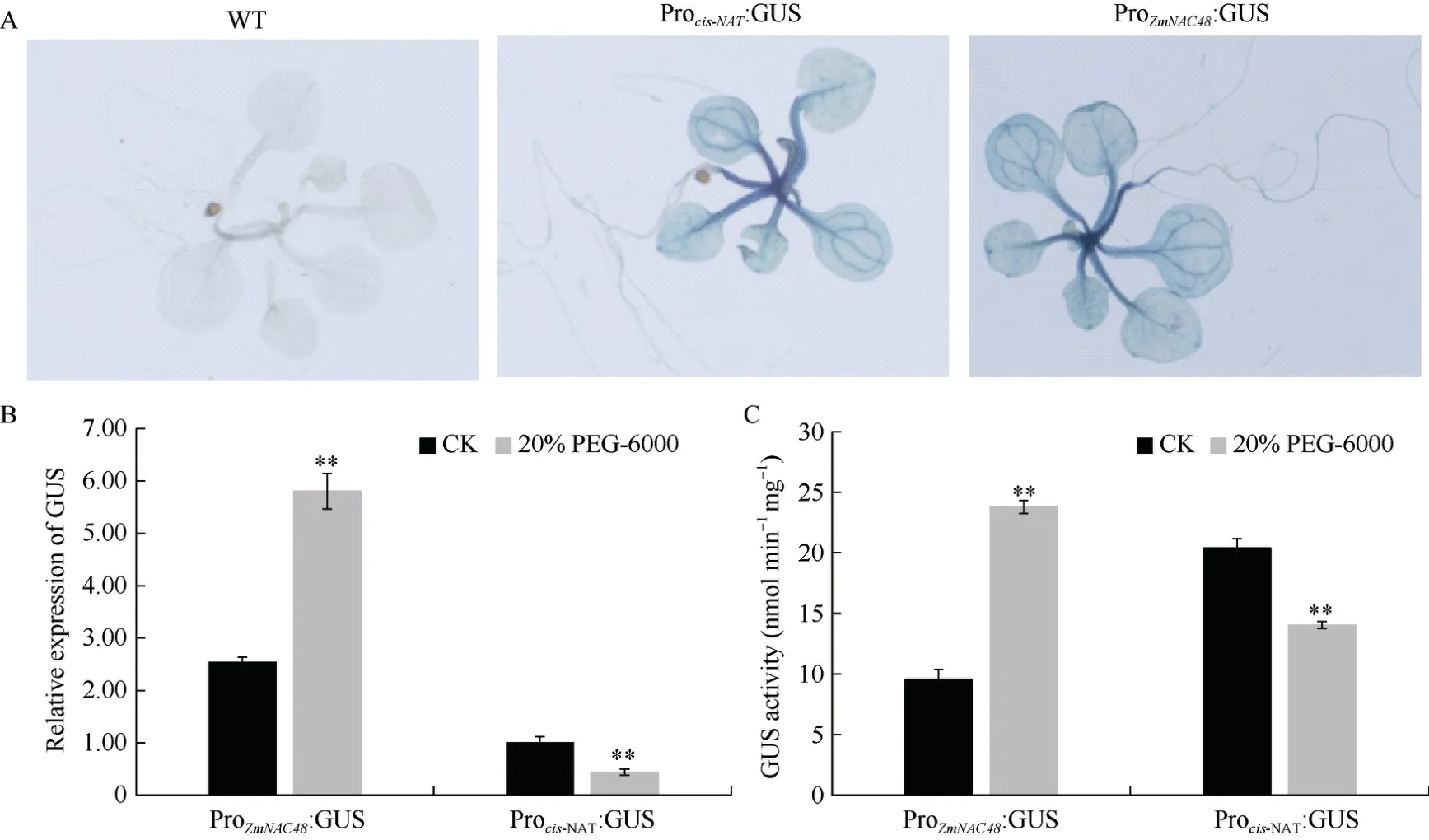
图1 Cis-NATZmNAC48 和ZmNAC48 启动子功能分析Fig.1 Function analysis of cis-NATZmNAC48 and ZmNAC48 promoter
为了明确cis-NATZmNAC48和ZmNAC48启动子是否为渗透胁迫响应启动子, 本研究用20% PEG-6000处理14 d 大小的拟南芥植株6 h 后, 分析转基因材料中GUS基因表达量和GUS 酶活性, 发现ProZmNAC48:GUS 拟南芥中GUS基因的表达量及GUS 酶活性显著增加, 而Procis-NATZmNAC48: GUS 中GUS基因的表达量及 GUS 酶活性显著下调(图1-B)。可见cis-NATZmNAC48和ZmNAC48启动子响应渗透胁迫。
2.4 玉米cis-NATZmNAC48 和ZmNAC48 启动子区域DNA 甲基化水平分析
为了解析cis-NATZmNAC48和ZmNAC48启动子应答渗透胁迫后调控自然反义转录本的表达的特异性,我们分析了玉米耐旱自交系AC7643 和干旱敏感自交系AC7729/TZSRWB 根系在正常供水和含20%PEG-6000 处理 24 h 后根系中cis-NATZmNAC48和ZmNAC48启动子序列中DNA 甲基化情况发现, 在cis-NATZmNAC48序列前400~1000 bp 为DNA 甲基化区域, 渗透胁迫后, 该区域甲基化并没有发生显著变化(图2-A)。ZmNAC48转录起始位点前500~900 bp为DNA 甲基化区域, 渗透胁迫处理后该甲基化富集程度降低(图2-B)。
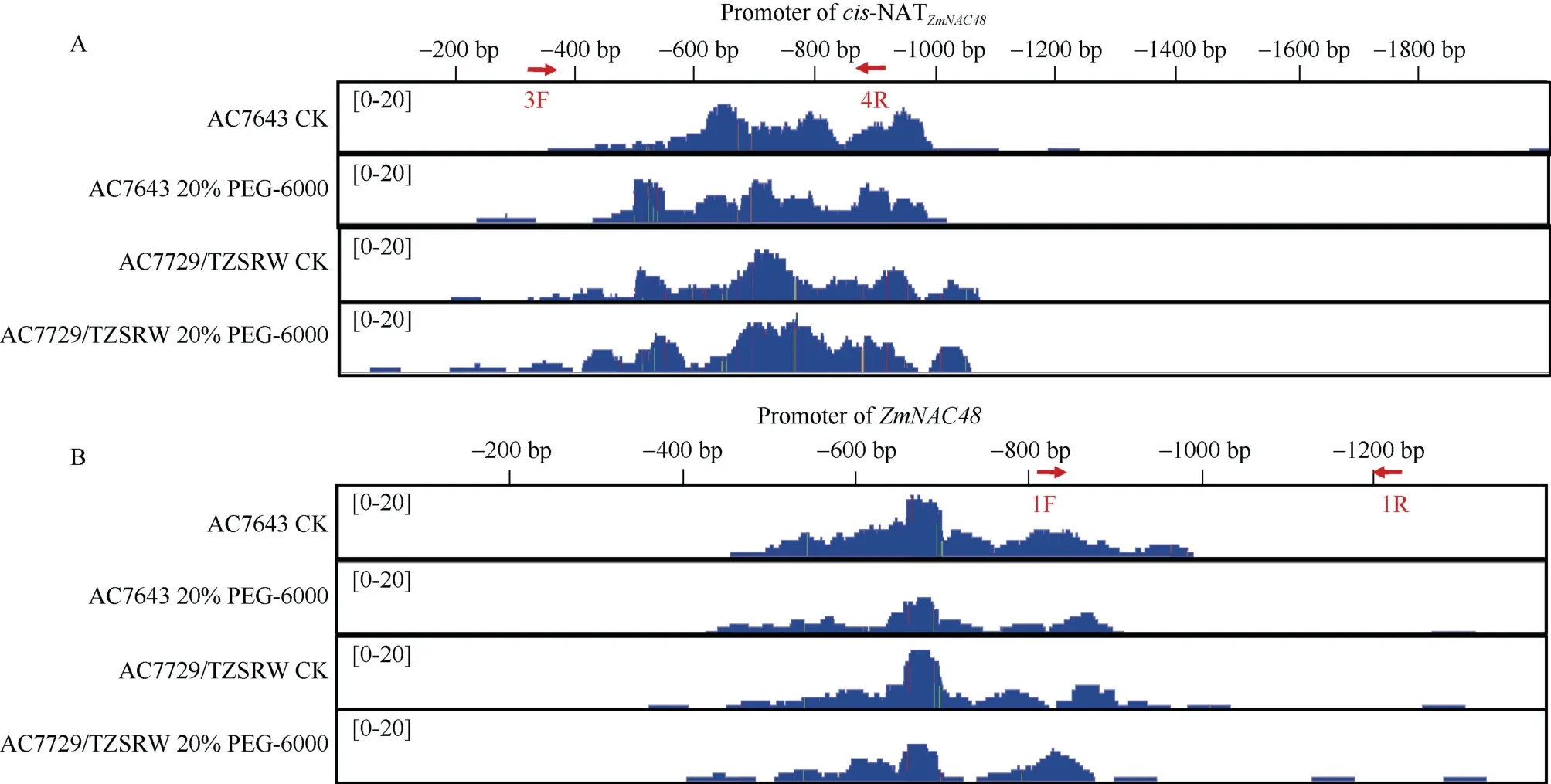
图2 Cis-NATZmNAC48 和ZmNAC48 启动子区域DNA 甲基化Fig.2 DNA methylation in cis-NATZmNAC48 and ZmNAC48 promoter
为了进一步验证启动子甲基化在渗透胁迫下的变化情况, 我们采用BSP 的方法, 分析渗透胁迫处理后,cis-NATZmNAC48和ZmNAC48启动子甲基化区域甲基化变化。如图3-A~E, 可以看到在cis-NATZmNAC48启动子甲基化区域检测到了GC、GCH 和CHH 甲基化富集, 且胁迫处理后玉米耐旱自交系AC7643 中甲基化富集增加, 干旱敏感自交系AC7729/TZSRWB中甲基化富集减少。且在胁迫处理中仅CHH 类甲基化发生显著变化, GC 类和GCH 类甲基化未发生显著变化。
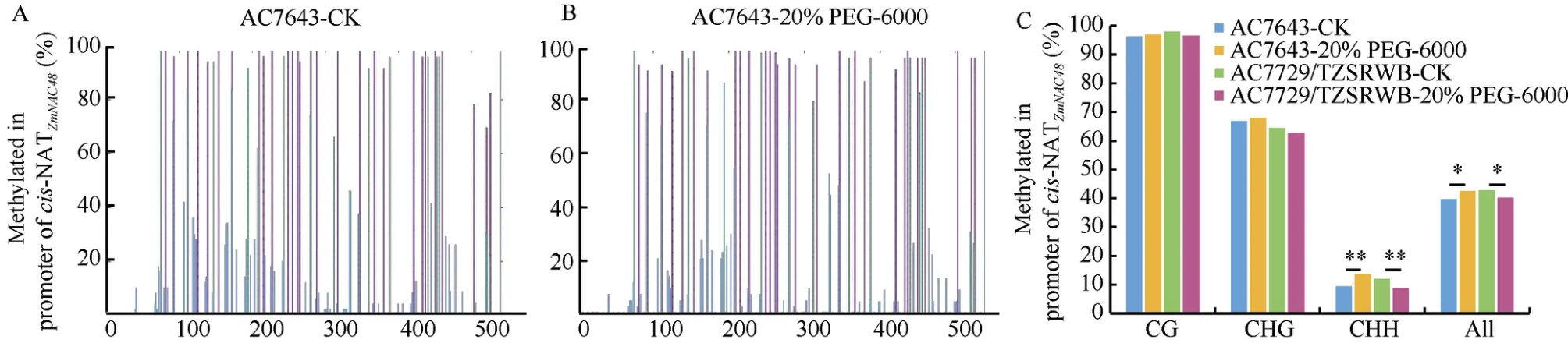
图3 Cis-NATZmNAC48 和ZmNAC48 启动子区域DNA 甲基化分析Fig.3 DNA methylation characteristics in cis-NATZmNAC48 and ZmNAC48 promoter
分析单个位点甲基化变化, 发现显著变化的甲基化位点均不在各顺式调控位点上(图4)。当我们对ZmNAC48启动子甲基化区域进行扩增时, 仅扩增到如图2-B 中引物1F/1R 间的区域, 该区域并未检测到甲基化富集(图3-F)。
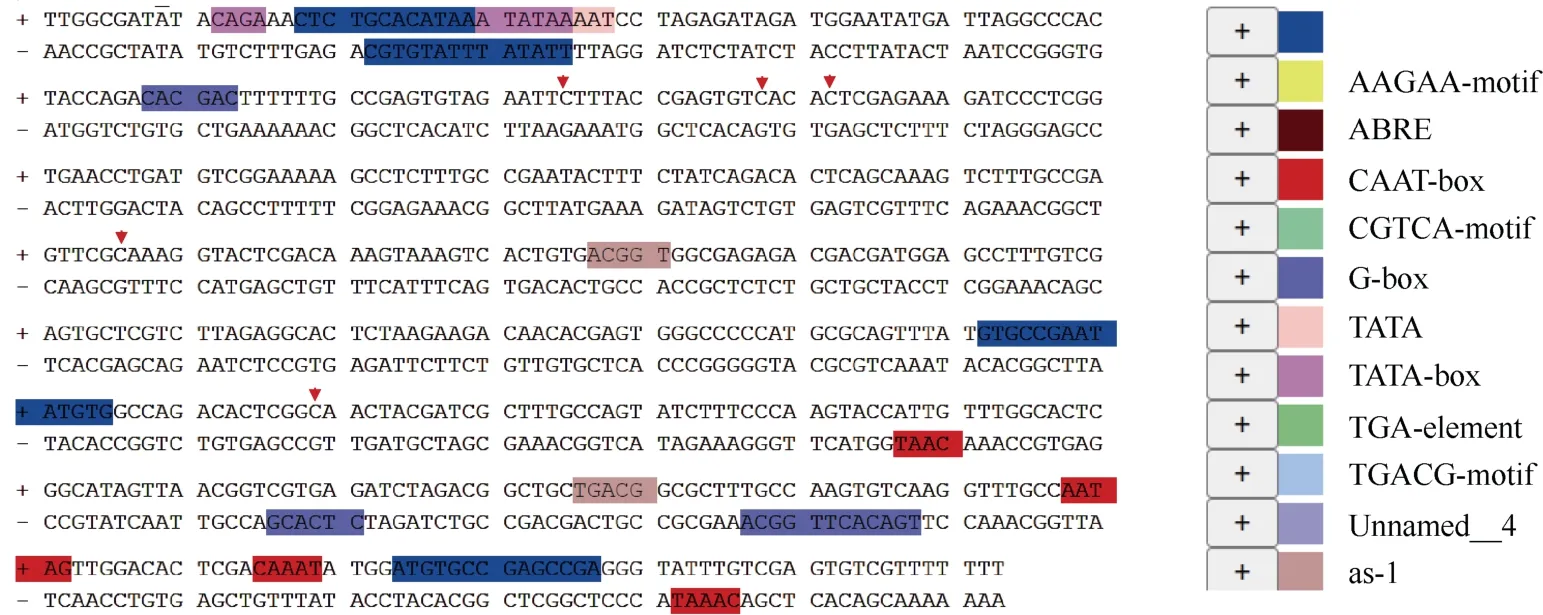
图4 Cis-NATZmNAC48 启动子甲基化区域顺式元件预测Fig.4 Cis-element prediction of cis-NATZmNAC48 promoter
3 讨论
探究渗透胁迫下玉米各基因的分子调控机制,有利于提高玉米抵抗逆境胁迫的能力, 为玉米抗逆分子育种提供理论基础和基因资源。NATs 作为一类重要的 lncRNAs, 在生物体内普遍存在, 大约有22%的人类、15%的果蝇、7%的水稻和9%的拟南芥基因含有NATs, 在玉米中约46%的转录本为NATs,其中约有29%的NATs 响应渗透胁迫[4,15]。因此, 深入研究NATs 的表达调控, 对理解玉米抗逆分子机制具有重要的意义。此前研究发现cis-NATZmNAC48可能通过双链RNA 依赖机制负调控玉米ZmNAC48基因表达进而影响玉米气孔开闭, 调控植物耐旱性[12]。启动子作为基因调控的关键因子, 其序列中分布着与基因功能密切相关的顺式调控元件。因此,解析渗透胁迫下cis-NATZmNAC48启动子的功能可为后续cis-NATZmNAC48的调控分析奠定重要的基础。
用PlantCARE[1]和New PLACE[2]分析启动子序列, 显示玉米cis-NATZmNAC48启动子含TGA、ABRE,W-box;ZmNAC48启动子含有ARE、MBS 等逆境胁迫应答元件(表2)。ABA-responsive element (ABRE)是ABA 应答的核心元件, 其在基因响应脱水、高盐、低温和ABA 胁迫处理中扮演着重要的角色[16-17]。W-box 序列可被WRKY 转录因子特异结合, 研究表明W-box 主要存在于与抗病、损伤、衰老、干旱相关基因的启动子区域, 因此WRKY 转录因子与植物的生物与非生物胁迫应答密切相关[18]。Abe 等研究发现MYB, MYC 转录因子识别位点如MBS 序列, 在干旱诱导RD22 基因表达中具有重要作用[19]。可见cis-NATZmNAC48和ZmNAC48启动子在cis-NATZmNAC48和ZmNAC48响应逆境胁迫具有重要作用。此外, 通过分析Procis-NATZmNAC48: GUS 和ProZmNAC48: GUS 转基因拟南芥在渗透胁迫下GUS基因表达情况及其GUS 酶活性, 证明cis-NATZmNAC48和ZmNAC48启动子响应渗透胁迫。
DNA 甲基化是影响启动子活性的调控事件之一。在有机体中, DNA 甲基化和基因表达之间的关系不是绝对的, 但一般的规律是: 甲基化作用阻止基因表达, 而表达则需要去甲基化作用[20-21]。TaGli-γ-2.1属于小麦麦胶蛋白基因家族成员, 是小麦面筋强度的负调控因子, 其启动子区域的高甲基化导致TaGli-γ-2.1基因表达量的降低, 提高了小麦面筋强度, 丰富了小麦品质育种资源[22]。渗透胁迫和盐胁迫诱导小麦甘油醛-3 磷酸脱氢酶基因TaGAPC1启动子区域的CG 和CHG 两种类型的甲基化程度降低[23]。本研究中我们发现cis-NATZmNAC48启动子区域甲基化会因为渗透胁迫而发生改变。渗透胁迫处理6 h, 玉米耐旱自交系AC7643 中甲基化富集增加, 干旱敏感自交系AC7729/TZSRWB 中甲基化富集减少(图3)。其中玉米耐旱自交系AC7643根系中cis-NATZmNAC48的表达量没有发生显著变化,而在干旱敏感自交系AC7729/TZSRWB 根系中cis-NATZmNAC48的表达量显著减少[12]。渗透胁迫处理24 h,玉米耐旱自交系AC7643 和干旱敏感自交系AC7729/TZSRWB 中甲基化富集没有变化(图2)。其中玉米耐旱自交系 AC7643 和干旱敏感自交系 AC7729/TZSRWB 根系中cis-NATZmNAC48的表达量显著减少[12]。因此关于cis-NATZmNAC48启动子区域甲基化变化是否影响cis-NATZmNAC48, 又是如何影响cis-NATZmNAC48表达, 进而调控植物耐旱性, 还有待进一步研究。但通过本研究我们可以确定的是渗透胁迫会影响cis-NATZmNAC48启动子区域DNA 甲基化富集。
4 结论
玉米自然反义转录本cis-NATZmNAC48启动子序列中含有TGA, ABRE, W-box 等非生物胁迫响应应答元件, 响应干旱等非生物胁迫。通过获得转基因材料进一步证明cis-NATZmNAC48和ZmNAC48启动子响应渗透胁迫。通过分析渗透胁迫下cis-NATZmNAC48启动子甲基化情况发现,cis-NATZmNAC48启动子区域DNA 甲基化受渗透胁迫影响, 但渗透胁迫下DNA甲基化变化显著的位点并未在个顺式调控元件中。

