叶面喷施丹参碳点缓解甘薯低磷胁迫的转录组与代谢组学分析
朱晓亚 张强强 赵 鹏 刘 明 王 静 靳 容 于永超 唐忠厚
江苏徐淮地区徐州农业科学研究所 / 中国徐州国家土壤质量观测试验站, 江苏徐州 221131
甘薯(Ipomoeabatatas(L.) Lam.)是中国重要的粮食作物和经济作物之一, 种植面积224.98 万公顷,总产达4919.56 万吨, 占世界总产的54.97%[1]。磷(P)是植物必需的营养元素之一, 对植物的生长发育、代谢、营养物质的积存和产量形成起着重要作用[2]。越来越多的研究表明, 磷有效性是限制全球范围内作物生产力的关键因素[3]。磷素营养不足引起甘薯光合速率下降, 碳氮代谢失常, 糖类积累量以及蛋白质合成受抑[4], 可导致甘薯产量损失高达25%~60%[5]。长期以来, 施用磷肥是实际农业生产中最为重要的增磷手段。但由于磷肥的当季利用率不到25%和磷肥的过量施用, 导致土壤磷素不断累积, 土壤遗留磷可供给作物生长9~22 年[6]。过量施用磷肥也会导致土壤污染、水体富营养化、威胁其他生物生存等问题。因此, 面对磷矿资源有限和磷肥利用率低的现状, 提高甘薯对土壤磷素的吸收和利用效率, 已成为我国甘薯生产和科研中亟待解决的重要课题。
近年来, 随着纳米科技的快速发展, 纳米材料在促进作物养分吸收、增强作物抗逆性方面的应用研究也越来越受到关注。将纳米材料通过叶面喷施、根施以及与土壤基质和营养液混合的方式应用于土壤和植物营养领域, 都对不同植物的生长发育及磷素营养状况起到不同程度的改善作用。如有研究表明, 叶面喷施纳米硅藻土后, 苋菜吸磷总量提高了36%, 干物质量提高了43.4%[7]。通过nTiO2/ZnO 处理水培生菜试验可显著增加生菜根系对磷元素的吸收以及生菜地上部磷含量[8]。尹勇和刘灵[9]将nSiO2添加到水稻土中, 发现土壤有效磷含量显著增加,促进了水稻对磷养分的吸收。最近的研究发现, 与传统的纳米材料相比, 纳米碳点(CDs)具有优异的光学性能、良好的水溶性、低毒性、环境友好性、生物相容性、原料来源广、制备成本低等诸多优点, 在增强作物抗逆性、促进作物生长方面展示了巨大的应用前景。纳米CDs 通过增强植物的光合作用, 可提高花生[10]和高粱[11]的耐旱性、保护水稻免受盐胁迫[12]、增强甘薯幼苗对低钾和低铁环境的适应性[13];或通过促进根系分泌琥珀酸(14.5 倍)、丙酮酸(10.0倍)和甜菜碱(11.8 倍)以及提高根际土壤中Pseudomonas(假单胞菌)、Sphingomonas(鞘氨醇单胞菌)、Nitrospira(硝化螺旋菌)和Conocybe(锥盖伞属)的丰度, 促进营养同化, 保护干旱胁迫下玉米幼苗的生长[14]。但纳米CDs 如何改善低磷胁迫环境下的作物生长, 目前尚不清楚。
本研究以商薯19 和徐薯32 为试验材料, 探究叶面喷施丹参制备的CDs 对0.01 mmol L-1KH2PO4胁迫处理下甘薯幼苗生长发育和磷素营养的影响;采用转录组学测序手段挖掘低磷胁迫处理下叶面喷施丹参CDs 前后甘薯根系中的差异表达基因, 筛选并解析响应低磷胁迫的功能基因的变化, 结合GC-MS 代谢组学分析手段解析甘薯根系代谢物的差异表达, 揭示叶面喷施丹参CDs 促进低磷胁迫下甘薯幼苗生长的作用机制。本研究结果可为建立甘薯磷养分高效的调控理论与调控新途径提供科学支撑和理论依据, 对于从根本上改变甘薯栽培中磷肥高投入的农业生产方式、推动农业绿色发展具有重要理论和实践意义, 也为后续针对纳米CDs 缓解低磷胁迫的相关研究提供了候选分子资源。
1 材料与方法
1.1 试验材料
供试甘薯材料为商薯19 和徐薯32, 由江苏徐淮地区徐州农业科学研究所提供。这2 个品种在山东、河南、江苏、安徽等地种植面积大、受众广; 且前期研究结果表明均为不耐低磷基因型甘薯品种[15]。
供试丹参CDs 由江苏师范大学生命科学学院甘薯课题组提供, 平均颗粒直径为3.32 nm。具体的合成与制备方法: 将3.50 g 丹参粉添加到70 mL 去离子水中, 混合均匀。然后, 将混合溶液在聚四氟乙烯内衬不锈钢高压釜中加热6 h (150 ℃)。冷却至室温后, 用0.22 μm 的滤膜去除溶液中的大颗粒。最后,通过在3500 Da 透析袋中透析进一步纯化, 于4℃下保存。
1.2 试验设计
水培试验于2022 年6 月在江苏徐淮地区徐州农业科学研究所(34°27′N, 117°29′E)进行。试验共设置3 个处理, 分别为: 低磷营养液(0.01 mmol L–1KH2PO4)叶面喷施超纯水(CK1)、正常磷营养液(1 mmol L–1KH2PO4)喷施超纯水(CK2)和低磷营养液喷施1.5 mg mL–1丹参碳点溶液(CDs)。具体操作如下: 从温室苗床中选取长势一致, 生长到三叶一心的商薯19 和徐薯32 甘薯幼苗, 剪切茎尖以下约15 cm 长的薯蔓, 在盛有蒸馏水的培养箱中缓苗3 d,再转移至1/2 含量Hogland 营养液中培养。营养液各成分如下: CaCl2332.5 mg L–1、NaNO3255 mg L–1、KH2PO4136 mg L–1(浓度为1 mmol L–1)、K2SO4435 mg L–1、MgSO4246.5 mg L–1、铁盐溶液2.5 mL (每500 mL 蒸馏水中加入FeSO4·H2O 2.78 g、Na2EDTA 3.73 g, pH 5.5)、微量元素溶液5 mL (含NaI 0.75 mg L–1、H3BO36.2 mg L–1、MnSO422.3 mg L–1、ZnSO48.6 mg L–1、Na2MoO40.25 mg L–1、CuSO40.025 mg L–1、CoCl20.025 mg L–1)。每个培养箱12 株, 每个品种分别培养36 (12×3)株。幼苗生长7 d 后, 分别将预处理后的甘薯幼苗按试验处理进行水培试验,其中低磷营养液KH2PO41.36 mg L–1(浓度为0.01 mmol L–1), 其他成分不变。每3 d 换一次营养液, 在温室中自然光温条件下培养。培养2 周出现缺磷症状后, 进行连续6 d 的叶面喷施CDs, 不进行叶面喷施CDs 的处理喷施等量的超纯水, 各处理每次喷施标准为喷施后叶面均匀布满雾状水滴, 共计10 mL,每个处理3 个重复。在胁迫处理的第23 天进行样品采集。
取样时, 每个处理取长势基本一致的3 株植株,将每株样品分为叶片、茎和根系3 部分, 并称其鲜质量。将不同处理的部分根系样品快速用锡纸包装,置于液氮中速冻, 后置于-80℃超低温冰箱保存, 供转录组和代谢组测定。其余叶片、茎和根系样品装入信封, 经105℃杀青, 再在75℃烘箱内烘干后, 用于磷含量测定。
1.3 样品测定与分析
1.3.1 磷含量测定 植物各器官样品分别经H2SO4-H2O2消解后, 采用钼蓝比色法测定磷含量[16]。
1.3.2 转录组测序 各试验处理甘薯幼苗根系总RNA 通过RNeasy Plus Universal Mini Kit (Qiagen)进行提取。使用Agilent 2100 Bioanalyzer (Agilent Technologies, Santa Clara, 美国)对RNA 质量进行评估, RNA 完整性数值>6.0 为高质量样本。利用NanoDrop 2000 分光光度计(Thermo Scientific, 美国)鉴定RNA 纯度和定量。使用VAHTS Universal V5 RNA-seq Library Prep 试剂盒依照说明书构建转录组文库。采用Ilumina Hiseq 2000 测序平台对文库进行测序。由上海欧易生物科技有限公司进行转录组测序和分析。
1.3.3 代谢组测定 称取 60 mg 根系样本于1.5 mL 离心管中, 加入600 μL 甲醇-水(v∶v=1∶1,含 L-2-氯苯丙氨酸, 2 μg mL–1), 在–40℃下预冷2 min 后, 进行研磨(60 Hz, 2 min), 然后置于冰水浴超声提取30 min。再加入150 μL 的氯仿, 涡旋仪中涡旋2 min; 冰水浴超声提取30 min; –40℃静置30 min; 低温离心10 min (18,000×g, 4 ℃)。然后, 取150 μL 的上清液装入玻璃衍生小瓶中, 加入80 μL的甲氧胺盐酸盐吡啶溶液(15 mg mL–1), 涡旋震荡2 min 后, 于37℃震荡培养箱中60 min。最后, 依次加入50 μL BSTFA 衍生化试剂、20 μL 正己烷, 10 μL内 标 (C8/C9/C10/C12/C14/C16/C18/C20/C22/C24),涡旋震荡2 min 后, 于70℃反应60 min。取出样本后, 在室温放置30 min, 进行GC-MS 代谢组学分析,由上海欧易生物科技有限公司进行。色谱条件:DB-5MS 毛细管柱(30 m × 0.25 mm × 0.25 μm,Agilent J&W Scientific, Folsom, 美国), 载气为高纯氦气(纯度不小于99.999%), 流速1.0 mL min–1, 进样口的温度为260℃。进样量1 μL, 不分流进样, 溶剂延迟5 min。程序升温: 柱温箱的初始温度为60 ℃,保持0.5 min; 以8 ℃ min–1程序升温至125 ; 8℃min–1升温至210 ℃; 15℃ min–1升温至270 ; 20℃min–1升温至305 ℃, 保持5 min。质谱条件: 230℃电子轰击离子源(EI), 四极杆温度150 ℃, 电子能量70 eV。扫描方式为全扫描模式(SCAN), 质量扫描范围:m/z 50~500。
1.4 数据处理
利用Microsoft Excel 2010 进行数据统计。利用SPSS 24.0 软件对所有处理甘薯幼苗各器官生物量和磷含量数据进行单因素方差分析(ANOVA), 运用Duncan’s 新复极差法比较不同处理间甘薯幼苗各器官生物量和磷含量在α=0.05 水平上的显著性差异。以CK1 处理为对照, 分别在CDs 和CK2 处理中筛选差异表达的代谢物和基因。其中, 差异表达代谢物(Differential expressed metabolites, DEMs)和差异表达基因(Differential expressed genes, DEGs)的筛选条件为|log2(Fold Change) |≥1 且q<0.05, 并基于GO和KEGG 数据库对DEMs 和DEGs 进行功能注释和分析。由上海欧易生物科技有限公司进行转录组和代谢组数据处理。
2 结果与分析
2.1 低磷胁迫下叶面喷施丹参碳点对甘薯幼苗表型和磷含量的影响
叶面喷施丹参CDs 显著促进了低磷胁迫下甘薯幼苗的生长(图1)。与CK1 处理相比, 叶面喷施丹参碳点后(CDs 处理), 商薯19 和徐薯32 均表现为叶片数增加、根系伸长、侧根长度和数量增加, 从而地上部和地下部生物量显著增加(P<0.05)。其中, 商薯19 叶片、茎和根系生物量较 CK1 处理分别增加388.05%、228.73%和1082.68%; 徐薯32 叶片、茎和根系生物量较CK1 处理分别增加90.18%、30.82%和894.44% (图2)。与CK1 处理相比, CDs 处理中商薯19 和徐薯32 根系磷含量也显著提高(P<0.05), 分别比CK1 处理提高71.43%和110.00% (图3)。CK1与CK2 比较组也得到了相似的结果。CK2 处理中商薯19 和徐薯32 各器官生物量以及磷含量较CK1 处理均显著提高。

图1 低磷胁迫下叶面喷施丹参碳点对甘薯幼苗表型的影响Fig.1 Effects of foliar spraying of Salvia miltiorrhiza CDs on the phenotypes of sweetpotato seedlings under low P stress
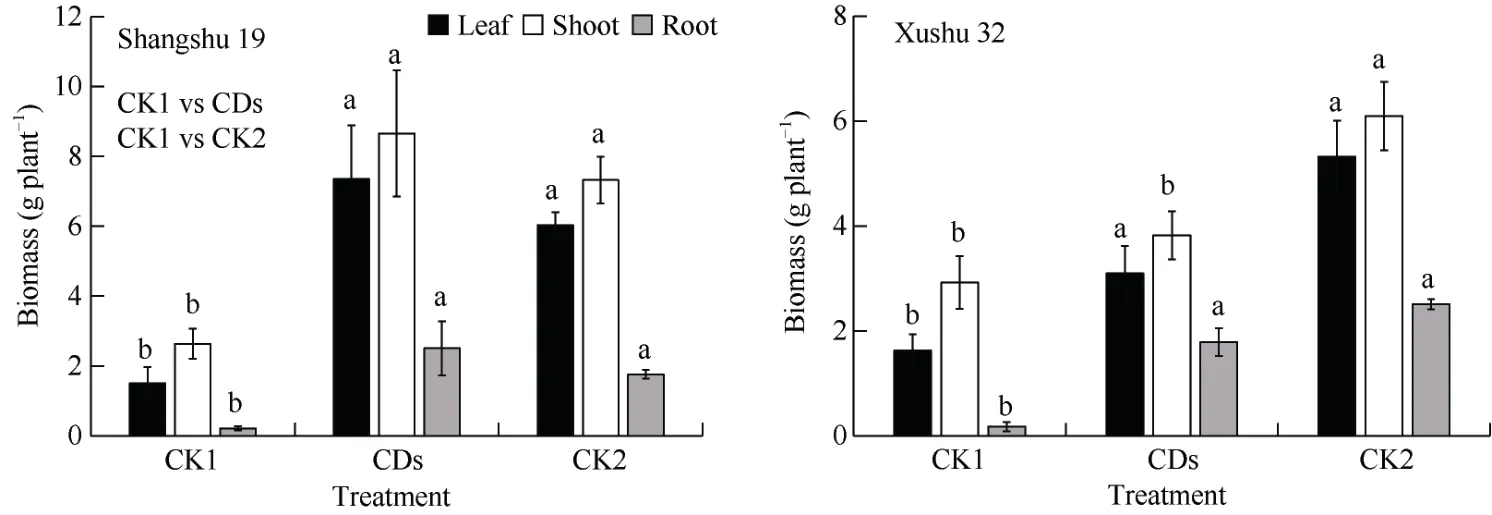
图2 低磷胁迫下叶面喷施丹参碳点对甘薯幼苗各器官生物量的影响Fig.2 Effects of foliar spraying of Salvia miltiorrhiza CDs on the biomass of various organs of sweetpotato seedlings under low P stress
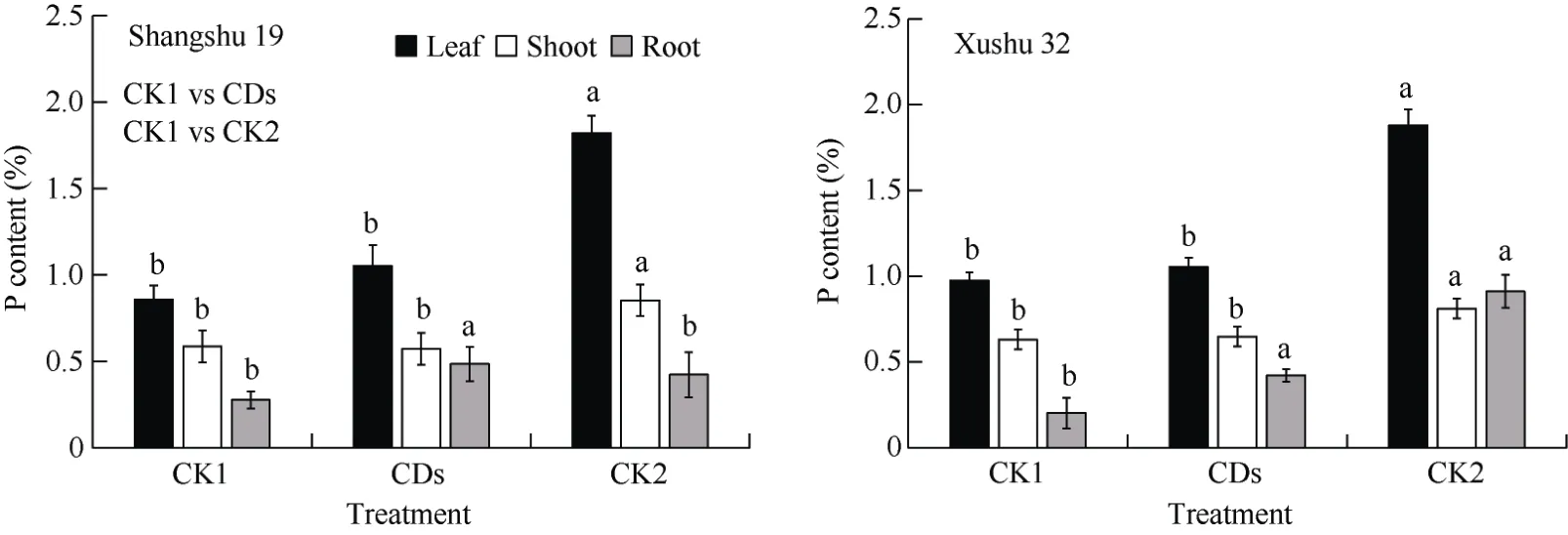
图3 低磷胁迫下叶面喷施丹参碳点对甘薯幼苗各器官磷含量的影响Fig.3 Effects of foliar spraying of Salvia miltiorrhiza CDs on the P content of various organs of sweetpotato seedlings under low P stress
2.2 转录组差异表达基因的筛选与分析
主成分分析(PCA)展示了不同甘薯品种根系转录组样本间的重复性及不同处理间的整体变化趋势(图4), 结果表明, 商薯19 和徐薯32 根系转录组在不同处理中样本重复性均较好, 呈显著聚集趋势,可以用于后续差异分析。商薯19 和徐薯32 在不同处理中样品间的整体变化趋势相同, 其中CK1 和CDs 处理与CK2 处理沿PC1 轴相距较远; 而CK1与CDs 处理主要沿PC2 轴相互分离。
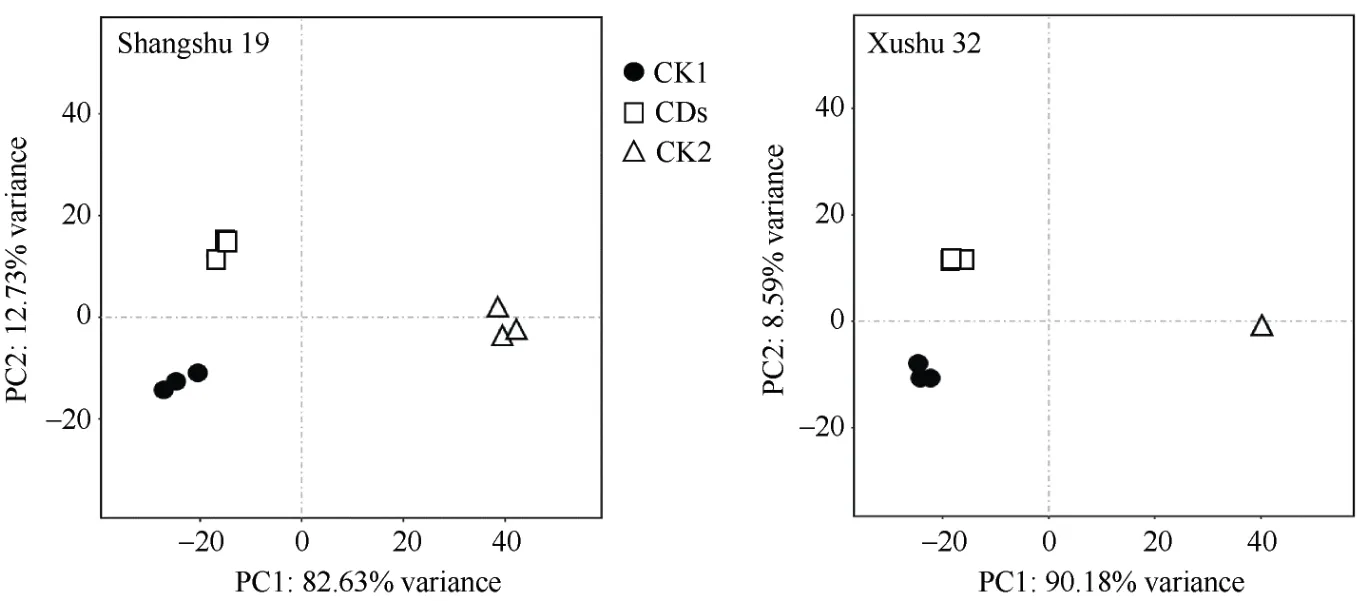
图4 不同处理下甘薯根系基因表达的PCA 分析Fig.4 PCA analysis of root gene expression in sweetpotato under different treatments
不同比较组间甘薯幼苗根部的DEGs 统计结果如表1 所示。与CK1 相比, 商薯19 和徐薯32 在叶面喷施CDs 后(CDs 处理)的DEGs 分别共有3554 个和2160 个, 其中下调基因的数目均显著高于上调基因数目。CK1 与CK2 比较组筛选的DEGs 数目较CK1 与CDs 比较组更多, 尤其是徐薯32, CK1 与CK2 比较组筛选的总DEGs 数目比CK1 与CDs 比较组多242.92%。但与徐薯32 相比, 商薯19 在CK1与CDs 比较组、CK1 与CK2 比较组间筛选出的DEGs更多, 其中CK1 与CDs 比较组上调基因数目和下调基因数目分别比徐薯32 增加了59.52%、67.44%。
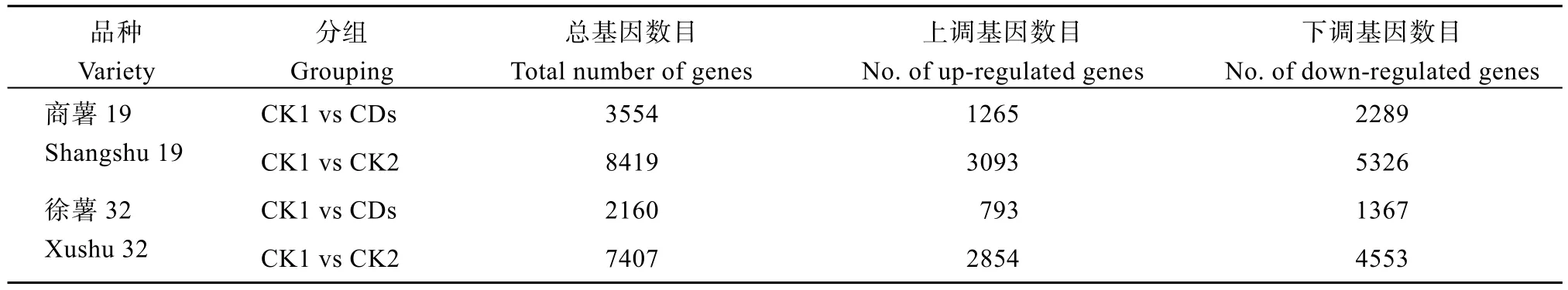
表1 差异表达基因数目统计结果Table 1 Summary of the number of differentially expressed genes
利用韦恩图显示不同比较组间共有及特有的DEGs 数量(图5), 商薯19 和徐薯32 在CK1 与CDs比较组中所特有的DEGs 数量分别为1276 个和654个。为研究叶面喷施CDs 对低磷胁迫下甘薯幼苗磷素营养和根系生长相关基因的影响, 分别对这1276个和654 个基因进行分析, 筛选与磷酸盐吸收和运输、酸性磷酸酶活性和根系生长相关的基因作基因热图。由图6 可知, 在商薯19 根系转录组中检索到3 个磷酸盐运输基因PHO1-H1、PHT1-4和GPT2, 2个磷酸根离子稳态基因At3g47420和ZAT6, 1 个肌醇代谢基因(VIP2)以及14 个与根系生长发育相关的基因(ZAT6、ZFP5、PLT5、ARF16、ZAT11、KUA1、MYB36、NAC021、PIN4、AIR9、IAA8、BPS1、CYP83B1、LBD16)。在徐薯32 根系转录组中检索到2 个磷酸盐运输基因PHO1、PHT1-4, 2 个磷酸根离子稳态基因At3g47420和ZAT6, 1 个肌醇代谢基因(VIP2), 2 个磷脂酶活性基因(PLDZETA1、PLP1)以及10 个与根系生长发育相关的基因(ZAT6、ZFP5、PLT5、ARF16、ZAT11、RPD1、PLDZETA1、CEPR1、PLP1、LON2)。PHO1、PHT1-4、At3g47420、ZAT6、VIP2、ZFP5、PLT5、ARF16和ZAT11是低磷胁迫下叶面喷施CDs 后商薯19 和徐薯32 根系共同的DEGs,表明这些基因在CDs 促进低磷胁迫下甘薯幼苗生长中发挥重要作用。其中,ZAT6既调控磷酸根离子稳态, 又参与调节根系发育。但值得注意的是, 在这1276 个和654 个基因中均未检索到具有酸性磷酸酶活性的基因的差异表达。
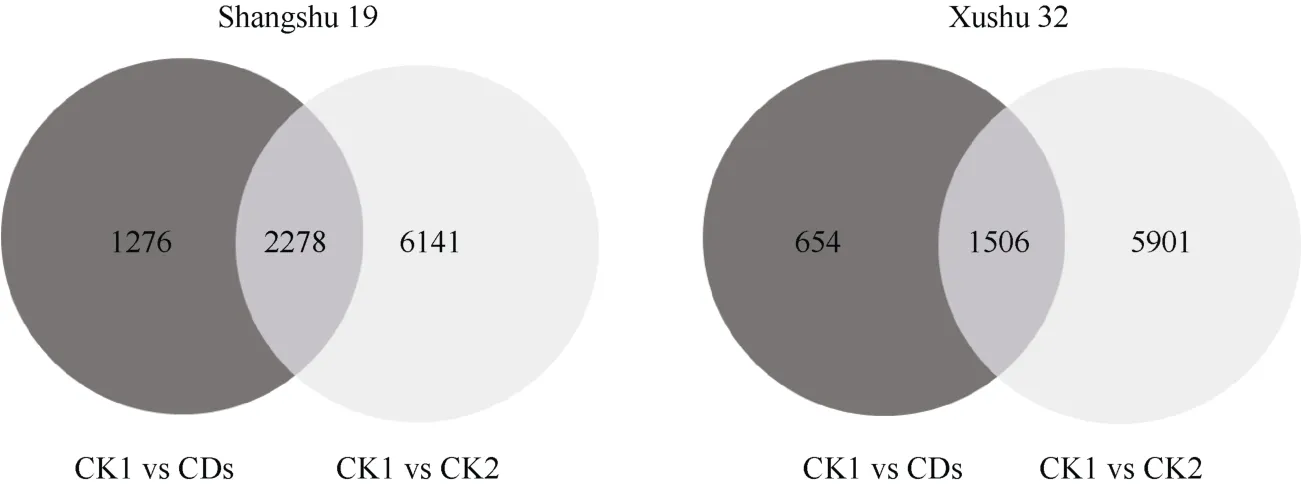
图5 不同分组甘薯根系差异表达基因的韦恩图Fig.5 Venn diagram of differential expression genes in sweetpotato roots in different groups
2.3 代谢组差异表达代谢物的筛选与分析
不同比较组间甘薯幼苗根部的DEMs 统计结果如表2 所示。与CK1 相比, 商薯19 和徐薯32 在叶面喷施CDs 后(CDs 处理)的DEMs 分别共有62 个和56 个,其中下调基因的数目均显著高于上调基因数目。商薯19 根系在CK1 与CK2 比较组间筛选的DEMs 最多(72个), 上调和下调DEMs 的数目分别为30 个和42 个;而徐薯32 根系在CK1 与CK2 比较组间筛选的DEMs最少(36 个), 且下调基因的数目少于上调基因数目。

表2 差异表达代谢物数目统计结果Table 2 Summary of the number of differentially expressed metabolites
商薯19 和徐薯32 根系代谢组中CK1 与CDs比较组筛选出的DEMs 均以有机酸及其衍生物、有机氧化合物类为主(图7-A), 这些物质可能是低磷胁迫下叶面喷施CDs 后甘薯幼苗根系产生的关键代谢物质。利用韦恩图显示不同比较组间共有及特有的DEMs 数量(图7-B), 商薯19 和徐薯32 在CK1 与CDs 比较组中所特有的DEGs 数量分别为35 个和45个。对这35 个和45 个DEMs 进行分析, 共筛选出11 个共有的DEMs (表3), 其中尿囊素酸、L-天门冬酰胺、瓜氨酸和2-羟基十一酸的变幅最大, 它们的|log2(Fold Change) |值依次降低; 而磷酸肌醇的变幅较小, 在商薯 19 和徐薯 32 根系中的|log2(Fold Change) |分别为0.69 和1.24。不同的是, 与CK1 相比, 低磷胁迫下叶面喷施CDs 后(CDs 处理)商薯19根系中磷酸乙醇胺和4-磷酸肌醇的表达量显著降低(图8-A), 而在徐薯32 根系中观察到柠檬酸和草酸的表达量显著增加(图8-B)。
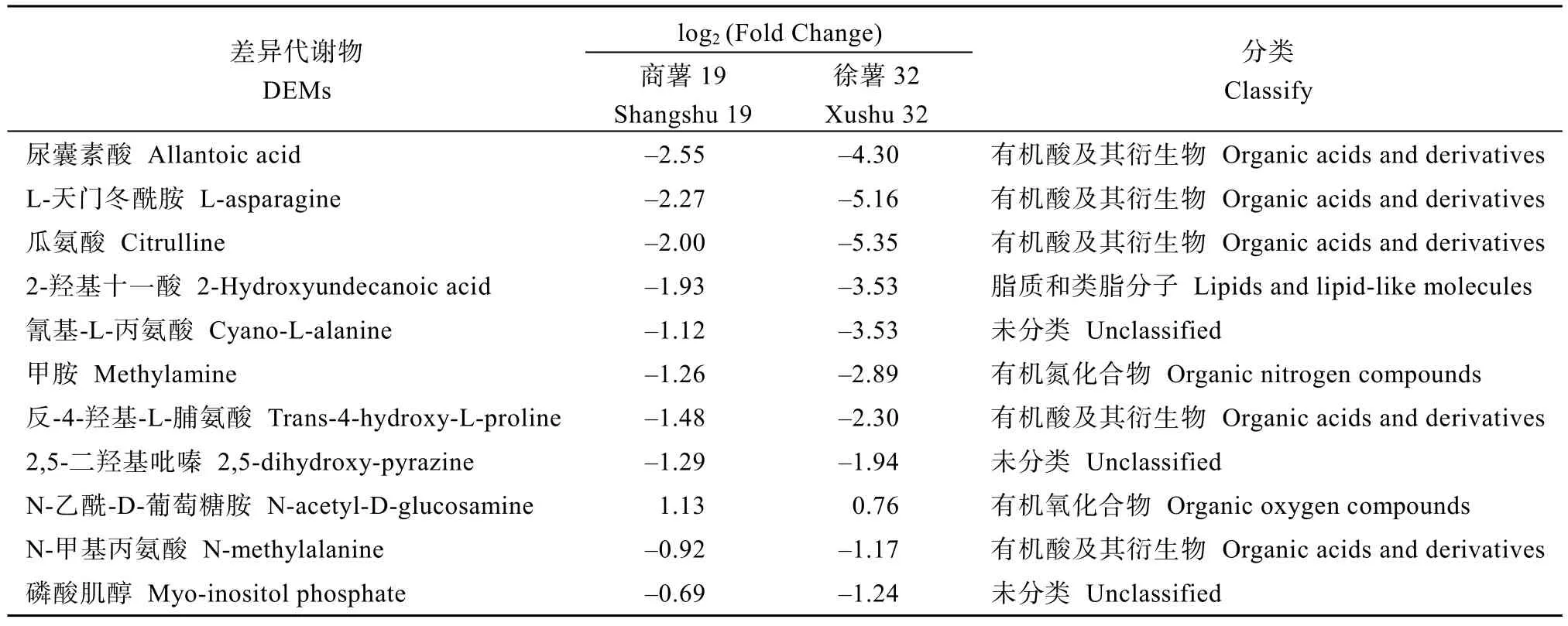
表3 商薯19 和徐薯32 根系代谢组中共有的差异表达代谢物Table 3 Common differentially expressed metabolites (DEMs) in root metabolome of Shangshu 19 and Xushu 32
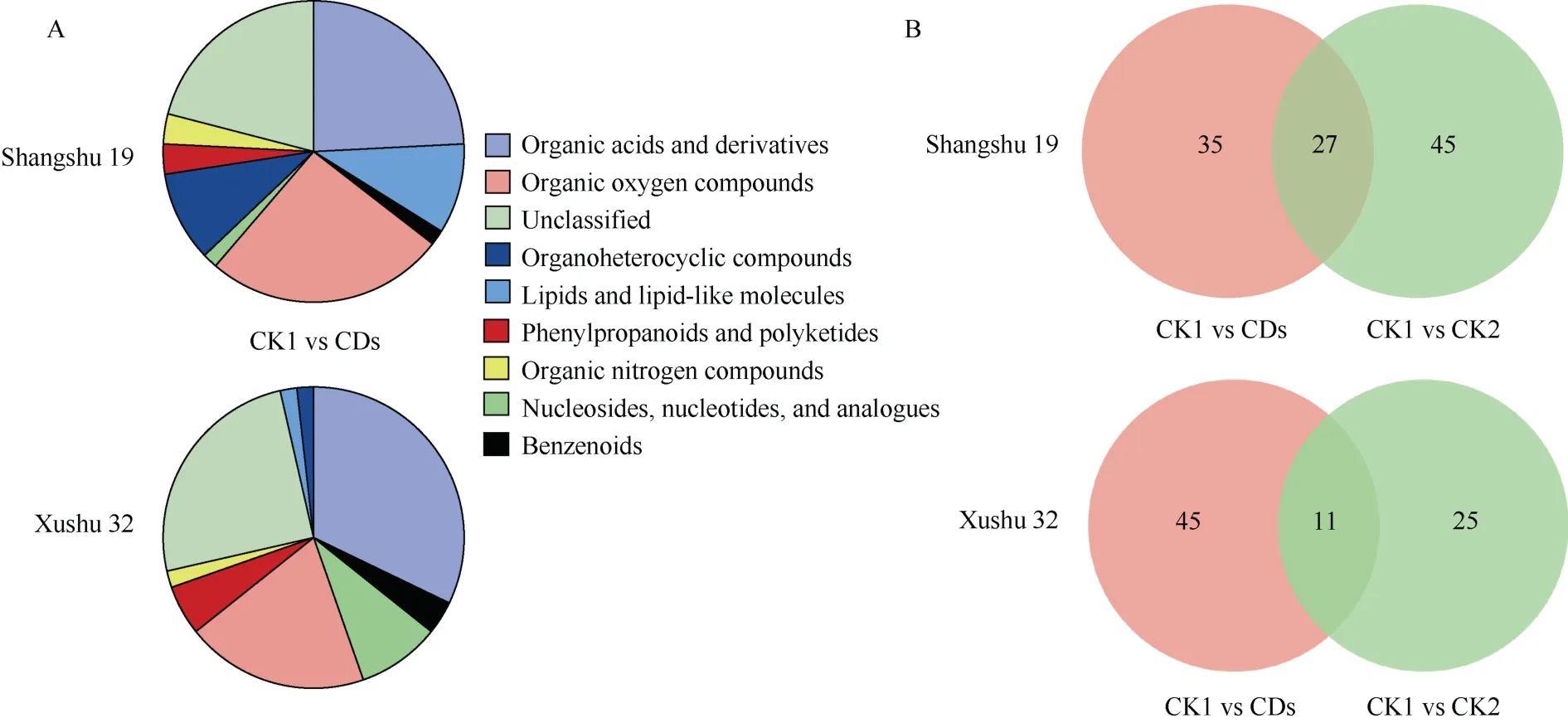
图7 低磷胁迫下叶面喷施碳点后甘薯根系差异表达代谢物的分类(A)和不同分组甘薯根系差异代谢物的韦恩图(B)Fig.7 Categories of DEMs in sweetpotato roots in different after foliar spraying carbon dots under low P stress (A) and Venn diagram of DEMs in sweetpotato roots in different groups (B)
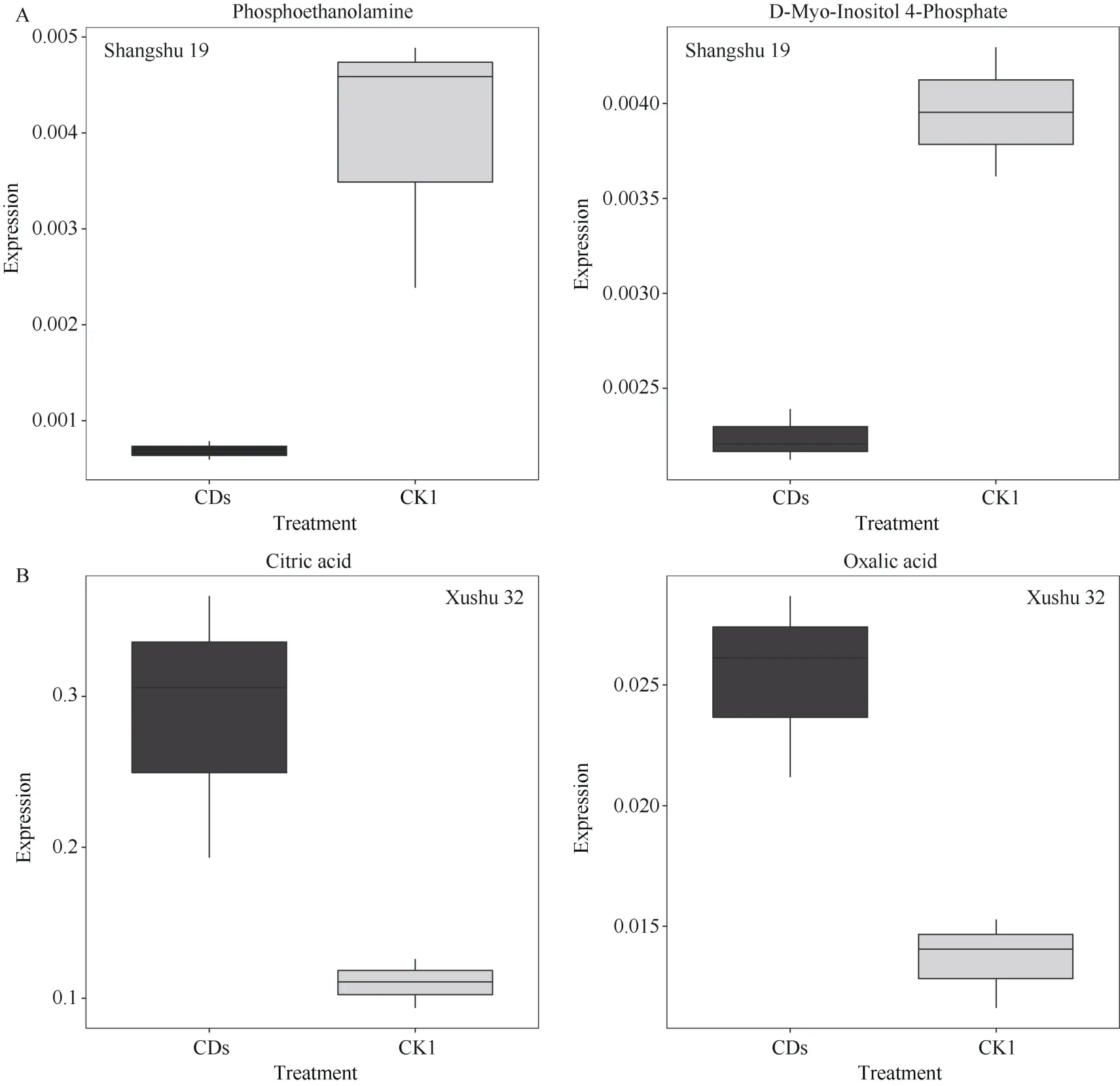
图8 CK1 与CDs 处理中商薯19 根系磷酸乙醇胺和4-磷酸肌醇(A)以及徐薯32 根系柠檬酸和草酸(B)的表达量Fig.8 Expression of phosphoethanolamine and D-Myo-Inositol 4-Phosphate of Shangshu 19 root (A) and citric acid and oxalic acid in of Xushu 32 root (B) in CK1 and CDs treatments
3 讨论
近年来, 利用纳米材料改善植物磷素营养、促进植物生长的应用研究越来越多。大量研究报道,纳米氧化物颗粒(nZnO、nCuO、nSiO2、nTiO2)和纳米CDs 等纳米材料, 可通过刺激根毛增殖和侧根形成、提高根系活力或通过释放金属离子、产生活性氧等直接或间接对植物和土壤微生物产生影响, 促进苋菜[7]、生菜[8]、小麦[17]、高粱[11]和水稻[9]等对土壤磷素的吸收, 进而促进植株生长。这些结果表明,利用纳米CDs 可以强化植物活化和吸收根际土壤磷的能力。但目前纳米材料在甘薯上的应用还不多见,尤其是用于改善低磷胁迫下甘薯的生长发育和磷素营养方面。本研究将丹参制备的纳米CDs 应用于低磷胁迫下生长的甘薯幼苗, 得到了与前人研究相一致的结果。本研究结果发现, 叶面喷施丹参CDs 增加了低磷胁迫下甘薯幼苗叶、茎和根系的生物量,促进了低磷胁迫下甘薯幼苗的生长, 表明叶面喷施丹参CDs 可增强甘薯幼苗的耐低磷性。同时, 叶面喷施丹参CDs 提高了根系磷含量, 而叶和茎磷含量较CK1 处理无显著差异(图3), 表明CDs 促进了植物将更多的磷分配到根系, 以更好地维持根系生长发育来响应低磷胁迫。甘薯幼苗侧根长度和数量增加(图1)以及根系生物量的增幅远高于叶和茎生物量的增幅(图2)就证明了这一点。但与正常磷处理相比, 叶面喷施CDs 缓解甘薯幼苗低磷胁迫的效果因品种而异, 这可能与不同甘薯品种本身的耐低磷性存在差异有关。整体来看, 叶面喷施丹参CDs 对低磷胁迫下商薯19 的改善效果较徐薯32 更好。
进一步通过转录组和代谢组学分析手段解析CDs 改善低磷胁迫下甘薯磷素营养的作用机制。经过对不同处理中根系转录组测序结果的比对分析,PHO1、PHT1-4、At3g47420、ZAT6、VIP2、ZFP5、PLT5、ARF16和ZAT11是低磷胁迫下叶面喷施CDs后商薯19 和徐薯32 根系共同的DEGs, 表明这些基因在缓解甘薯幼苗低磷胁迫中发挥着关键作用。其中,PHO1主要参与根系木质部无机磷的装载,PHT1-4编码高亲和力的磷酸盐转运蛋白[18-19], 它们的表达量的增加意味着根系吸收和转运磷酸盐的能力增强; 锌指蛋白ZAT6[20]、PLT5[21]和ZFP5[22]可通过调控植株的根系构型来调节其体内的磷动态平衡。基于GO_term 分析,VIP2基因参与肌醇磷酸盐的生物合成, 其表达量的降低抑制了磷酸肌醇的合成[23]。代谢组分析也得到了相一致的结果,CDs 处理较CK1 处理商薯19 和徐薯32 根系磷酸肌醇的表达量均显著降低(表3)。这些结果表明: 低磷胁迫下, 叶面喷施CDs 主要通过诱导高亲和磷吸收转运系统、优化根系构型等以提高甘薯对磷素的吸收能力, 同时调整植株体内的磷代谢过程来维持磷稳态。
然而, 由于不同甘薯品种本身耐低磷性的不同,导致CDs 介导下不同甘薯品种的低磷胁迫反应也存在品种特异性。在转录水平上, 除上述共有的DEGs外, 在商薯19 根系转录组中还发现NAC021、PIN4、AIR9、IAA8、ARF16和LBD16的差异表达(图6)。有研究报道,NAC021为含有NAC domain 的转录因子, 低磷胁迫下, 其mRNA 在根系尤其是侧根原基中大量积累, 通过调节生长素信号, 进而调节生长素下游基因表达, 促进侧根数量增加[24]。而PIN4、AIR9、IAA8、ARF16、LBD16均是与生长素的极性运输以及信号传导相关的基因[25]。其中, PIN 基因的表达受PLT 调控, 影响生长素在植物体内的分布[26]。这些结果表明, CDs 介导下, 生长素在调控植物低磷胁迫反应, 尤其是调控低磷胁迫下甘薯的根系发育方面具有重要作用。此外, 值得关注的是,叶面喷施CDs 后, 商薯19 根系CYP83B1基因的表达量显著增加(图6), 基于GO_term 分析, 该基因具有响应红光和调控不定根发育等功能。我们都知道,纳米CDs 具有优异的紫外光吸收和光致发光特性,该基因的差异表达, 为揭示CDs 促进根系生长的调控途径奠定了基础, 即CDs 可能通过植物光信号途径来调控根系生长以响应低磷胁迫, 这为进一步探索CDs 缓解甘薯低磷胁迫的分子调控途径奠定了基础。与商薯19 不同的是, 在徐薯32 根系转录组中观察到2 个磷脂酶活性基因PLDZETA1、PLP1的差异表达(图6), 它们可将植株体内磷脂中的无机磷释放出来[27]; 同时, 徐薯32 根系代谢组中柠檬酸和草酸的表达量显著增加(图8-B), 它们能够活化土壤中的难溶性磷, 使土壤难溶性磷得以释放, 促进植物磷吸收[28]。但由于本研究是水培试验, 生长介质中无更多的难溶性磷来源, 这可能是导致CDs 处理中徐薯32 根系磷含量显著低于正常磷处理、而不同于商薯19 根系磷含量与正常磷处理无显著差异的原因之一。综上所述, CDs 缓解不同甘薯品种低磷胁迫的作用机制可能不同, 但最终都是通过增加侧根长度和数量以增大根系吸收的表面积、提高高亲和力磷酸盐转运家族基因的表达量, 增加磷酸转运蛋白含量, 促进根系对磷的吸收和转运。值得注意的是,由于不同甘薯品种本身的差异性, 本研究仅对目前栽培面积大、受众好的两个甘薯品种进行研究, 具有一定的局限性。
4 结论
叶面喷施丹参碳点(CDs)增加了低磷胁迫下甘薯幼苗地上部和根系的生物量, 提高了根系磷含量,促进了低磷胁迫下甘薯幼苗的生长, 增强了甘薯幼苗的耐低磷性。然而, 叶面喷施CDs 缓解甘薯幼苗低磷胁迫的效果及其作用机制因品种而异, 这可能与不同甘薯品种本身的耐低磷性存在差异有关, 但最终都是通过增加侧根长度和数量以增大根系吸收的表面积、提高高亲和力磷酸盐转运家族基因的表达量, 增加磷酸转运蛋白含量, 促进根系对磷的吸收和转运。

