小麦TabHLH112-2B 基因克隆及每穗小穗数相关功能标记开发
范子培 李 龙 史雨刚 孙黛珍,* 李超男,* 景蕊莲
1 山西农业大学农学院, 山西太谷 030801; 2 中国农业科学院作物科学研究所, 北京 100081
小麦是我国的主要口粮作物, 小麦生产对于保障粮食安全至关重要。然而, 由于气候变化引发的降水量减少和温度上升等, 预测到2050 年全球小麦产量可能下降23.2%~27.2%[1]。小麦生育期内的干旱和高温胁迫往往同时发生, 例如我国黄淮海和北方小麦主产区在灌浆期经常出现干热风天气, 严重威胁小麦产量, 降低品质[2]。因此, 培育高产广适品种是应对复杂环境、保障小麦安全生产的重要途径。
小麦产量由单位面积穗数、穗粒数和粒重三要素组成。产量三要素中的穗粒数与每穗小穗数密不可分, 通过提高每穗小穗数可以进一步提高小麦产量[3-4]。Ding 等[5]鉴定出 5 个小麦 QTL, 其中QSns.sau-2D能在不同环境下增加14.72%的每穗小穗数, 并发现每穗小穗数与开花期、株高、穗长和穗粒数之间呈显著正相关。WAPO1通过调节末端小穗形成的时间影响每穗小穗数, 与野生型相比, 功能缺失突变体wapo-A1的每穗小穗数显著降低, 而携带由天然启动子驱动的额外拷贝WAPO-A1的转基因小麦株系具有更多的每穗小穗数、更紧凑的穗顶端区域和更小的顶生小穗, 产量较高[6-7]。
bHLH 家族作为植物中最大的转录因子家族之一, 广泛存在于真核生物中[8], 研究表明bHLH 家族基因参与调节作物耐逆性和产量。该家族蛋白存在一个由 50~60 个氨基酸残基组成的高度保守的bHLH 结构域, 该结构域由两部分组成: 一段10~15个氨基酸残基组成的DNA 结合结构域和一段约40个氨基酸组成的α 螺旋-环-α 螺旋结构域[9-10]。在水稻中, 干旱胁迫诱导OsbHLH130 的积累, 进而激活OsWIH2的表达,OsWIH2通过调节角质层蜡质的生物合成, 降低植物失水率和ROS 积累, 从而提高水稻抗旱性[11];OsbHLH57的突变体与野生型相比, 籽粒变小、结实率变低, 降低粮食产量, 而过表达OsbHLH57提高水稻产量[12]; TabHLH49 正向调控脱水蛋白基因WZY2表达, 提高小麦抗旱性[13]; bHLH蛋白TaPGS1 能够直接与Fl3(PLATZTF)启动子的E-box 基序结合, 诱导Fl3的表达, 增加籽粒大小和重量[14]。因此, 研究bHLH 家族基因对于提高小麦耐逆性和产量具有十分重要的意义。
本研究克隆了小麦TabHLH112-2B基因, 分析其基因序列和蛋白结构, 检测其在小麦不同发育阶段的组织表达模式, 明确了其对ABA、IAA、MeJA等植物激素和干旱、高盐、低温和高温等胁迫具有应答反应; 序列多态性分析发现其启动子区存在2个SNP, 根据SNP-682 开发分子标记, 鉴定出干旱、高温等多种环境下与每穗小穗数相关的优异等位变异, 为进一步解析TabHLH112-2B功能, 以及利用分子标记辅助选育高产广适小麦新品种提供了基因资源和技术支撑。
1 材料与方法
1.1 试验材料及试验设计
本研究以4 个小麦群体作为主要实验材料。群体1 由32 份高多态性的小麦材料组成[15], 用于分析基因序列多态性。群体2 是由323 份小麦种质组成的自然群体, 包含12 份地方品种、36 份高代品系和275 份现代育成品种[16], 用于表型性状与基因型的关联分析; 群体3 由157 份地方品种组成, 群体4 包括348 份现代育成品种[17], 用于分析基因单倍型在我国小麦育种历史中的应用情况。群体2 分别于3个生长季(2014—2017)种植在中国农业科学院作物科学研究所北京顺义(40°23'N, 116°56'E)和昌平(40°13'N, 116°13'E)试验基地, 设雨养(drought stress,DS)和灌溉(well-watered, WW)两种水分处理, 以及高温胁迫处理(heat stress, HS), 小区长2 m, 4 行, 行距30 cm, 每行40 粒种子, 成熟后调查株高、穗长、每穗小穗数、穗粒数等农艺性状。DS 为全生长期雨养, 3 个生长季的降水量分别为161、173 和143 mm;WW 分别在越冬前、开花期和灌浆期灌溉, 灌水量为750 m3hm–2。HS 是在开花后1 周用聚乙烯塑料膜覆盖的温室模拟高温环境。群体4 于2005—2006生长季种植在河南洛阳(34°61'N, 112°45'E),2010—2011 生长季种植在北京顺义, 成熟后统计农艺性状。
以小麦品种旱选10 号为材料检测基因表达水平。将小麦材料种植于25℃、16 h/20℃、8 h (光照/黑暗)的人工气候室, 培养2 周后对其叶、根基(茎基部次生根发生的部位)、根进行取样, 用于提取RNA,分析基因在幼苗期组织中的表达模式。在中国农业科学院作物科学研究所试验基地(39°48′N, 116°28′E),利用聚氯乙烯(PVC)硬管和软质塑料管套装的管栽法种植小麦[16], 分别在拔节期、抽穗期、开花期对地上部和地下部的组织取样, 用于基因表达模式分析。将小麦种植于人工气候室(22℃、相对湿度70%、光照强度150mol m–2s–1、16 h 光照/8 h 黑暗), 水培1 周左右, 待生长至一叶一心, 对幼苗分别进行不同激素和胁迫处理(50 µmol L–1ABA、0.1 mmol L–1IAA、0.1mol L–1MeJA、16.1% PEG-6000、250 mmol L–1NaCl、4℃、34℃), 在处理后0、0.5、1、2、3、6、12、24、48 和72 h 分别对根系进行取样,用于提取RNA, 检测不同处理下的基因表达水平。
1.2 生物信息学分析
通过Ensembl Plants (https://plants.ensembl.org/index.html) 获取TabHLH112-2B(TraesCS2B02G 510800)基因的序列信息; 通过 WheatOmics 1.0(http://wheatomics.sdau.edu.cn/)下载TabHLH112-2B基因的启动子序列。使用在线工具对TabHLH112-2B进行生物信息学分析(表1)。
1.3 TabHLH112-2B 序列多态性分析
利用DNAMAN 设计特异性引物TabHLH112-2B-F/R、TabHLH112-pro-2B-F/R (表2), 使用Pfu 高保真酶(AP231-22, 北京全式金生物技术股份有限公司)扩增群体1 的DNA 样品, 以获得TabHLH112-2B的基因序列和启动子序列。PCR 反应体系:TransStartFastPfuFly DNA Polymerase 0.4L、5×TransStartFastPfubuffer 4L、2.5 mmol L–1dNTPs 1.6L、TabHLH112-2B-CDS-F/R 0.4L/0.4L、ddH2O 13.2L。PCR 程序为95 ℃ 2 min; 95 ℃ 30 s,60 ℃ 30 s, 72 ℃ 2 min, 40个循环; 72℃ 10 min。利用1.2%琼脂糖凝胶电泳分离PCR 产物, 在紫外灯下切割目标条带, 利用琼脂糖凝胶 DNA 回收试剂盒(TD407-200, 北京天漠科技开发有限公司)回收PCR产物。
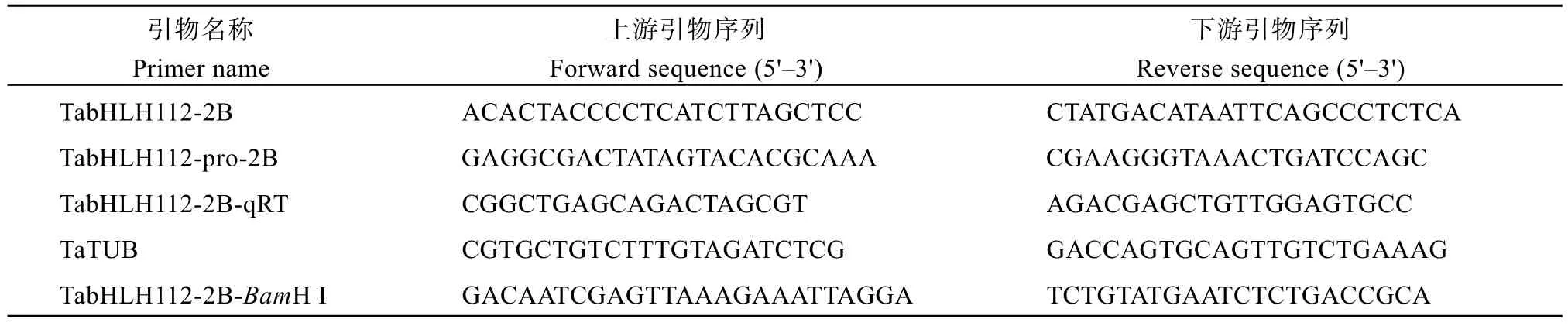
表2 本实验所用引物Table 2 Primers used in this study
将目的DNA 片段连接于pEASY-Blunt Cloning载体上(CB101, 北京全式金生物技术股份有限公司), 转化大肠杆菌 Trans1-T1 Phage Resistant Chemically Competent Cell 感受态细胞(CD501, 北京全式金生物技术股份有限公司)。挑选单菌落, 利用M13F/R 引物进行菌落PCR 检测, 挑选阳性菌落测序。使用 SeqMan 软件比对测序结果, 分析TabHLH112-2B的多态性位点。
1.4 实时荧光定量PCR
利用植物总RNA 提取试剂盒(ZP405K-2, 北京庄盟国际生物基因科技有限公司)提取样品RNA。利用反转录试剂盒(KR116-02, 天根生物科技(北京)有限公司)反转录合成cDNA。
设计特异性引物TabHLH112-2B-qRT-F/R 和内参基因引物TaTUB-F/R (表2), 使用SYBR Premix ExTaq(RR420A, 北京宝日医生物技术有限公司)试剂进行实时荧光定量PCR 实验(qRT-PCR), 反应体系为: TB Green 10L, cDNA 0.3L (50 ngL–1), 引物F/R 0.4L (10mol L–1), ddH2O 8.9L。采用2–△△Ct(Ct 为反应循环数)计算TabHLH112-2B在不同组织部位中的相对表达量。
1.5 dCAPS 分子标记开发
根据单核苷酸位点 SNP-682, 利用 dCAPS Finder 2.0 (http://helix.wustl.edu/dcaps/dcaps.html)开发分子标记, 设计特异性引物 TabHLH112-2BBamH I-F/R (表2)。使用BamH I 酶切PCR 产物, 根据酶切产物大小区分两种单倍型。
1.6 关联分析
利用开发的dCAPS 分子标记检测群体2 样品的基因型, 采用TASSEL 5 软件的一般线性模型(GLM)对群体 2 的基因型与农艺性状进行关联分析, 以P<0.05 作为显著性相关阈值。
2 结果与分析
2.1 小麦TabHLH112-2B 序列分析
利用WheatOmics 分析TabHLH112-2B基因序列,从起始密码子至终止密码子基因序列全长2481 bp,包含7 个外显子和6 个内含子, 其中编码区1335 bp,非编码区668 bp, 编码444 个氨基酸(图1-A)。蛋白结构域分析显示, 在TabHLH112-2B 的第320~372位氨基酸处有一个典型的HLH 保守结构域, 表明该基因是bHLH 家族成员(图1-B)。

图1 TabHLH112-2B 基因序列和蛋白结构预测分析Fig.1 Predictive analysis of TabHLH112-2B gene sequence and protein structure
采用SOPMA 工具分析TabHLH112-2B 蛋白的二级结构, 结果发现该蛋白主要由 α-螺旋(alpha helix)、β-转角(beta turn)、无规则卷曲(random coil)、延伸链(extended strand)组成。其中, α-螺旋有108 个氨基酸, 占24.32%; β-转角有24 个氨基酸, 占5.41%;无规则卷曲有263 个氨基酸, 占59.23%; 延伸链有49 个氨基酸, 占11.04% (图1-C)。利用Phyre2 预测蛋白的三级结构, TabHLH112-2B 蛋白为典型的螺旋-环-螺旋结构域(图1-D)。
利用ProtParam 预测分析TabHLH112-2B 蛋白理化性质。结果表明, 该蛋白由20 种氨基酸组成, 其中丝氨酸含量最高, 有52 个, 占氨基酸总数的11.7%;其次是丙氨酸, 有49 个, 占总数的11.0% (图2-A)。该蛋白分子式为C2040H3152N594O646S17, 原子数为6449,相对分子质量为46,880.08, 理论等电点(pI)为7.04, 带正电的氨基酸残基(Arg+Lys)为32, 带负电的氨基酸残基(Asp+Glu)为 33。利用 ExPASy-ProtScale 分析TabHLH112-2B 的亲/疏水性, 发现整个氨基酸序列中亲/疏水氨基酸分布不均, 亲水性平均系数为–0.472(图2-B)。
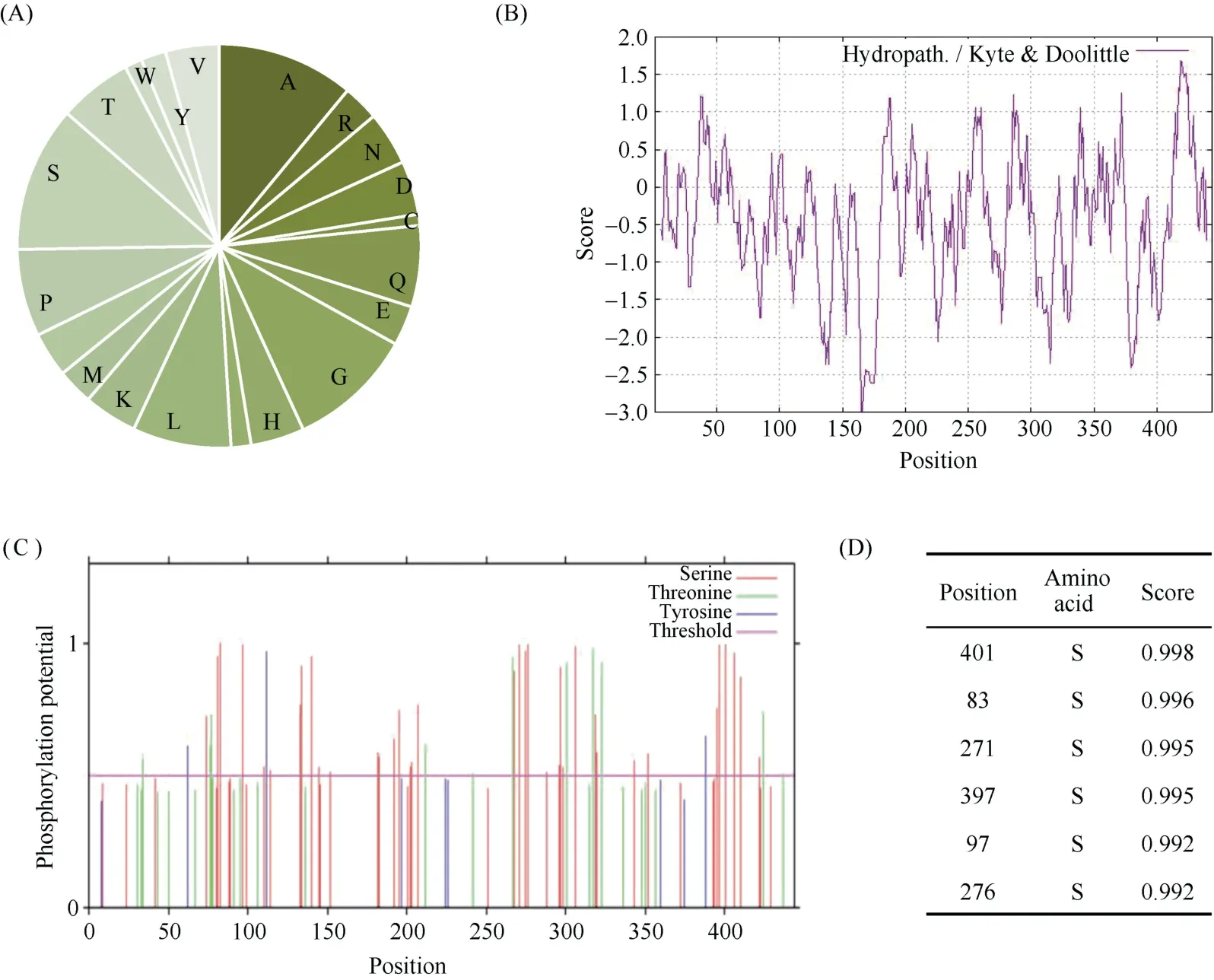
图2 TabHLH112-2B 蛋白性质和磷酸化位点预测Fig.2 Prediction of TabHLH112-2B protein properties and phosphorylation sites
利用NetPhos-3.1 预测TabHLH112-2B 氨基酸序列的磷酸化位点, 结果显示分值大于阈值0.5 的氨基酸磷酸化位点有85 个, 且分布不均, 其中丝氨酸(Serine) 65 个, 苏氨酸(Threonine) 16 个, 酪氨酸(Tyrosine) 4 个(图2-C)。位于第83 位、第97 位、第271 位、第276 位、第397 位、第401 位丝氨酸的磷酸化预测值均高于0.990, 远高于阈值0.5 (图2-D)。
2.2 TabHLH112-2B 在不同发育时期的多个组织中表达
为了研究TabHLH112-2B在小麦不同发育时期的组织表达模式, 利用qRT-PCR 检测其在幼苗期、拔节期、抽穗期和开花期各组织中的表达量, 结果显示TabHLH112-2B在各组织中均有表达。在幼苗期,TabHLH112-2B在叶中的表达量是根和根基中的2 倍(图3-A); 拔节期TabHLH112-2B的表达主要集中在心叶、根和根基中(图3-B); 抽穗期TabHLH112-2B在根中表达量最高, 且表达水平为所有发育时期中的最大值(图3-C); 开花期TabHLH112-2B在根中的表达量最高(图3-D)。
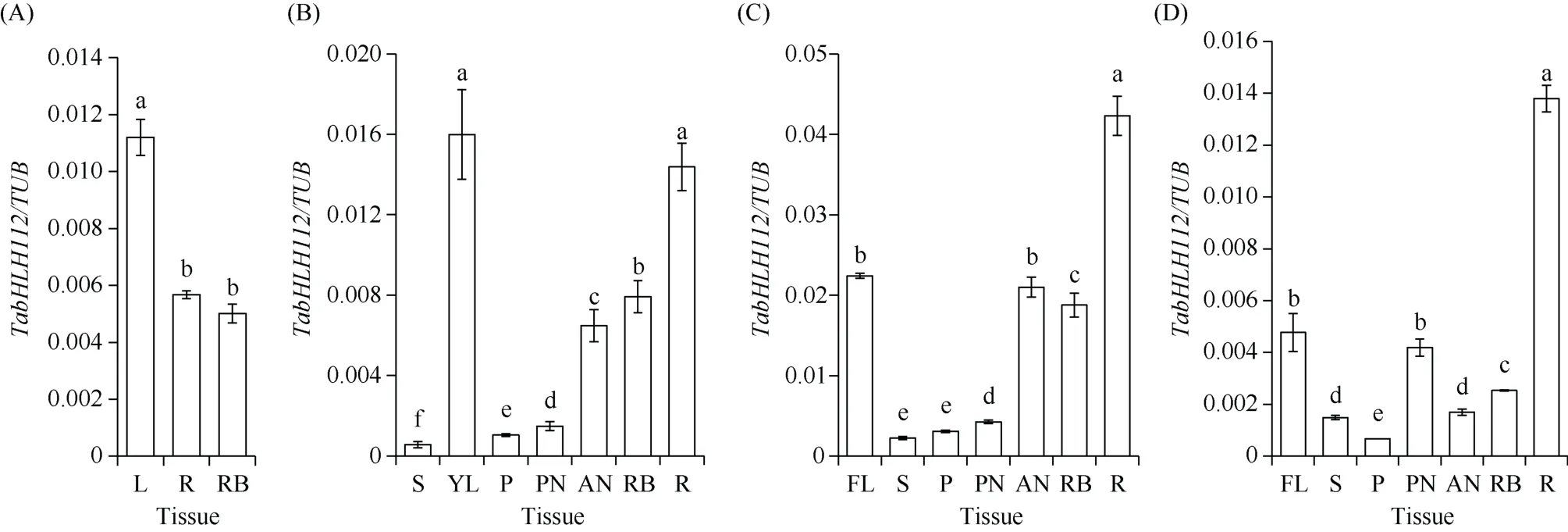
图3 小麦TabHLH112-2B 在不同发育时期的组织表达谱Fig.3 Tissue expression pattern of TabHLH112-2B genes at different developmental stages in wheat
2.3 TabHLH112-2B 响应激素和胁迫处理
对TabHLH112-2B起始密码子上游2000 bp 的启动子序列进行预测, 发现其中存在大量的顺式作用元件, 例如脱落酸(ABA)响应元件ABRE, 茉莉酸甲酯(MeJA)响应元件CGTCA-motif、TCT-motif, 干旱响应元件MYC、MBS, 低温响应元件LTR, 厌氧诱导响应元件ARE, 以及光响应元件I-box、LAMPelement、Sp1 等, 表明TabHLH112-2B的表达受脱落酸等激素信号和光信号的调节, 并参与干旱和低温等非生物胁迫应答。此外, 还存在与分生组织发育相关的顺式作用元件CAT-box (图4-A), 表明该基因可能参与小麦生长发育调节。
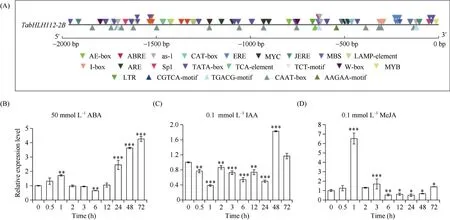
图4 小麦幼苗根中TabHLH112-2B 在不同激素处理下的表达谱Fig.4 Relative expression pattern of TabHLH112-2B genes in wheat seedling roots under different hormone treatments
为了进一步明确TabHLH112-2B响应激素信号和非生物胁迫, 结合该基因在小麦根中的表达情况, 利用qRT-PCR 检测不同激素处理条件下TabHLH112-2B在根中的表达谱。结果显示, 在ABA 处理24 h 以后,TabHLH112-2B的表达水平整体呈现上升趋势, 处理72 h 的表达量最高(图4-B); 在IAA 处理后的24 h 内,TabHLH112-2B的表达受到抑制, 48~72 h 表达量上升(图4-C); MeJA 处理1 h 时,TabHLH112-2B的表达量急剧升高, 处理6 h 后表达量呈现下降趋势(图4-D)。
我们还检测了小麦幼苗在干旱、高盐、低温(4℃)、高温(34℃)处理条件下TabHLH112-2B的表达情况, 在PEG 模拟干旱处理1 h 内TabHLH112-2B的表达量显著下降, 随后升高(图5-A)。在盐胁迫处理下,TabHLH112-2B受到诱导上调表达, 在24 h 达到峰值(图5-B); 在低温胁迫处理下,TabHLH112-2B表达量显著下调, 72 h 降到最低值(图5-C); 在高温胁迫下,TabHLH112-2B表达量在24 h 显著上调, 48 h达到最高值(图5-D)。因此,TabHLH112-2B的表达受长期干旱和高温胁迫诱导, 在高盐胁迫下被诱导,受低温胁迫抑制。
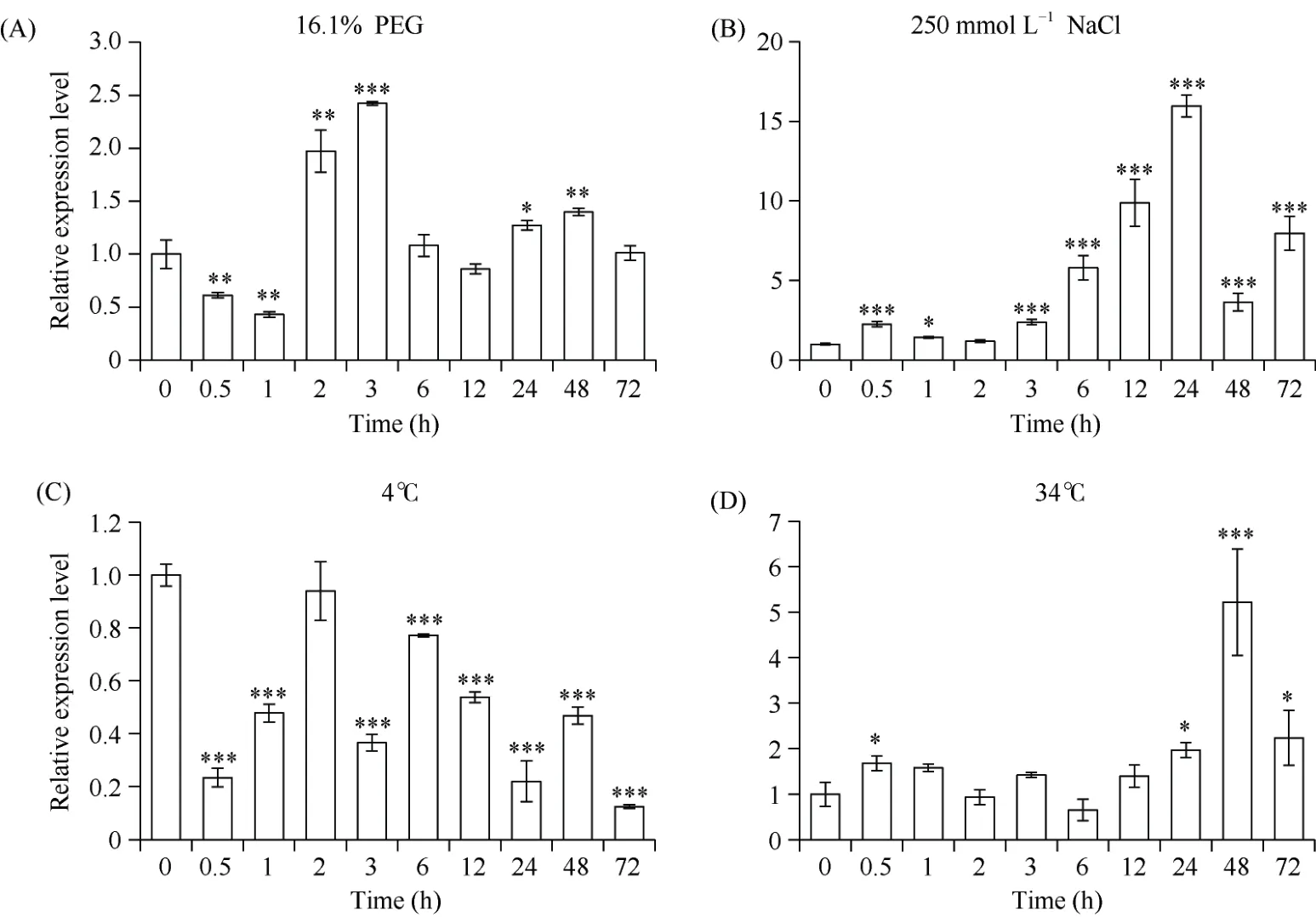
图5 不同胁迫处理下小麦幼苗中TabHLH112-2B 的表达谱Fig.5 Relative expression patterns of TabHLH112-2B genes in seedling stage under abiotic stress conditions in wheat
2.4 基因序列多态性及其分子标记
以小麦群体1 材料的DNA 为模板, 利用特异性引物TabHLH112-2B-F/R、TabHLH112-pro-2B-F/R 分别扩增TabHLH112-2B基因序列及启动子序列, 测序结果发现启动子区存在2 个SNP 位点, 分别是位于–910 bp 的SNP-910(T/C)和位于−682 bp 的SNP-682(C/T), 这2 个SNP 紧密连锁, 组成了2 种单倍型Hap-2B-1 和Hap-2B-2 (图6-A)。
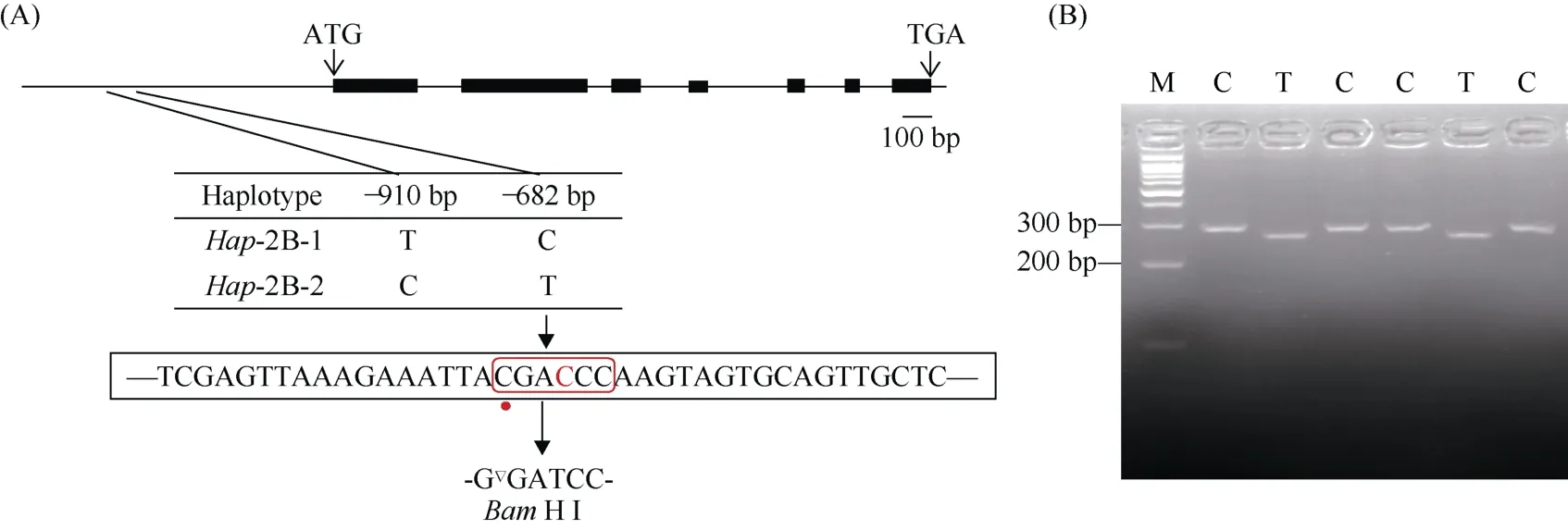
图6 TabHLH112-2B 的序列多态性及其dCAPS 分子标记Fig.6 Sequence polymorphism and dCAPS molecular marker of TabHLH112-2B
基于SNP-682, 利用dCAPS Finder 2.0 设计了dCAPS 标记TabHLH112-682-dCAPS, 通过引入1 个错配碱基G, 形成BamH I 酶切位点(G▼GATCC)。经过2 轮PCR 扩增, 即先用TabHLH112-pro-2B-F/R 进行第1 轮扩增, 再利用TabHLH112-2B-BamH I- F/R对第1 轮PCR 产物进行第2 轮扩增, 得到长度为287 bp 的扩增产物。利用BamH I 酶切第2 轮PCR 产物,其中Hap-2B-2(T)的PCR 产物可以被酶切为264 bp和23 bp 两个片段;Hap-2B-1(C)的PCR 产物不能被切开, 酶切产物仍为287 bp (图6-B), 因此可以区分2 种单倍型。
2.5 每穗小穗数的优异单倍型及其分布
利用开发的TabHLH112-682-dCAPS 标记扫描小麦群体2 的基因型, 并与16 种环境(年份×地点×处理)下的农艺性状进行关联分析。结果显示,TabHLH112-2B标记与14 种环境下的每穗小穗数显著关联(表3), 具有单倍型Hap-2B-2 基因型的小麦材料每穗小穗数多于Hap-2B-1 基因型(图7)。因此,单倍型Hap-2B-2 是在干旱、高温等多种种植环境下每穗小穗数较多的优异单倍型。
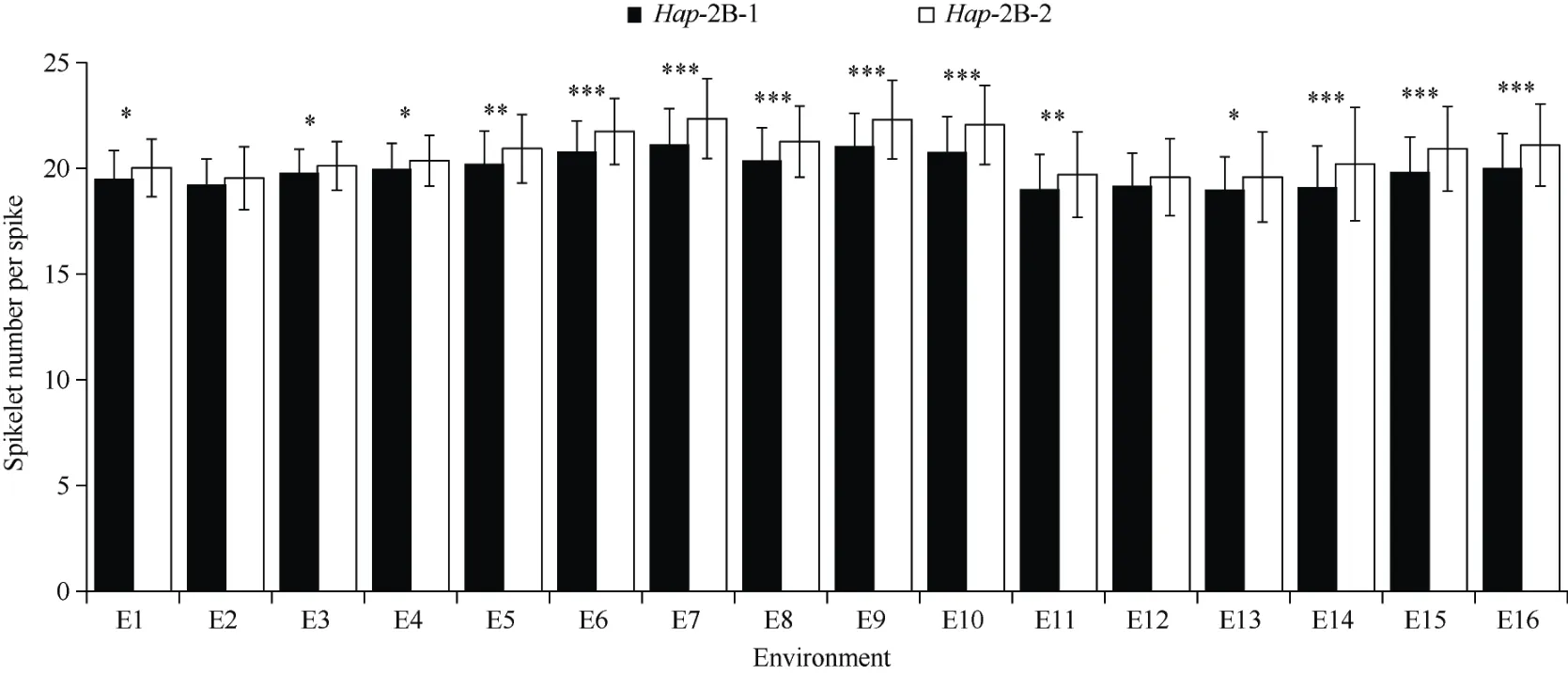
图7 TabHLH112-2B 单倍型与每穗小穗数的关联分析结果Fig.7 Analysis of association between haplotype of TabHLH112-2B and spikelet number per spike
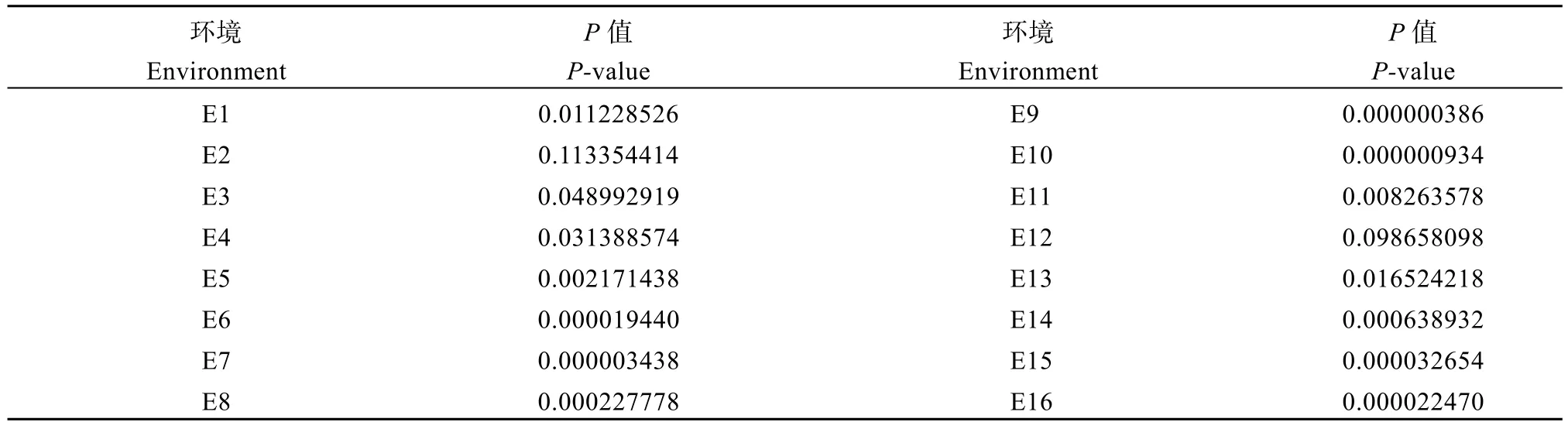
表3 TabHLH112-2B 单倍型与16 种环境下每穗小穗数的关联分析结果Table 3 Association analysis between haplotype of TabHLH112-2B and spikelet number per spike
为了明确TabHLH112-2B两种单倍型在我国十大麦区的地理分布, 以及其在小麦育种历史中的应用情况, 本研究统计了来自十大麦区的157 份地方品种(群体3)和348 份现代育成品种(群体4)中2 种单倍型的频率。结果表明: 在地方品种中具有优异单倍型Hap-2B-2 的基因型仅占3.8%, 并且仅在3个麦区检测到Hap-2B-2 基因型, 包括在黄淮冬麦区(II, 5.7%)、西南冬麦区(IV, 4.3%)和新疆冬春麦区(X,30.0%), 其频率远远低于单倍型Hap-2B-1 (占比96.2%) (图8-A)。在现代育成品种中, 具有优异单倍型Hap-2B-2 的基因型频率显著增加, 提高至11.3%,除华南冬麦区(V)、北部春麦区(VII)、青藏春冬麦区(IX)外, 单倍型Hap-2B-2 在育成品种中的频率都有较大幅度增加, 表明在我国的小麦育种历史中与较多小穗数相关的优异单倍型Hap-2B-2 受到了一定程度的正向选择(图8-B)。
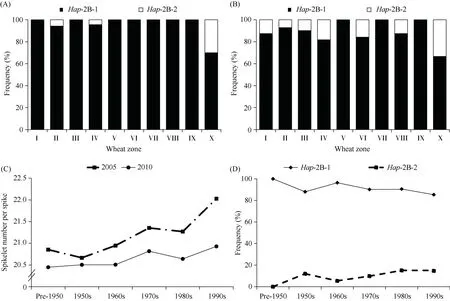
图8 TabHLH112-2B 优异单倍型在我国小麦育种历史中的应用Fig.8 Application of TabHLH112-2B favorable haplotype in Chinese wheat breeding history
根据育成年代将群体4 的348 个品种分为6 组,以观察随育种年代推移2 种单倍型的频率变化趋势。结果显示, 从20 世纪50 至90 年代, 育成品种的每穗小穗数呈现逐渐增多的趋势(图8-C), 单倍型Hap-2B-2 的占比从0 增加到15%, 而单倍型Hap-2B-1 的占比从100%下降到85% (图8-D)。该结果表明, 在我国的小麦育种进程中, 每穗小穗数较多的优异单倍型Hap-2B-2 经历了正向选择。
3 讨论
bHLH 转录因子是一类具有basic Helix-Loop-Helix 结构域的蛋白家族, 在动植物中广泛分布[18]。前人研究表明, bHLH 基因参与小麦的生长发育、激素信号转导和逆境胁迫应答。在PEG 模拟干旱胁迫和外源ABA 处理下, 过表达TabHLH1转基因小麦提高了渗透调节物质积累、ROS 稳态和气孔关闭能力, 因而增强了对渗透胁迫的耐受性[19]。bHLH 转录因子家族基因TaMYC2 通过与TaICE41 和TaJAZ7的相互作用, 激活下游抗寒途径ICE-CBF-COR 模块表达,TaMYC2过表达株系在低温条件下脯氨酸含量增加, 抗氧化能力提高, 抗冻性增强[20]。本研究通过顺式作用元件预测发现TabHLH112-2B启动子区存在脱落酸、茉莉酸甲酯、干旱胁迫、低温胁迫等应答元件, 以及与分生组织发育相关的作用元件。组织表达模式和激素、非生物胁迫处理下的表达分析结果表明,TabHLH112-2B主要在叶和根中发挥作用,且参与对ABA、IAA、MeJA 等植物激素和干旱、高盐、低温、高温等非生物胁迫的应答。
近年来, 气候变化导致的温度、降水等环境变化已严重影响小麦生产[21]。研究表明, 干旱胁迫损伤了小麦叶片PSII 反应中心, 叶片净光合速率降低,光合作用产物减少, 导致地上部分生物量和产量下降[22]。高温胁迫破坏小麦的生物膜结构, 使旗叶净光合速率下降, 植株光合机能减弱, 加速了植株衰老, 穗粒数及粒重显著降低[23]。在实际生产中, 干旱和高温往往同时发生在小麦的开花期和/或灌浆期,影响叶片的光合作用, 缩短灌浆持续时间, 导致减产[15,24]。因此, 培育抗旱耐高温的抗逆高产广适品种是作物育种工作的重要目标。随着分子生物技术的快速发展, 分子标记辅助育种成为准确选育目标性状、提高育种效率的重要手段之一。本研究通过分析小麦TabHLH112-2B基因组序列多态性, 发现其启动子区存在2 个SNP, 分为2 种单倍型。基于SNP-682 开发分子标记, 关联分析发现TabHLH112-2B与干旱、高温等多种环境下的每穗小穗数显著相关, 且单倍型Hap-2B-2 是每穗小穗数较多的优异单倍型。随着育种年代的推进, 优异单倍型Hap-2B-2受到了正向选择, 但在现代育成品种中该优异单倍型占比偏低, 具有较大的提升空间, 为在正常灌溉、干旱、高温、干旱高温并存的多种环境下培育高产新品种提供了优异基因资源。
不同小麦品种启动子区的序列变异是影响基因表达、产生显著表型差异的重要因素[25]。例如, 小麦雄性不育突变体ms2(male-sterile2)是由于雄性不育基因Ms2启动子区插入了一个TRIM (末端重复反转录转座子微型元件), 该元件的插入激活了Ms2转录, 导致小麦不育[26]。在TaMOR-B启动子中发现了一个159 bp 的MITE (微型反向重复转座元件)插入,导致DNA 甲基化及低水平表达, 该MITE 插入与根干重低和株高矮的表型有关[27]。与此类似, 启动子区ARFs 结合位点的变异导致TaPYL4-2A基因的表达差异, 使得TaPYL4-2A两种单倍型的株高和穗下节长表现出显著差异[28]。本研究在TabHLH112-2B的启动子区检测到2 个SNP, 即SNP-682(C/T)和SNP-910(T/C), 经预测发现SNP-910 的碱基T 与C的差异导致了上游LFY (LEAFY)结合位点的变异(http://www.softberry.com/)。LFY基因在植物花分生组织形成中发挥关键作用[29], 在拟南芥中, LFY 通过激活下游AG(AGAMOUS)的表达, 促进最内层花器官的发育, 过表达LFY可以将所有侧稍转变成花芽[30-31]。因此, LFY 结合位点的改变可能是导致TabHLH112-2B两种单倍型每穗小穗数表型差异的原因, 需要进一步探讨。
4 结论
小麦TabHLH112-2B基因在不同发育时期各组织中均有表达, 响应植物激素信号和非生物胁迫,在多种环境下与每穗小穗数显著相关,Hap-2B-2 为每穗小穗数较多的优异单倍型, 利用分子标记TabHLH112-682-dCAPS 可以选择优异基因型, 提高抗旱耐热高产品种选育效率。

