柴胡皂苷A抗抑郁的靶点识别及作用研究
任 历,邵钰婷,秦书华,杨文强,刘 莹,*
1锦州医科大学基础医学院,锦州 121000;2昆明理工大学生命科学与技术学院,昆明 650500;3锦州医科大学生命科学研究院,锦州 121000
抑郁症是一种常见的精神系统疾病,其发病率逐年上升,预计到2030年,抑郁症将成为全球非正常死亡和残疾的首要原因。
中药柴胡具有疏肝解郁、清热解表的功效,常作为治疗抑郁症的中药复方中的君药,如小柴胡汤、柴胡疏肝散及柴胡桂枝汤等。柴胡中主要活性成分为三萜皂苷类化合物柴胡皂苷,其中柴胡皂苷A(saikosaponin A,SSA)、柴胡皂苷B2(saikosaponin B2,SSB2)和柴胡皂苷D(saikosaponin D,SSD)是柴胡皂苷的主要药效成分[1]。研究表明,SSA通过增加抑郁模型大鼠脑内单胺类神经递质含量,激活p-CREB/BDNF通路,并抑制海马神经元凋亡发挥抗抑郁作用[2]。此外,SSA通过增强大鼠海马组织的BDNF-TrKB信号通路,进而发挥抗抑郁的作用[3]。SSA亦能通过增加富含脯氨酸的跨膜蛋白(proline-rich transmembrane proteins,PRRT2)的表达,升高海马组织内多巴胺(dopamine receptor,DA)含量,发挥抗抑郁的作用[2]。虽然SSA的抗抑郁作用已经明确,但是既往的研究仅仅利用神经递质含量改变来表征SSA的抗抑郁作用,检测指标单一,机制研究也较少,不能全面阐释抗抑郁药物的作用靶点。为了明确SSA的抗抑郁作用及作用靶点,本文拟构建慢性不可预知性温和应激(chronic unpredictable mild stress,CUMS)模型小鼠,利用小鼠悬尾(tail suspension test,TST)和强迫游泳实验(forced swimming test,FST)明确SSA的抗抑郁作用;进一步地利用计算机分子对接技术分析SSA的靶标,并利用细胞热转移测定实验(cellular thermal shift assay,CETSA)和药物亲和力靶稳定性实验(drug affinity responsive target stability,DARTS)验证SSA的靶标;并采用Western blotting等技术研究SSA的抗抑郁作用机制。本研究将为小分子药物靶点发现提供新的方法和策略。
抑郁症发病机制目前尚不清楚,存在多假说[4],其中单胺类神经递质紊乱假说在抑郁症的发病中扮演着重要的角色。与神经递质紊乱相关受体,如:5-羟色胺受体(5-serotonin receptor,5-HT)、多巴胺受体(dopamine receptor,DAR)、褪黑素受体(melatonin receptor,MT)、催产素受体(oxytocin receptor,OXTR)等都是G蛋白偶联受体;对抑郁症患者的研究显示,催产素及其受体基因与抑郁症具有相关性[5],催产素(oxytocin,OT)是一种由9个氨基酸构成的垂体神经肽,它能降低焦虑水平、增强镇静,具有明显的抗抑郁作用;其特异性的靶向OXTR的表达、激活与抑郁、焦虑以及压力所引发的一些病症相关[5]。因此,OXTR是SSA抗抑郁作用的最主要靶点之一。本研究拟对抑郁症相关的G蛋白偶联受体进行全面分析,明确SSA抗抑郁的作用靶点。本文旨在研究SSA抗抑郁的作用靶点和机制,为抑郁症等精神疾病的临床研究和新药开发提供必要的理论与参考依据。
1 材料和方法
1.1 实验动物
1.1.1 实验动物
SPF级C57/B6雄性小鼠48只,共分为6组,每组8只,4~5周龄,购自北京维通利华实验动物技术有限公司[动物生产许可证号:SCXK(京)2016-0006];动物使用许可证号:SYXK[辽]2019-0007。本研究动物实验在锦州医科大学实验动物中心进行,经锦州医科大学实验动物伦理委员会批准(批准号:2022015)。
1.1.2 细胞
稳定的诱导表达pcDNA5/FRT/TO和pcDNA5/FRT/TO-VSV-GluR-OXTR细胞系由前期构建完成并保藏。
1.2 药物及试剂
SSA(上海源叶生物科技有限公司,规格:1 g,批号:20171229);氟西汀(盐酸盐)(fluoxetine)(上海萨恩化学技术(上海)有限公司,规格:1 g,批号:CL090016);Way-267464(重庆金麦生物科技有限公司,规格:10 mg,批号:1432043-31-6)。
胎牛血清(批号:10091-148,规格:500 mL)、DMEM培养基(批号:C11875500BT,规格:500 mL)、0.25%胰蛋白酶-EDTA消化液(批号:20200906,规格:100 mL)、Lipofectamine 2000(批号:11668019,规格:1.5 mL)(赛默飞世尔(美国)有限公司);Anti-ERK(批号:9102S,规格:100 μL)、anti-pERK(批号:5726S,规格:100 μL)、anti-GAPDH(批号:2146S,规格:100 μL)、anti-OXTR(批号:ABN297,规格:100 μL)、anti-VSV-G(批号:81454S,规格:100 μL)等抗体(Cell signaling Technology公司)。
1.3 主要仪器
小鼠动物行为机能系统Video Tracking System(型号:ANY-maze,Anymaze,Stoelting Co.,Wood Dale,USA);小鼠悬尾测试仪(型号:BW-YLS-18A,成都泰盟科技技术有限公司)。
1.4 实验方法
1.4.1 CUMS模型小鼠的建立
除正常对照组外,其余小鼠均采用CUMS法制备小鼠抑郁模型[6]。建模过程如下:禁食、禁水(24 h)、昼夜颠倒(12 h/12 h)、强迫游泳(10 min)、噪声(30 min)、频闪(12 h)、动物束缚(12 h)、湿垫料(12 h)、倾笼45°(12 h),夹尾(尾尖1 cm处)2 min、陌生异常物品刺激(如塑料杯、牙刷等)过夜,每天随机采取2~3种不同方式进行不规律刺激,连续4周。
1.4.2 分组与给药
小鼠连续造模4周后,糖水偏爱实验检测CUMS模型小鼠造模是否成功,将小鼠分为空白组(control,Con)、模型组(model,Mod),Fluoxetine组(Flu,20 mg/kg),SSA低剂量组(SSA-L,10 mg/kg),SSA中剂量组(SSA-M,20 mg/kg),SSA高剂量组(SSA-H,40 mg/kg),每组8只小鼠,分组后1 d开始灌胃给药,空白组给予等体积溶剂,每日1次,给药时间为上午10∶00,连续灌胃给药4周,各组于给药后1 h继续进行CUMS刺激。
1.4.3 小鼠悬尾实验
连续给药4周后,利用CUMS模型TST[7]检测SSA对小鼠不动时间的影响。实验全程通常持续6 min,TST不动时间一般被评价为小鼠绝望状态。自制离地面高度20 cm的纸箱,纸箱一面敞开,便于观察小鼠,其余各面封闭,避免外界环境的干扰,从其中一个侧面穿一小圆孔,将小鼠尾巴从圆孔穿过去,一位实验员抓小鼠尾根1/3处保持不动,另一位实验员记录小鼠不动的时间。前2 min让小鼠适应环境,后4 min记录不动时间,实验过程中保持实验室环境安静,采用ANY-maze自动采集系统进行小鼠不动时间的测定。
1.4.4 小鼠强迫游泳实验
连续给药4周后,利用CUMS模型FST[7]检测SSA对小鼠不动时间的影响。将小鼠放入高30 cm,直径20 cm的圆柱形游泳池,水位15 cm,水温23~25 ℃,将小鼠放置在水中6 min,前2 min让其适应环境后,记录后4 min中内不动的时间,当小鼠以直立的姿势漂浮,只做一些小动作把头露出水面时才被判断为不动。每次测完后换水,实验过程中保持实验室环境安静,采用ANY-maze自动采集系统进行测定。
1.4.5 细胞培养
稳定表达pcDNA5/FRT/TO-VSV-GluR-OXTR细胞株培养于含10%的胎牛血清(FBS)、100 U/mL的青霉素、100 μg/mL的链霉素、3.3 μg/mL Blasticitin、60 μg/mL Hygromycin的DMEM(Gibco)维持培养基中。细胞培养箱的环境为37 ℃、5% CO2。
1.4.6 Western blotting
蛋白样品收集并经过BCA法定量,采用聚丙烯酰胺(SDS-PAGE)凝胶电泳对蛋白样品进行分离,并转移到PVDF膜上,经过封闭、孵育一抗、二抗后,再经ECL化学发光仪显影,可根据条带大小位置和颜色深浅对目的蛋白的表达水平进行分析。
1.4.7 CETSA实验
CETSA[8]可监测配体和靶蛋白之间的物理相互作用,并且基于Western blotting和抗体对靶蛋白有高选择性。当细胞生长汇合度达到60%时,多西环素诱导稳定表达细胞系36 h后,弃去培养基,不同浓度的药物处理细胞3 h。收集细胞,用加入了蛋白酶抑制剂和磷酸酶抑制剂的冰冷PBS重悬细胞,混匀后均分至7个PCR小管。PCR仪设置七个温度梯度:40、44、48、52、56、60、64 ℃处理细胞悬液3 min,室温放置3 min,之后在液氮和水中反复冻融5次,使细胞壁破碎。4 ℃,20 000×g离心25 min,小心吸取上清液至新的EP管,避免吸到沉淀。加入5×loading buffer后混匀,96 ℃煮样3 min。
1.4.8 DARTS实验
DARTS[9]是一种无标记直接对靶蛋白进行识别的方法,即靶蛋白的结构稳定性是通过与其相应配体的结合而改变的。该法通过改变在蛋白酶处理下的蛋白水解模式,从而检测靶蛋白稳定性的变化。具体操作步骤如下:
当细胞生长汇合度达到60%时,多西环素诱导稳定表达细胞系36 h后,弃去培养基,不同浓度的药物处理细胞3 h,收集细胞。加入IP Buffer,混匀后置于冰上,裂解30 min。样品于4 ℃,12 000×g离心20 min,将上清收集至新的EP管中加入10×TNC buffer,充分混匀。BCA法测定细胞裂解液中蛋白质的浓度后,将样品每管均分成三份,加入指定浓度的药物(用培养基配制),24 ℃水浴中恒温处理50 min。将每一管加药处理后的样品均分,加入2 μL酶与蛋白的比例为0、1∶10 000、1∶5 000、1∶1000所对应的酶(用1×TNC buffer配制),24 ℃水浴中恒温处理20 min。加入5×loading buffer后混匀,96 ℃煮样3 min。
1.4.9 计算机分子对接
使用Molecular Operating Environment(MOE)软件辅助预测配体分子与靶标之间的相互作用[10]。制备并使用Minimize功能对配体的结构进行优化。之后准备蛋白质受体,从靶蛋白PDB数据库中获取受体蛋白的三维结构;将蛋白质结构导入到MOE,删除水分子以及有机溶剂,只保留蛋白质以及原始底物配体,设置对接参数并选择对接活性口袋为Ligand Atoms。最后进行分子对接:对配体和定义好口袋的受体进行分子对接,保存好的分子数据库路径输入到对话框。初对接产生50个构象并输出3个对接结果供参考,其余的参数保留默认设置。评价的标准主要看S,即Score,其值越小代表这个构象的小分子与配体结合更加紧密。
1.5 统计学分析方法
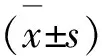
2 实验结果
2.1 SSA对CUMS模型小鼠行为学的影响
TST实验结果表明,与空白组相比(小鼠在悬尾环境中平均不动时间为82.3±12.8 s),模型组小鼠在悬尾环境中的平均不动时间明显增加,为139.3±17.6 s,说明小鼠出现行为绝望的抑郁行为;与模型组相比,阳性对照Flu组的平均不动时间明显降低,为99.6±37.5 s;SSA高、中、低剂量组小鼠TST不动时间显著缩短(P<0.05或P<0.01);结果表明SSA能够显著缩短小鼠的不动时间,具有潜在的抗抑郁作用(见图1)。
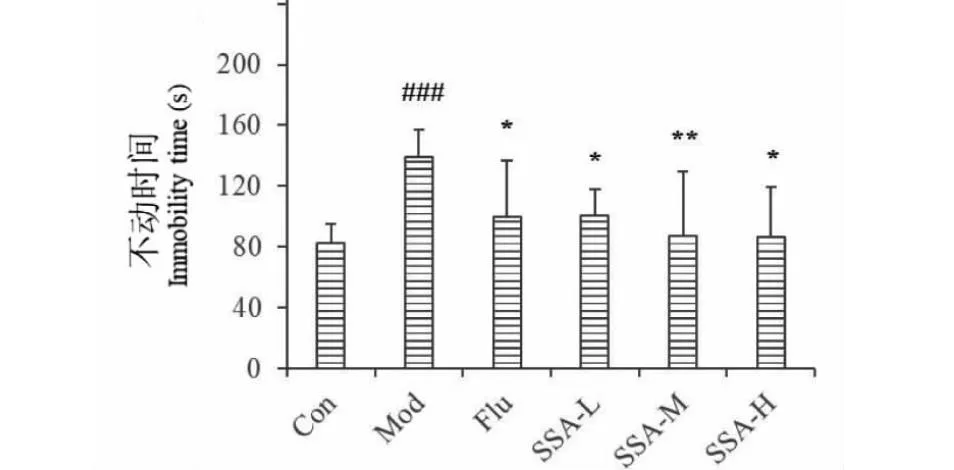
图1 SSA对CUMS模型TST不动时间的
强迫游泳实验结果表明,与空白组相比(小鼠在强迫游泳环境中平均不动时间为125.3±9.4 s),模型组小鼠在强迫游泳环境中的平均不动时间明显增加,为143.9±13.6 s,说明小鼠出现行为绝望的抑郁行为;与模型组相比,阳性对照Flu组的平均不动时间明显降低,为114.3±10.4 s;SSA高、中、低剂量组小鼠FST不动时间显著缩短(P<0.05或P<0.01);结果表明SSA能够显著缩短小鼠的不动时间,具有潜在的抗抑郁作用(见图2)。
图2 SSA对CUMS模型小鼠FST不动时间的影响
2.2 SSA作用靶点的预测与验证
在Drugbank数据库中查询6个抑郁症相关受体(OXTR、MT1、MT2、5HTIB、5HT2A、CB1)(见表1),各选取5个能够与受体结合的小分子化合物作为参照配体,包括受体的激动剂或拮抗剂。通过比较结合能反映小分子化合物与受体的结合情况,其中参照配体与受体的结合能既是阳性对照,同时也保证了分子对接过程中的方法正确。将数据进行归一化处理后得到柴胡皂苷单体化合物与6种受体结合能的热图。

表1 抑郁症相关的G蛋白偶联受体及其功能
受体与配体的结合能的值越小,表明该小分子与受体结合更紧密、亲和力更强。分子对接结果表明,SSA与OXTR结合能最小(-8.55 kcal/mol),与激动剂Way的结合能(-8.27 kcal/mol)相近;SSA与5HTIB的结合能为-9.43 kcal/mol,SSA与OXTR、5HTIB的结合能力均强于阳性对照。此外,SSA与5HT2A的结合能远大于5HT2A的参照配体;SSA与MT1、MT2和CB1的结合能均为正值,表明SSA与MT1、MT2和CB1受体之间结合能力很弱或不结合(见图3)。
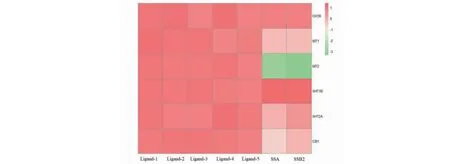
图3 SSA与6种受体结合能的热图
此外,分子对接结果表明,SSA与OXTR的氨基酸残基GLU 307、GLN 295、GLN 92形成3个稳定的氢键;与PHE 311、ILE 210、TYR 200、ILE 204、LEU 120、SER 319、ALA 318、VAL 88、TRP 288、GLN 171、MET 123、GLN 119、LYS 116、ALA 189、GLN 96、TRP 99之间形成范德华力;与PHE 175、TRP 188、PHE 291、ILE 312、MET 315形成疏水性相互作用力(图4A、4B)。

图4 SSA与OXTR的结合模式图
CETSA结果表明,随着温度升高,蛋白的变性程度越强,40 ℃时蛋白基本不变性,而64 ℃时蛋白基本完全变性。在40、44、48 ℃三个温度下,1 μmol/L的SSA能够明显抑制OXTR的热变性作用,而10 μmol/L的SSA对OXTR的热变性无明显抑制作用;提示SSA非剂量依赖性地与OXTR结合,并能显著增强受体的结构稳定性,延缓受体的热变性作用(见图5A、5B)。

图5 细胞热转移测定法验证SSA作用靶点电泳图
DARTS结果表明,酶:蛋白比值越小,受体蛋白水解程度越弱;比值为1∶10 000时,受体蛋白水解程度最弱,比值为1∶1 000时,受体蛋白水解程度最强;提示SSA能够与OXTR结合,抑制酶对受体蛋白的水解作用(见图6)。以上结果表明,SSA能够与OXTR结合,并以OXTR为靶点发挥抗抑郁作用。
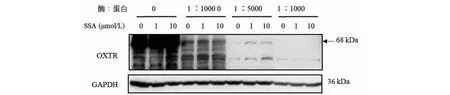
图6 药物亲和力反应靶稳定性法验证SSA作用靶点电泳图
2.3 SSA对OXTR受体及其下游信号通路激活的影响
Western blotting实验结果显示,与OXTR激动剂(Way-267464,Way)组相比,SSA对OXTR下游的ERK1/2通路没有明显的激活作用,可能的原因是SSA虽然能够激活OXTR,但并未激活其下游ERK1/2通路(见图7A)。此外,SSD(SSA的同分异构体)亦能激活OXTR但并不激活其下游的ERK1/2通路(见图7B),提示SSA激活OXTR发挥抗抑郁作用并不通过ERK1/2通路。

图7 各组OXTR下游ERK1/2通路的表达结果及电泳图
3 讨论与结论
抑郁症对患者的生活和工作产生了极大的影响,给患者家庭和社会带来巨大的负担。抑郁症的病理机制复杂,目前市售的各类抗抑郁药物,大多起效较慢,治愈率差,无法从根本上治愈,且不良反应发生率高。因此,开发一种全新的抗抑郁药物,对抑郁症的临床治疗具有重要的应用价值,将给抑郁症患者带来希望与福音。
柴胡具有多种药理作用,包括抗炎、抗癌、抗病毒、抗菌、保肝和免疫调节作用[16]。近年来,中药治疗抑郁症已取得显著疗效。现有数据表明,抗抑郁用药的1/3为柴胡类中药方剂,表明柴胡在抑郁症治疗中的重要性。柴胡中具有抗抑郁作用的活性成分主要包括:SSA、SSB2和SSD,其中SSA和SSD的分子式相同,仅在空间结构上存在差,因此,研究SSA的抗抑郁机制对中药柴胡的开发利用具有重要意义。尽管柴胡皂苷对抑郁症的有益作用已经确立,但其作用机制尚不明确。
催产素被认为在亲密感、社交认可、伴侣间的联系和焦虑等方面具有一定的作用。而OXTR与抑郁、焦虑以及压力所引发的一些病症也存在一定的联系,其可以通过对下丘脑-垂体-肾上腺轴(HPA轴)和海马神经元靶标的调节来改善患者的抑郁症状[2,5],所以OXTR很有可能成为抑郁症治疗的新靶点。
本研究首先以前期细胞筛选的结果为基础,以CUMS模型小鼠为载体,利用TST和FST检测SSA的抗抑郁作用,实验结果表明SSA具有显著的抗抑郁作用,其抗抑郁的效果与阳性对照Fluoxetine相当。进一步地,利用计算机分子对接技术、CETSA、DARTS明确了SSA的作用靶标。
MAPK通路的激活,特别是MEK1/2磷酸化激活是催产素发挥抗焦虑作用的一个重要途径,而ERK1/2是MAPK途径中的主要激酶之一[17]。因此,本研究通过检测ERK1/2的磷酸化水平的改变来初步判断小分子化合物的抗抑郁药效。虽然分子对接实验、细胞热转移测定实验以及药物亲和力反应靶稳定性实验均显示出SSA与OXTR结合,且SSA与OXTR的结合能力强于SSB2。但在ERK1/2磷酸化水平检测实验中SSA对OXTR下游的ERK1/2通路没有激活作用。可能的原因是SSA虽然能够与OXTR结合,但它与OXTR结合后发挥抗抑郁作用并不通过MAPK途径。OXTR可与多种G蛋白偶联(包括Gq和Gi),而这些G蛋白可能将OXTR信号传导至不同的细胞内途径,从而导致不同的细胞功能。该结果与前人的报道一致,例如在前列腺癌细胞中,活化的OXTR主要依赖于Gi途径介导前列腺癌细胞的迁移,且在该过程中并未激活ERK1/2通路[18]。此外,SSA通过抑制脂多糖(LPS)诱导的核转录因子κB(NF-κB)和κB抑制剂(IκBα)的磷酸化水平,发挥保护LPS引起的子宫内膜炎的作用[19,20]。后续我们可以使用SSA刺激稳定表达OXTR的细胞,通过检测其下游信号通路的磷酸化水平来进一步判断SSA通过激活OXTR进而发挥抗抑郁作用的具体机制。
鉴于中药柴胡在治疗抑郁中的巨大潜力,并且中药具有比西药不良反应少的优点,因此,阐明SSA的抗抑郁作用机制在抑郁症的防治中有着极其重要的作用。G蛋白偶联受体家族有800多个成员,几乎参与调控了人体内所有的病理、生理过程,针对OXTR研究SSA是否以其为作用靶标及相关的细胞信号传导通路,为抑郁症等精神疾病的临床研究治疗和新药开发提供必要的理论与参考依据。

