环杷明与香青兰总黄酮联合用药对肺纤维化小鼠的影响
吕佳敏,唐云辉,何承辉,翟科峰*,段 红
1新疆维吾尔自治区药物研究所,乌鲁木齐 830004;2宿州学院生物与食品工程学院,宿州 234000
肺纤维化(pulmonary fibrosis,PF)是一种慢性进行性肺疾病,具有明显的组织病理模式,包括大量慢性呼吸系统病变,并伴有各肺间室结缔组织生长,其中间质性肺疾病和特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是肺实质进行性纤维化的最严重且不可逆的疾病[1,2]。PF是由组织修复异常引起的,并与持续严重的组织损伤和细胞应激有关。这种异常的性质涉及上皮细胞屏障修复不足,并伴有成纤维细胞的调节受损,从而导致肺泡上皮细胞和成纤维细胞的深刻变化,导致不受控制的纤维化,其特征是纤维化肺泡壁增厚,导致气体传递受损,通气模式受限,从而导致呼吸衰竭[3]。近几年,在现代医学领域中PF疾病严重危害了人的健康,由于诊断方法的不断进步以及人口老龄化,PF的死亡率和发病率持续上升,该疾病发病原因复杂,病理机制尚不清楚,患者临床表现为进行性肺组织顺应性减退,弥散功能降低,通气/血流比例失调,导致患者出现难治性呼吸困难,最终呼吸衰竭而死亡[4]。
Hedgehog(Hh)通路在胚胎发生发育以及组织重塑中有重要作用。Hh信号转导通路主要由信号分子(SHH、IHH、DHH)、跨膜受体(Ptch、SMO)、下游转录因子(Gli1蛋白家族)组成,Hh通路激活后主要通过Gli1蛋白家族发挥作用[5]。IPF中已证实Hh通路活性增加,在进行纤维化重塑的区域,分别在肺泡上皮和下层成纤维细胞中检测到SHH及其信号效应物的显著表达[6]。在肺中,SHH处理增加了成纤维细胞的增殖、存活、迁移和细胞外基质(extracellular matrix,ECM)的产生,但没有升高α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达[7]。在博来霉素诱导的PF模型中,气道和肺泡上皮细胞中SHH表达升高。在博来霉素模型中,抑制Hh信号传导不能阻止纤维化,但纤维化期SHH过表达会加重PF[8]。因此,尽管SHH信号对正常肺发育和维持间质静止至关重要,但它在PF中也被慢性激活。
环杷明(cyclopamine,Cyc)是一种异甾体类生物碱,同时是Hh信号通路的抑制剂。通过改变SMO的空间构象,从而抑制SMO的活性,来抑制Hh信号通路的下游信号传导,从而使Hh通路处于抑制状态[9]。Cyc能够抑制肿瘤基因的转录与表达,干预SHH介导的Hh信号通路,发挥抗肿瘤与抗PF的作用,进而抑制相关疾病进程[10]。相关研究表明,通过与 Hh信号通路中的SMO蛋白结合,影响SMO蛋白下游信号的传导,可减少α-SMA和1型胶原蛋白(collagen type 1,Col-1)蛋白的相关表达,从而减弱甚至阻止超敏C反应蛋白的这种变化,进而改善门静脉高压症[11]。另外Cyc等干扰Hh信号的药物可能有助于预防前列腺癌细胞的雄激素抵抗和疾病进展[12]。Hh信号通路影响疾病的发生和发展,然而,Cyc在PF相关疾病中的作用尚不清楚。
香青兰(DracocephalummoldevicaL.)是唇形科植物,以全草地上部分入药,主要化学成分为挥发油、多糖、萜类、黄酮类、氨基酸、微量元素,具有保护心脑血管、抗动脉粥样硬化、防哮喘、清热解毒、活血通络、抗氧化、调节血脂异常等多种药理作用,同时具有疏风清热、感冒发热、咳嗽气喘等功效[13,14]。研究发现,香青兰含有的黄酮类化合物共有41种,而香青兰的药用功效主要来源于黄酮类化合物[15]。前期研究证明,TFDM作为香青兰的主要有效成分之一,对于镇咳平喘具有非常有效的作用,可明显减缓小鼠的气道内部的高反应性,从而修复肺功能的损伤[16]。使小鼠体内的白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-17(interleukin-17,IL-17)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等大量释放,从而明显降低白细胞介素-4(Interleukin-4,IL-4)/干扰素-γ(Interferon-γ,IFN-γ)的比值,从而调整了Th1/Th2的免疫失衡状态[17,18]。其中,TFDM能够通过减少肺部组织中Col-1含量,进而控制NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)表达,最后实现了缓解PF的目的[13]。并且前期研究已经证明,香青兰总黄酮(total flavonoid fromDracocephalummoldavicaL.,TFDM)可以通过下调或上调Hh信号通路的SHH、Ptch1、SMO、SUFU、Gli1等重要调控蛋白从而有效缓解由博来霉素引起的PF[19]。因此本文基于Hh信号通路研究Cyc和TFDM对PF的作用机制。
1 材料与方法
1.1 动物
雄性6~8周龄C57BL/6小鼠50只(SPF级),体重为28±2 g,购自河南斯克贝斯生物科技股份有限公司,许可证号SCXK(豫)2020-0005。适应性饲养一周于12 h光照/12 h黑暗环境中,操作均符合新疆维吾尔自治区药物研究所实验室伦理标准,伦理审批号为XJIMM-20211025。
1.2 药物与试剂
TFDM提取物(批号20210320,新疆维吾尔自治区药物研究所);Cyc(货号:C860641-100 mg)、硫酸博来霉素(批号:B802467-100 mg)、水合氯醛(批号:C804539-100 g)(上海麦克林生化科技有限公司);HYP检测试剂盒(批号:YFX0111)、Masson染色试剂盒(批号:YFX1293)(南京翼飞雪生物科技有限公司);苏木精-伊红染液(上海Beyotime生物有限公司,批号,C0105);BCA蛋白浓度定量试剂盒(批号:E112-01)、RIPA裂解液(批号:E311-02)(南京Vazyme生物科技股份有限公司);二抗兔抗和鼠抗(Bioworld,货号,AB45151);一抗Col-1(批号:14695-1-AP)、α-SMA(批号:20697-1-AP)、FN1(批号:15613-1-AP)、SHH(批号:20697-1-AP)、SUFU(批号:26759-1-AP)、Gli1(批号:66905-1-AP)(Proteintech公司);SMO抗体(批号:E1A743G,南京恩晶生物科技有限公司);GAPDH抗体(批号:AP0063,Bioworld)。
1.3 仪器
Tecan Infinite200酶标测定仪(瑞士);Leica CM1850UV冷冻切片机(德国Leica);Leica正置荧光显微镜(德国);电泳仪和电泳槽(美国 Bio-Rad);Sartorius高速冰冻离心机(德国);Touch Imager成像系统(上海易孛特光电技术有限公司);AniRes2005动物肺功能分析系统(北京贝兰博有限公司)。
1.4 动物分组、造模及给药
选用50只SPF级C57BL/6小鼠,随机分为5组:即正常对照组(control,Con)、模型组(model,Mod)、香青兰总黄酮组(360 mg/kg,TFDM)[19]、环杷明(cyclopamine,Cyc)组(5 mg/kg)和香青兰总黄酮组+环杷明抑制剂组(TFDM+Cyc),除正常组外,其余各组气管内滴入博来霉素(4 mg/kg)构建小鼠PF模型。小鼠腹腔注射5%的水合氯醛,分离暴露气管。使用1 mL注射器吸取博来霉素药液,朝两环骨间刺入小鼠气管,然后推入博来霉素药液。给药结束后,直立起解剖板,并晃动使博来霉素药液均匀分布在肺中。随后在相同条件下,空白小鼠气管内滴注等体积的生理盐水。造模第2 d,正常组和模型组分别灌胃给予等体积的蒸馏水,给药组给予对应药物,即Cyc组灌胃给予5 mg/kg的Cyc混悬液、TFDM组灌胃给予360 mg/kg的TFDM混悬液、TFDM+Cyc组灌胃给予TFDM(360 mg/kg)和Cyc(5 mg/kg)的混合悬液,每日灌胃1次,连续四周。
1.5 水解法测定PF小鼠肺组织中HYP的含量
使用试剂盒的操作说明,每组提取适量肺组织,在组织匀浆器中研磨成匀浆,在磨好的匀浆中滴加6 mol/L的盐酸,随后转移至1.5 mL的EP管中,在水浴锅中煮沸,随后使用高速离心机在12 000 r/min,25 ℃的条件下,离心25 min。最后用NaOH调节PH至6~8,并用纯水标定体积,使用上清液,在560 nm处进行OD值测定,计算HYP的含量。
1.6 肺组织病理学检查
首先制作肺组织冰冻切片,取适量肺组织,使用PBS冲洗干净,随后使用OCT包埋胶将肺组织包埋于载物托上,立即放置于冰冻切片机中进行低温冷冻,将肺组织切成8 μm的薄片并贴于载玻片上。切片完毕后,使用制作好的切片,进行HE染色和Masson染色观察肺组织病理的情况。
1.7 PF小鼠肺功能检测
末次给药后,用5%水合氯醛6 mL/kg麻醉小鼠,逐层分离气管,行气管插管,将气管另一端连于小鼠体锚箱,密闭体锚箱,采用肺功能仪中的AniRes2005动物肺功能分析系统,进行吸气相气道阻力(inhalation phase airway resistance of lung,RL)、呼气相气道阻力(expiratory phase airway resistance of expiration,RE)、肺顺应性(respiratory dynamic compliance,Cdyn)、用力肺活量(force vital capacity,FVC)、呼气峰流速(peak expiratory flow rate,PEF)和FEV0.1/FVC相应数据的采集。
1.8 Western blot法测定PF小鼠肺组织中的蛋白表达水平
取每组适量肺组织,放入组织匀浆器中加入RIPA裂解液进行研磨,研磨至匀浆后在高速离心机上在4 ℃ 12 000 r/min的条件下,离心5 min。转移上清液至1.5 mL的EP管中,测定蛋白浓度,使用BCA蛋白定量法。随后对定量后的蛋白进行凝胶电泳,电泳结束后,将蛋白条带转移到PVDF膜上,5%BSA室温封闭,随后加入一抗稀释液Col-1、FN1、α-SMA、SHH、Ptch1、SMO、Gli1和SUFU放置4 ℃冰箱过夜。第二天孵育二抗,并使用ECL显出蛋白条带,Touch Imager成像系统采集条带图像,将条带用Alpha View SA图像分析软件进行半定量分析,结果用灰度值表示。
1.9 统计学处理
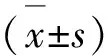
2 结果
2.1 Cyc与TFDM对PF小鼠肺组织病理学的影响
探究Cyc与TFDM对PF小鼠肺组织病理学的影响。通过HE染色(见图1A),可以观察出,正常对照组小鼠肺组织结构完整,未见炎症细胞浸润;模型组小鼠肺组织结构被严重破坏,肺泡间隔明显增厚,伴有大量炎症细胞浸润;与模型组比较Cyc组和TFDM组小鼠肺组织结构基本完整,炎症细胞浸润明显减少,另外TFDM+Cyc组与单独给予Cyc组和TFDM组相比,可以更明显地看出肺组织结构恢复正常形态,肺泡结构正常,几乎无炎性细胞浸润。Masson结果显示(见图1B),正常对照组小鼠肺组织结构完整,几乎无蓝色纤维组织,与正常对照组相比,模型组肺组织出现大量蓝色纤维组织,肺组织纤维化程度显著;Cyc组和TFDM组肺组织纤维化程度得到明显缓解,与Cyc组和TFDM组相比,TFDM+Cyc组可明显看出几乎无蓝色胶原纤维组织,肺组织得到明显修复。

图1 Cyc与TFDM对PF小鼠肺组织病理学的影响(×200)
2.2 Cyc与TFDM对PF小鼠肺功能的调控
通过AniRes2005肺功能分析系统检测了PF小鼠的RL、RE、Cdyn、FVC、PEF和FEV0.1/FVC肺功能指标。结果如图所示(见图2),与正常对照组比较,PF损伤模型RL、RE和FEV0.1/FVC显著升高(P<0.01),Cdyn、FVC和PEF显著降低(P<0.01),符合PF肺功能状态。给予Cyc和TFDM干预后,RL、RE和FEV0.1/FVC显著下降(P<0.01),Cdyn、FVC和PEF显著上调(P<0.05,P<0.01),另外进行组间比较与TFDM组相比,TFDM组+Cyc组RL、RE和FEV0.1/FVC下降(P<0.05,P<0.01),Cdyn、FVC和PEF显著上调(P<0.05,P<0.01),有明显差异,与单独给药Cyc组相比,TFDM组+Cyc组RE和FEV0.1/FVC下降(P<0.05,P<0.01),其中RL呈现下降趋势,但数据无明显差异,Cdyn、FVC和PEF上调(P<0.05)。
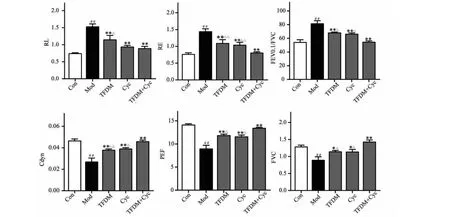
图2 Cyc与TFDM对PF小鼠肺功能的调控
2.3 Cyc与TFDM对肺组织中HYP含量的影响
如图3所示,与正常对照组比较,模型组小鼠肺组织中HYP含量显著升高,差异有统计学意义(P<0.01);与模型组比较,Cyc组和TFDM组肺组织中HYP含量明显下降,差异有统计学意义(P<0.01);与TFDM组相比,TFDM+Cyc组肺组织中HYP含量显著下降(P<0.01),有明显差异;另外TFDM+Cyc组与单独给药Cyc组相比,P>0.05,无明显差异。
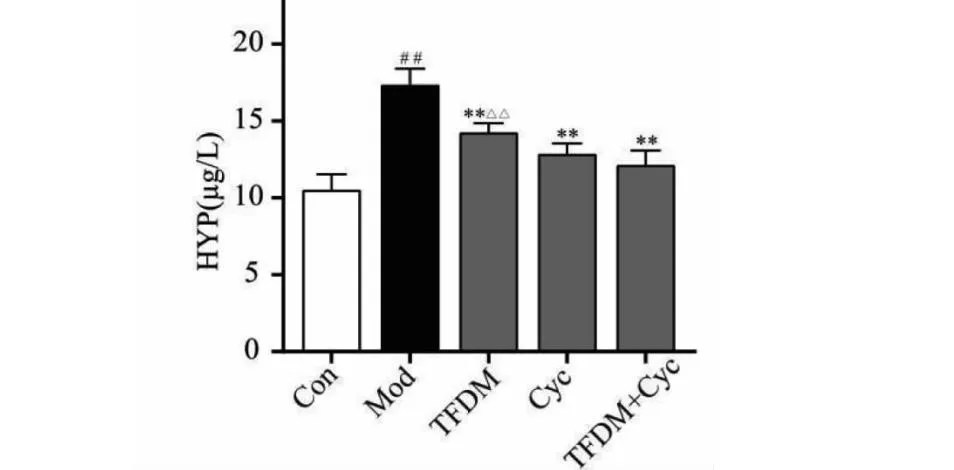
图3 Cyc与TFDM对肺组织中HYP
2.4 Cyc与TFDM对肺组织中PF蛋白表达的影响
结果如图4所示,与正常对照组比,模型组小鼠肺组织中Col-1、FN1、α-SMA蛋白表达升高(P<0.01);与模型组相比,Cyc组和TFDM组小鼠肺组织中Col-1、FN1、α-SMA蛋白表达显著降低(P<0.01);另与TFDM组相比,TFDM组+Cyc组Col-1、FN1、α-SMA蛋白显著降低(P<0.01),具有显著性差异;同时TFDM组+Cyc组与单独给药Cyc组相比,α-SMA蛋白显著降低(P<0.01),其中Col-1、FN1蛋白呈现下降趋势,但数据无明显差异。
图4 Cyc与TFDM对肺组织中PF蛋白表达的影响
2.5 Cyc与TFDM对肺组织中Hh信号通路蛋白表达的影响
如图5所示,使用Western blot的方法验证分析,检测了小鼠肺组织中Hh信号通路中SHH、SMO、Gli1和SUFU蛋白的表达水平。结果如图5所示,SHH、SMO、Gli1蛋白表达水平在博来霉素致PF损伤后显著升高(P<0.01),SUFU蛋白的表达水平显著下降(P<0.01);Cyc组和TFDM组中SHH、SMO、Gli1蛋白表达水平显著下降(P<0.01),SUFU蛋白的表达水平显著升高(P<0.01);另与TFDM组相比,TFDM组+Cyc组SHH、SMO、Gli1蛋白显著降低(P<0.01),SUFU蛋白表达明显升高(P<0.01)具有显著性差异;同时TFDM组+Cyc组与单独给药Cyc组相比,SHH、SMO蛋白表达明显下降(P<0.01),其中Gli1蛋白有下降趋势,但差异无显著性,SUFU蛋白显著升高(P<0.01),有明显差异。
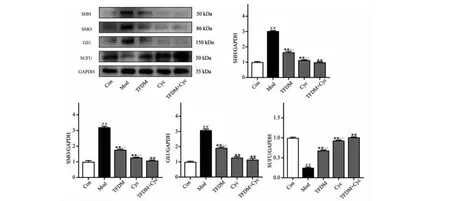
图5 Cyc与TFDM对肺组织中Hh信号通路蛋白表达的影响
3 讨论与结论
前期对香青兰进行了大量的研究工作,确定了香青兰最佳提取工艺,采用大孔吸附树脂纯化香青兰提取液,得到香青兰有效部位,并将香青兰有效部位进行分离,进行结构分析鉴定。在此之前,对香青兰有效部位的含量进行了测定,并根据临床给药剂量,依据相关文献折换为动物体内给药剂量[19]。并且在前期研究中基于Hh信号通路探讨了TFDM(90、180、360 mg/kg)相关剂量在PF小鼠模型中的作用机制,发现Hh信号通路在PF小鼠模型中被激活,而TFDM可通过干预Hh信号通路的重要调控蛋白,起到改善PF的作用,且TFDM高剂量(360mg/kg)效果较为明显[19]。
因此本文在前期的研究基础之上重点探讨了Cyc抑制Hh信号通路,TFDM(360 mg/kg)在博来霉素所致PF小鼠体内的相关作用研究。采用气管内滴注博来霉素构建PF小鼠模型,构建模型第二天,灌胃给予小鼠Cyc和TFDM等相关药物。由于Cyc和TFDM都为难溶性药物,故采用0.5 %羧甲基纤维素钠配置成相应混悬液灌胃给药。
PF模型构建初期,患病小鼠均呈现体重下降,食欲不振,毛色杂乱,并且精神状况不佳等症状,并出现大量死亡,同时根据HE和Masson染色的肺组织病理切片的结果得出结论PF模型的构建是成功的。经过连续给予药物干预,PF模型构建后期,小鼠各症状得到明显改善,肺组织病理切片的结果发现Cyc组和TFDM组肺组织结构正常,炎性细胞和纤维化组织明显减少。随后,又进行了HYP含量的测定,研究结果显示,模型组HYP含量升高,Cyc组和TFDM组能显著降低HYP的含量。PF的临床表现是持续性干咳和急性呼吸困难,伴随肺损伤的加剧,患者的肺功能持续下降,导致死亡。PF会引起肺功能丧失,它的临床特征是进行性呼吸困难,导致气体交换障碍和限制性通气问题[20]。因此本研究进行了肺功能测定,结果发现Cyc组和TFDM组可通过降低RL、RE和FEV0.1/FVC,同时可升高Cdyn、FVC和PEF,改善PF气流受限,缓解限制性通气功能障碍,进而可以有效缓解博来霉素诱导的PF的相关症状。
Hh通路在PF过程中发挥重要作用,如ECM分泌和代谢,以控制PF。Hh信号通路由配体的分泌启动,Ptch消除对SMO的抑制作用,从而促进转录因子Gli1的激活和核易位,导致Hh靶基因的表达,如Gli1、SMO[21]。因此,在目前的研究中,本研究使用SMO抑制剂Cyc抑制Hh通路,来确定TFDM在PF小鼠中的作用。本研究检测了Col-1、α-SMA、FN1、SHH、SMO、SUFU、Gli1等相关蛋白,Cyc和TFDM抑制Hh通路可以抑制ECM的产生和血管生成作用,这可能是通过下调Col-1、α-SMA、FN1、SHH、SMO、Gli1等相关蛋白和上调SUFU蛋白来实现的。由此更证实PF与抑制Hh信号通路有关。Cyc组和TFDM组均能修复肺组织损伤,改善胶原纤维的含量,下调或上调Hh信号通路相关蛋白含量,进而缓解肺组织纤维化进程,并且Cyc和TFDM联合用药效果更佳。
总之,本文进一步阐述了PF的发生发展,并且经过验证TFDM有一定的治疗作用,并深入挖掘了Hh信号通路与PF相关的作用机制,为PF的相关作用机制研究提供了良好的研究基础。

