基于响应面法优化牛蒡子多糖提取工艺及对细胞抗炎作用研究
潘博雅,孟宪群,康廷国,尹海波,许 亮,王 丹
辽宁中医药大学药学院,大连 116600
牛蒡子为菊科植物牛蒡(ArctiumlappaL.)成熟的干燥果实,收录于2020版《中国药典》中。现代研究表明,牛蒡子因其具有多种药理活性,例如抗炎、抗肿瘤、抗糖尿病肾病、调节免疫力、抗病毒、降血糖、利尿及泻下等功效[1-3]而被广泛研究。但目前关于牛蒡子活性成分的研究主要集中在木脂素类成分[4],而其中的多糖作为果实类中药中富含的主要成分之一[5]在牛蒡子中却研究较少。炎症是机体免疫系统的第一道防线,是机体的一种自然保护性反应,但长时间的、慢性的炎症可导致疾病的发生,如发烧、哮喘、动脉粥样硬化、关节炎、神经退行性疾病甚至癌症。目前对于炎症的治疗主要集中在类固醇和非类固醇抗炎药物,但因其能够引起高血压、骨质疏松、免疫抑制、出血性胃炎、上消化道溃疡、肝毒性、过敏等副作用,不能长期使用。因此亟待开发出一类安全、有效的新药源[6]。近年来,天然多糖因其安全性、易得性和良好的抗炎活性而受到广泛关注[7]。
因此,本研究在考察单因素条件的基础上,采用响应面中的Box-Behnken方法,进行三因素三水平实验设计。以牛蒡子多糖提取率为参考依据,构建牛蒡子多糖提取工艺最佳组配。通过建立以脂多糖(lipopolysaccharide,LPS)为诱导条件的RAW 246.7细胞炎症模型,对牛蒡子多糖的相关抗炎机制进行初步研究,为开发新抗炎药物和综合利用牛蒡子多糖提供科学依据。
1 材料与方法
1.1 实验材料
牛蒡子(江苏省徐州丰县有限公司),经辽宁中医药大学康廷国教授鉴定为牛蒡(ArctiumlappaL.)干燥成熟果实。
1.2 试剂与设备
无水葡萄糖对照品(批号:M11bv141284,纯度≥98%,北京索莱宝科技有限公司);CCK8试剂盒(批号:MA0218-Oct-171,北京博奥森生物技术有限公司);IL-6、TNF-αELISA试剂盒(批号:AD202112、AD202203,上海研谨科技有限公司);蒸馏水(杭州娃哈哈集团有限公司)。UV-5100型紫外可见分光光度计(上海元析仪器有限公司);FA210SL型电子天平(华质电子科技有限公司);HH-ZK6型数显式电热恒温水浴锅、LY15-101-1型电热恒温干燥箱(上海龙跃仪器设备有限公司);TDZ4-WS型低速离心机(湖南湘仪实验室仪器开发有限公司)。
1.3 牛蒡子多糖的提取研究
1.3.1 多糖的提取
称牛蒡子干燥粉末10 g,加甲醇(20 mL)进行热回流提取。去除甲醇提取液,将药渣挥干后,用1.5倍体积的蒸馏水加热提取3次,每次2.5 h,将3次提取的水提液合并,用乙醇进行醇沉,测定乙醇终浓度为80%,醇沉过夜。将醇沉后的样品通过丙酮淋溶后进行抽滤,将抽滤沉淀中的有机溶剂挥干,取适当沉淀物根据苯酚浓硫酸法,当反应液颜色为棕褐色,多次测量反应液的吸光度值趋于稳定时,即为纯度较为稳定的牛蒡子粗多糖。
1.3.2 多糖纯度的测定
采用高效凝胶渗透色谱(high performence gel permeation chromatography,HPGPC)法测量多糖纯度。精密称取样品5 mg,溶解于1 mL的流动相溶液(0.05 mol/L NaCl溶液)中,配制成5 mg/mL溶液,超声10 min后,12 000 r/min离心10 min。吸取上清液,用0.22 μm的水系微孔滤膜过滤备用。色谱方法为流动相:0.05 M NaCl溶液;色谱柱:BRT105-103-101串联凝胶柱(8 mm× 300 mm);流速:0.8 mL/min;柱温:40 ℃;进样量:25 μL;检测器:示差检测器RID-20A;分析时间:60 min。
1.3.3 单因素考察
称牛蒡子干燥粉末10 g,对提取多糖过程中涉及的3个因素(料液比、提取时间、提取温度)进行实验设计。以牛蒡子多糖提取率为参考响应值,测定不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30 g/mL)、提取时间(2、3、4、5、6 h)和提取温度(60、70、80、90、100 ℃)对多糖提取的影响,确定各提取因素的最佳范围。
1.3.4 响应面试验设计
通过单因素实验确定提取范围之后,采取Box-Behnken设计方法,对确定范围下的料液比、提取时间和提取温度进行试验组配,以多糖提取率为响应值指标,通过对不同组配的多糖提取,得到数据并进行分析,建立三个影响因素与响应值之间的拟合方程,生成响应图,并利用软件预测最佳工艺条件[8]。
1.4 牛蒡子多糖提取率的测定
取牛蒡子多糖样品1 mL,使用修改的苯酚-浓硫酸法[9],以葡萄糖标准曲线为参考,测定牛蒡子多糖样品在490 nm处吸光度值,通过标准曲线得到多糖浓度,并根据公式(1)计算其提取率。
(1)
式中:c(g/mL)代表牛蒡子多糖溶液浓度,V(mL)代表牛蒡子多糖溶液体积,m(g)代表牛蒡子用量。
1.5 RAW 246.7细胞培养
向DMEM高糖培养液中加入含10%的新生小牛血清及100 U/mL青霉素、链霉素,对RAW 264.7细胞进行培养。培养条件:5% CO2,温度37 ℃,隔天换新培养液。每天观察细胞的生长状态。
1.6 CCK8法检测细胞活力
取生长至70%~80%融合程度的RAW 264.7细胞,用0.25%胰蛋白酶消化。当细胞密度达到5 × 103个/mL时,接种到96孔板中,培养24 h。设置7个牛蒡子多糖质量浓度组(0、10、20、40、80、160、320 μg/mL),每组4个复孔。当细胞充分贴壁后,将孔内液体弃置,各组加入200 μL培养液,其中含有相应质量浓度的药物,培养24 h弃掉孔内液体,每孔加入180 μL的完全培养基和20 μL的CCK8溶液,培养3 h,用酶标仪检测各孔光密度(OD)值,计算各组细胞的相对存活率[10]。
1.7 牛蒡子多糖对RAW 264.7细胞增殖的影响
将RAW 264.7细胞随机分成空白组,LPS模型组(1.0 μg/mL),牛蒡子多糖低、中、高剂量浓度组(20、40、80 μg/mL),每组设置3个复孔。用无血清培养液培养空白组细胞24 h,之后换新培养基继续培养1 h,LPS模型组细胞在无血清培养液培养24 h后,加入含100 μg/mL的LPS培养基继续培养1 h,牛蒡子多糖组分别换入含20、40、80 μg/mL牛蒡子多糖的培养基培养24 h,之后加入含100 μg/mL的LPS培养基继续培养1 h。于波长450 nm处测定吸光度(OD)值,并计算细胞的生长抑制率。
1.8 RAW 246.7细胞上清液中TNF-α、IL-6水平检测
收集不同处理组的RAW 264.7细胞上清液(3 000 r/min离心15 min),参照ELISA试剂盒说明书,检测不同处理组细胞上清液中TNF-α和IL-6水平。
1.9 Western blot法检测TLR4、MyD88和NF-κBp65的蛋白表达水平
收集每组细胞上清液,3 000 r/min离心15 min,取上清液,采用Western blot将蛋白质样品通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将所得蛋白质转移到聚偏二氟乙烯上,并在5%脱脂奶粉(磷酸盐缓冲液,0.1%吐温)中孵育。在所分析的检测液中,检测TLR4、MyD88和NF-κBp65的蛋白表达水平,通过分析着色位置和着色深度来判断。
1.10 数据统计分析
Box-Behnken设计采用Design-Expert Software12.0软件对响应面实验数据进行二次多项回归拟合方差分析。方差分析使用One-Way AVONA检验其显著性,P< 0.05代表差异具有统计学意义。
2 结果与分析
2.1 多糖纯度测定
采用HPGPC对牛蒡子粗多糖进行纯度鉴定(见图1)。通过已知分子量的标准葡聚糖作为标准品,根据葡聚糖凝胶标准曲线的测算,牛蒡子粗多糖的纯度为80.73%。

图1 牛蒡子粗多糖HPGPC图
2.2 单因素实验优化结果
2.2.1 提取料液比的影响
通过对牛蒡子多糖提取过程中不同料液比这一因素的研究,发现在1∶10、1∶15、1∶20、1∶25、1∶30 g/mL这5个料液比条件下,牛蒡子多糖提取率会随着提取液占比的升高,出现增高趋势(见图2),当料液比为1∶15 g/mL时,牛蒡子多糖的提取率最高为7.03%。当继续提高提取液比例,牛蒡子多糖的提取率又呈现下降的趋势,这可能是由于过大的溶剂和溶质之间的浓度差,反而影响了牛蒡子多糖在水中的溶解度,进而影响了多糖的提取率。
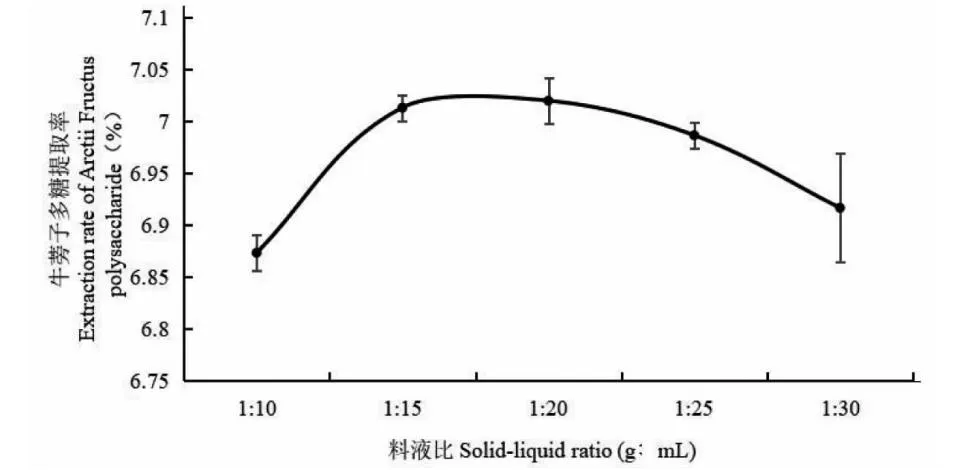
图2 不同料液比对牛蒡子多糖提取率的影响
2.2.2 提取时间的影响
通过对牛蒡子多糖提取过程中不同提取时间这一因素的研究,发现在2、3、4、5、6 h这5个提取时间条件下,牛蒡子多糖的提取率在3 h时达到最大值,为7.11%。之后随着提取时间的继续增加,多糖提取率呈现下降趋势(见图3)。可能是在多糖的提取过程中,提取时间过长会一定程度上破坏多糖结构,影响最终的多糖提取率。
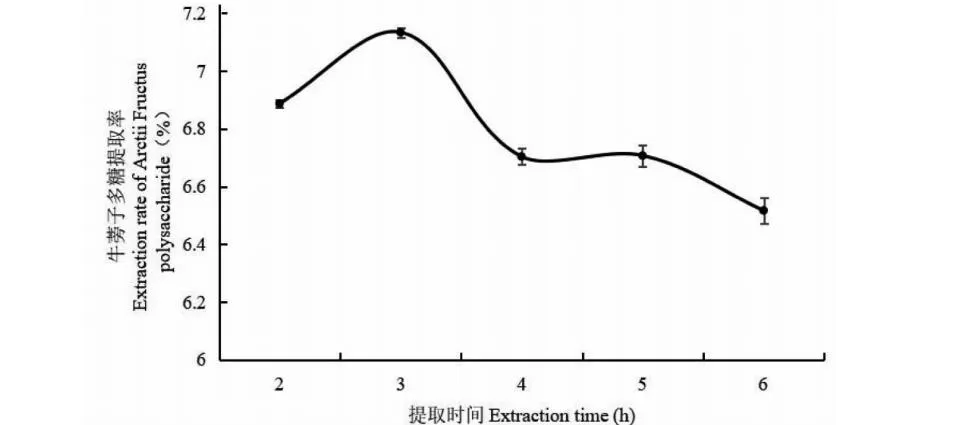
图3 不同提取时间对牛蒡子多糖提取率的影响
2.2.3 提取温度的影响
通过对牛蒡子多糖提取过程中不同提取温度这一因素的研究,发现在60、70、80、90、100 ℃这5个提取温度条件下,在60~80 ℃温度范围内,多糖提取率随着提取温度的升高而增加。在80 ℃条件下,多糖提取率最高,为7.14%(见图4)。当温度继续升高时,多糖提取率反而呈现下降趋势,可能是过高的提取温度会使多糖结构遭到一定程度的破坏,影响最终的多糖提取率。

图4 不同提取温度对牛蒡子多糖提取率的影响
2.3 响应面优化牛蒡子多糖的提取工艺组配结果
通过对上述三因素(料液比、提取温度、提取时间)提取条件范围的确定,基于Box-Behnken设计方法进行响应面实验(见表1)。

表1 牛蒡子多糖提取条件响应面实验设计及结果
根据Design expert软件,获得提取率对以上三个因素的拟合回归方程为:多糖提取率=7.19+0.1 506A+0.1 138B+0.1 800C-0.1 000A×B-0.0 025A×C-0.0 075B×C-0.0 319A2-0.2 056B2-0.4 831C2,式中A代表料液比,B代表提取温度,C代表提取时间。分析模型应用方差的结果表明:回归方程具有较高的拟合度和可信度,获得的实验方案可靠。回归系数R2> 0.9,说明自变量与响应值间含有线性关系,它的回归方程可以进行最佳提取工艺条件优化。通过回归方程进行响应面图和等高线图的绘制(图5)。

图5 响应面试验优化牛蒡子多糖提取率
通过Box-Behnken设计17组不同的提取方式组配,并根据多糖提取率判定,预测牛蒡子多糖最佳的提取条件组合为:料液比为1∶15 g/mL,提取温度为80 ℃,提取时间为3 h,在此组合下的多糖提取率可达7.29%。为了进一步验证实验结果,在此预测组配下进行3次平行实验,得到的牛蒡子多糖提取率平均值为7.19%,基本符合预期结果。
2.4 RAW 246.7细胞培养
通过传代的RAW 246.7细胞在光镜下显示其状态生长旺盛,细胞透亮,核仁清晰,细胞碎片少(见图6)。

图6 传代的RAW 246.7细胞生长情况
2.5 牛蒡子多糖对RAW 246.7细胞的毒性检测
牛蒡子多糖对RAW 246.7细胞的毒性检测结果见图7。牛蒡子多糖浓度为10~320 μg/mL时,RAW 246.7细胞存活率均高于90%,可视为无细胞毒性。当牛蒡子多糖浓度为20、40、80 μg/mL时,细胞活力显著提高(P <0.01)。因此,本研究选择细胞活性较高的20、40、80 μg/mL牛蒡子多糖浓度组,进行后续实验研究。

图7 不同牛蒡子多糖浓度对RAW 246.7细胞生长活力的影响
2.6 不同处理组对LPS诱导的RAW 246.7细胞炎症因子分泌的影响
通过检测RAW 246.7细胞炎症因子TNF-α和IL-6分泌情况发现,LPS模型组较空白组显著升高(P< 0.01);与LPS模型组比较,40、80 μg/mL的牛蒡子多糖组TNF-α和IL-6分泌显著降低(P< 0.05),且整体呈剂量依赖趋势,而20 μg/mL的牛蒡子多糖组差异不显著(见图8)。许多文献研究表明,多糖浓度在一定范围内与抗炎活性呈一定的剂量依赖关系[11-14],但是对于多糖纯度与抗炎活性的关系研究并未见报道,可以在后续的进一步研究中进行补充。
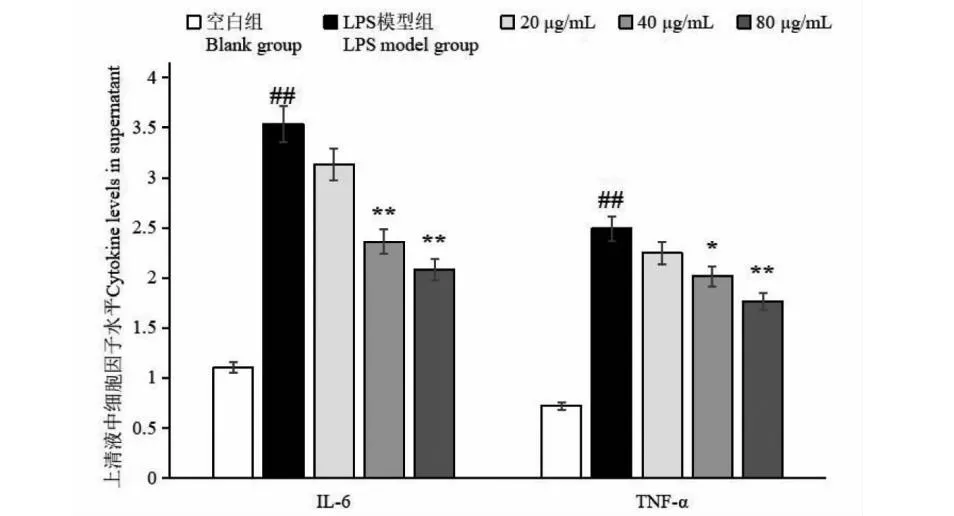
图8 不同牛蒡子多糖浓度对RAW 246.7细胞炎症因子的影响
2.7 不同处理组对LPS诱导的RAW 246.7细胞TLR4、MyD88及NF-κBp65蛋白表达的影响
通过对不同处理组细胞中TLR4、MyD88及NF-κBp65蛋白表达水平的检测发现,与空白组相比,LPS模型组中蛋白表达水平显著升高(P<0.01);与LPS模型组比较,20、40、80 μg/mL的牛蒡子多糖组细胞TLR4、和NF-κBp65表达显著降低(P<0.05),并且呈一定的剂量依赖作用。对于MyD88蛋白表达水平,与LPS模型组相比,不同浓度的牛蒡子多糖组均存在一定的抑制作用,其中40、80 μg/mL的牛蒡子多糖组抑制作用显著(P<0.05)(见图9)。
3 结论
本文通过对牛蒡子多糖提取过程中的三个因素(料液比、时间和温度)进行范围确定研究,并在此基础上,通过Box-Behnken进行三因素组配实验设计,根据实际牛蒡子多糖提取率,得到牛蒡子多糖最佳提取工艺条件(料液比=1∶15 g/mL、提取时间3 h、提取温度80 ℃)。通过研究不同浓度的牛蒡子多糖在细胞炎症中的作用机制,发现牛蒡子多糖能够抑制由LPS诱导的RAW 264.7细胞上清液中TNF-α和IL-6的分泌,并且能够通过调控TLR4/MyD88/NF-κB通路上的相关蛋白起到免疫调控作用,该研究可为牛蒡子多糖的开发和应用奠定科学基础,为牛蒡在抗炎作用方面的开发应用提供技术参考。

