响应面法优化碱法提取狐臭柴叶多糖工艺及生物活性研究
杨丹丹,朱玉昌,周大寨*
1生物资源保护与利用湖北省重点实验室;2湖北民族大学林学园艺学院;3湖北民族大学生物与食品工程学院,恩施 445000
狐臭柴(PremnapuberulaPamp)又名长柄臭黄荆和神仙豆腐柴等,属于马鞭草科豆腐柴属植物,是一种药食同源的植物[1];狐臭柴叶片含有十分丰富的活性物质,如黄酮类[2]、多酚类[3]、挥发油类[4]及多糖类[5],具有抗氧化[6]、抑菌[4]、抗肿瘤[7]及抗炎[8]等活性作用。目前狐臭柴叶片研究主要集中在活性成分的提取、药理作用以及在食品加工方面的应用等,叶片中多糖是主要的功能成分,果胶含量高达35.53%[9]。狐臭柴叶多糖的研究主要集中在酸溶性多糖[10]和水溶性多糖[11]的提取、抗氧化[5]、抗炎[12]等方面,Shi等[5]比较酸提取法、碱提取法和草酸铵超声辅助提取法对豆腐柴叶果胶的抗氧化活性影响,结果表明DPPH自由基、羟基自由基清除能力最佳为碱提取法,抗氧化活性优于其他两种提取方法。狐臭柴叶碱溶性多糖主要研究在多糖的提取[5],并未系统研究提取工艺,而碱溶性多糖的抗肿瘤活性的研究国内未见报道。
本文为充分开发利用狐臭柴多糖资源,以狐臭柴叶酸法提取多糖后的残渣为原料,通过单因素和响应面实验进行狐臭柴叶碱溶性多糖(alkali-soluble polysaccharide fromPremnapuberulaPamp leaves,PLAP)提取的工艺优化,并探讨PLAP的体外抗氧化能力和抗肿瘤活性,旨在为狐臭柴资源得到最大利用化及其在功能食品研发和医药领域的应用提供一定的理论支撑。
1 材料与方法
1.1 材料与试剂
本实验所需狐臭柴叶由湖北雄展公司提供,由湖北民族大学易咏梅教授鉴定为狐臭柴PremnapuberulaPamp的叶片;氢氧化钠(NaOH)、浓硫酸、苯酚、抗坏血酸(Vc)(分析纯,国药集团化学试剂有限公司);1,1-二苯基-2-三硝基苯肼(DPPH)(批号BCBM1255V,西格玛奥德里奇贸易有限公司);2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)(批号KZTCI-AE,梯希爱化成工业发展有限公司);1640培养基、胎牛血清(FBS)、青霉素/链霉素溶液(批号J104FC0251、IB09FA0003、IA27KA6853,生工生物工程股份有限公司);0.25%胰酶(批号MA0233-Oct-09G2,大连美仑生物科技有限公司);pH 7.4磷酸盐缓冲液(PBS)(批号8122571,赛默飞世尔生物化学制品(北京)有限公司);细胞增殖-毒性检测试剂盒CCK-8(批号22346564,北京兰杰柯科技有限公司);人A549肺癌细胞和人HepG2肝癌细胞(中国医学科学院细胞研究所)。
1.2 仪器与方法
TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);CO2培养箱(赛默飞世尔科技有限公司);M200PRO酶标仪(帝肯贸易有限公司)。
1.3 实验方法
1.3.1 狐臭柴叶的预处理
称取一定量的狐臭柴叶,经烘干、粉碎过60目筛,用85%乙醇反复浸泡4~5次,用丙酮浸泡1~2次脱脂、脱色、除去低聚糖等杂质。粉末进行55 ℃烘干过60目筛,即为狐臭柴叶脱脂脱色粉末。通过酸提取法提取狐臭柴叶酸溶性多糖,提取条件为0.05 mol/L草酸-磷酸氢二钠pH 2.0的提取液,在料液比1∶31 g/mL、提取温度60 ℃的磁力搅拌器中水浴提取60 min,5 000 r/min离心15 min,重复提取三次,残渣即为处理好的原料备用。
1.3.2 PLAP的提取
PLAP的提取参考Wang等[13]的方法,加以修改;将残渣以0.25 mmol/L NaOH为提取液,在料液比1∶50 g/mL、磁力搅拌器水浴室温提取110 min,5 000 r/min离心15 min,重复提取三次,将上清液合并,浓缩至原体积1/3左右,Sevage法[14]除蛋白,80%乙醇进行沉淀多糖,5 000 r/min离心15 min,沉淀进行冷冻干燥即为狐臭柴叶碱溶性多糖(PLAP)。
1.3.3 PLAP含量的测定
采用苯酚-硫酸法[15]测定PLAP浓度,以吸光度值为纵坐标(y),葡萄糖质量浓度(μg/mL)为横坐标(x),制作标准方程,得到线性方程为:y=0.016 6x+0.012 2;R2=0.997 6。通过公式(1)计算PLAP提取率(R)。
R=(C×n×V)/(m×10-6)×100%
(1)
式中:C表示PLAP浓度(μg/mL);n表示稀释倍数;V表示提取液体积(mL);m表示处理后的原料干重(g)。
1.3.4 单因素实验
实验研究提取料液比(1∶20、1∶30、1∶40、1∶50、1∶60 g/mL)、NaOH浓度(0.05、0.1、0.15、0.2、0.25 mmol/L)、提取时间(30、60、90、120、150 min)对PLAP提取率的影响。
1.3.5 响应面实验
在单因素实验基础上,选择最优的3个水平,进行料液比、NaOH浓度、提取时间的3因素、3水平的响应面实验分析。实验条件见表1。

表1 响应面分析因素和水平
1.3.6 PLAP抗氧化活性测定
DPPH自由基清除能力的测定:参考Chen等[16]方法,并加以修改;取不同浓度的PLAP溶液1 mL,加入2 mL DPPH 75%乙醇溶液,混匀后避光反应30 min,在517 nm处测吸光度值;对照组用75%乙醇代替DPPH 75%乙醇溶液;空白组用同体积的蒸馏水代替样品;以Vc作为阳性对照。通过公式2)计算DPPH自由基清除率(RC)。
RC=[1-(A1-A2)/A0]×100%
(2)
式中:A0表示空白组吸光度值;A1表示样品组吸光度值;A2表示对照组吸光度值。
羟基自由基清除能力的测定:参考Zhang等[17]方法,并加以修改;取不同浓度的PLAP溶液1 mL,分别加入9 mmol/L 1 mL FeSO4·7H2O、1 mL水杨酸和1 mL H2O2溶液,在37 ℃水浴30 min后静置30 min在510 nm处测吸光度值;对照组用蒸馏水代替FeSO4·7H2O和H2O2溶液,无水乙醇代替水杨酸;空白组用蒸馏水代替样品溶液;以Vc作为阳性对照。通过公式(2)计算羟基自由基清除率。
ABTS自由基清除能力的测定:参考Cui等[18]方法,并加以修改;取不同浓度的PLAP溶液各1 mL,分别加入2 mL ABTS溶液,避光反应60 min在734 nm处测定吸光度值;对照组用蒸馏水代替ABTS溶液;空白组用蒸馏水代替样品溶液;以Vc作为阳性对照。通过公式(2)计算ABTS自由基清除率。
还原能力的测定:参考Yang等[19]方法,并加以修改;取不同浓度的PLAP溶液各1 mL分别加入pH为7.4的磷酸缓冲溶液2 mL和2 mL 1%铁氰化钾在50 ℃水浴15 min后,加入2 mL 10%三氯乙酸,反应终止,4 000 r/min 10 min离心,上清液取1 mL加入0.2 mL 1%三氯化铁和1 mL蒸馏水混匀静置10 min,在700 nm处测吸光度值。吸光度值越大,则多糖的总还原能力越强。
1.3.7 PLAP抗肿瘤活性
1.3.7.1 PLAP对A549和HepG2细胞增殖实验
采用CCK-8法[20]测定A549和HepG2细胞增殖抑制率,当细胞培养瓶内细胞长满80%~90%面积时,弃瓶内培养基并加1 mL 0.25%胰酶消化至部分细胞变圆,加1 mL培养基(1640培养基中加入10%的胎牛血清和1%的青霉素/链霉素)终止消化,吹打均匀,制成细胞悬液,按1∶5稀释细胞悬液,每孔100 μL于96孔板中,5%的CO2培养箱孵育48 h后,弃培养基,加1 mL PBS迅速清洗死细胞,重复三次,分别向各孔加入100 μL含不同PLAP浓度(0、1、2、3、4、5、6 mg/mL)的培养基,每组6个复孔,5%的CO2培养箱孵育48 h后,弃培养基,每孔加入100 μL 10% CCK-8溶液,继续培养45 min,酶标仪450 nm测吸光度值。通过公式(3)计算细胞增殖抑制率(RI)。
RI=[(A2-A0)-(A1-A0)]/
(A2-A0)×100%
(3)
式中:A0表示空白组的吸光度值;A1表示实验组吸光度值;A2表示对照组吸光度值。
1.3.7.2 PLAP对A549和HepG2细胞迁移率实验
采用划痕实验[21]测定A549和HepG2细胞迁移率,取对数生长期细胞接种于6孔板中,浓度为1×105个/mL,每孔2 mL,于CO2培养箱中孵育48 h,弃培养基,用100 μL枪头画一条竖穿过孔的线,加1 mL PBS清洗死细胞,重复3次,分别加入2 mL用培养基配制PLAP(1、3、5 mg/mL)溶液,空白组加2 mL培养基,阳性对照组加2 mL培养基配制的0.01 mg/mL 5-氟尿嘧啶(5-FU)溶液,分别于0、24 h在倒置显微镜下拍照,用Image J软件测量各时间段划痕间距,通过公式(4)计算迁移率(Rm)。
Rm=(A0-A1)/A0×100%
(4)
式中:A0表示0 h划痕间距值;A1表示24 h划痕间距值。
1.4 数据处理
2 结果与分析
2.1 单因素实验结果
不同料液比对PLAP提取率的影响,固定NaOH浓度为0.05 mmol/L、提取时间30 min,改变料液比(1∶20、1∶30、1∶40、1∶50、1∶60 g/mL)进行PLAP提取的单因素实验,料液比对PLAP提取率的影响如图1a所示。随着料液比的增加,PLAP提取率呈现先增加后减少的趋势,当料液比达到1∶40 g/mL时,PLAP提取率达到最高(10.56±0.11)%,此时继续增加料液比,PLAP提取率开始降低,其原因可能是过大的料液比会导致部分多糖水解[22]。单因素最佳提取料液比为1∶40 g/mL;选择1∶30、1∶40、1∶50 g/mL作响应面实验。
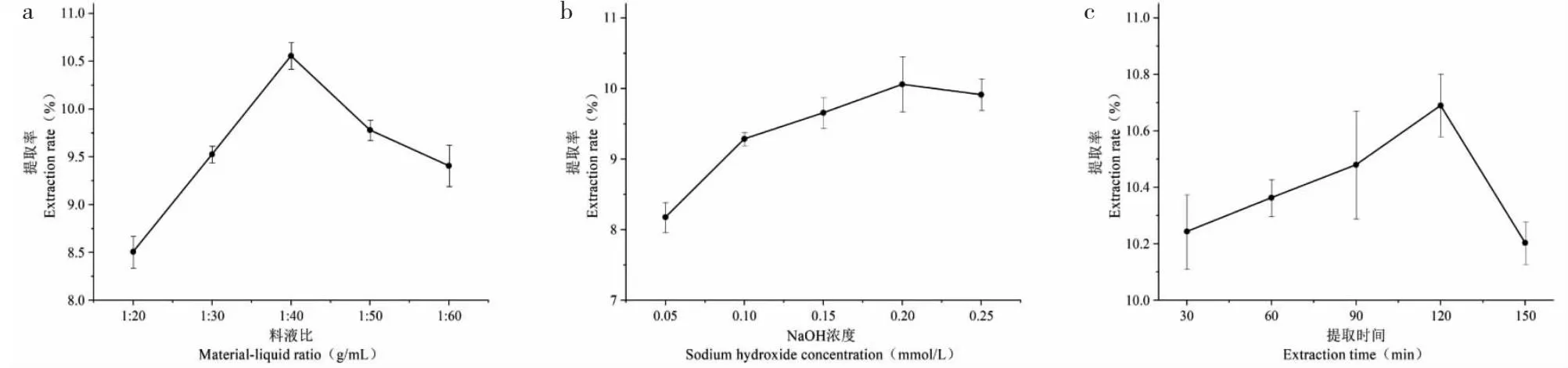
图1 不同因素对PLAP提取率的影响
不同NaOH浓度对PLAP提取率的影响,固定料液比1∶40 g/mL、提取时间30 min,改变NaOH浓度(0.05、0.1、0.15、0.2、0.25 mmol/L)进行PLAP提取的单因素实验,NaOH浓度对PLAP的提取率影响如图1b所示。随着NaOH浓度的增加,PLAP提取率呈现先增加后下降的趋势,当NaOH浓度为0.2 mmol/L时,PLAP提取率达最高点为(10.06±0.32)%,当继续增加NaOH浓度时,PLAP提取率下降,碱性过高的条件下,会导致多糖结构被破坏[23],单因素最佳提取NaOH浓度为0.2 mmol/L;选择0.15、0.2、0.25 mmol/L作响应面实验。
不同提取时间对PLAP提取率的影响,固定料液比1∶40 g/mL、NaOH浓度为0.2 mmol/L,改变提取时间(30、60、90、120、150 min)进行PLAP提取的单因素实验,提取时间对PLAP提取率的影响如图1c所示。当提取时间在30~120 min时,提取时间与多糖提取率呈现正相关,在提取时间为120 min时,此时提取率最高为(10.69±0.09)%,当提取时间大于120 min时,多糖提取率呈现下降的趋势,因此单因素最佳提取时间为120 min;选择90、120、150 min作响应面实验。
2.2 响应面实验结果
2.2.1 响应面模型分析
以料液比、NaOH浓度、提取时间三个因素为自变量,PLAP提取率为响应值,通过Box-Behnken响应面设计对PLAP提取条件进一步优化,PLAP提取实验设计及结果见表2。
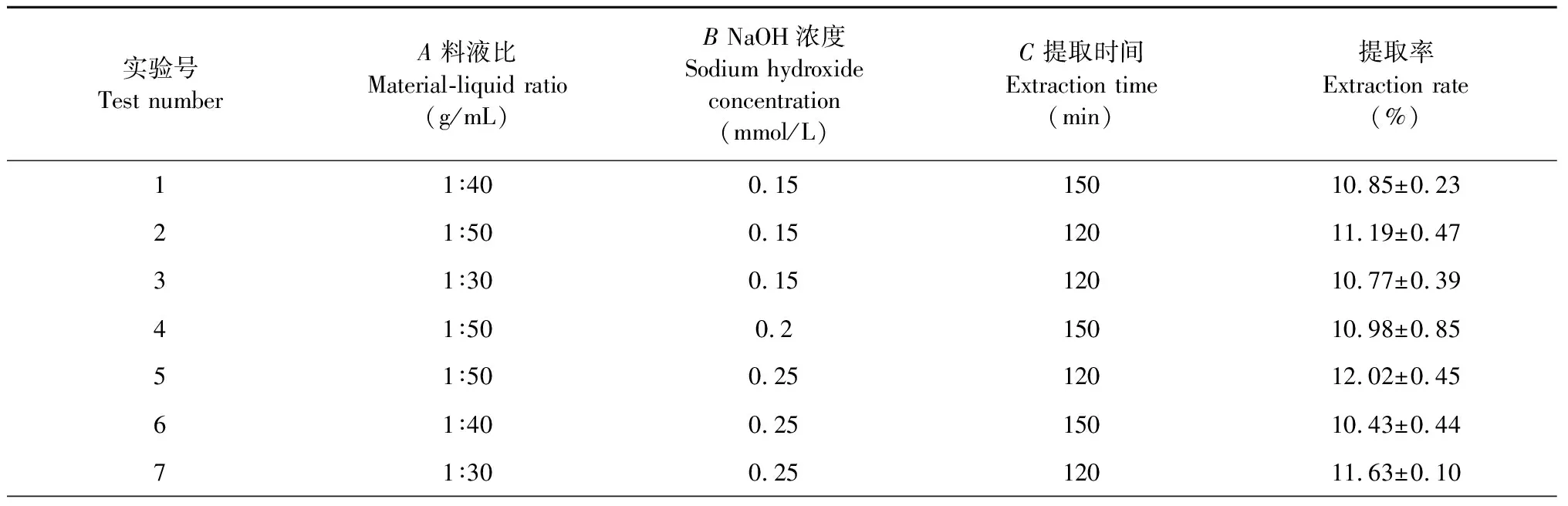
表2 Box-Behnken 实验设计和结果
通过响应面实验对表2中数据对模型进行方差分析,分析结果见表3,模型P<0.000 1(P<0.01)是具有极显著性的,因变量与自变量线性关系显著(R2=0.976 3),模型调整确定系数值为0.945 9,模型的失拟项为0.361 7>0.05,不显著,表明此模型可以分析和预测PLAP提取的最佳工艺条件,3个因素对PLAP的提取率影响大小依次为B(NaOH浓度)>A(料液比)>C(提取时间),二次多项回归方程如下:
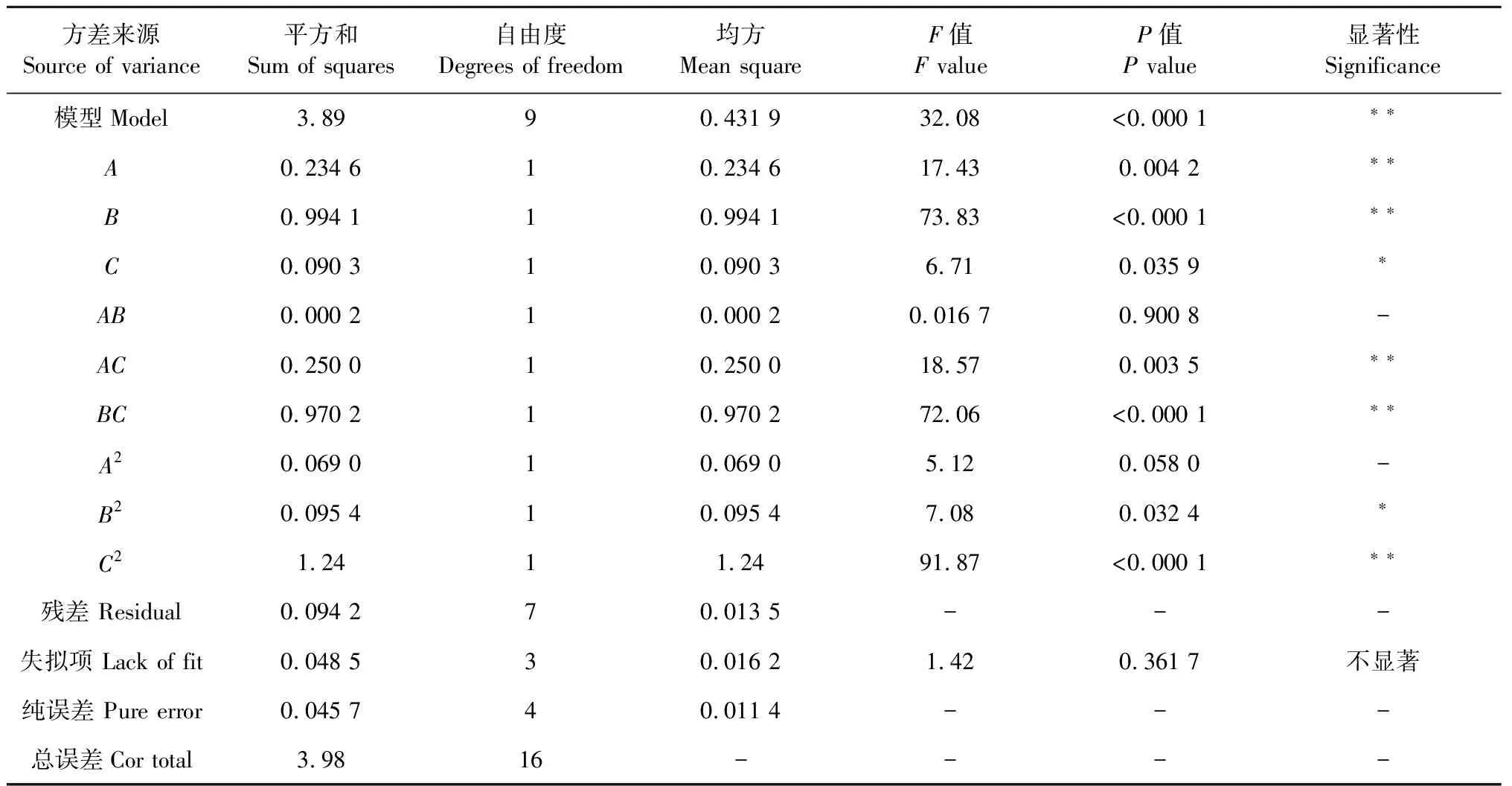
表3 响应面实验的方差分析结果
Y=11.12+0.171 3A+0.352 5B-0.106 3C-0.007 5AB+0.25AC-0.492 5BC+0.128 0A2+0.150 5B2-0.542C2
各交互项对PLAP提取率的影响见图2,3D的曲面图越陡表明交互作用对PLAP的提取率影响越大,图2a为料液比和温度的交互作用,表面平缓,说明料液比与温度的交互作用对提取率影响较小,图2b、2c表面陡峭,说明提取时间和料液比交互作用、提取时间和NaOH浓度交互作用对提取率影响较大。
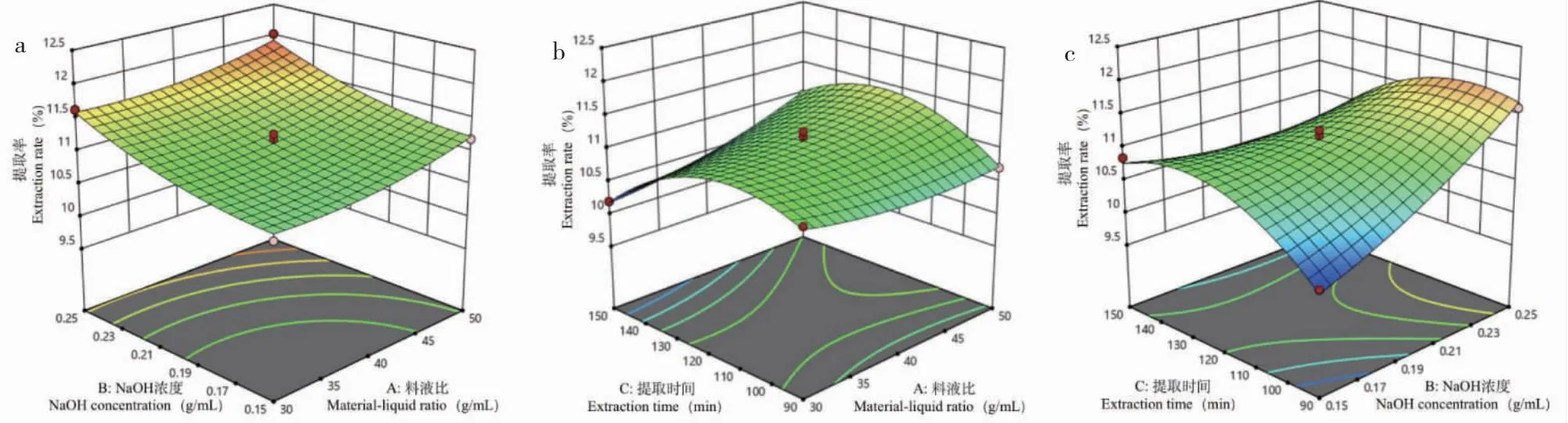
图2 各因素交互作用对PLAP提取率影响的响应面3D图
2.2.2 验证实验结果
响应面预测PLAP最佳提取条件为料液比1∶50 g/mL、NaOH浓度0.25 mmol/L、提取时间110.76 min时,理论上PLAP提取率最高为11.97%。按实际情况,将时间调整为110 min的条件下,经过三次重复性验证实验后,PLAP提取率平均值为11.80±0.50%,与理论值接近,模型值与理论值误差为0.17%拟合度较好,说明此模型可以用来预测PLAP的提取。
2.3 PLAP抗氧化活性测定结果
不同浓度的PLAP对DPPH自由基清除能力如图3a所示。由如图3a可知,PLAP具有一定的DPPH自由基清除能力,随着PLAP浓度的增加清除能力呈现缓慢增加的趋势。当浓度达5 mg/mL时,PLAP和Vc清除率分别为(15.18±1.03)%、(96.52±0.23)%,Vc清除率相比PLAP上升百分比为81.34%,PLAP远小于Vc的清除率,经过线性拟合,PLAP半数抑制浓度IC50值为12.38 mg/mL,低于Hu等[24]研究樱桃核多糖的DPPH自由基清除效果(IC50值0.31 mg/mL)。
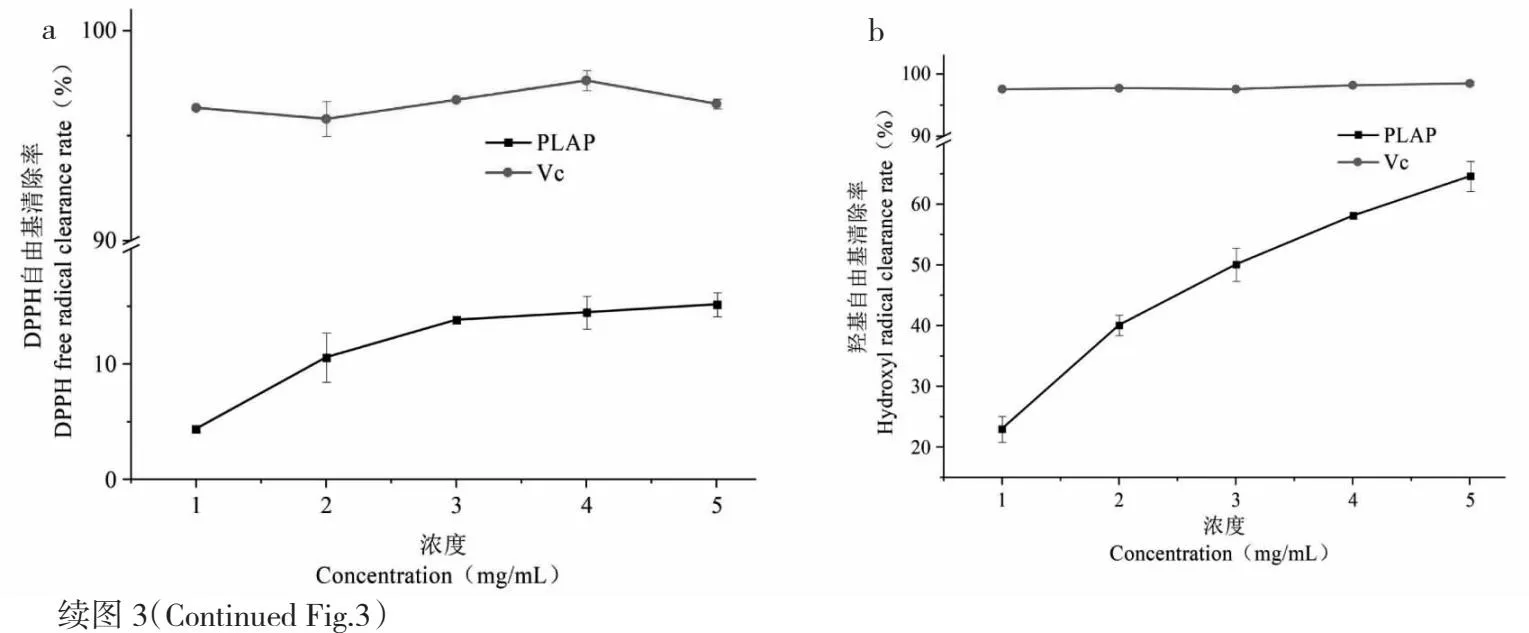
图3 PLAP对DPPH、羟基、ABTS自由基的清除能力及还原力活性
不同浓度的PLAP对羟基自由基清除能力如图3b所示。由如图3b可知,在1.0~5.0mg/mL的质量浓度范围内,随着浓度的增加,PLAP清除率呈现上升的趋势,当浓度为5 mg/mL时,Vc清除率为(98.48±0.31)%,PLAP清除率为(64.6±2.45)%,PLAP清除率与Vc相比下降百分比为33.88%,Vc清除效果优于PLAP,PLAP清除羟基自由基的IC50值为3.22 mg/mL,Feng等[25]研究海藻多糖的抗氧化活性,紫菜多糖羟基自由基清除率IC50值为26.59 mg/mL,PLAP优于紫菜多糖清除羟基自由基能力。
不同浓度的PLAP对ABTS自由基清除能力如图3c所示。由如图3c可知,在0.2~1.0 mg/mL的范围内,随着浓度的增加,清除效果明显增加,在浓度为1.0 mg/mL时,PLAP清除率为(97.87±1.11)%,Vc清除率为(99.36±0.11)%,此时清除率与Vc相接近,PLAP对ABTS自由基清除能力的IC50值为0.18 mg/mL。
不同浓度PLAP还原能力的强弱如图3d所示。由如图3d可知,PLAP随着浓度的增加,还原能力明显增加,在浓度5 mg/mL时,PLAP在700 nm处吸光度值为0.627。
2.4 PLAP抗肿瘤活性
2.4.1 A549和HepG2细胞增殖抑制率实验结果
PLAP对A549肺癌和HepG2细胞增殖抑制作用如图4a和4b所示,采用CCK-8法测定不同给药浓度下处理A549和HepG2细胞48 h的增殖抑制率,不同浓度的PLAP对A549和HepG2均有增殖抑制的效果,并且呈现剂量依赖性,PLAP对A549肺癌细胞在不同处理浓度下均有显著性差异(P<0.05);PLAP对HepG2肝癌细胞也均有显著性差异(P<0.05),在PLAP浓度为6 mg/mL时,对A549和HepG2细胞抑制率分别为(82.60±1.05)%和(77.37±1.48)%。
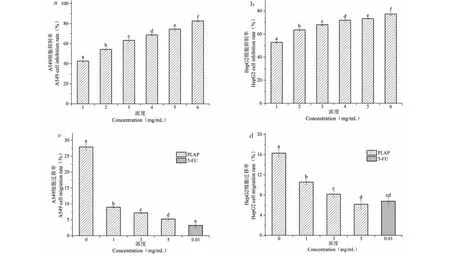
图4 PLAP对A549和HepG2细胞的增殖和迁移作用的影响
2.4.2 A549和HepG2细胞划痕实验结果
PLAP对A549肺癌和HepG2肝癌细胞划痕实验结果如图4c和4d所示,PLAP对A549和HepG2细胞有一定的抑制迁移效果,呈现剂量依赖性,不同剂量组的PLAP对A549肺癌细胞与空白相比较均有显著性差异(P<0.05),与阳性对照5-FU相比较具有显著性差异(P<0.05),说明不同浓度的PLAP有一定抑制迁移效果,但与阳性对照有一定差距;不同剂量组的PLAP对HepG2细胞与空白组相比较有显著性差异,说明PLAP可抑制HepG2细胞迁移,PLAP与5-FU相比较,当PLAP浓度为1 mg/mL具有显著性差异(P<0.05),当浓度为3和5 mg/mL时,无显著性差异。表明PLAP具有较好的抑制A549肺癌和HepG2肝癌细胞迁移效果。
3 讨论与结论
本实验以狐臭柴叶片通过酸提取法提取后残渣为原料,采用NaOH溶液为提取液,通过单因素和响应面实验得到PLAP的最佳提取工艺:液料比1∶50 g/mL、NaOH浓度为0.25 mmol/L、提取时间110 min、此条件下PLAP提取率为(11.80±0.50)%;PLAP的抗氧化能力较好,其中对ABTS自由基、羟基自由基、DPPH自由基的IC50值分别为0.18、3.22、12.38 mg/mL;抗肿瘤活性实验表明,PLAP对A549和HepG2细胞增殖具有一定抑制效果,均呈现明显剂量效应(P<0.05),PLAP对A549和HepG2细胞迁移抑制效果较好,与空白组对比,均有显著性差异;本研究使狐臭柴叶多糖资源利用达到最大化,狐臭柴经顺序提取得到的PLAP具有较高的生物活性,可为食品加工、医药领域的研究提供理论支撑。

