基于数据挖掘、网络药理学及实验验证探讨中药治疗变应性鼻炎的用药规律及相关药理分析
王笑雨,王 召,曹利华,贺红娟,王真真,李秀敏,苗明三*
1河南中医药大学中医药科学院,郑州 450046;2纽约医学院 微生物和免疫学科,纽约 10595
变应性鼻炎(allergic rhinitis,AR)又称过敏性鼻炎,在特应性个体暴露于致敏原后,由免疫球蛋白E (immunoglobulin E,IgE)介导的以炎性因子(组胺、白三烯、前列腺素和血小板活化因子等)释放、并由多种免疫活性细胞和免疫因子共同参与的鼻黏膜慢性非感染性炎症[1]。炎性因子对鼻局部黏膜产生水肿渗出刺激鼻感觉神经,从而产生阵发性及反复性鼻痒、打喷嚏、清水样涕等典型症状,也可伴有鼻塞、嗅觉减退、哮喘等症状[2]。AR除了过敏原以外,还与遗传因素、地区气候、空气污染、神经和精神因素、社会经济因素密切相关[3]。AR属于中医学“鼻鼽”的范畴,中医认为此病为内外因共同作用的结果,内因多为脏腑虚损、正气不足,外因多为风邪、寒邪或异气侵袭,邪正相搏,肺气不宣,发为鼻鼽[4]。临床上主要采用抗组胺药、鼻用糖皮质激素等治疗AR,但是长期使用疗效差,且易反复发作。中医则通过口服、鼻腔冲洗中药汤剂或穴位贴敷、中药熏蒸、雾化等方法治疗AR[5,6]。本文采用数据挖掘的方法分析中药治疗AR的用药规律,并运用网络药理学及体内药理学验证的方法对高频中药药对治疗AR的潜在作用机制进行预测和验证,为其临床治疗AR提供合理化参考和科学理论依据。
1 资料与方法
1.1 数据挖掘
1.1.1 数据来源
以中国知识资源总库(CNKI)、万方、维普三大数据库为数据来源,以“中药”、“变应性鼻炎”、“过敏性鼻炎”和“鼻鼽”为主题进行全文搜索,时间选取范围是2000年1月至2023年2月,共检索到9 442篇期刊文献。
1.1.2 纳入与排除标准
剔除实验研究、综述、联合用药、使用重复方剂、无具体药物组成等文献,排除加减方、序贯治疗方,舍去单味药机制研究的文献,仅选择中药复方治疗AR的临床研究文献共252篇。
1.1.3 数据处理
按照纳入与排除标准,最终筛选出符合标准的252首中药方剂,并录入Excel 2016处理,以此建立中药复方治疗AR的数据库。根据《中华人民共和国药典》(以下简称《中国药典》)2020版[7]和人卫版“十三五”规划教材《中药学》[8]上述中药名称、分类、性味归经及功效进行统一,如“川弓”“川穹”统一为“川芎”,“北芪”统一为“黄芪”,“白芥子”统一为“芥子”,“元胡”统一为“延胡索”,“辛夷花”“辛荑”统一为“辛夷”,“制附子”统一为“附子”,“苍耳”统一为“苍耳子”等。
1.1.4 统计分析
采用Excel 2016软件252首复方所含单味中药的药物类型、四气五味归经进行用药频次统计分析;采用IBM SPSS Modeler 18.0 软件对高频中药进行关联规则分析,挖掘单味中药间的潜在关联;利用GraphPad Prism 8.0软件对高频中药的用药剂量进行统计分析。使用IBM SPSS Statistics 23.0软件对高频中药进行系统聚类分析。
1.2 网络药理学
1.2.1 活性成分筛选及靶点预测
根据数据挖掘结果分析,将最高频药对组合作为研究对象,进行网络药理学分析。使用中药系统药理学数据库与分析平台(TCMSP数据库,http://tcmspw.com/tcmsp.php)及文献补充获取药对组合的化学成分,利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)和OpenBabel.2.4.1软件获取成分SMILES号,再通过TCMSP数据库、SwissTargetPrediction数据库(swisstargetprediction.ch/)、SEA数据库(sea.bkslab.org/)、PubChem数据库(pubchem.ncbi.nlm.nih.gov/)和DrugBank数据库(https://www.drugbank.com/)获取成分的靶点信息。
1.2.2 获取疾病靶点并构建“成分-靶点-疾病网络”
以“allergic rhinitis”作为关键词,从TTD数据库(db.idrblab.net/ttd/)、DisGeNet数据库(disgenet.org/)、GAD数据库(geneticassociationdb.nih.gov/)及DrugBank数据库中检索与AR相关发病机制靶点,合并、去重后与成分靶点取交集即得该药对组合治疗AR的潜在疾病靶点。利用Uniprot数据库对上述获取的成分靶点及疾病靶点进行基因名称标准化处理,利用Cytoscape 3.7.2软件构建“成分-靶点-疾病”可视化网络。
1.2.3 富集分析
利用Metascape数据库(https://metascape.org/gp/index.html#/main/step1)对潜在疾病靶点进行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)的富集分析,并通过微生信网站(http://www.bioinformatics.com.cn)进行可视化展示。
1.2.4 构建“成分-靶点-通路-疾病”网络
通过KEGG富集分析结果,分析关键通路、核心靶点蛋白及核心成分之间的关系,利用Cytoscape 3.7.2软件,构建“成分-靶点-通路-疾病”可视化网络。
1.2.5 分子对接
首先,通过“成分-靶点-通路-疾病”网络分析,选取度值 ≥ 5的靶点作为受体,通过PDB数据库(https://www.rcsb.org/)下载其分子结构,利用Pymol软件去水去残基,再使用Autodock软件加氢处理后另存为pdbqt文件。其次,从PubChem数据库下载核心成分的分子结构,通过Chem3D软件转换为mol2文件,再利用Autodock软件处理后另存为pdbqt文件。最后,使用Autodock Vina软件对蛋白受体与核心成分小分子配体进行分子对接结合能分析。根据分析结果,选择结合能最低的靶点蛋白-小分子配体复合物作为最优选择,进行分子对接可视化展示。
1.3 体内验证实验
1.3.1 实验动物
4~6周雌性Balb/c小鼠(合格证号:20230512Zbzz0619000975),体重16~18 g,共45只,采购自浙江维通利华实验动物技术有限公司(许可证号SCXK(浙)2019-0001),环境温度(21±2) ℃,环境相对湿度30%~70%,正式实验前适应性饲养7 d,给予自由饮食和交替12 h光照。小鼠适应良好,毛色健康,四肢及大小便正常,体重稳定增长。河南中医药大学实验动物福利伦理委员会已对本课题所涉及的动物实验予以批准(批准编号:DWLLGZR202303189)。
1.3.2 试剂及药品
豚草花粉(ragweed,RW)(批号:366782,美国Stallergenes Greer公司);免疫球蛋白E(immunoglobulin E,IgE)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白介素-6(interleukin 6,IL-6)、白介素-10(interleukin 10,IL-10)ELISA试剂盒(批号:3815-1H-6、3511-1A-20、3361-1A-6、3432-1A-6,瑞典Mabtech公司);组胺ELISA试剂盒(批号:MM-0548M1,江苏酶免实业有限公司);PAGE凝胶快速制备试剂盒(批号:03655300,上海雅酶生物医药科技有限公司);二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度试剂盒(批号:PC0020,北京索莱宝科技有限公司);小鼠GAPDH抗体(批号:AB0037,上海泊湾生物科技有限公司);前列腺素-内过氧化物合成酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、热休克蛋白(heat shock protein 90,HSP90)、诱导型一氧化氮合成酶(nitric oxide synthase 2,NOS2)抗体(批号:bs-10411R、bsm-61215M、bs-20601R,北京博奥森生物科技有限公司);氯雷他定片(loratadine,LT,批号:2106027,扬子江药业集团上海海尼药业有限公司)。
中药黄芪(批号:230603)和辛夷(批号:230601-2)购买于河南张仲景大药房股份有限公司。参考《中国药典》2020版[7],黄芪:辛夷(3∶1)浸泡过夜后用75%乙醇加热回流三次,收集滤液用旋转蒸发仪减压浓缩,置于-20 ℃冷预冻过夜,随后在冷冻干燥机中进行冷冻干燥至恒质量,即得黄芪-辛夷醇提物,得率为30.44%。
1.3.3 造模及分组
将小鼠随机分为5组,每组9只:正常对照组(C)、模型组(M)、氯雷他定阳性对照组(1.7 mg/kg,LT),黄芪-辛夷醇提物高剂量组(3.04 g/kg,HQ-XYG),黄芪-辛夷醇提低剂量组(1.52 g/kg,HQ-XYD)。除C组外,其余各组小鼠在第1、8 d腹腔注射(i.p.)豚草花粉溶液Ⅱ(500 μL含200 μg RW和2.5 mg Alum的PBS溶液)各一次;第15、22、29~33 d,C组小鼠给予鼻腔滴注(i.n.)PBS 10 μL各一次,其余组小鼠给予鼻腔滴注(i.n.)豚草花粉溶液Ⅱ(10 μL含500 μg RW的PBS溶液)各一次;第15 d开始,各给药组灌胃给予相应剂量的相应药物,C组和M组以相同给药方式给予0.9%生理盐水,共给药18 d。
1.3.4 指标检测
1.3.4.1 小鼠行为学观察
从造模开始的第29~33 d,每次豚草花粉鼻腔激发及给药后,立刻观察并记录各组小鼠15 min内小鼠挠鼻次数和打喷嚏次数。
1.3.4.2 ELISA法检测小鼠血浆中组胺的水平
小鼠末次激发后眼球取血1~2滴置于EDTA抗凝离心管中,将全血与抗凝剂充分混合,4 ℃、10 800 r/min离心20 min,取上清液即为血浆,利用ELISA法检测血浆中组胺含量,详细操作步骤参照试剂盒说明。
1.3.4.3 ELISA法检测小鼠血清中总IgE、RW特异性IgE、TNF-α和IL-10水平
小鼠末次激发后眼球取血,室温下静置2 h,4 ℃、10 800 r/min离心20 min,取上清液即为血清,利用ELISA法检测血清中总IgE、RW特异性IgE、TNF-α和IL-10水平,详细操作步骤参照试剂盒说明书。
1.3.4.4 ELISA法检测小鼠肺泡灌洗液和鼻腔灌洗液中TNF-α、IL-6和IL-10水平
小鼠末次激发处死后,解剖暴露气管,分别用1 mL无菌生理盐水分三次灌洗肺部和冲洗小鼠前鼻腔,分别得肺泡灌洗液和鼻腔灌洗液,并于4 ℃ 3 000 r/min离心5 min,取上清于-20 ℃冻存。利用ELISA法检测肺小鼠泡灌洗液和鼻腔灌洗液中TNF-α、IL-6和IL-10水平,详细操作步骤参照试剂盒说明书。
1.3.4.5 免疫印迹法检测肺组织中PTGS2、HSP90和NOS2蛋白表达
每组随机取3只小鼠肺组织,按照15 mg/μL加入组织裂解液进行总蛋白的提取,使用BCA试剂盒检测总蛋白含量。通过上样、聚丙烯酰胺凝胶电泳、PVDF转膜、脱脂奶粉封闭后,加入按比例稀释后的一抗PTGS2、HSP90、NOS2和GAPDH抗体,4 ℃下孵育过夜;TBST溶液清洗3次后,加入稀释后的HRP标记的羊抗兔二抗摇床孵育1 h,洗膜3次后使用超灵敏发光检测试剂盒显色后显影,利用Image J软件分析条带灰度值。
1.3.4.6 统计学分析
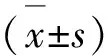
2 结果
2.1 数据挖掘
2.1.1 单味药用药频次分析
将录入的252首中药方剂中的全部中药进行排序,统计得出共有223味中药,累计频率2 473次,其中用药频次 ≥ 30的高频中药共21种,累计出现1 598次,占比64.62%,其中以辛夷、黄芪、防风、甘草、苍耳子等的使用频次相对较高(见表1)。
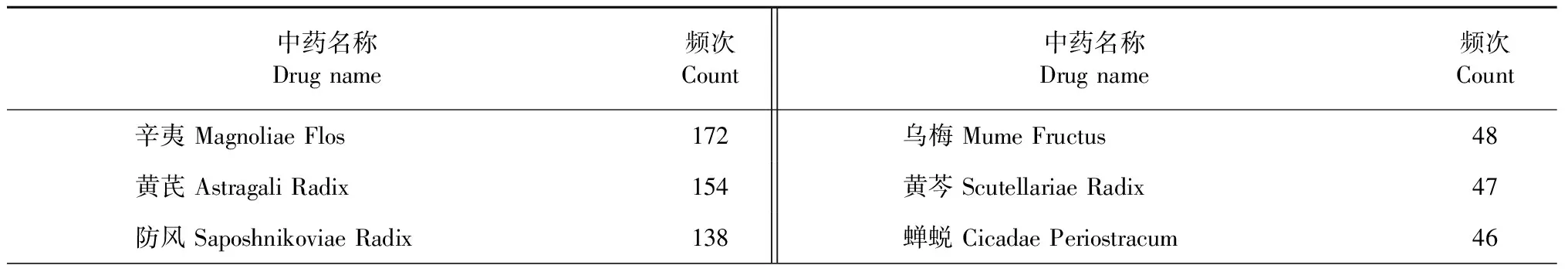
表1 频次 ≥ 30的单味中药
2.1.2 高频中药性味分析
依据《中国药典》2020年版和《中药学》分类标准,对纳入标准的高频中药(用药频次 ≥ 30)进行性味的统计分析。将同一味中药的不同性味分别统计入内。统计结果表明,药味涉及辛(868次,38.70%),甘(767次,34.20%),苦(309次,13.78%),酸(129次,5.75%),微苦(49次,2.18%),涩(48次,2.14%),淡(40次,1.78%)和咸(33次,1.47%),见图1A;药性涉及温(852次,53.32%),微温(292次,18.27%),平(254次,15.89%)寒(126次,7.88%),凉(44次,2.75%)和微寒(30次,1.88%),结果见图1B。
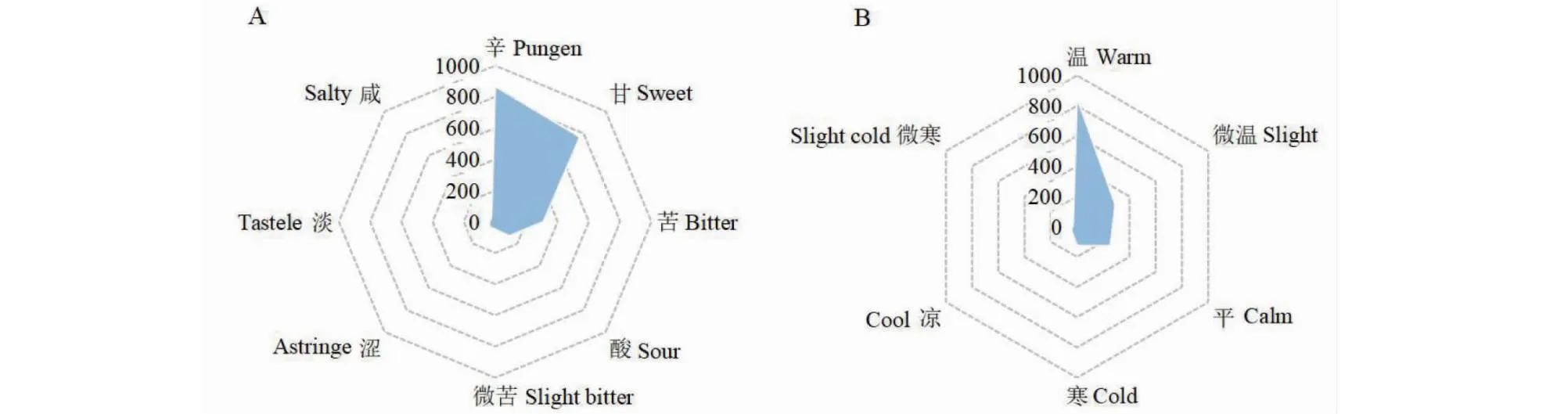
图1 中药治疗AR单味药药味(A)及药性(B)分析
2.1.3 高频中药归经分析
依据《中国药典》2020年版和《中药学》分类标准,对纳入标准的高频中药(用药频次 ≥ 30)进行归经的统计分析。将同一味中药的不同归经分别统计入内。统计结果显示,高频中药归经涉及肺(1 242次,29.86%)、脾(771次,18.53%)、胃(522次,12.55%)、心(390次,9.38%)、肝(379次,9.11%)、膀胱(277次,6.66%)、肾(204次,4.90%)、大肠(201次,4.83%)、胆(87次,2.09%)、小肠(47次,1.13%)和心包(40次,0.96%)(见表2)。
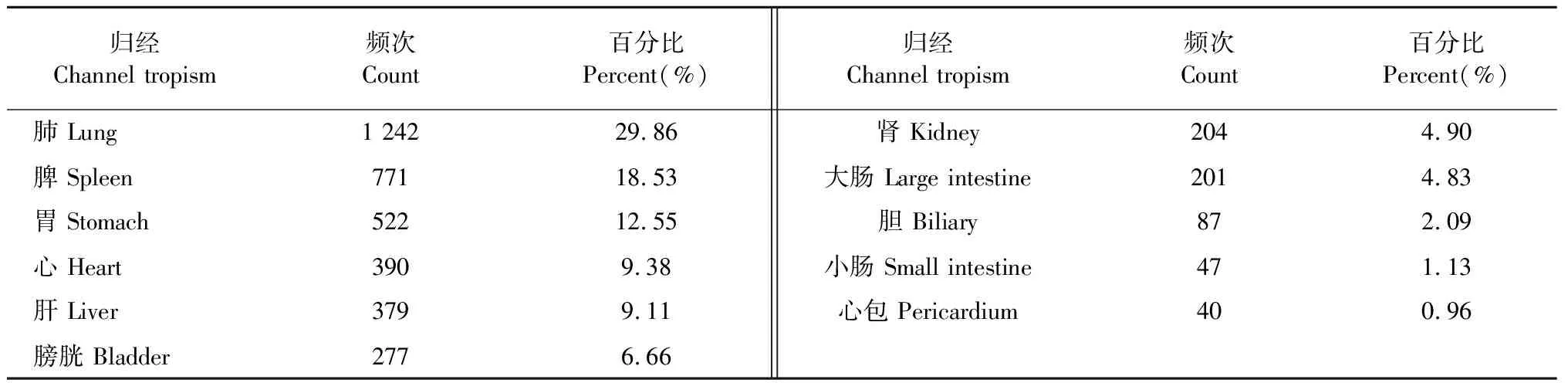
表2 中药治疗AR单味药归经分析
2.1.4 高频中药功效分析
将21味高频中药(用药频次 ≥ 30)参考《中药学》进行功效分类规范,共涵盖了9种功效分类,涉及解表药(725次,45.37%)、补虚药(465,29.10%)、祛风湿药(117次,7.32%)、收涩药(99次,6.20%)、清热药(47次,2.94%)、活血化瘀药(40次,2.5%)、利水渗湿药(40次,2.5%)、平肝熄风药(33次,2.07%)和化痰止咳平喘药(32次,2%)(见图2)。
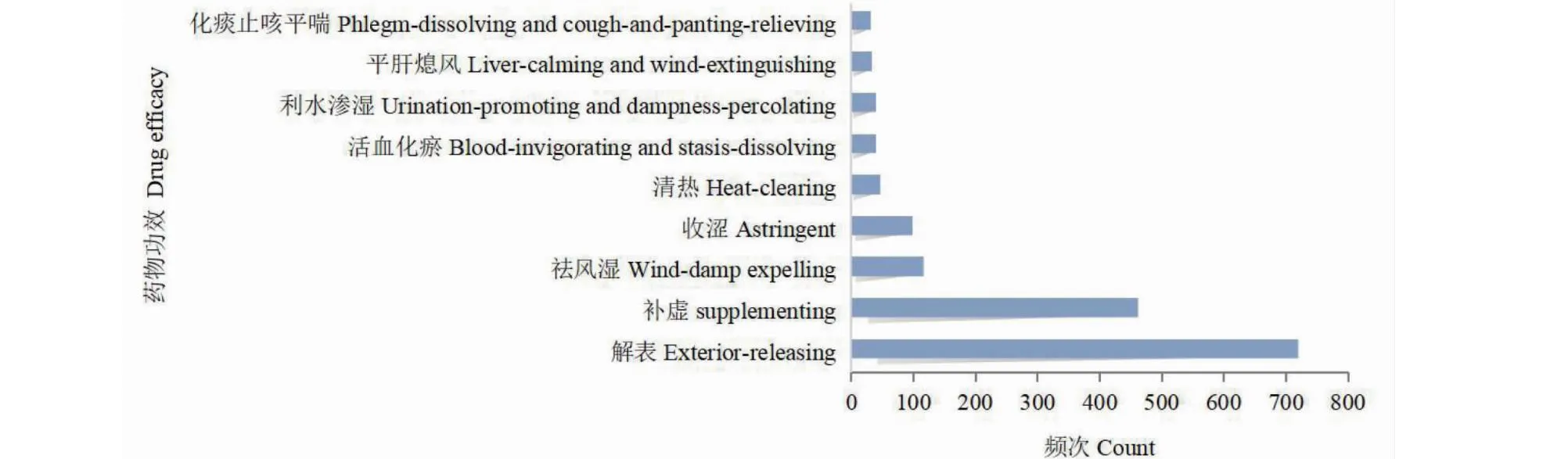
图2 中药治疗AR功效分析
2.1.5 高频中药关联规则分析
使用IBM SPSS Modeler 18.0软件对高频中药(用药频次 ≥ 30)进行关联规则分析,建立“数据→类型→网络”的关联规则数据流,设置“弱链接上限”为15,“强链接下限”为45,得到频数 ≥ 60的药物组合21种(见表3),并将高频中药间的关联网络图进行可视化展示(见图3)。设置支持度为12%,置信度为95%,提升度 ≥ 1,最大前项数为5,利用Apriori建模进一步挖掘个高频中药之间的配伍关系,结果得到11对核心药物组合(见表4)。
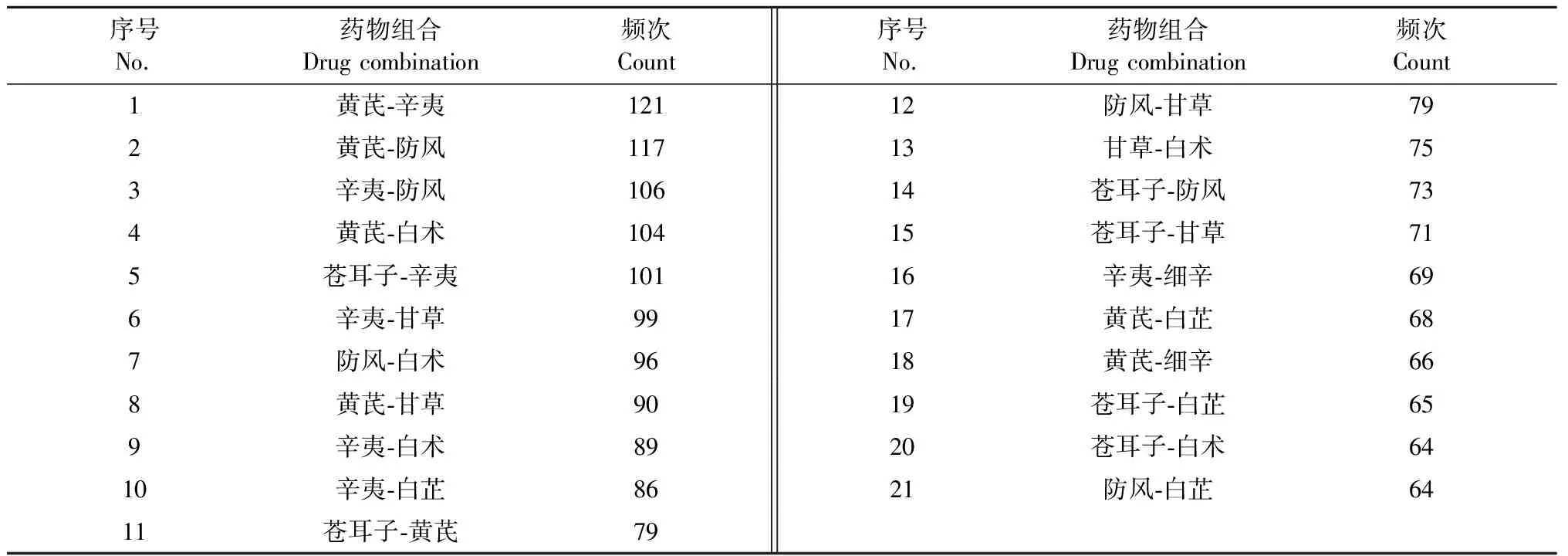
表3 中药方剂中频次 ≥ 60的药物组合
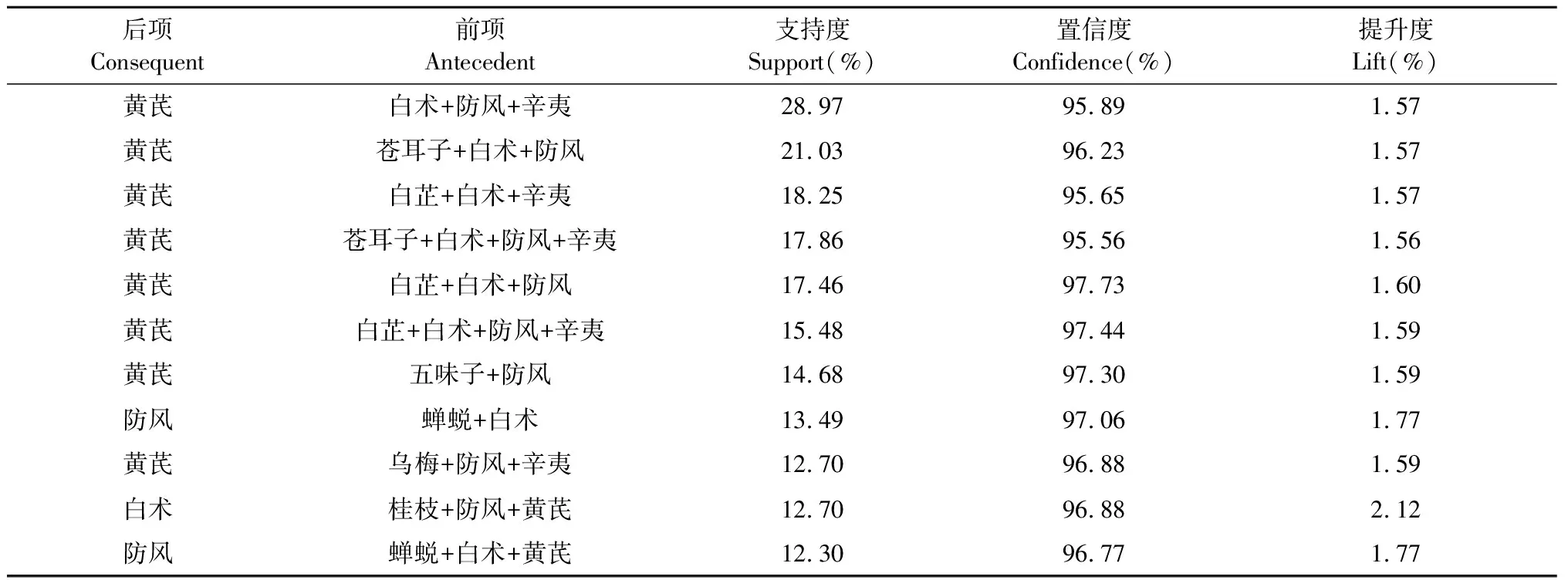
表4 高频中药治疗AR关联规则分析
2.1.6 高频中药剂量分析
利用Graphpad Prism 8.0软件对21味高频中药(用药频次 ≥ 30)进行剂量统计分析。结果显示在高频药物剂量使用中,常用剂量除五味子、蝉蜕和薄荷超出外,其余高频药物均在《中国药典》规定用量范围之内,详见图4。图中以药物中文名称首字母缩写代表相应中药。
2.1.7 高频中药治疗AR聚类分析
利用IBM SPSS Statistics 23.0软件对21味高频中药(用药频次 ≥ 30)进行“瓦尔德”聚类分析。取类间距离18,将药物分为四类,聚一类:1组(黄芪、白术、防风、甘草、茯苓、党参),2组(乌梅、蝉蜕、地龙),3组(桂枝、白芍、五味子);聚二类:辛夷、苍耳子、白芷、薄荷、黄芩、川芎;聚三类:细辛、芥子;聚四类:麻黄,详见图5。

图5 中药治疗AR聚类分析
2.2 网络药理分析
根据数据挖掘结果显示,黄芪-辛夷(HQ-XY)药对是中药临床治疗AR使用频率最高的药物组合,出现频次为121次,为进一步探讨黄芪-辛夷药对治疗AR的分子作用机制,现运用网络药理学、分子对接等手段进行深层次分析。
2.2.1 黄芪-辛夷药对活性成分筛选及靶点预测
使用TCMSP数据库获取黄芪和辛夷的活性成分,并按照药动学参数(ADME)进行筛选,设置筛选标准为:口服生物利用度(oral bioavailability,OB)≥ 30%,类药性(drug-likeness,DL)≥ 0.18,并进一步通过文献补充未纳入的主要成分,共得到黄芪活性成分24个,辛夷活性成分24个,合并后共得到48个活性成分,相关信息详见表5。其中,黄芪异黄烷苷、毛蕊异黄酮、芒柄花黄素等是中药黄芪代表性成分,木脂素、玉兰花碱、辛夷脂素等为中药辛夷代表性成分。通过TCMSP、SwissTargetPrediction、SEA、PubChem和DrugBank数据库获取上述活性成分的靶点信息,合并、去重后共得到306个可能的活性靶点。
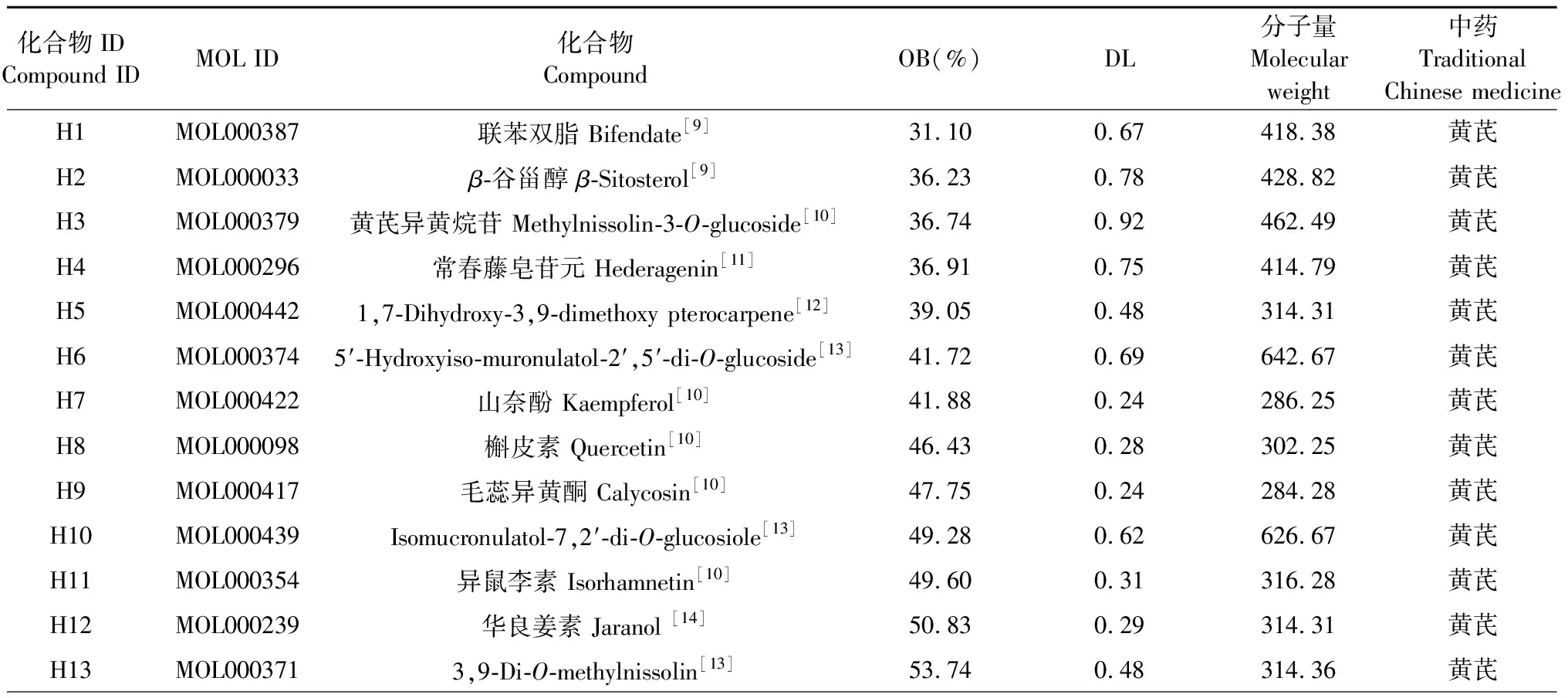
表5 黄芪-辛夷药对的活性成分
2.2.2 获取AR疾病靶点并“成分-靶点-疾病”网络的构建
从TTD、DisGeNet、GAD及DrugBank数据库中检索与AR相关发病机制靶点,合并、去重后得到AR疾病靶点321个。将306个黄芪-辛夷成分靶点和321个疾病靶点取交集得到63个黄芪-辛夷药对治疗AR的潜在疾病靶点。利用Uniprot数据库对上述获取的成分靶点及疾病靶点进行基因名称标准化处理,利用Cytoscape 3.7.2,软件构建“成分-靶点-疾病”可视化网络,详见图6。该网络包含35个活性成分节点,63个靶点蛋白节点和347条边(注:有13个活性成分未找到对应靶点,故网络中只显示35个有效成分节点)。
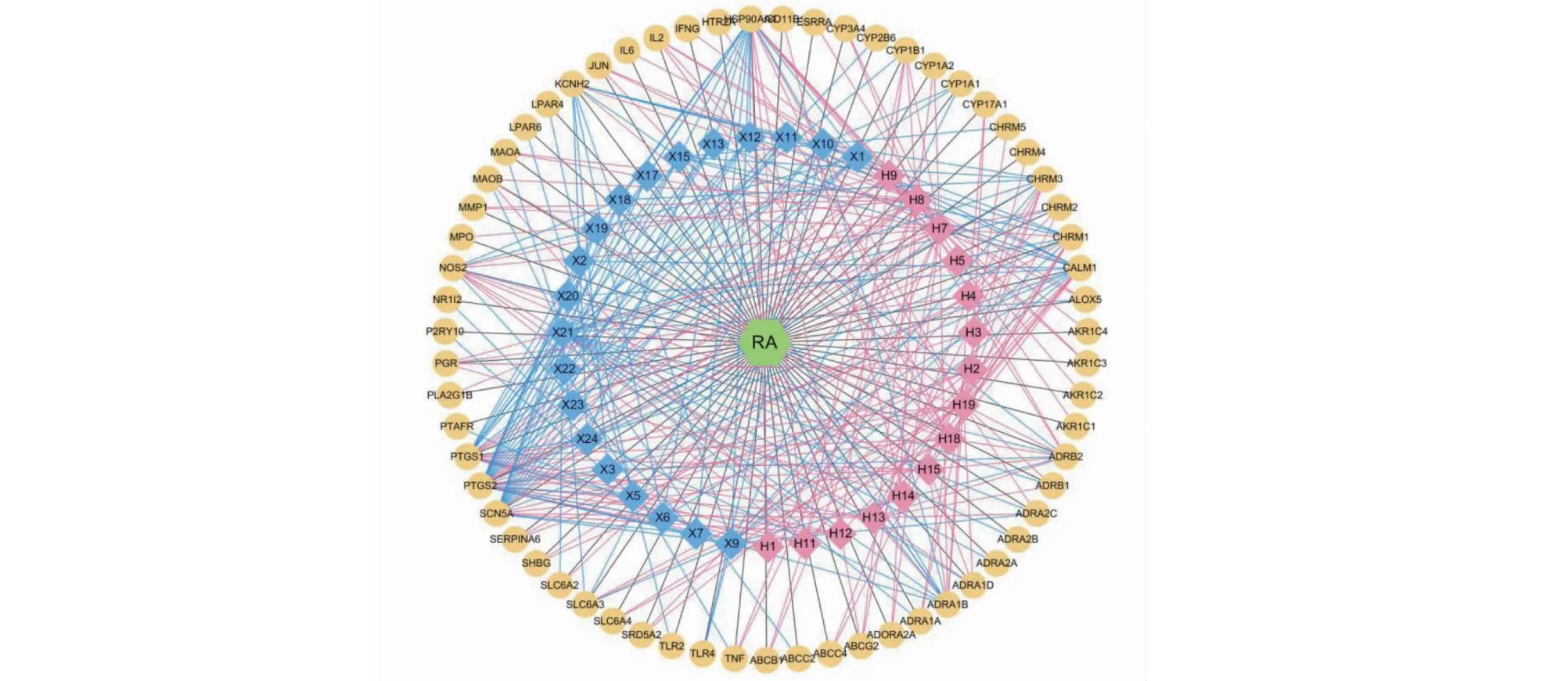
图6 黄芪-辛夷药对治疗AR的“成分-靶点-疾病”网络
2.2.3 GO基因功能富集分析和KEGG通路富集分析
将63个潜在作用靶点在线导入Metascape网站,限定物种为人,设定阈值为P<0.05,进行GO和KEGG富集分析。
在GO分析富集中,共得到生物过程(biological progress,BP)条目共656个,细胞组分(cellular components,CC)条目36个,分子功能(molecular functions,MF)条目共122个。GO分析结果表明,相关靶点主要涉及对外源性刺激的反应(response to xenobiotic stimulus)、血液循环调节(regulation of blood circulation)、血管直径维持(blood vessel diameter maintenance)以及管径调节功能(regulation of tube diameter)等生物过程,参与G蛋白偶联胺受体活性(G protein-coupled amine receptor activity)、氧化还原酶活性(oxidoreductase activity)、肾上腺素受体活性(adrenergic receptor activity)和血红素结合(heme binding)等分子功能,与膜筏(membrane raft)、膜微区(membrane microdomain)、突触膜(synaptic membrane)、顶端质膜外侧(external side of apical plasma membrane)及等离子体膜筏(plasma membrane raft)等细胞组分密切相关。筛选BP、CC、MF的前10位做成柱状图(见图7A)进行展示。
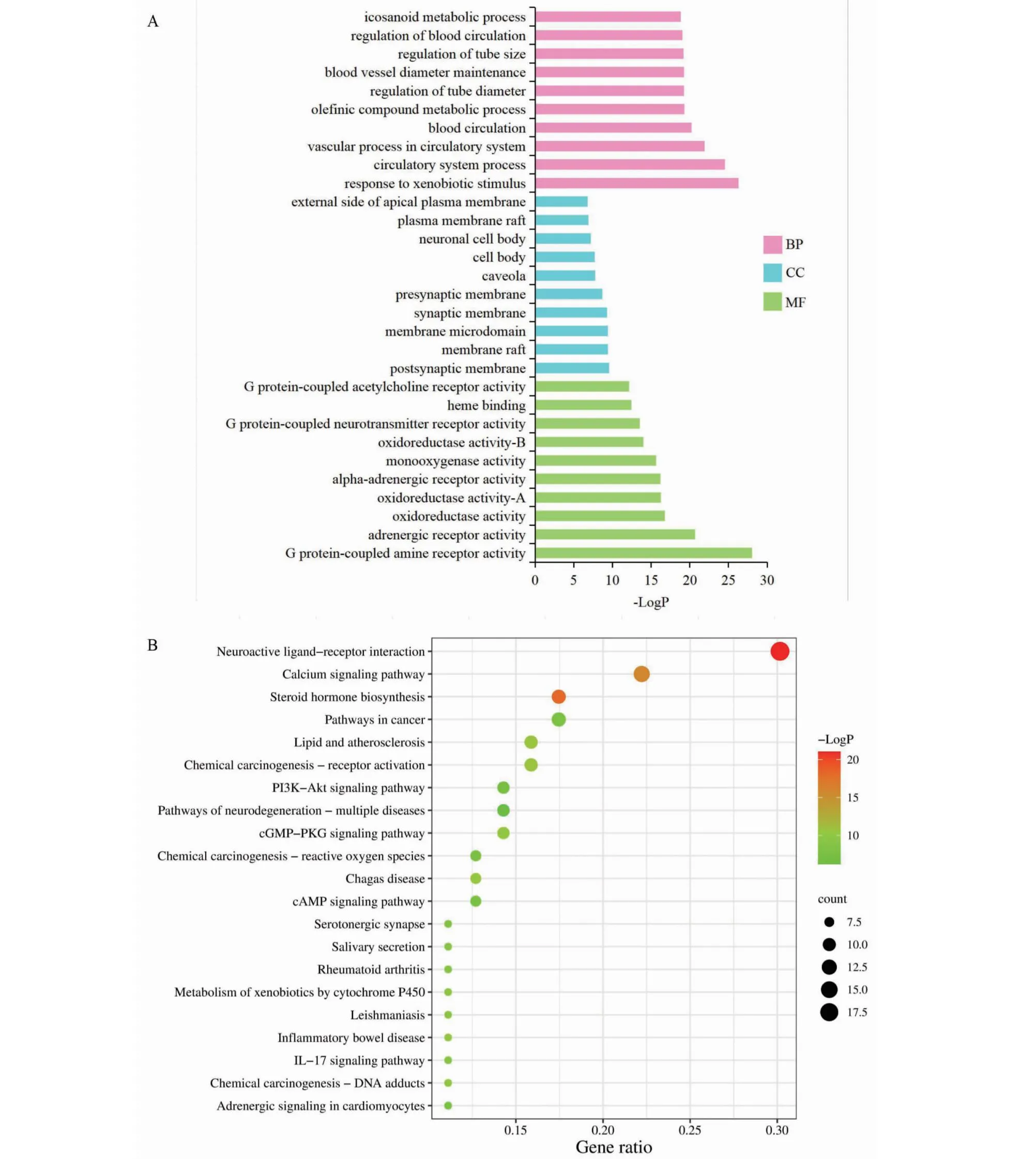
图7 黄芪-辛夷药对治疗AR核心靶点的GO基因功能富集分析(A)和KEGG通路富集分析(B)
KEGG富集分析P<0.05的目录有92个,将显著性最高的前20个通路做成气泡图(见图7B)进行展示。结果表明,辛夷-黄芪药对治疗AR的主要靶点重点涉及神经活性配体-受体相互作用通路(neuroactive ligand-receptor interaction)、钙离子信号通道(calcium signaling pathway)、类固醇激素生物合成通路(steroid hormone biosynthesis)、癌症通路(pathways in cancer)、脂质与生物合成通路(lipid and atherosclerosis)、化学致癌-受体活化通路(chemical carcinogenesis-receptor activation)和cAMP信号通路等信号通路(cAMP signaling pathway)等。
2.2.4 构建“成分-靶点-通路-疾病”网络
通过KEGG富集分析发现,有四个关键通路的潜在靶点蛋白个数超过10个,分别是神经活性配体-受体相互作用通路(P1,19个)、钙离子信号通道(P2,14个)、类固醇激素生物合成通路(P3,11个)和癌症通路(P4,11个);四条关键通路共涉及39个关键靶点蛋白和34个活性成分,利用Cytoscape 3.7.2软件,构建“成分-靶点-通路-疾病”可视化网络(见图8),图中节点大小和颜色深浅与网络中的靶点度值呈正相关。结果显示,黄芪-辛夷药对活性成分主要通过作用于PTGS2、HSP90AA1、CALM1、NOS2、ADRA1B、CHRM1、ADRB2、CHRM3、CYP1B1等靶点调控上述四条通路实现对AR的治疗作用。
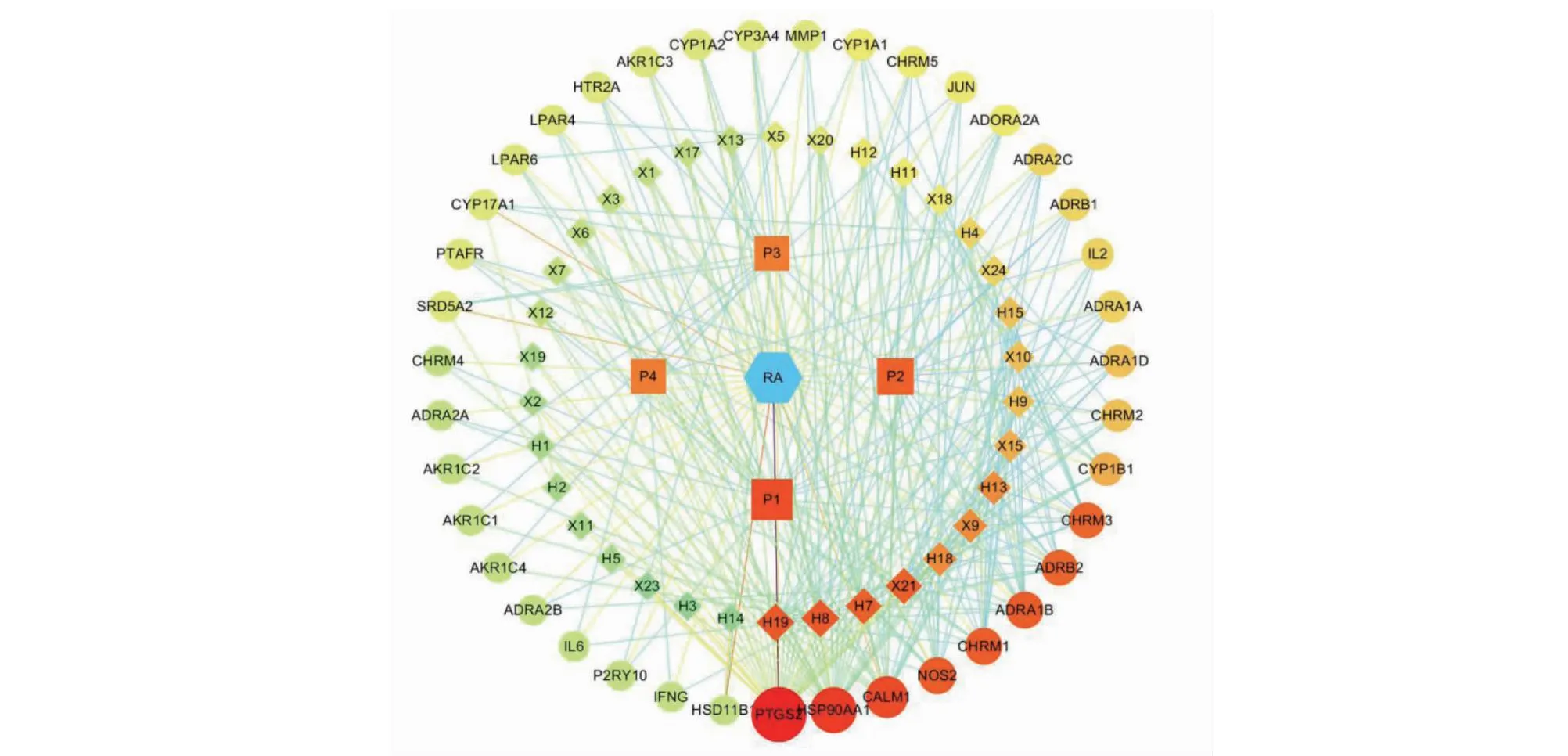
图8 黄芪-辛夷药对“成分-靶点-通路-疾病”网络
2.2.5 分子对接验证
分析四条关键通路、39个潜在靶点蛋白(度值 ≥ 8)及34个对应化合物的相互关系(见表6),选择度值较高的PTGS2(P4)、CHRM1(P1,2)、CYP1B1(P3)代表四条关键通路,与相应化合物进行分子对接结合能分析,结果见图9。根据结合能越低活性分子与靶点蛋白结合稳定性越高、结合能力越强的原则,因此选择结合能最小的PTGS2-X2(-10.2 kcal/mol)、PTGS2-H18(-9.5 kcal/mol)、CHRM1-H7(-9.2 kcal/mol)、CYP1B1-H8(-10.5 kcal/mol)和CYP1B1-H7(-9.9 kcal/mol)进行分子对接可视化展示,如图10结果显示黄芪-辛夷药对中的活性成分山柰酚、槲皮素、芒柄花黄素和细辛素在治疗AR中发挥重要作用。
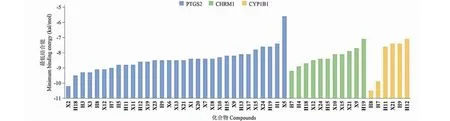
图9 核心靶点和相应化合物的最低结合能
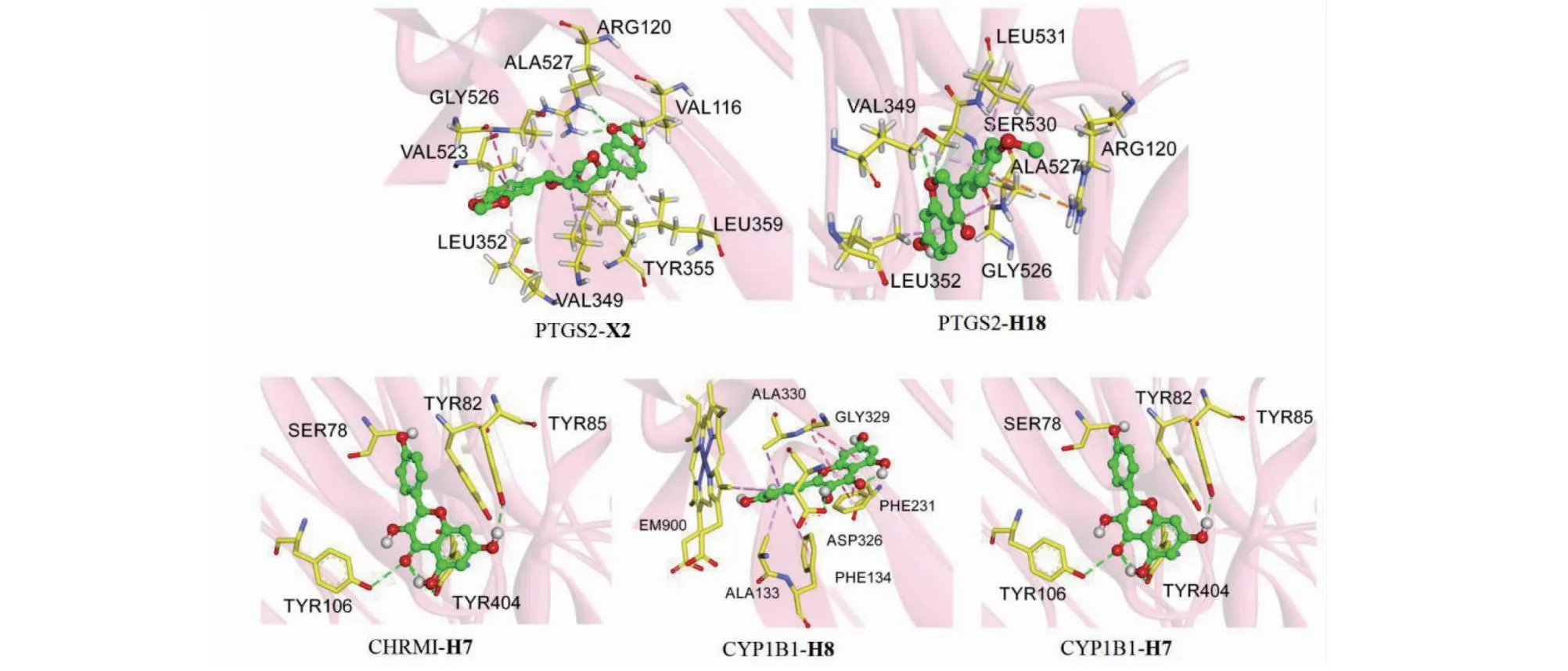
图10 分子对接模式
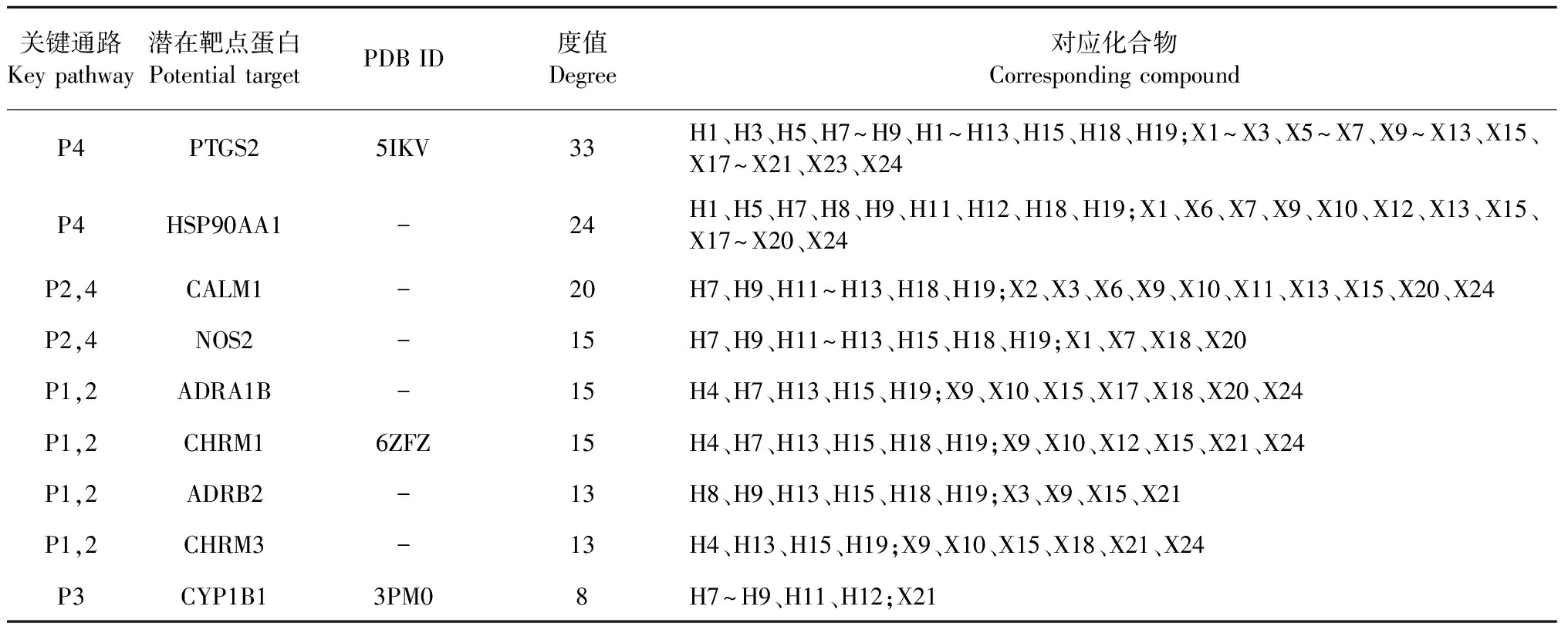
表6 关键通路、潜在靶点蛋白及有效化合物的关系表格
2.3 体内实验验证
2.3.1 各组小鼠AR症状观察及比较
观察连续鼻腔激发5 d的小鼠行为学变化:与C组相比,M组小鼠的挠鼻和喷嚏次数呈现显著增加趋势、并在末次激发后达到最高峰(平均挠鼻64.2次、喷嚏16次);LT组小鼠挠鼻和喷嚏次数在连续激发的第2~3 d有所增加、但第4~5 d呈现明显下降趋势并在第5 d达到与对照组相当的水平(平均挠鼻21.8次、喷嚏0.8次);HQ-XYG组小鼠的喷嚏和挠鼻次数一直稳定保持在与对照组相当的水平(平均挠鼻15.6次、1.8次);HQ-XYD组小鼠的挠鼻和喷嚏次数分别在第2 d和第3 d呈现一个小高峰,但整体水平相比模型组呈现被抑制状态,最后一天的挠鼻和喷嚏次数呈现较低水平(平均挠鼻26.4次、喷嚏6.4次),详见图11。
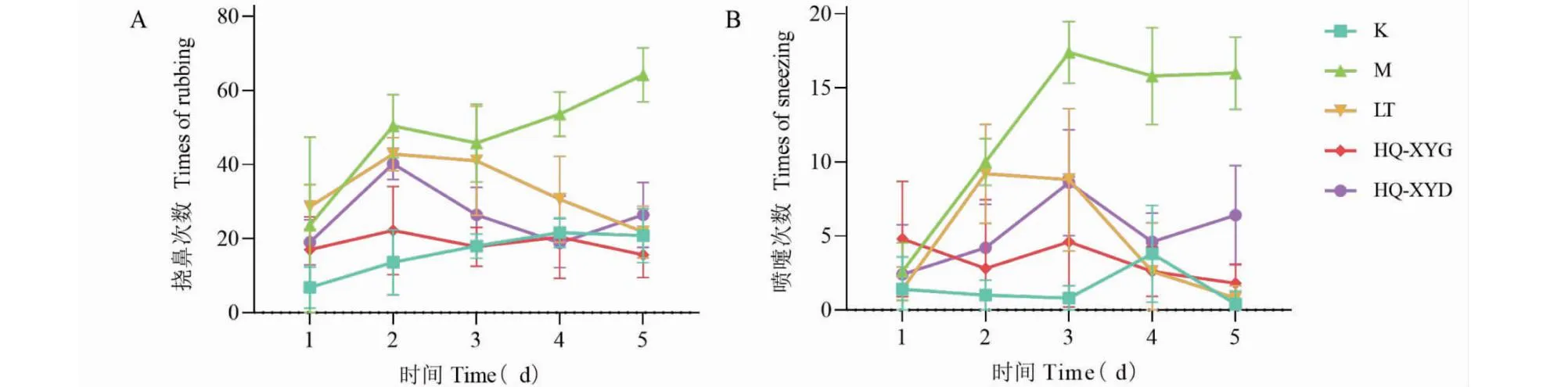
图11 连续5 d每次激发后15 min内各组小鼠行为学观察
2.3.2 各组小鼠血浆中组胺水平比较
与C组小鼠比较,M组小鼠血浆中组胺水平显著上升(P<0.001)。与M组比较,LT组、HQ-XYG组和HQ-XYD组小鼠血浆中组胺水平显著下降(P<0.001,P<0.01),详见图12。
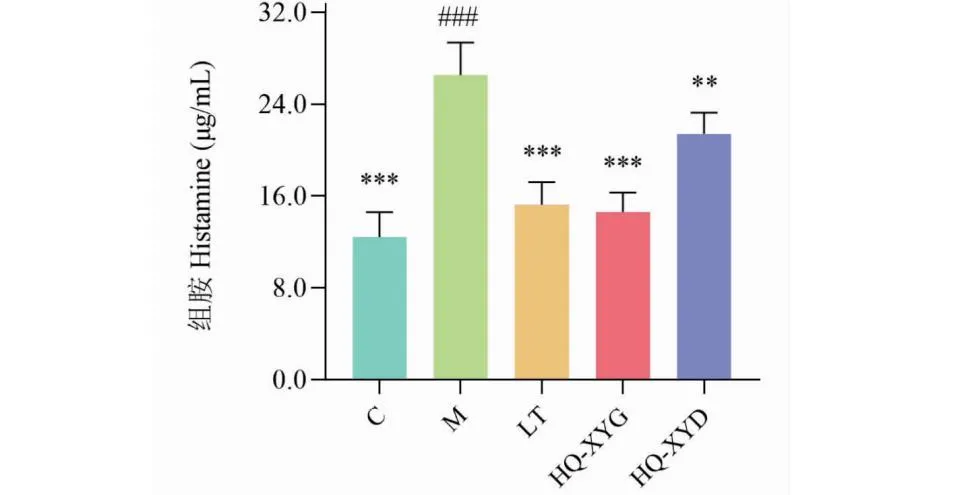
图12 各组小鼠血浆中组胺水平比较
2.3.3 各组小鼠血清中IgE、RW特异性IgE、TNF-α、IL-6和IL-10水平比较
与C组小鼠比较,M组小鼠血清中总IgE、RW特异性IgE、TNF-α水平显著上升(P<0.001),IL-10水平显著下降(P<0.001)。与M组相比,LT组、HQ-XYG组和HQ-XYD组小鼠血清中总IgE、RW特异性IgE、TNF-α水平显著下降(P<0.001),IL-10 水平显著上升(P<0.01,P<0.001)(见图13)。
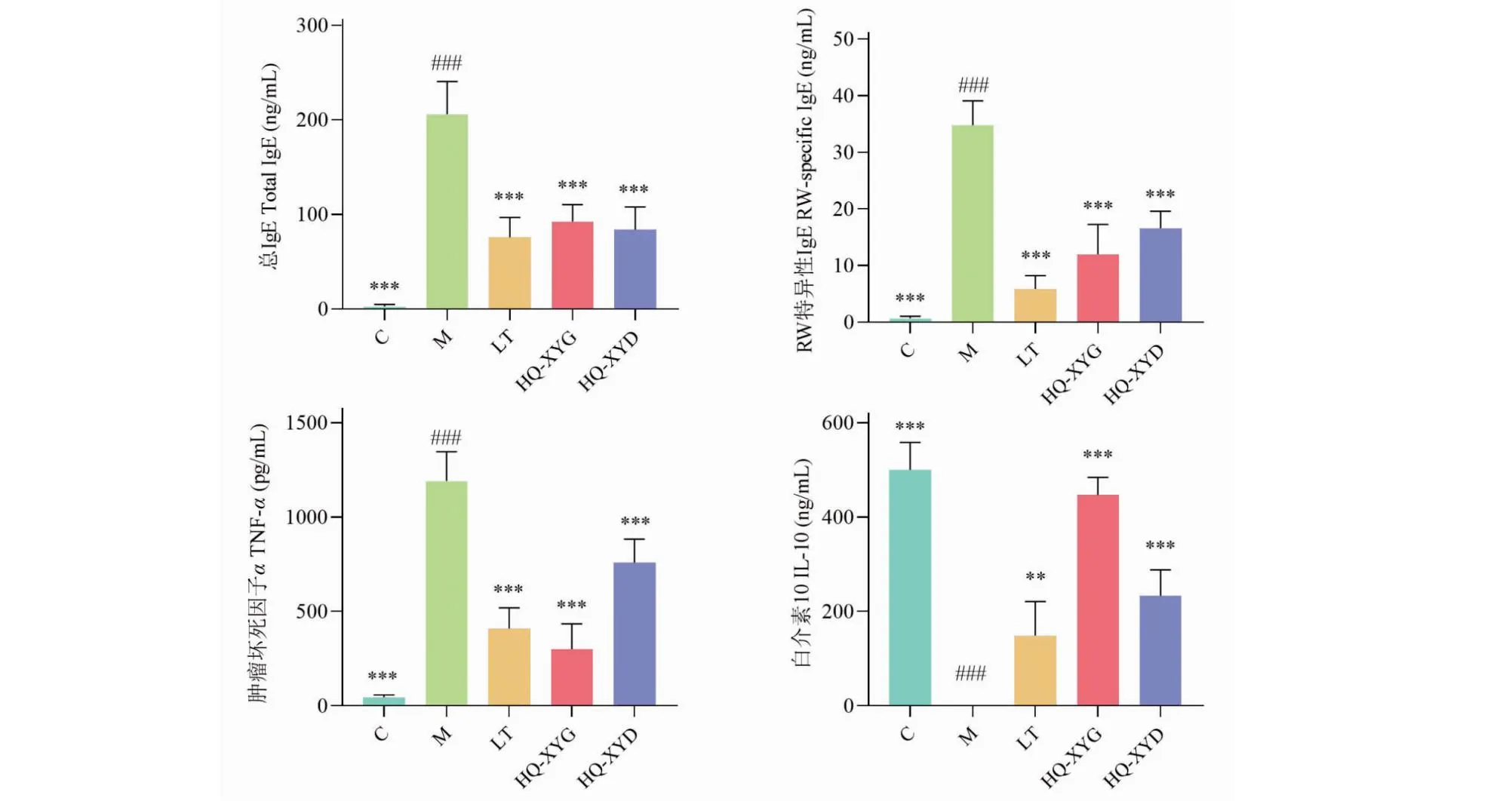
图13 各组小鼠血清中总IgE、RW特异性IgE、TNF-α、IL-6和IL-10水平比较。
2.3.4 各组小鼠肺泡灌洗液及鼻腔灌洗液中TNF-α、IL-6和IL-10水平
与C组小鼠比较,M组小鼠肺泡灌洗液和鼻腔灌洗液中TNF-α和IL-6水平显著上升(P<0.001),IL-10水平显著下降(P<0.05,P<0.01)。与M组小鼠比较,LT组、HQ-XYG组和HQ-XYD组小鼠肺泡灌洗液和鼻腔灌洗液中TNF-α和IL-6水平显著下降(P<0.01,P<0.001),LT组和HQ-XYG组小鼠肺泡灌洗液和鼻腔灌洗液中IL-10水平显著上升(P<0.05,P<0.01,P<0.001),HQ-XYD组小鼠肺泡灌洗液和鼻腔灌洗液中IL-10水平差异无统计学意义,详见图14和图15。
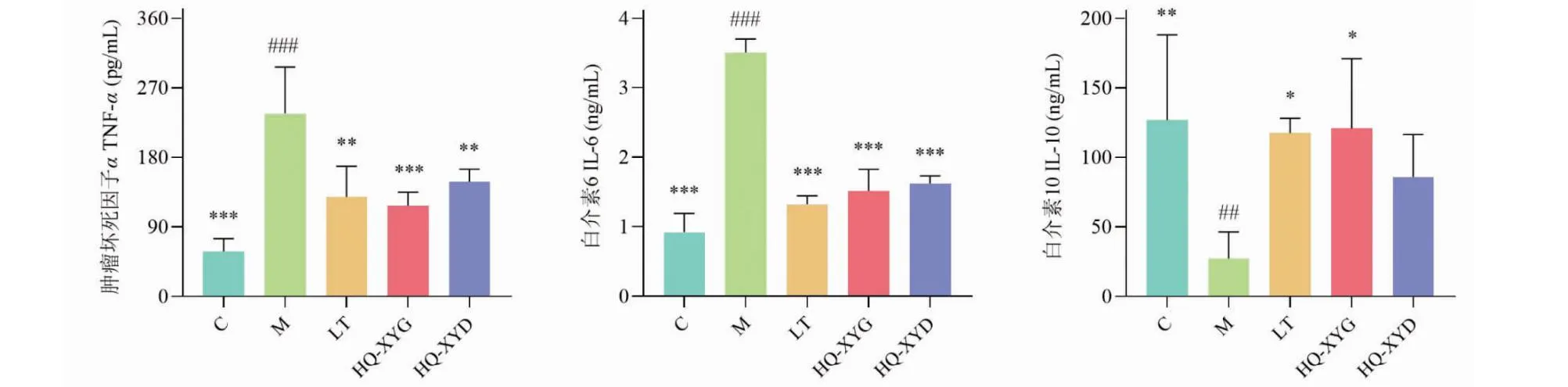
图14 各组小鼠肺泡灌洗液中TNF-α、IL-6和IL-10水平比较。

图15 各组小鼠鼻腔灌洗液中TNF-α、IL-6和IL-10水平比较。
2.3.5 各组小鼠肺组织中PTGS2、HSP90和NOS2蛋白表达比较
与C组小鼠比较,M组小鼠肺组织中PTGS2、HSP90和NOS2的蛋白表达水平显著升高(P<0.01)。与M组小鼠比较,LT组和HQ-XYG组小鼠肺组织中PTGS2、HSP90和NOS2蛋白表达水平显著下降(P<0.05,P<0.01,P<0.001),HQ-XYD组小鼠肺组织中NOS2蛋白表达水平显著降低(P<0.001),HQ-XYD组小鼠肺组织中PTGS2和HSP90蛋白表达水平差异无统计学意义。详见图16和图17。
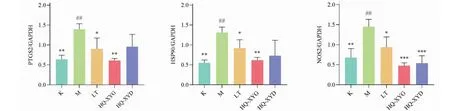
图16 各组小鼠肺组织中PTGS2、HSP90和NOS2蛋白表达水平比较。
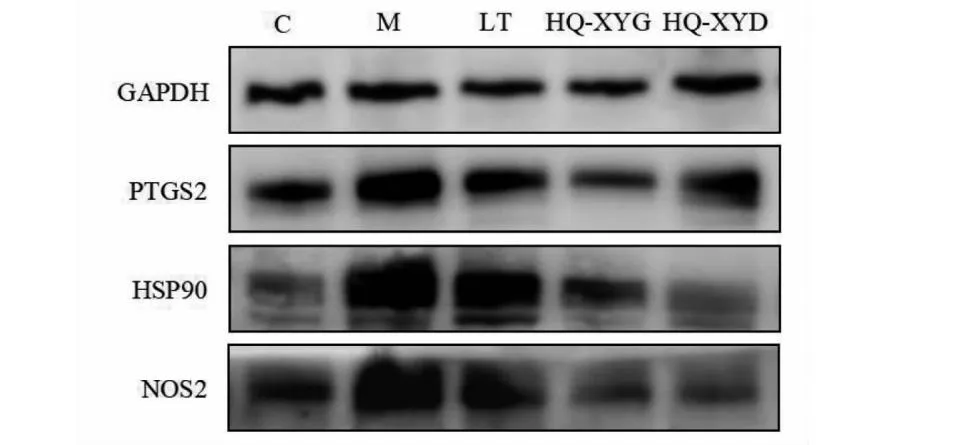
图17 各组小鼠肺组织中PTGS2、HSP90和NOS2蛋白表达水平比较
3 讨论与结论
治疗AR的中药用药频次分析中,使用频次最高的前五位中药为辛夷、黄芪、防风、甘草、苍耳子。辛夷作为用药频次最高的单味中药,性温,能散风寒、通鼻窍,主要成分为挥发油类、木脂素类及生物碱类化合物,具有保护黏膜、改善局部血液循环、抗炎、抗菌、抗过敏、抗氧化以及舒张平滑肌等广泛的药理作用[18]。辛夷常作为君药用于治疗各种鼻炎及鼻部疾病的药剂中,如辛夷鼻炎丸、鼻炎康片、鼻渊丸、通窍鼻炎颗粒、辛芳鼻炎胶囊、辛夷散、辛夷丸、辛夷膏、鼻窦灌注液等。李时珍在《本草纲目》[19]中也记载:“辛夷能温中,治头面目鼻九窍之病”。
经研究发现,在252首中药方剂中,药物分类主要以解表药(辛夷、防风、细辛、白芷、桂枝等)和补虚药(黄芪、甘草、白术、等)为主,药性大多集中于温,药味以辛、甘为主。温药具有温中祛寒、补火助阳的作用,辛味药能散风寒、行气血,甘味药有调和药性、补益和中的作用,药物归经多涉及肺经、脾经和肝经。综合分析,治疗AR的单味中药多为辛温解表药(辛夷、防风、苍耳子、细辛、白芷、桂枝等),主要用于恶寒发热、头痛、无汗、肢体酸痛、清涕、鼻塞、苔薄白、喉痒咳嗽、脉浮的风寒表现。
在关联规则分析中,支持度较高的核心药物组合为黄芪-白术-防风-辛夷、黄芪-苍耳子-白术-防风、黄芪-白芷-白术-辛夷、黄芪-苍耳子-白术-防风-辛夷、黄芪-白芷-白术-防风、黄芪-白芷-白术-防风-辛夷,由此可见,中药治疗AR多选用解表药、补虚药、祛风解湿药,符合中医对AR发病机制(肺气虚寒、脾气虚弱、肾阳亏虚以及风寒袭表)的理解。除五味子、蝉蜕和薄荷外,其余高频药物常用剂量均在《中国药典》规定用量范围内。
在聚类分析中,聚一类中药以补虚药和解表药为主,其中一组黄芪的主要活性成分黄芪多糖可以缓解AR喷嚏、挠鼻和流涕等症状,能够通过上调AR大鼠鼻黏膜组织中T-bet和IFN-γmRNA表达、下调GATA-3和IL-4 mRNA表达减轻AR大鼠鼻黏膜组织炎症情况[20],并能够降低血清IL-4、IL-6、IL-1β、IgE、TNF-α等炎性因子的水平促进AR的痊愈[21]。防风具有祛风解表、胜湿止痒的功效,防风多糖经体外实验证明有良好的抗过敏功效,防风醇提物能够通过降低体外细胞的PAR-2的表达发挥抗过敏作用[22]。桂枝具有发汗解肌,温通经脉,助阳化气,散外感风邪的功效。聚二类苍耳子有散风寒、通鼻窍、祛风湿之功效,用于风寒头痛、鼻塞流涕、鼻鼽、鼻渊、风湿瘙痒、湿痹拘挛;苍耳子正丁醇萃取部位能够缓解AR豚鼠的鼻黏膜炎症反应,降低白细胞数、嗜酸粒细胞百分比、血清SIgE水平[23];苍耳子水提物能够减轻AR豚鼠鼻黏膜脱落、组织水肿及炎症细胞浸润等症状,降低血清中炎性细胞因子IgE、IL-4和IFN-γ的表达水平[24]。
本文通过TCMSP数据库搜索及文献补充,共得到黄芪-辛夷药对中的有效成分共有48个,对应作用靶点306个,每个成分都多用于多个靶点,为进一步说明作用靶点与成分之间的关系,将成分靶点与疾病靶点取交集后构建“成分-靶点-疾病”网络,显示主要成分山柰酚、槲皮素与靶点关联度最高,可能是黄芪-辛夷治疗AR的关键成分,发挥重要的药理作用。有研究表明山柰酚能够通过改善肠道屏障的完整性降低肠道炎症的发生,且具有显著的抗高血糖、抗氧化作用[25];槲皮素能够通过抑制galectin-3和NLRP3的结合显著降低动脉粥样硬化性炎症[26]。进一步通过KEGG通路分析,发现神经活性配体-受体相互作用通路、钙离子信号通道、类固醇激素生物合成通路和癌症通路是黄芪-辛夷抗AR的主要作用通路,涉及34个活性成分和39个核心靶点,通过分析“成分-靶点-通路-疾病”关系,我们发现PTGS2、HSP90、NOS2、CALM1、CHRM1、CYP1B1等是通路中起主要作用的靶点蛋白。PTGS2参与炎症或肿瘤等病理反应,是非甾体类抗炎药物的作用靶点,能够被促炎细胞因子和生长因子等高度诱惑分泌炎症因子,引发炎症反应[27]。HSP90是一种ATP依赖性分子伴侣,能够协助客户蛋白完成正确的空间折叠并参与细胞周期调节,有研究表明在机体生理应激状态下HSP90能够调控淋巴细胞的活化、促进淋巴细胞迁移至感染部位、促进局部炎性反应的发生[28]。NOS2是一种机体损伤后诱导表达的诱导型一氧化氮合成酶,能够利用一氧化氮的氧化应激作用参与机体的免疫调控和炎性反应。CALM1是一种钙调蛋白,CALM1过表达能异常激活细胞钙离子信号通道,最终引发机体炎症反应和一定程度的肝脏损伤。CHRM1是一种副交感神经受体,有研究表明CHRM1激动剂能够通过增强细胞钙离子活性调控神经元分化[29],在分子对接验证中与山柰酚结合能低、可通过调控激活钙离子通道引发细胞炎症因子的释放。CYP1B1是类固醇激素合成通路的主要参与蛋白,类固醇激素具有显著的抗炎抗过敏等免疫调控作用,在分子对接验证中与槲皮素和山柰酚有良好稳定的结合能力。通过上述分析可以看出,黄芪-辛夷中主要成分可能通过PTGS2、HSP90、NOS2、CALM1、CHRM1、CYP1B1等靶点作用于神经活性配体-受体相互作用通路、钙离子信号通道、类固醇激素生物合成通路和癌症通路发挥治疗AR的作用。本研究为进一步验证上述预测结果的可靠性,构建豚草花粉诱导的AR小鼠模型展开体内实验验证,研究结果表明:黄芪-辛夷药对能够降低AR小鼠体内PTGS2、HSP90、NOS2的蛋白表达,抑制AR小鼠血清、鼻腔灌洗液和肺泡灌洗液中炎性因子组胺、IgE、TNF-α和IL-6的表达水平,升高抗炎因子IL-10的表达,显著缓解AR小鼠挠鼻和打喷嚏症状,揭示了黄芪-辛夷药对可能通过抑制HSP90/PTGS2/NOS2通路,进而抑制炎性反应的发生发展,达到干预AR的效果。
综上所述,通过数据挖掘统计分析和网络药理学技术对临床治疗AR的用药规律进行总结,并深入研究高频药物组合黄芪-辛夷治疗AR的分子作用机制,分子对接模拟验证了黄芪-辛夷多成分、多靶点、多通路的作用特点,并通过体内实验验证了黄芪-辛夷药对可能是通过抑制HSP90/PTGS2/NOS2通路进而抑制炎性反应的发生、缓解小鼠AR症状、最终达到治疗AR的作用。本研究结果能够为辛夷-黄芪药对在临床上的合理用药提供科学的理论依据,进一步推动中药治在疗变应性鼻炎中的应用。

